Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude vol.8 no.3 Ananindeua set. 2017
http://dx.doi.org/10.5123/s2176-62232017000300005
ARTÍCULO ORIGINAL
Infección oculta por el virus de la hepatitis B en comunidad amazónica sometida a intenso flujo migratorio, estado de Pará, Brasil
1 Instituto Evandro Chagas/SVS/MS, Seção de Hepatologia, Belém, Pará, Brasil
2 Instituto Evandro Chagas/SVS/MS, Centro de Inovações Tecnológicas, Ananindeua, Pará, Brasil
INTRODUCCIÓN:
La infección oculta por el virus de la hepatitis B - VHB (IOB) se define como la presencia del VHB-ADN en el hígado, que puede o no ser detectada en el suero con HBsAg-, y sus posibles implicaciones clínicas.
OBJETIVO:
Investigar brotes de IOB en la población del municipio de Juruti, estado de Pará, Brasil, entre febrero de 2007 y noviembre de 2010.
MATERIALES Y MÉTODOS:
Se evaluaron, por técnicas inmunoenzimáticas, muestras de suero de 3991 personas, y seleccionadas las anti-HBc total+ aislado en las que se investigó el VHB-ADN para identificar la presencia de IOB.
RESULTADOS:
El estudio encontró 0,5% de portadores, 8,3% con perfil de infección anterior, 1,1% con perfil de infección anterior o actual y 33,6% con respuesta vacunal, caracterizando al Municipio como de baja endemicidad para este virus. El VHB-ADN fue detectado en el 66,7% de las muestras HBsAg+, con carga viral entre < 55 UI/mL y > 38.000 UI/mL; el 69,2% de estas muestras presentaron subgenotipo A1; 15,4%, F2; y 15,4%, F4. Del total examinado, el 1,1% eran muestras de individuos anti-HBc total+ aislado, cuyas pruebas de biología molecular revelaron que un 9,3% presentaba VHB-ADN, con carga viral entre < 15 UI/mL y 48 UI/mL.
CONCLUSIÓN:
Los hallazgos del estudio indicaron la presencia de portadores de IOB en 0,1% de la población de Juruti. La baja prevalencia de IOB encontrada está, probablemente, relacionada con la baja endemicidad del VHB en esa población.
Palabras-clave: Virus de la Hepatitis B; Hepatitis Viral Humana; Técnicas de Genotipado
INTRODUCCIÓN
La hepatitis B sólo ha sido reconocida desde hace casi 130 años, con los primeros registros realizados durante la investigación de casos de ictericia posvacunación antivariólica a trabajadores de los astilleros de Bremen en Alemania1. El virus de la hepatitis B (VHB) pertenece a la familia Hepadnaviridae, género Orthohepadnavirus, especie Hepatitis B virus2.
La infección oculta por el virus de la hepatitis B (IOB) fue descrita a finales de la década de 1970, revelando la importancia de la presencia del anti-HBc como indicador de infección por el VHB y levantando la hipótesis de que individuos con títulos elevados de anti-HBc podrían transmitir la infección3.
El diagnóstico de la IOB es eminentemente serológico y virológico, observándose de forma constante el bajo nivel del VHB-ADN, generalmente alrededor de 103 copias/mL en el suero, en comparación con el nivel de 104 copias/ml encontrado en los portadores asintomáticos y de 108 copias/mL en los portadores de hepatitis crónica4,5.
En un taller internacional sobre IOB realizado en Taormina, Italia, los expertos hicieron recomendaciones, entre las que se destacó la definición de IOB como la presencia del VHB-ADN en el hígado (con o sin la detección del VHB-DNA en suero) de individuos HBsAg- por pruebas convencionales6.
Se mantienen controvertidos los resultados de varios estudios sobre la relación entre la IOB y el retraso en el aclaramiento del HBsAg; mientras que algunos estudios demuestran un impacto beneficioso del aclaramiento del HBsAg, otros sugieren una elevada incidencia en la progresión de la enfermedad y en el desarrollo de complicaciones7,8,9,10,11.
La respuesta inmune del huésped a la infección por el VHB puede ser anulada por inmunosupresores o por agentes citotóxicos, proporcionando replicación viral y progresión de la enfermedad. La reactivación de la hepatitis crónica B o incluso el surgimiento de fallo hepático fulminante fue reportado en pacientes con IOB sometidos a terapia citotóxica, el transplante autólogo de células madre, transplante alogénico de médula ósea, linfoma, anemia aplásica o leucemia12,13,14,15,16,17,18.
La asociación entre el VHB y el carcinoma hepatocelular (CHC) está bien establecida, sin embargo, sigue siendo controvertida de si la IOB también estaría implicada en el surgimiento del CHC - prevalencia variable de la IOB en pacientes con CHC ha sido reportada en Asia, Japón y Estados Unidos19,20,21,22.
Por un mecanismo de transmisión similar, la coinfección VHB y el virus de la hepatitis C (VHC) es una presentación clínica común, con alta prevalencia del anti-VHC, más asociada al anti-HBc positivo (anti-HBc+) que al HBsAg positivo (HBsAg+), quedando indefinido el impacto clínico de la coinfección VHC/IOB4.
La evaluación del papel de la IOB en pacientes con hepatitis crónica con elevación de alanina aminotransferasa (ALT) detectó el VHB-ADN en 13,3% de los pacientes con ALT normal o ligeramente elevada, mientras que con la elevación de ALT (≥ 5 veces los valores normales), el VHB-ADN fue detectado en 63,3% de los pacientes, lo que indica que la prevalencia de IOB sería más alta en pacientes positivos para el VHC que en negativos23.
El virus de la hepatitis D (VHD), único representante del género Deltavirus, es un virus defectivo, que necesita la presencia del VHB para provocar infección in vivo. En una comunidad amerindia de Argentina, fueron identificadas, entre 46 muestras no reactivas para el VHD por ELISA, tres que eran VHD-ARN+ por nested reacción en cadena de la polimerasa (PCR) vía transcriptasa inversa (RT) - RT-Nested PCR. Las muestras eran anti-HBc+ aislado y dos de ellas fueron identificadas como IOB, evidenciando que la infección por el VHD puede ocurrir entre individuos con IOB24.
Se sabe que el VIH altera la historia natural de la infección por el VHB. En la infección aguda por el VHB en pacientes portadores del VIH, las posibilidades de que estos se convierten en portadores crónicos del VHB son de cinco a seis veces mayores que para las personas con resultado negativo para el VIH. Los pacientes coinfectados con VIH y VHB progresan más rápidamente a la etapa final de la enfermedad hepática y los diferentes genotipos del VHB pueden tener un impacto distinto en la progresión de la enfermedad25.
En el análisis de 191 muestras de suero de pacientes belgas coinfectados VIH/VHB, con anti-HBc+, el 65,3% presentaba "infección evidente" y el 34,7%, "infección oculta". Los genotipos A (69,6%), E, D, C y G. El genotipo A se observó en todos los pacientes del grupo clínico y de etnias variadas, y el genotipo E en pacientes africanos26.
Estudios comprobaron la existencia de alta prevalencia de la IOB entre dializados, sin embargo la prevalencia de IOB entre receptores de trasplante renal es controvertida27,28,29,30,31,32. El análisis de 752 muestras HBsAg-, para identificar IOB en pacientes de hemodiálisis de cinco clínicas de Recife, estado de Pernambuco, Brasil, encontró seroprevalencia del 5,7% para el anti-HBc total+ aislado, y la IOB fue identificada en 1,5% de las muestras examinadas. El genotipo A fue detectado en 33,3% de las muestras y el D en 66,7%, y no se observó ninguna mutación33. El estudio de 207 pacientes HBsAg-, receptores de trasplante de riñón, del estado de Rio de Janeiro, encontró un 1,0% con VHB-ADN positivo, indicando presencia de IOB34.
En 2014, un estudio realizado para determinar la frecuencia de IOB entre coinfectados por VIH/VHB, con anti-HBc+, donantes de sangre en Medellín, Norte de Colombia Occidental, y caracterizar los genotipos virales y mutaciones, relató que el HBsAg utilizado en la clasificación en los bancos de sangre redujo el riesgo de transmisión de VHB por transfusión; sin embargo, el descubrimiento de IOB entre donantes de sangre hizo imperativa la mejora en la seguridad de la donación. En este estudio, se analizaron 302 muestras de suero HBsAg-/anti-HBc+; el análisis por PCR del genoma del VHB identificó seis muestras (1,98%) como IOB, todas Del subgenotipo F335.
Una encuesta sobre IOB realizada con donantes de dos bancos de sangre, en Nigeria, identificó, entre 429 individuos, un 17,0% con IOB. La carga viral fue de <50 copias/mL en la IOB y predominó el genotipo E. Se concluyó que la gran incidencia de la IOB era relevante en áreas de alta endemicidad y un problema general para la seguridad de la donación de sangre, por la elevada prevalencia detectada36.
Es de conocimiento general que los usuarios de drogas ilícitas presentan un riesgo aumentado de infección por VHB. Un estudio desarrollado para investigar el perfil seroepidemiológico y molecular de la infección por VHB en esos individuos, en la Región Centro-Oeste de Brasil, analizó a 1.002 usuarios que utilizaban drogas inyectables (UDI) y no inyectables (UDNI). La prevalencia global de la infección por el VHB fue del 15,0%, siendo que un 20,7% pertenecía al grupo de UDI y 14,0% al de UDNI. El índice de IOB fue del 3,6% entre usuarios anti-HBc+, mostrando la presencia de IOB y la necesidad de investigar los casos HBsAg-, para controlar la infección entre esos usuarios37.
En la región oeste del estado de Pará, en el margen derecho del río Amazonas, formando parte de la Mesorregión del Bajo Amazonas y de la Microrregión de Óbidos, el municipio de Juruti, con una población estimada por el Instituto Brasileño de Geografía y Estadística38 en 52.179 habitantes para 2016, viene siendo sometido desde 2005 a la explotación de reserva de bauxita, la cual resultó en gran migración poblacional hacia el municipio. Por la posibilidad del surgimiento o del aumento de la frecuencia de enfermedades influenciadas por esa explotación, particularmente en cuanto a las hepatitis virales, se desarrolló, entre 2007 y 2010, un proyecto de investigación en Juruti, el cual, entre otras investigaciones, desarrolló un estudio para definir la prevalencia de las infecciones por los virus de las hepatitis. En este estudio se recolectaron en los dos primeros años 1.630 muestras de suero de personas de la demanda hospitalaria municipal, las cuales fueron sometidas al análisis de los marcadores serológicos de las hepatitis A, B, C y D, por técnicas inmunoenzimáticas, habiendo prevalencia de 1,4% de individuos con perfil de infección anterior o actual por el VHB (anti-HBc total+ aislado)39.
La Amazonía Occidental es una de las regiones en el mundo con una alta prevalencia de hepatitis B, y pocos son los estudios desarrollados sobre la IOB en esa región. La detección de individuos con serología anti-HBc total+aislado indicó la necesidad de conocer la prevalencia de ese hallazgo en poblaciones amazónicas, como es el caso de Juruti. Esto puede contribuir a la detección, el entendimiento de la evolución y el pronóstico de los portadores de esta enfermedad, principalmente porque las drogas actualmente utilizadas por el sistema público de salud de Brasil todavía son ineficaces para el tratamiento de la hepatitis B, habiendo la perspectiva de que, en los próximos años, nuevas drogas compongan el arsenal para su tratamiento.
Este estudio tuvo como objetivo investigar brotes de IOB en la población del municipio de Juruti. De forma específica, el objetivo fue de definir la seroprevalencia de la infección por el VHB; determinar la frecuencia de IOB; describir las características demográficas de los portadores del VHB y de los portadores de IOB; determinar la carga viral y los genotipos en portadores del VHB-ADN/HBsAg+ seleccionados; determinar la carga viral y los genotipos en portadores del VHB-ADN/anti-HBc total+ aislado; comparar los genotipos de las muestras anti-HBc total+ aislado con las muestras HBsAg+, identificando los genotipos circulantes en la población examinada; identificar mutaciones en la estructura del HBsAg que permitan el escape y la no detección por las pruebas inmunoenzimáticas; y detectar la presencia de coinfección de la IOB con el VIH, el VHC y el VHD.
MATERIALES Y MÉTODOS
Estudio descriptivo, transversal, retrospectivo, desarrollado entre marzo de 2012 y abril de 2015, con muestras de suero colectadas durante la ejecución de proyecto sobre hepatitis virales en el municipio de Juruti, oeste del estado de Pará, Brasil, por la Sección de Hepatología (SAHEP) del Instituto Evandro Chagas (IEC), que se realizó entre febrero de 2007 y noviembre de 2010.
Se incluyeron en el presente estudio, muestras de individuos con serología HBsAg+ y anti-HBc total+ aislado, seleccionadas a partir del referido proyecto, de forma aleatoria, totalizando 3.991 muestras.
En la SAHEP, se realizaron por técnicas inmunoenzimáticas, pruebas serológicas para las hepatitis B (HBsAg, anti-HBc total y anti-HBs) y C (anti-VHC) en las 3.991 muestras, se utilizaron kits comerciales de los laboratorios bioMérieux® (Marcy-l'Etoile, Francia) y ORTHO® (New Jersey, EUA), respectivamente.
En las muestras HBsAg+ y anti-HBc total+ aislado, se estudiaron, por técnica inmunoenzimática, los marcadores serológicos anti-HBc IgM (bioMérieux®, Marcy-l'Étoile, Francia); HBeAg (Bio-RAD®, Marnes-la-Coquette, Francia); anti-HBe (RADIM®, Pomezia, Italia) y anti-VHD (bioMérieux®, Marcy-l'Étoile, Francia). Se consideraron dudosas las pruebas que presentaron densidad óptica situada 20,0% para arriba o para abajo del límite de cut-off.
En las muestras anti-HBc total+ aislado, también se realizaron, en la Sección de Virología del IEC, las pruebas serológicas para el anti-HIV 1/2 SYM (Symbiosys®, São Paulo, Brasil). Todas las pruebas fueron ejecutadas e interpretadas conforme las indicaciones de los fabricantes.
Las pruebas de biología molecular para el VHB se realizaron en la SAHEP/IEC. Todas las muestras HBsAg+ y anti-HBc total+ aislado fueron sometidas a la cuantificación de la carga viral por PCR en tiempo real, utilizando el sistema automatizado Abbott m24sp/m2000rt con el kit Abbott RealTime HBV® (Abbott Laboratories, Chicago, EUA), que presenta linealidad de 10 UI/mL a 1.000.000.000 UI/mL.
Las muestras que presentaron carga viral de VHB detectables fueron sometidas a amplificación por Nested PCR de un fragmento de 734 pares de base (pb) de los genes que codifican la polimerasa viral y el HBsAg, utilizando los iniciadores y condiciones de PCR40,41.
La secuenciación se realizó utilizando el kit BigDye® Terminator v3.1 Cycle Sequencing (Applied Biosystems, Carlsbad, EUA) en el secuenciador automático ABI 3500 (Applied Biosystems, Carlsbad, EUA), siendo utilizados los iniciadores FHBS2, RHBS2 5'- GCC ARG AGA AAC GGR CTG AGG CCC - 3', 5'LAM5 5'-TGC RYY TGT ATT CCC ATC CCA TC - 3' y RADE2M.
Las secuencias obtenidas fueron editadas y alineadas en el programa Geneious v8.1.3, junto con secuencias de los diferentes genotipos y subgenotipos del VHB disponibles en el GenBank. El cladograma se construyó usándose el método neighbor-joining42 Kimura 2-parámetros en el programa MEGA v6.06.
Para la identificación de mutaciones que llevaran al escape en la detección de las pruebas inmunoenzimáticas, se hizo la deducción de aminoácidos a partir de la secuenciación de nucleótidos de la región S/Pol, utilizando el programa Geneious v8.1.3. Las secuencias obtenidas fueron alineadas con secuencias de VHB del tipo "salvaje" y analizadas visualmente para la detección de mutaciones en la región MHR en el gen S, abarcando los aminoácidos 100 a 169. También se investigaron mutaciones en el gen que codifica la polimerasa viral y se analizaron los aminoácidos que hacen parte de los dominios funcionales de la transcriptasa reversa (dominios A-E).
Las muestras positivas para anti-VHC fueron sometidas a la cuantificación de la carga viral, utilizando el kit Abbott RealTime HCV® (Abbott Laboratories, Des Plaines, EUA) en el sistema automatizado Abbott m24sp/m2000rt. En los casos positivos por la PCR en tiempo real, se realizó heminested PCR de un fragmento de 382 pares de base (PB) del gen que codifica la NS5B para identificar el genotipo del VHC, utilizando los iniciadores y condiciones de PCR43,44.
Las muestras excedentes fueron almacenadas en freezer a -70 ºC, e integran el Biorrepositorio del referido estudio.
Los datos de la Ficha Preliminar de Investigación de Salud y los resultados serológicos fueron almacenados en base de datos de la SAHEP/IEC (Hepatoware). Se determinó la distribución espacial de los casos detectados, sobre la base de medidas epidemiológicas que incluyeron el cálculo de frecuencias para casos prevalentes y la relación con el perfil epidemiológico de los casos (sexo, edad, estado civil, procedencia, si era vacunado contra el VHB, si tuvo hepatitis, y los síntomas y señales). Los análisis estadísticos se realizaron empleando el software Epi InfoTM v7 y BioEstat v5.045. Se utilizó la prueba de significación estadística (prueba exacta de Fisher del programa Epi InfoTM v7, con un nivel de significación del 5% y un intervalo de confianza - IC del 95%), para analizar las diferencias entre los grupos y la aplicación Microsoft Excel para las representaciones gráficas. Las muestras fueron probadas bajo la hipótesis de nulidad (H0) de que la infección oculta por el VHB no ocurre en el municipio de Juruti; y bajo la hipótesis alternativa (H1) de que la infección oculta por el VHB ocurre en el Municipio.
En base a la Resolución CNS nº 466/2012 de la Comisión Nacional de Ética en Investigación46, este proyecto fue aprobado el 31 de marzo de 2011, por el Comité de Ética en Investigación Involucrando a Seres Humanos del IEC, con un dictamen de aprobación nº 010/2011 (CAAE: 0038.0.072.000-10).
RESULTADOS
Se seleccionaron 3.991 muestras de suero de individuos de Juruti, en el período de febrero de 2007 a noviembre de 2010, recolectadas en la sede del Municipio, en el Hospital Francisco Barros (75,2%; 3.001/3.991); en la Comunidad Café Torrado (5,8%, 230/3.991); en la localidad Jauari (1,0%; 42/3.991); en la Comunidad Nova Galileia (2,8%, 110/3.991); en Vila Muirapinima (7,7%, 307/3.991); y en la invasión, a orillas del Lago Jará (7,5%, 301/3.991).
Se observó una frecuencia del 62,7% (2.501/ 3.991) para individuos del sexo femenino. El promedio de edad de la población fue de 27,6 ± 18,7 años (variación de 5 meses a 89 años) y el promedio, de 25 años de edad. La mayor concentración de participantes estaba en la sede del Municipio; la mayor y la menor frecuencia de individuos fueron encontrados en el grupo de edad de 20 a 29 años (20,8%, 832/3.991) y entre los menores de 1 año de edad (0,3%, 10/3.991), respectivamente.
Se identificó una prevalencia del 0,5% (21/3.991, IC 95% 0,39-0,61) para HBsAg+; 8,3% (332/3.991, IC 95% 5,33-11,26) para anti-HBc total+ /anti-HBs+; 1,1% (43/3.991, IC 95% 0,79-1,41) para anti-HBc total+ aislado; y el 33,6% (1.339/3.991, IC 95% 31,07-36,13) presentaron respuesta vacunal contra el VHB (anti-HBs+ aislado). El perfil serológico vacunal, hasta los 29 años de edad, se mostró en el 47,8% (1.135/2.375), conforme se puede visualizar en la tabla 1.
Tabla 1 - Seroprevalencia de HBsAg+, anti-HBc total+/anti-HBs+, anti-HBc+ aislado y anti-HBs+ aislado, por grupo de edad, en Juruti, estado de Pará, Brasil, de febrero de 2007 a noviembre de 2010
| Grupo de edad (años) | Población examinada | HBsAg+ | Anti-HBc total+/anti-HBs+ | Anti-HBc total+ aislado | Anti-HBs+ aislado | Susceptibles | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| N | % | N | % | N | % | N | % | N | % | N | % | |
| < 1 | 10 | 0,3 | − | − | 1 | 10,0 | − | − | 4 | 40,0 | 5 | 50,0 |
| 1 - 4 | 317 | 7,9 | − | − | 2 | 0,6 | − | − | 197 | 62,2 | 118 | 37,2 |
| 5 - 9 | 488 | 12,2 | − | − | 2 | 0,4 | 1 | 0,2 | 271 | 55,6 | 214 | 43,8 |
| 10 - 19 | 728 | 18,2 | 2 | 0,3 | 7 | 1,0 | 4 | 0,5 | 418 | 57,4 | 297 | 40,8 |
| 20 - 29 | 832 | 20,8 | 3 | 0,4 | 34 | 4,1 | 3 | 0,4 | 245 | 29,4 | 547 | 65,7 |
| 30 - 39 | 618 | 15,5 | 5 | 0,8 | 69 | 11,2 | 3 | 0,5 | 103 | 16,7 | 438 | 70,8 |
| 40 - 49 | 393 | 9,9 | 5 | 1,3 | 60 | 15,3 | 6 | 1,5 | 37 | 9,4 | 285 | 72,5 |
| 50 - 59 | 331 | 8,3 | 3 | 0,9 | 74 | 22,4 | 8 | 2,4 | 32 | 9,7 | 214 | 64,6 |
| ≥ 60 | 274 | 6,9 | 3 | 1,1 | 83 | 30,3 | 18 | 6,6 | 32 | 11,7 | 138 | 50,3 |
| Total | 3.991 | 100,0 | 21 | 0,5 | 332 | 8,3 | 43 | 1,1 | 1.339 | 33,6 | 2.256 | 56,5 |
N: Población examinada; Señal convencional utilizada: − dato numérico igual a cero, no resultante de redondeo; HBsAg+: Portador de VHB; Anti-HBc total+/anti-HBs+: Perfil de infección anterior por VHB; Anti-HBs+ aislado: Perfil compatible con protección vacunal; Anti-HBc total+ aislado: Perfil compatible con infección anterior o actual por VHB.
Se ha comprobado que, entre los individuos HBsAg+, no se encontraron muestras positivas para el anti HBc IgM, el anti-VHC o el anti-HD. Las pruebas de biología molecular identificaron que el 66,7% (14/21) de los individuos presentaban PCR VHB-ADN cualitativo+.
La prueba de carga viral realizada en las 14 muestras HBsAg+ varió entre < 55 UI / mL y > 38.000 UI/mL. En 13 de estas muestras, fue posible realizar el genotipado del VHB, con la detección en 69,2% (9/13) del genotipo A, subgenotipo A1, y del genotipo F, siendo el 15,4% (2/13) del subgenoma F2 y 15,4% (2/13) del subgenoma F4. En estas 13 muestras, también se detectaron 69,2% (9/13) de subtipos serológicos adw2 (todos del subgenotipo A1) y 30,8% (4/13) de subtipos adw4 (dos del subgenotipo F2 y dos del F4), como se muestra en el cuadro 1.
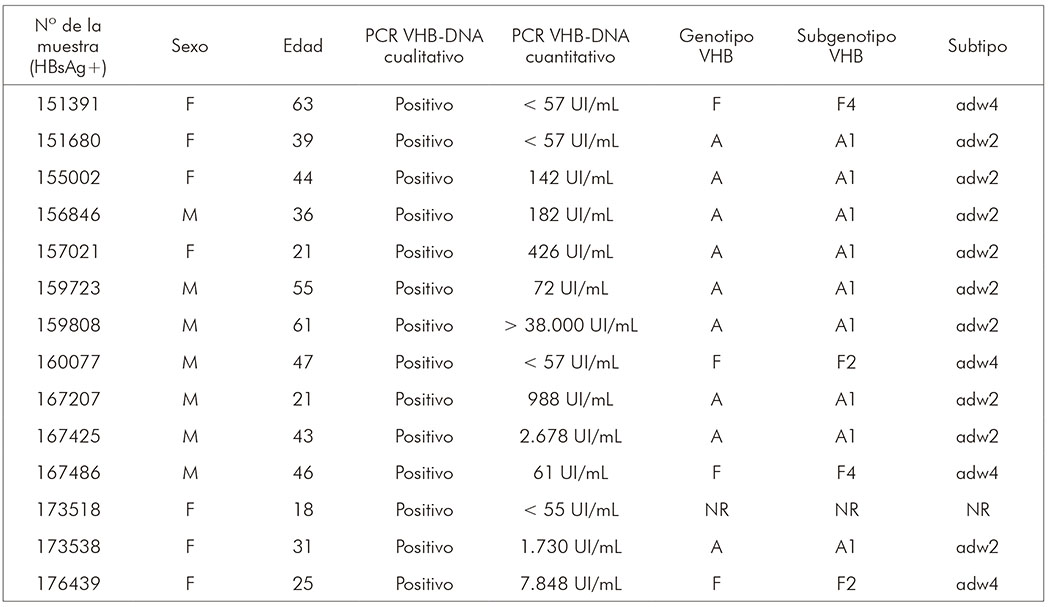
NR: No realizado, por muestra agotada.
Cuadro 1 - Genotipos, subgenotipos y subtipos de VHB-ADN identificados entre 14 muestras de individuos HBsAg+, en Juruti, estado de Pará, Brasil, de febrero de 2007 a noviembre de 2010
En cuanto a la prevalencia de genotipos, el subgenotipo A1 fue el más prevalente con 64,3% (9/14), principalmente en el grupo de edad entre 30 y 39 años. Se detectaron los subgenotipos F2 y F4, siendo que el subgenotipo F2 se presentó en individuos de 25 y 47 años y el F4 en individuos de 46 y 63 años.
El cladograma desarrollado para las muestras de VHB se basó en la alineación de secuencias de la región S/Pol (742 pb), utilizando el método neighbor-joining (Kimura 2-parámetros) y la prueba de bootstrap de 1.000 réplicas. Nueve muestras agruparon con secuencias del subgenotipo A1, que es el más frecuente en el continente americano. También se identificaron cuatro secuencias de VHB, genotipo F, siendo dos del subgenotipo F2 y dos del F4 (Figura 1).
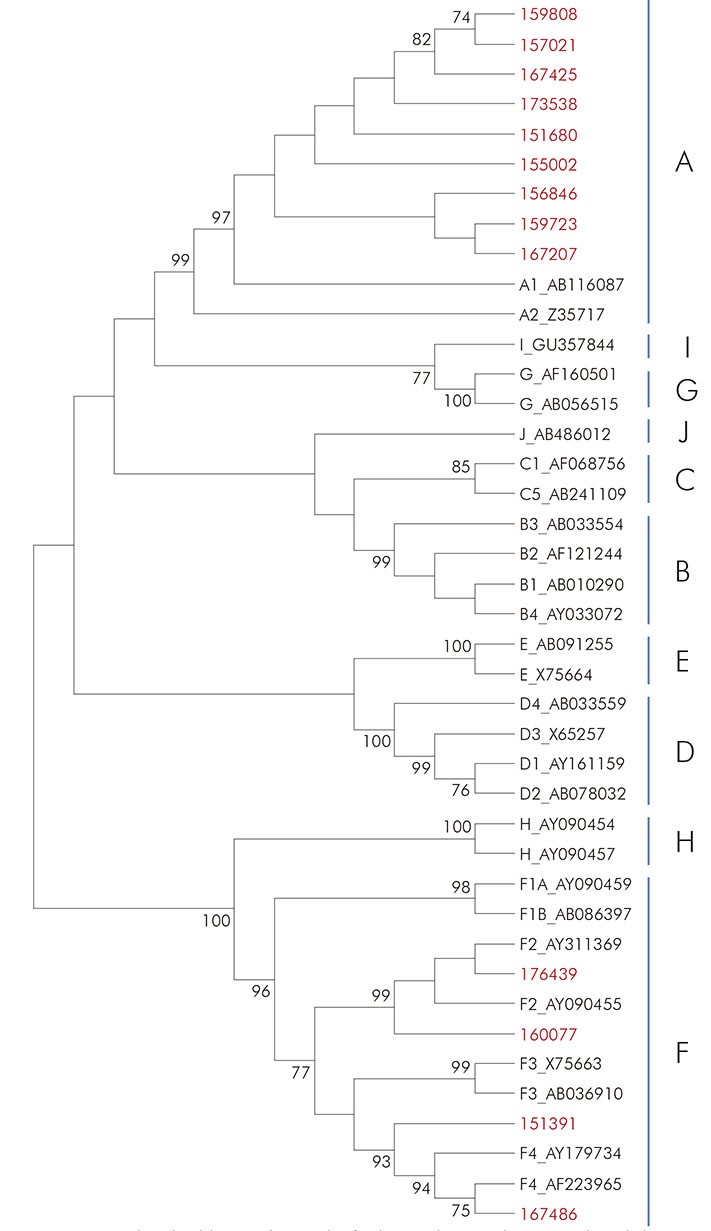
Las secuencias obtenidas del GenBank están identificadas con el número de acceso. Valores de bootstrap superiores a 70,0% se muestran en el árbol.
Figura 1 - Cladograma de la región S/Pol del VHB inferida por el método neighbor-joining (Kimura 2-parámetros)
El análisis de la región del dominio C de la polimerasa y del determinante "a" del HBsAg no detectó la presencia de mutaciones; sin embargo, cuando se realizaron los análisis de otras regiones, se encontraron dos mutaciones. Una en la posición 169, con sustitución de una arginina por una prolina (R169P) en el gen S, de la muestra 151680 (Figura 2). La muestra pertenecía a una paciente de 39 años de edad, casada, comerciante, natural del municipio de Oriximiná, oeste del estado de Pará, oligosintomática, con hepatoesplenomegalia, que había recibido el esquema completo de vacunación y presentaba HBsAg+ desde 2003. Otra mutación ocurrió en el dominio D de la polimerasa, con sustitución de una serina por ácido aspártico (rtS238D) de la transcriptasa reversa, en la muestra 151391 (Figura 3). Esta muestra pertenecía a una paciente de 63 años de edad, casada, jubilada, procedente de Juruti, oligosintomática, sin historia anterior de infección por el VHB, y que había recibido el esquema vacunal completo contra el VHB.
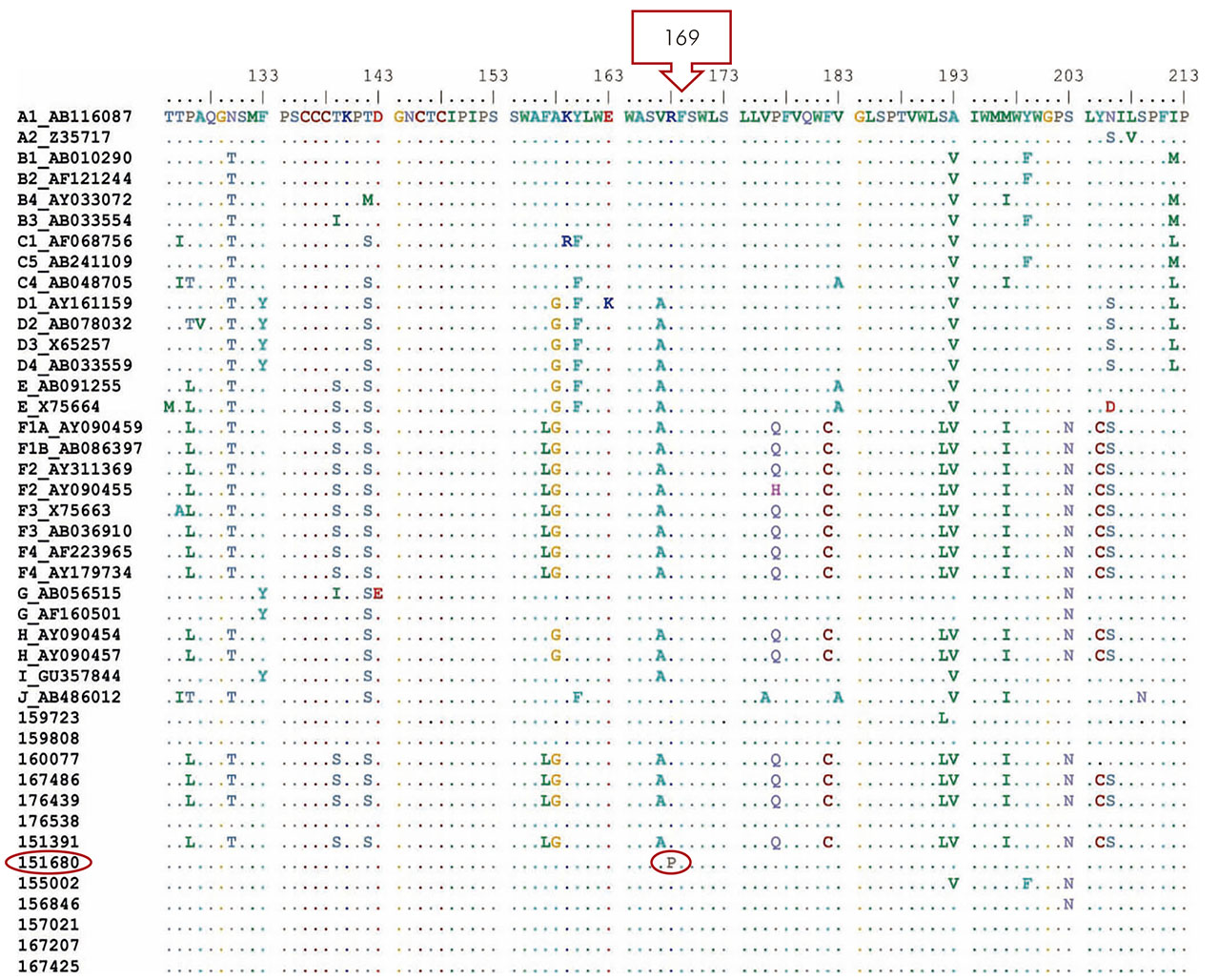
Figura 2 - Alineamiento de la secuencia de aminoácidos de la región S del VHB de las muestras del estudio y de las obtenidas del GenBank

Figura 3 - Alineamiento de la secuencia de aminoácidos de la región Pol del VHB de las muestras del estudio y las obtenidas del GenBank
El análisis de las características demográficas de los 14 pacientes HBsAg+ con VHB-ADN+ mostró ausencia de portadores del VHB con edad inferior a los 10 años; 50,0% (7/14) eran del sexo masculino; un 64,3% (9/14) estaban casados; 57,1% (8/14) procedía de Juruti, 21,4% (3/14) de otras ciudades de Pará (Óbidos, Oriximiná y Rurópolis) y el 21,4% (3/14) de los estados de Amazonas (Parintins), Ceará (Uruburetama) y Paraná (Diamante D'Oeste); 78,6% (11/14) informaron que no se vacunaron contra el VHB; 92,9% (13/14) no sabían si habían contraído hepatitis; y el 50,0% (7/14) respondió afirmativamente sobre la presencia de síntomas y señales.
Sólo la variable "vacunado contra la hepatitis B" mostró significancia estadística, con p=0,04, y los individuos no vacunados contra el VHB tuvieron un riesgo (razón de prevalencia) 0,32 veces mayor de ser infectados por el VHB, cuando comparados a los vacunados.
Del total de 43 muestras anti-HBc total+ aislado, no se detectó el marcador serológico anti-HBc IgM. Las pruebas de biología molecular de estas muestras detectaron un 9,3% (4/43) de individuos VHB-ADN+, con carga viral entre < 15 UI/mL y 48 UI/mL. La baja carga viral encontrada imposibilitó el genotipado y la secuenciación de esas muestras (Cuadro 2).
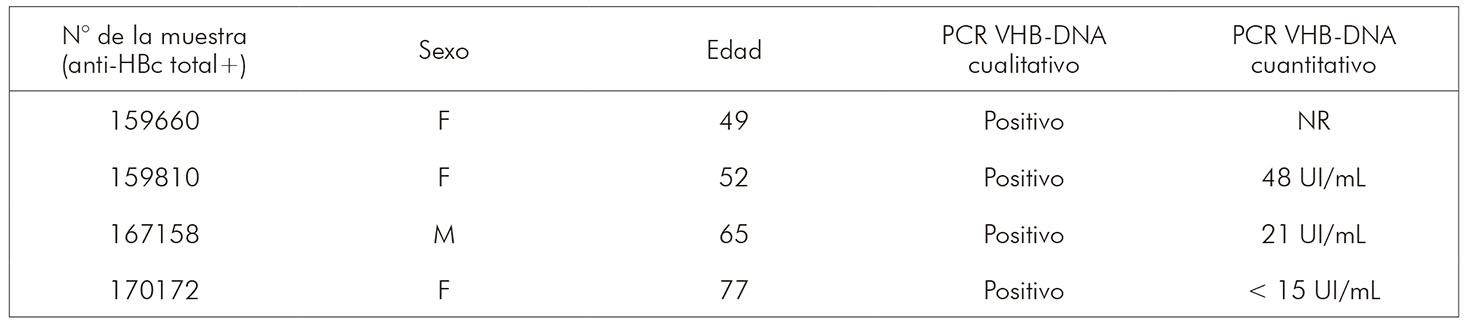
NR: No realizado, por muestra agotada.
Cuadro 2 - Pruebas de PCR VHB-ADN cualitativo y cuantitativo en cuatro muestras anti-HBc total+ aislado, en Juruti, estado de Pará, Brasil, de febrero de 2007 a noviembre de 2010
En las muestras anti-HBc total+ aislado, la investigación detectó prevalencia del anti-VHC del 4,7% (2/43), siendo confirmado por RT-PCR, como portador del VHC, genotipo 1a, un individuo del sexo masculino, De 80 años de edad, asintomático, casado, residente en el área urbana de Juruti. En estas muestras, la investigación del anti-HD se mostró negativa. Y no se han detectado serias anti-VIH positivas.
En cuanto a la distribución de pacientes anti-HBc total+ aislado con VHB-DNA+, la presencia Del virus fue detectada a partir de los 40 años de edad, con mayor frecuencia entre los individuos a partir de 60 años.
DISCUSIÓN
La IOB es una entidad clínica desafiante, reconocida por dos características principales: ausencia de HBsAg y baja replicación viral. Sin embargo, en las décadas de 1990 y 2000, hubo un notable progreso en la comprensión de sus implicaciones clínicas. Se percibió que debían ser adoptadas técnicas diagnósticas apropiadas, ya que ensayos sensibles de amplificación del VHB-ADN se consideran como el estándar oro para detección de la IOB. Se identificó que factores virales y factores del huésped estarían implicados en la patogénesis de la IOB, aunque algunos investigadores todavía creen que la infección por la IOB por transfusión es limitada. Por estas razones, varios aspectos de la transmisión de la IOB, su grado de infestación y relación con el desarrollo de enfermedades crónicas del hígado y CHC todavía necesitan ser investigados28,29.
La IOB, conceptualizada como la detección del VHB-ADN en suero o en el hígado por prueba diagnóstica sensible, en pacientes HBsAg- con o sin marcadores serológicos de exposición previa viral, parece ser elevada entre pacientes con alto riesgo de infectarse por el VHB y con enfermedad hepática. Puede originarse tanto por la contaminación con sangre como por la donación de órganos y funcionar como elemento desencadenante de reactivación después de una hepatitis, dependiendo de las características del virus y de factores del huésped30.
Este estudio fue desarrollado con el objetivo de investigar el hallazgo de IOB en una muestra de población de Juruti entre febrero de 2007 y noviembre de 2010. La presencia de portadores del VHB fue comprobada en esa población por la detección del 0,5% de muestras HBsAg+; un 8,3% de los individuos presentaron perfil de infección anterior por VHB, con anti-HBc total+/anti-HBs+; un 1,1% de los examinados presentaron perfil compatible con infección anterior o actual por VHB, con anti-HBc total+ aislado; y el 33,6% tuvo respuesta vacunal contra el VHB (anti-HBs+ aislado).
La seroprevalencia del 0,5% (IC 95% 0,39-0,61) de portadores del virus (HBsAg+) encontrada en la población de Juruti lo clasificó como de baja endemicidad para el VHB, resultado similar al encontrado en el "Estudio de prevalencia de base poblacional de las infecciones por los virus de las hepatitis A, B y C", realizado entre 2005 y 2009, en las 26 capitales brasileñas y en el Distrito Federal, que mostró prevalencia serológica para el HBsAg del 0,37% (IC 95% 0,25-0,50), clasificando el conjunto de las capitales de Brasil como de baja endemicidad para el VHB47.
Entre las 21 muestras HBsAg+, no se detectaron casos agudos de infección por el VHB, ni se encontraron individuos portadores de infección por VHC y VHD, lo que traduce la baja endemicidad de esos virus en la región. La investigación del VHB-DNA de estas muestras fue positiva en 66,7%, y la carga viral de las muestras positivas varía entre < 55 UI/mL y > 38.000 UI/mL, posibilitando la realización de genotipado, constatando que nueve de ellas presentaban el subgenótipo A1, dos eran del subgenótipo F2 y dos del subgenótipo F4, concluyendo que el subgenótipo A1 era el más prevalente en la muestra estudiada.
La identificación de los genotipos del VHB es importante para estimar la progresión de la enfermedad y para planificar el tratamiento. Según diversos estudios sobre la distribución de los genotipos y subgenotipos del VHB en el mundo, el genotipo A presenta tendencia a la cronicidad y es más frecuente en el África Subsahariana, en el norte de Europa y en África Occidental; los genotipos B y C son característicos de Asia, y las mutaciones se encuentran más frecuentemente en el genotipo C; el D predomina en África, Europa, los países del Mediterráneo y en India, siendo frecuente tanto la evolución hacia la cronicidad como la aparición de mutaciones; el genotipo E fue descrito en estudios en África Central y Arabia Saudita; el F en estudios en Túnez, en Brasil y en España; el genotipo G se ha reportado en Francia, Alemania y en los Estados Unidos, en coinfección con otros genotipos; el H ES comúnmente encontrado en las Américas del Sur y Central, también relacionado con las coinfecciones; el genotipo I fue recientemente reportado en Vietnam y Laos, y el J fue identificado en las islas de Japón48.
Un estudio que involucró a 40 pacientes de hemodiálisis en el estado de Santa Catarina, encontró el genotipo D (57,1%) como el más prevalente, siguiéndolo el A (30,6%) y el F (12,2%); en el estado de Rio Grande do Sul, hubo mayor prevalencia del genotipo D (60,0%), y también se detectaron los genotipos A (34,0%) y F (5,0%); en el estado de Paraná, los genotipos D (82,9%) y A (14,1%) fueron los más frecuentes49,50,51.
El examen de 121 individuos, en Río de Janeiro, detectó un 68,0% con genotipo A, un 15,0% con genotipo F y un 14,0% con genotipo D. El análisis de 60 pacientes, en Recife, identificó mayor prevalencia de los subgenótipos A1 (79,0%) y F2 (12,0%)52,53.
En la Amazonía Oriental, un estudio relató prevalencia del genotipo A de 81,8%, 89,5% y 93,7% en pacientes asintomáticos, sintomáticos con HBeAg+ y sintomáticos con HBeAg-, respectivamente. Otro estudio realizado en Belém, en Pará, encontró, entre 40 pacientes, los genotipos A1 (87,5%), A2 (7,5%) y D (5,0%)54,55.
En la Amazonía Occidental, se detectó entre 34 portadores de HBsAg+, prevalencia de los genotipos A (73,5%) y F (26,5%)56. El análisis retrospectivo de 14 muestras de pacientes que desarrollaron hepatitis fulminante y murieron en la Amazonía Occidental, entre 1978 y 1989, encontró los genotipos F (50,0%), A (28,6%) y D (21,4%)41. Otro estudio desarrollado entre individuos HBsAg+ de áreas urbanas, rurales e indígenas del municipio de Lábrea, Amazonía Occidental, mostró que en 86 muestras HBsAg+, 39 presentaron VHB-ADN positivo, detectándose la prevalencia del genotipo A (60,0%) y la presencia de los genotipos D (35,0%) y F (5,0%)57. En ese mismo estudio, se constató que, entre nueve muestras de indígenas, 44,4% eran genotipo A y 55,6% genotipo D57. Todas las investigaciones presentadas, incluso la realizada en Juruti, ratifican la información de que, en Brasil, los genotipos A, D y F son los más frecuentes.
La investigación realizada en Juruti detectó nueve (69,2%) subtipos serológicos adw2 (todos de pacientes con subgenotipo A1) y cuatro (30,8%) subtipos adw4 (dos del genotipo F2 y dos del F4). Un estudio de prevalencia de las hepatitis B y C entre mineros de la Amazonía brasileña, expuestos a la malaria, encontró los subtipos adw2 (59,0%), adw4 (8,1%), ayw3 (8,1%) y ayw2 (5, 4%)58. Entre pacientes con clínica evidente de hepatitis, atendidos en el sistema público de salud de Goiânia, estado de Goiás, sobre la seroprevalencia de infección por el VHB, se identificaron los subtipos adw2 (62,7%), ayw3 (23,5%), ayw2 (9,8%) y adw4 (3,9%)59. En cambio, en pacientes hospitalizados en Porto Alegre, estado de Rio Grande do Sul, fueron encontrados principalmente los subtipos ayw (60,4%) en pacientes con genotipo D, adw (34,0%) en pacientes con genotipo A y adw4 (5,4%) en pacientes con genótipo F, evidenciando que la distribución de los genotipos y subtipos virales encontrados en los diferentes estudios puede reflejar el patrón de ocupación del virus en las diferentes regiones del país51.
En la presente investigación, se encontraron dos mutaciones. Una en la posición 169, con sustitución de una arginina por una prolina (R169P) en el gen S, de la muestra 151680, ubicada en la mayor región hidrofílica (MHR) de la proteína S, entre los aminoácidos 103 y 173; no en tanto fuera de la región de la determinante "a"(entre los aminoácidos 124-147), principal epítopo para inducir una respuesta inmune protectora, correlacionada con la reducción de la secreción del HBsAg y de la partícula viral.
Las mutaciones en la región pre-S/S se han reportado en muchas regiones del mundo, pero pueden ocurrir naturalmente o surgir durante la terapia antiviral, por el uso de la inmunoglobulina o la vacunación. Estas mutaciones están fuertemente relacionadas con la antigenicidad del HBsAg, pudiendo resultar en variaciones antigénicas y permitir el escape vacunal del VHB, siendo conocidas como "mutaciones de escape vacunal".
El HBsAg es un importante marcador diagnóstico, y su nivel de expresión está relacionado con la eficacia del tratamiento antiviral. La mutación más común encontrada en la región S del VHB es la sustitución de la glicina por la arginina en el codón 145 del HBsAg (G145R), o de aspartato por la alanina en el codón 144 (D144A)60. La otra mutación fue hallada en el dominio D, con sustitución de una serina por ácido aspártico (rtS238D) de la transcriptasa reversa, en la muestra 151391, que puede estar potencialmente correlacionada con mutación de resistencia a los antivirales adefovir y entecavir, pues algunos estudios relacionaron esas mutaciones a la progresión de la enfermedad hepática y a las terapias antivirales utilizadas61,62.
Un estudio sobre la resistencia al adefovir y al entecavir en el tratamiento de la hepatitis B crónica mostró que la resistencia al adefovir está generalmente asociada al surgimiento de mutación en el codón 236 (rtN236T) o en el codón 181 (rtA181V) del gen de la polimerasa del VHB. El adefovir, cuando utilizado en monoterapia el primer año de tratamiento, suele desarrollar resistencia, y, a partir del segundo, tercero, cuarto y quinto años, se puede observar la aparición de cepas resistentes en 3,0%, 11,0%, 18,0% y 29,0% de los pacientes, respectivamente63. La utilización de métodos más sensibles de detección posibilitó encontrar mutación de resistencia al adefovir, luego de un año de uso, llegando a 20,0% después del segundo año; esa resistencia se encontró, principalmente, en pacientes resistentes a la monoterapia por la lamivudina64.
Con relación al entecavir, la aparición de resistencia en pacientes que nunca recibieron tratamiento fue poca, por la eficiente capacidad de supresión viral y la alta barrera genética proporcionada por el mismo. El estudio ETV-60 demostró incidencia acumulativa de resistencia en cinco años de solamente 1,2%. En pacientes resistentes a la lamivudina, se verificó resistencia en menos de 2,0% de los pacientes durante terapia por un año65.
En el total de 3.991 muestras examinadas, entre las 43 (1,1%) que presentaban anti-HBc total+ aislado, se encontró la prevalencia de anti-VHC en 4,7% (2/43) de los individuos y confirmado, por RT-PCR, un portador de VHC, genotipo 1a, con VHB-DNA negativo, lo que revela que, en esa población, la IOB no era expresiva con relación a la hepatitis crónica C.
Si la infección por el VHC está asociada al aumento del riesgo de CHC, entonces la coinfección activa VHB/VHC podría aumentar ese riesgo, permaneciendo indeterminado el papel patogénico de la IOB en el CHC, relacionado al VHC. El hecho de haber encontrado el VHB-DNA en 14,8% de los pacientes HBsAg negativo/VHC positivo y en 15,0% de 100 adultos sanos HBsAg negativo/VHC negativo indicó que no había significado clínico con la hepatitis crónica C, en áreas donde la infección por el VHB era endémica66.
En las muestras anti-HBc total+ aislado, la investigación del anti-HD fue negativa, semejante a lo encontrado en las muestras HBsAg+, permitiendo caracterizar la baja endemicidad del VHD en esa población. Un estudio sobre la prevalencia serológica y las características moleculares del VHD, dentro de una comunidad amerindia de Argentina, identificó, entre 46 muestras VHD negativas por ELISA, tres VHD-RNA positivas por RT-nested PCR. Estas muestras eran anti-HBc positivo aislado, y dos de ellas fueron identificadas como IOB. Todas las secuencias fueron identificadas como VHD genotipo 1, pero exhibían diferencias de nucleótidos que codificaban la región HDAg-L, con mutaciones en los codones 197 y 201, responsable, según relatado, por promover in vitro una interacción inadecuada con HBsAg, evidenciando que la infección por el VHD puede ocurrir entre individuos con IOB24.
En todas las muestras anti-HBc total+ aislado, se ha investigado el anti-VIH, con resultados negativos, aunque se ha demostrado que coinfectados VHB/VIH pueden evolucionar a IOB, con baja carga viral y HBsAg no detectable, siendo necesario un diagnóstico específico por la investigación del VHB-ADN67. Un estudio desarrollado en Manaus, estado de Amazonas, mostró que la probabilidad de encontrarse IOB fue cuatro veces mayor entre los individuos VIH reactivos, sugiriendo la posibilidad de la asociación entre individuos portadores de VIH e IOB68.
El VHB-ADN fue encontrado en 9,3% (4/43) de las muestras anti-HBc total+ aislado, con carga viral entre <15 UI/mL y 48 UI/mL, imposibilitando la realización del genotipado y la secuenciación de esas muestras, lo que generó dificultades para comparar los genotipos de las anti-HBc total+ aislado con las HBsAg+ e identificar los genotipos circulantes en la población examinada. Esto se justifica tanto por la baja carga viral como por la diferencia en la sensibilidad de las metodologías, pues la PCR convencional suele ser menos sensible que la PCR en tiempo real, utilizada para la detección/cuantificación68. En el presente estudio, la metodología de PCR utilizada en el laboratorio tenía una sensibilidad de 50 UI/mL.
La prevalencia del VHB se define por las pruebas realizadas entre los pacientes; sin embargo la aproximación diagnóstica se presenta inadecuada dado que, en la mayoría de los casos, el diagnóstico de la IOB requiere ensayos de alta sensibilidad y especificidad, con un límite de detección < 10 UI/mL para VHB-DNA y < 0,1 mg/mL para HBsAg69.
El análisis de las características demográficas de las muestras HBsAg+/VHB-ADN+ no reveló significación estadística entre las variables analizadas, a excepción de la variable relacionada a la información sobre la vacunación contra el VHB, que fue estadísticamente significativo. Entre las muestras anti-HBc+/VHB-ADN+, el 75,0% de los sujetos examinados no mencionó haber sido vacunado contra el VHB; sin embargo, no fue posible realizar pruebas estadísticas por el reducido número de resultados encontrados.
Un estudio, para investigar la prevalencia de IOB y de genotipos de VHB entre niños mexicanos con hepatitis clínica, evaluó 215 niños por medio de marcadores serológicos del VHB y del VHB-ADN. La infección por el VHB fue encontrada en el 11,2% de los niños con hepatitis clínica, con VHB-ADN+, y la IOB fue identificada en el 87,5% de los casos, entre los cuales el 12,5% eran VHB-ADN+, con HBsAg-. La IOB fue más frecuente en las que no habían sido vacunadas contra hepatitis B que en aquellas que habían sido vacunadas, lo que destaca la importancia del diagnóstico molecular de la infección por el VHB en niños con hepatitis clínica, enfatizando la necesidad de la vacunación contra la hepatitis B70.
La cobertura vacunal contra el VHB registrada por el Departamento de Informática del Sistema Único de Salud, en el período de febrero de 2007 a noviembre de 2010, período en el cual fueron recolectadas las muestras del presente estudio, entre menores de 29 años de edad, fue de 71,2%; en la Región Norte, del 85,8%; en el estado de Pará, del 79,8%; y del 81,6% para el municipio de Juruti71. Los porcentuales estuvieron siempre por debajo de lo que preconiza el Ministerio de Salud, el cual recomienda que una serie de tres dosis de la vacuna debe inducir niveles protectores de anti-HBs en más del 95,0% de los niños y adolescentes y en cerca de 90,0% de los adultos sanos72.
En el presente estudio, fueron identificados 56,5% de individuos susceptibles al VHB, que podrían ser beneficiados por la vacunación. La elevada prevalencia de susceptibles asociada a la baja prevalencia del VHB encontrada identificó la necesidad de ampliar las actividades de prevención y control del VHB, principalmente en relación a la vacunación que, en Brasil, a partir de 2016, está disponible para toda la población, independiente de grupo de edad y/o condiciones de vulnerabilidad72.
En la población en general, se encuentran pocos estudios sobre la prevalencia de IOB, que ha sido reportada en varias partes del mundo, incluso en áreas de baja endemicidad para el VHB. Analizando a 487 individuos norteamericanos, se detectó la prevalencia de IOB en el 18,0% de los individuos que presentaban evidencia previa de infección por el VHB y en 8,0% de individuos seronegativos para ese virus73. Un estúdio realizado en población coreana sana, con transaminasas normales, que eran VHB y VHC negativos, captó un 16,0% de prevalencia de IOB74. Otro, sobre la prevalencia de la IOB en 98 muestras de tejido hepático de individuos italianos, sin enfermedad hepática, se detectó la presencia de 16,3% (16/98) de casos de IOB, siendo que 62,5% (10/16) de estos era anti-HBc+ y 7,3% (6/82) eran individuos seronegativos para VHB75.
Los métodos serológicos y de biología molecular utilizados en este estudio, considerando que la muestra era de 3.991 individuos residentes en Juruti, determinaron prevalencia del 0,4% de portadores del VHB con HBsAg+/VHB-ADN+ y prevalencia del 0,1% de individuos con IOB, anti-HBc total+/VHB-ADN+.
En el suero de 17.677 individuos coreanos, divididos en dos grupos, el grupo del Centro de Promoción de Salud (grupo HPC, 4.014 sueros) y el grupo de pacientes (13.663 sueros) de todos los departamentos clínicos del hospital, en los que se probaron el HBsAg, el anti-HBc y el anti-HBs, la investigación de la presencia de IOB encontró prevalencia del 8,9% del anti-HBc+ aislado significativamente más elevada en el grupo de pacientes que en el grupo del HPC. El VHB-DNA fue detectado solamente en el 1,7% (4/230) de los individuos con anti-HBc+ aislado, que eran pacientes con condiciones no relacionadas a la enfermedad crónica del hígado76.
Semejante al estudio en Juruti, una investigación sobre la prevalencia de IOB entre 1.401 pacientes y sometidos a hemodiálisis permanentemente, de Japón oriental, encontró el 0,6% HBsAg+, con VHB-ADN+, entre los 212 pacientes HBsAg- con anti-HBc+; tres muestras fueron positivas para VHB-ADN, concluyendo que la prevalencia de IOB en la muestra japonesa era del 0,3%77. Otro estudio sobre la prevalencia de IOB entre 1.451 individuos australianos portadores de enfermedad hepática encontró el 0,7% de pacientes que atendía a los criterios de IOB78.
La prevalencia de IOB entre personas con historia familiar de hepatitis crónica por VHB no está bien aclarada. Al examinar 747 sueros de individuos de China HBsAg-, con historia familiar de infección crónica por el VHB, y 579 donantes de sangre voluntarios con HBsAg-, Zhang et al.79 encontraron prevalencia de IOB del 8,0% en los individuos con una historia familiar de infección crónica por el VHB y del 2,6% entre los donantes de sangre.
Los diversos aspectos de la IOB todavía son incomprendidos, incluso la propia definición y la estandarización de laboratorio. A pesar del desarrollo en todo el mundo de varios estudios con el objetivo de definir la prevalencia y los factores que pueden contribuir al surgimiento de la IOB, como área geográfica, pruebas de laboratorio utilizadas y población investigada, aún no se ha establecido completamente su significado como entidad clínica.
Es necesario definir el impacto de la IOB en la coyuntura clínica y en la progresión para cirrosis y CHC, si la IOB puede reactivarse bajo inmunosupresión o si se puede transmitir por medio de transfusiones de sangre y transplantes de órganos. Con relación a la salud pública, su importancia clínica está ligada al riesgo de transmisión del VHB, siendo importante determinar los grupos de riesgo para la IOB, con el objetivo de prevenir la transmisión68.
Debe darse la debida importancia al marcador serológico de infección previa o actual por el VHB, el anti-HBc, el que debe ser utilizado en la selección de donantes de sangre y de órganos, en pacientes sometidos a quimioterapia o en tratamiento con inmunosupresores, en individuos sometidos a hemodiálisis y portadores de infección por VHC, VHD y VIH, cuyo resultado positivo aislado deberá ser acompañado de la investigación del VHB-ADN, para confirmar o excluir la presencia de IOB.
CONCLUSIÓN
La prevalencia de los marcadores serológicos de la hepatitis B encontrada en la población examinada caracterizó al municipio de Juruti como de baja endemicidad para el VHB.
Los hallazgos de este estudio indicaron la presencia de portadores de IOB en 0,1% de la población de Juruti. La baja prevalencia de IOB encontrada está, probablemente, relacionada a la baja endemicidad del VHB en esa población. En ninguno de los individuos con IOB se encontró coinfección con VHC, VHD y HIV.
Deben realizarse estudios adicionales involucrando a un mayor número de muestras en otras localidades, para evaluar cual es el papel de la IOB en la evolución de la enfermedad hepática; su importancia entre donantes de sangre y órganos, inmunosuprimidos, sometidos a hemodiálisis y enfermos renales; y su participación en las coinfecciones con VHC, VHD y HIV, así como la respectiva necesidad de desarrollo e incorporación en los protocolos de investigación y tratamiento de nuevas tecnologías para su detección.
REFERENCIAS
1 Mendes TF. Um século de vírus B. Mod Hepatol.1984;9(1):1-6. [ Links ]
2 International Committee on Taxonomy of Viruses. Virus Taxonomy: 2015 Release [Internet]. London: ICTV; 2015 [cited 2016 Nov 18]. Available from: Available from: https://talk.ictvonline.org/taxonomy/p/taxonomy_releases . [ Links ]
3 Hoofnagle JH, Seeff LB, Bales ZB, Zimmerman HJ. Type B hepatitis after transfusion with blood containing antibody to hepatitis B core antigen. N Engl J Med. 1978 Jun;298(25):1379-83. Doi: 10.1056/NEJM197806222982502 [Link] [ Links ]
4 Cacciola I, Pollicino T, Squadrito G, Cerenzia G, Orlando ME, Raimondo G. Occult hepatitis B virus infection in patients with chronic hepatitis C liver disease. N Engl J Med. 1999 Jul;341(1):22-6. Doi: 10.1056/NEJM199907013410104 [Link] [ Links ]
5 Noborg U, Gusdal A, Horal P, Lindh M. Levels of viraemia in subjects with serological markers of past or chronic hepatitis B virus infection. Scand J Infect Dis. 2000;32(3):249-52. Doi: 10.1080/00365540050165866 [Link] [ Links ]
6 Raimondo G, Allain JP, Brunetto MR, Buendia MA, Chen DS, Colombo M, et al. Statements from the Taormina expert meeting on occult hepatitis B virus infection. J Hepatol. 2008 Oct;49(4):652-7. Doi: 10.1016/j.jhep.2008.07.014 [Link] [ Links ]
7 Raimondo G, Pollicino T, Squadrito G. Clinical virology of hepatitis B virus infection. J Hepatol. 2003;39 Suppl 1:S26-30. Doi: 10.1016/S0168-8278(03)00135-1 [Link] [ Links ]
8 Lok ASF. Occult hepatitis B virus infection: diagnosis, implications and management? J Gastroenterol Hepatol. 2004 Dec;19(7):S114-7. Doi: 10.1111/j.1440-1746.2004.03657.x [Link] [ Links ]
9 Chen CJ. Time-dependent events in natural history of occult hepatitis B virus infection: the importance of population-based long-term follow-up study with repeated measurements. J Hepatol. 2005 Apr;42(4):438-40. Doi: 10.1016/j.jhep.2005.01.003 [Link] [ Links ]
10 Chemin I, Trépo C. Clinical impact of occult HBV infections. J Clin Virol. 2005 Dec;34 Suppl 1:S15-21. Doi: 10.1016/S1386-6532(05)80005-8 [Link] [ Links ]
11 Fabris P, Brown D, Tositti G, Bozzola L, Giordani MT, Bevilacqua P, et al. Occult hepatitis B virus infection does not affect liver histology or response to therapy with interferon alpha and ribavirin in intravenous drug users with chronic hepatitis C. J Clin Virol. 2004 Mar;29(3):160-6. Doi: 10.1016/S1386-6532(03)00117-3 [Link] [ Links ]
12 Chazouillères O, Mamish D, Kim M, Carey K, Wright TL, Ferrell L, et al. “Occult” hepatitis B virus as source of infection in liver transplant recipients. Lancet. 1994 Jan;343(8890):142-6. Doi: 10.1016/S0140-6736(94)90934-2 [Link] [ Links ]
13 Dickson RC, Everhart JE, Lake JR, Wei Y, Seaberg EC, Wiesner RH, et al. Transmission of hepatitis B by transplantation of livers from donors positive for antibody to hepatitis B core antigen. Gastroenterology. 1997 Nov;113(5):1668-74. Doi: 10.1053/gast.1997.v113.pm9352871 [Link] [ Links ]
14 Uemoto S, Sugiyama K, Marusawa H, Inomata Y, Asonuma K, Egawa H, et al. Transmission of hepatitis B virus from hepatitis B core antibody-positive donors in living related liver transplants. Transplantation. 1998 Feb;65(4):494-9. [Link] [ Links ]
15 Nunes J, Marinho RT, Fonseca JE, Silva JAP, Velosa J. Prophylaxis of hepatitis B reactivation with immunosuppressive therapy in rheumatic diseases. Orientations for clinical practice. Acta Reumatol Port. 2011 Apr-Jun;36(2):110-8. [Link] [ Links ]
16 Mutimer D, Shaw J, Neuberger J, Skidmore S, Martin B, Hubscher S, et al. Failure to incriminate hepatitis B, hepatitis C, and hepatitis E viruses in the aetiology of fulminant non-A non-B hepatitis. Gut. 1995 Mar;36(3):433-6. Doi: 10.1136/gut.36.3.433 [Link] [ Links ]
17 Mason A, Sallie R, Perrilo R, Rayner A, Xu L, Dohner DE, et al. Prevalence of herpesviridae and hepatitis B virus DNA in the liver of patients with non-A, non-B fulminant hepatic failure. Hepatology. 1996 Dec;24(6):1361-5. Doi: 10.1002/hep.510240608 [Link] [ Links ]
18 Teo EK, Ostapowicz G, Hussain M, Lee WM, Fontana RJ, Lok ASF. Hepatitis B infection in patients with acute liver failure in the United State. Hepatology. 2001 Apr;33(4):972-6. Doi: 10.1053/jhep.2001.23065 [Link] [ Links ]
19 Tamori A, Nishiguchi S, Kubo S, Enomoto M, Koh N, Takeda T, et al. Sequencing of human-viral DNA junctions in hepatocellular carcinoma from patients with HCV and occult HBV infection. J Med Virol. 2003 Apr;69(4):475-8. Doi: 10.1002/jmv.10334 [Link] [ Links ]
20 Shibata Y, Kanata K, Tsuruta S, Hamasaki K, Hayashida Y, Kato Y, et al. Detection of hepatitis B virus X-region DNA in liver tissue from patients with hepatitis C virus-associated cirrhosis who subsequently developed hepatocellular carcinoma. Int J Oncol. 1999 Jun;14(6):1153-6. Doi: 10.3892/ijo.14.6.1153 [Link] [ Links ]
21 Kannangai R, Molmenti E, Arrazola L, Klein A, Choti M, Thomas DL, et al. Occult hepatitis B viral DNA in liver carcinomas from a region with a low prevalence of chronic hepatitis B infection. J Viral Hepat. 2004 Jul;11(4):297-301. Doi: 10.1111/j.1365-2893.2004.00502.x [Link] [ Links ]
22 Chen L, Zhao H, Yang X, Gao JY, Cheng J. HBsAg-negative hepatitis B virus infection and hepatocellular carcinoma. Discov Med. 2014 Oct;18(99):189-93. [Link] [ Links ]
23 Selim HS, Abou-Donia HA, Taha HA, El Azab GI, Bakry AF. Role of occult hepatitis B virus in chronic hepatitis C patients with flare of liver enzymes. Eur J Intern Med. 2011 Apr;22(2):187-90. Doi: 10.1016/j.ejim.2010.12.001 [Link] [ Links ]
24 Delfino CM, Eirin ME, Berini C, Malan R, Gentile E, Castillo A, et al. HDAg-L variants in covert hepatitis D and HBV occult infection among Amerindians of Argentina: new insights. J Clin Virol. 2012 Jul;54(3):223-8. Doi: 10.1016/j.jcv.2012.04.014 [Link] [ Links ]
25 Thio CL, Seaberg EC, Skolasky Jr R, Phair J, Visscher B, Muñoz A, et al. HIV-1, hepatitis B virus, and risk of liver-related mortality in the Multicenter Cohort Study (MACS). Lancet. 2002 Dec;360(9349):1921-6. Doi: 10.1016/S0140-6736(02)11913-1 [Link] [ Links ]
26 Pourkarim MR, Lemey P, Amini-Bavil-Olyaee S, Houspie L, Verbeeck J, Rahman M, et al. Molecular characterization of hepatitis B virus strains circulating in Belgian patients co-infected with HIV and HBV: overt and occult infection. J Med Virol. 2011 Nov;83(11):1876-84. Doi: 10.1002/jmv.22174 [Link] [ Links ]
27 Aghakhani A, Banifazl M, Kalantar E, Eslamifar A, Ahmadi F, Razeghi E, et al. Occult hepatitis B virus infection in hemodialysis patients with isolated hepatitis B core antibody: a multicenter study. Ther Apher Dial. 2010 Jun;14(3):349-53. Doi: 10.1111/j.1744-9987.2009.00798.x [Link] [ Links ]
28 Motta JS, Mello FC, Lago BV, Perez RM, Gomes SA, Figueiredo FF. Occult hepatitis B virus infection and lamivudine-resistant mutations in isolates from renal patients undergoing hemodialysis. J Gastroenterol Hepatol. 2010 Jan;25(1):101-6. Doi: 10.1111/j.1440-1746.2009.05972.x [Link] [ Links ]
29 Said ZNA. An overview of occult hepatitis B virus infection. World J Gastroenterol. 2011 Apr;17(15):1927-38. Doi: 10.3748/wjg.v17.i15.1927 [Link] [ Links ]
30 Sav T, Gursoy S, Torun E, Sav NM, Unal A, Oymak O, et al. Occult HBV infection in continuous ambulatory peritoneal dialysis and hemodialysis patients. Ren Fail. 2010 Jan;32(1):74-7. Doi: 10.3109/08860220903391242 [Link] [ Links ]
31 Peres AA, Dias EA, Chesky M, Alvares-da-Silva MR, Jobim LF, Gonçalves LF, et al. Occult hepatitis B in renal transplant patients. Transpl Infect Dis. 2005 Jun;7(2):51-6. Doi: 10.1111/j.1399-3062.2005.00091.x [Link] [ Links ]
32 Bae E, Park CH, Ki CS, Kim SJ, Huh W, Oh HY, et al. Prevalence and clinical significance of occult hepatitis B virus infection among renal transplant recipients in Korea. Scand J Infect Dis. 2012 Oct;44(10):788-92. Doi: 10.3109/00365548.2012.680488 [Link] [ Links ]
33 Albuquerque ACC, Coelho MRCD, Lemos MF, Moreira RC. Occult hepatitis B virus infection in hemodialysis patients in Recife, State of Pernambuco, Brazil. Rev Soc Bras Med Trop. 2012 Sep-Oct;45(5):558-62. Doi: 10.1590/S0037-86822012000500004 [Link] [ Links ]
34 Franz C, Perez RM, Zalis MG, Zalona ACJ, Rocha PTMCA, Gonçalves RT, et al. Prevalence of occult hepatitis B virus infection in kidney transplant recipients. Mem Inst Oswaldo Cruz. 2013 Aug;108(5):657-60. Doi: 10.1590/0074-0276108052013019 [Link] [ Links ]
35 Rios-Ocampo WA, Cortes-Mancera F, Olarte JC, Soto A, Navas MC. Occult hepatitis B virus infection among blood donors in Colombia. Virol J. 2014;11:206. Doi: 10.1186/s12985-014-0206-z [Link] [ Links ]
36 Oluyinka OO, Van Tong H, Tien SB, Fagbami AH, Adekanle O, Ojurongbe O, et al. Occult hepatitis B virus infection in Nigerian blood donors and hepatitis B virus transmission risks. PLoS One. 2015 Jul;10(7):e0131912. Doi: 10.1371/journal.pone.0131912 [Link] [ Links ]
37 Ferreira RC. Infecção pelo vírus da hepatite B em usuários de drogas ilícitas na Região Centro-Oeste do Brasil: aspectos epidemiológicos e moleculares [tese]. Goiânia (GO): Universidade do Estado de Goiás, Instituto de Patologia Tropical e Saúde Pública; 2008. 96 p. [Link] [ Links ]
38 Instituto Brasileiro de Geografia e Estatística. Censo demográfico 2010 [Internet]. Rio de Janeiro: IBGE; 2010 [citado 2016 nov 18]. Disponível em: Disponível em: http://www.ibge.gov.br/home/estatistica/populacao/censo2010/calendario.shtm . [ Links ]
39 Nunes HM, Soares MCP, Brito EMF, Alves MM, Souza OSC, Borges AM, et al. Prevalência de infecção pelos vírus das hepatites A, B, C e D na demanda de um hospital no Município de Juruti, oeste do Estado do Pará, Brasil. Rev Pan-Amaz Saude. 2010 jun;1(2):105-11. Doi: 10.5123/S2176-62232010000200013 [Link] [ Links ]
40 Sitnik R, Pinho JRR, Bertolini DA, Bernardini AP, Silva LC, Carrilho FJ. Hepatitis B virus genotypes and precore and core mutants in Brazilian patients. J Clin Microbiol. 2004 Jun;42(6):2455-60. Doi: 10.1128/JCM.42.6.2455-2460.2004 [Link] [ Links ]
41 Gomes-Gouvêa MS, Soares MCP, Bensabath G, Carvalho-Mello IMVG, Brito EMF, Souza OSC, et al. Hepatitis B virus and hepatitis delta virus genotypes in outbreaks of fulminant hepatitis (Labrea black fever) in the wester Brazilian Amazon region. J Gen Virol. 2009 Nov;90(Pt 11):2638-43. Doi: 10.1099/vir.0.013615-0 [Link] [ Links ]
42 Saitou N, Nei M. The neighbor-joining method: a new method for reconstructing phylogenetic trees. Mol Biol Evol. 1987 Jul;4(4):406-25. [Link] [ Links ]
43 Morice Y, Roulot D, Grando V, Stirnemann J, Gault E, Jeantils V, et al. Phylogenetic analyses confirm the high prevalence of hepatitis C virus (HCV) type 4 in the Seine-Saint-Denis district (France) and indicate seven different HCV-4 subtypes linked to two different epidemiological patterns. J Gen Virol. 2001 May;82(Pt 5):1001-12. Doi: 10.1099/0022-1317-82-5-1001 [Link] [ Links ]
44 Sandres-Sauné K, Deny P, Pasquier C, Thibaut V, Duverlie G, Izopet J. Determining hepatitis C genotype by analyzing the sequence of the NS5b region. J Virol Methods. 2003 May;109(2):187-93. Doi: 10.1016/S0166-0934(03)00070-3 [Link] [ Links ]
45 Ayres M, Ayres Jr M, Ayres DL, Santos AS. BioEstat 5.0: aplicações estatísticas nas áreas das ciências biológicas e médicas. Belém: Sociedade Civil Mamirauá; 2007. 364 p. [ Links ]
46 Brasil. Ministério da Saúde. Consenho Nacional de Saúde. Comissão Nacional de Ética em Pesquisa. Resolução CNS n° 466, de 12 de dezembro de 2012. Aprova diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília (DF), 2013 jun 13. Seção 1:59. [Link] [ Links ]
47 Pereira LMMB, Martelli CMT, Merchán-Hamann E, Montarroyos UR, Braga MC, Lima MLC, et al. Population-based multicentric survey of hepatitis B infection and risk factor differences among three regions in Brazil. Am J Trop Med Hyg. 2009 Aug;81(2):240-7. Doi: 10.4269/ajtmh.2009.81.240 [Link] [ Links ]
48 Sunbul M. Hepatitis B virus genotypes: global distribution and clinical importance. World J Gastroenterol. 2014 May;20(18):5427-34. Doi: 10.3748/wjg.v20.i18.5427 [Link] [ Links ]
49 Carrilho FJ, Moraes CR, Pinho JRR, Mello IMVGC, Bertolini DA, Lemos MF, et al. Hepatitis B virus infection in haemodialysis centres from Santa Catarina State, Southern Brazil. Predictive risk factors for infection and molecular epidemiology. BMC Public Health. 2004 Apr;4:13. Doi: 10.1186/1471-2458-4-13 [Link] [ Links ]
50 Becker CE, Mattos AA, Bogo MR, Branco F, Sitnik R, Kretzmann NA. Genotyping of hepatitis B virus in a cohort of patients evaluated in a hospital of Porto Alegre, south of Brazil. Arq Gastroenterol. 2010 Jan-Mar;47(1):13-7. Doi: 10.1590/S0004-28032010000100003 [Link] [ Links ]
51 Bertolini DA, Gomes-Gouvêa MS,Carvalho-Mello IMVG, Saraceni CP, Sitnik R,Grazziotin FG, et al. Hepatitis B virus genotypes from European origin explains the high endemicity found in some areas from southern Brazil. Infect Genet Evol. 2012 Aug;12(6):1295-304. Doi: 10.1016/j.meegid.2012.04.009 [Link] [ Links ]
52 Nabuco LC, Mello FCA, Gomes SA, Perez RM, Soares JAS, Coelho HSM, et al. Hepatitis B virus genotypes in Southeast Brazil and its relationship with histological features. Mem Inst Oswaldo Cruz. 2012 Sep;107(6):785-9. Doi: 10.1590/S0074-02762012000600013 [Link] [ Links ]
53 Moura IF, Lopes EP, Alvarado-Mora MV, Pinho JR, Carrilho FJ. Phylogenetic analysis and subgenotypic distribution of the hepatitis B virus in Recife, Brazil. Infect Genet Evol. 2013 Mar;14:195-9. Doi: 10.1016/j.meegid.2012.11.022 [Link] [ Links ]
54 Conde SRSS, Móia LJP, Barbosa MSB, Amaral ISA, Miranda ECBM, Soares MCP, et al. Prevalência de genótipos e de mutantes pré-core A-1896 do vírus da hepatite B e suas implicações na hepatite crônica, em uma população da Amazônia oriental. Rev Soc Bras Med Trop. 2004;37 supl 2:33-9. Doi: 10.1590/S0037-86822004000700005 [Link] [ Links ]
55 Conde SRSS, Pinheiro LM, Lemos JAR, Demachki S, Araújo MT, Soares MCP, et al. Prevalence of genotypes and sub-genotypes of the hepatitis B virus in a population of the Brazilian Amazon Region (Pará State). J Antivir Antiretrovir. 2003 Sep;5(5):108-12. Doi: 10.4172/jaa.1000072 [Link] [ Links ]
56 Viana S, Paraná R, Moreira RC, Compri AP, Macedo V. High prevalence of hepatitis B virus and hepatitis D virus in the Western Brazilian Amazon. Am J Trop Med Hyg. 2005 Oct;73(4):808-14. Doi: 10.4269/ajtmh.2005.73.808 [Link] [ Links ]
57 Dias ALB, Oliveira CMC, Castilho MC, Silva MSP, Braga WSM. Molecular characterization of the hepatitis B virus in autochthonous and endogenous populations in the Western Brazilian Amazon. Rev Soc Bras Med Trop. 2012 Jan-Feb;45(1):9-12. Doi: 10.1590/S0037-86822012000100003 [Link] [ Links ]
58 Souto FJD, Fontes CJF, Gaspar AMC. Prevalence of hepatitis B and C virus markers among malaria-exposed gold miners in Brazilian Amazon. Mem Inst Oswaldo Cruz. 2001 Aug;96(6):751-5. Doi: 10.1590/S0074-02762001000600001 [Link] [ Links ]
59 Silva CO, Azevedo MSP, Soares CMA, Martins RMB, Ramos CH, Daher RR, et al. Seroprevalence of hepatitis B virus infection in individuals with clinical evidence of hepatitis in Goiânia, Goiás. Detection of viral DNA and determination of subtypes. Rev Inst Med Trop S Paulo. 2002 Nov-Dec;44(6):331-4. Doi: 10.1590/S0036-46652002000600007 [Link] [ Links ]
60 Weber B. Genetic variability of the S gene of hepatitis B virus: clinical and diagnostic impact. J Clin Virol. 2005 Feb;32(2):102-12. Doi: 10.1016/j.jcv.2004.10.008 [Link] [ Links ]
61 Kao JH, Chen PJ, Lai MY, Chen DS. Occult hepatitis B virus infection and clinical outcomes of patients with chronic hepatitis C. J Clin Microbiol. 2002 Nov;40(11):4068-71. Doi: 10.1128/JCM.40.11.4068-4071.2002 [Link] [ Links ]
62 Kramvis A, Kew M, François G. Hepatitis B virus genotypes. Vaccine. 2005 Mar;23(19):2409-23. Doi: 10.1016/j.vaccine.2004.10.045 [Link] [ Links ]
63 Barbosa TC. Resistência ao adefovir, entecavir e telbivudina no tratamento da hepatite B crônica [monografia]. Salvador (BA): Universidade Federal da Bahia, Faculdade de Medicina da Bahia; 2013. 38 p. [Link] [ Links ]
64 Lee YS, Suh DJ, Lim YS, Jung SW, Kim KM, Lee HC, et al. Increased risk of adefovir resistance in patients with lamivudine-resistant chronic hepatitis B after 48 weeks of adefovir dipivoxil monotherapy. Hepatology. 2006 Jun;43(6):1385-91. Doi: 10.1002/hep.21189 [Link] [ Links ]
65 Yokosuka O, Takaguchi K, Fujioka S, Shindo M, Chayama K, Kobashi H, et al. Long-term use of entecavir in nucleoside-naïve Japanese patients with chronic hepatitis B infection. J Hepatol. 2010 Jun;52(6):791-9. Doi: 10.1016/j.jhep.2009.12.036 [Link] [ Links ]
66 Kao JH, Chen PJ, Lai MY, Chen DS. Hepatitis B genotypes correlate with clinical outcomes in patients with chronic hepatitis B. Gastroenterology. 2000 Mar;118(3):554-9. Doi: 10.1016/S0016-5085(00)70261-7 [Link] [ Links ]
67 Neau D, Winnock M, Jouvencel AC, Faure M, Castéra L, Legrand E, et al. Occult hepatitis B virus infection in HIV-infected patients with isolated antibodies to hepatitis B core antigen: aquitaine cohort, 2002-2003. Clin Infect Dis. 2005 Mar;40(5):750-3. Doi: 10.1086/427882 [Link] [ Links ]
68 Barros Júnior GM, Braga WSM, Oliveira CMC, Castilho MC, Araújo JR. Hepatite crônica B oculta: prevalência e aspectos clínicos em população de elevada endemicidade de infecção pelo vírus da hepatite B na Amazônia ocidental brasileira. Rev Soc Bras Med Trop. 2008 jan-dez;41(6):596-601. Doi: 10.1590/S0037-86822008000600010 [Link] [ Links ]
69 Ocana S, Casas ML, Buhigas I, Lledo JL. Diagnostic strategy for occult hepatitis B virus infection. World J Gastroenterol. 2011 Mar;17(12):1553-7. Doi: 10.3748/wjg.v17.i12.1553 [Link] [ Links ]
70 Escobedo-Melendez G, Panduro A, Fierro NA, Roman S. High prevalence of occult hepatitis B virus genotype H infection among children with clinical hepatitis in west Mexico. Mem Inst Oswaldo Cruz. 2014 Sep;109(6):728-37. Doi: 10.1590/0074-0276140058 [Link] [ Links ]
71 Ministério da Saúde (BR). Departamento de Informática do Sistema Único de Saúde. Cobertura vacinal contra hepatite B, por faixa etária, na série histórica de terceiras doses aplicadas, Estados, Região e Brasil, 1994 a 2011 [Internet]. Brasília: Ministério da Saúde; 2012 [citado 2016 jan 26]. Disponível em: Disponível em: http://pni.datasus.gov.br/download_ sh_Hepatite_B_2011.asp . [ Links ]
72 Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Coordenação Geral do Programa Nacional de Imunizações. Nota Informativa nº 149/CGPNI/DEVIT/SVS/MS, 2015. Informa as mudanças no Calendário Nacional de Vacinação para o ano de 2016. Brasília: DEVIT; 2015. [Link] [ Links ]
73 Minuk GY, Sun DF, Uhanova J, Zhang M, Caouette S, Nicolle LE, et al. Occult hepatitis B virus infection in a North American community-based population. J Hepatol. 2005 Apr;42(4):480-5. Doi: 10.1016/j.jhep.2004.11.037 [Link] [ Links ]
74 Kim SM, Lee KS, Park CJ, Lee JY, Kim KH, Park JY, et al. Prevalence of occult HBV infection among subjects with normal serum ALT levels in Korea. J Infect. 2007 Feb;54(2):185-91. Doi: 10.1016/j.jinf.2006.02.002 [Link] [ Links ]
75 Raimondo G, Navarra G, Mondello S, Costantino L, Colloredo G, Cucinotta E, et al. Occult hepatitis B virus in liver tissue of individuals without hepatic disease. J Hepatol. 2008 May;48(5):743-6. Doi: 10.1016/j.jhep.2008.01.023 [Link] [ Links ]
76 Kang SY, Kim MH, Lee WI. The prevalence of “anti-HBc alone” and HBV DNA detection among anti-HBc alone in Korea. J Med Virol. 2010 Sep;82(9):1508-14. Doi: 10.1002/jmv.21862 [Link] [ Links ]
77 Nagakawa O, Miyatomi Y, Shigeta Y, Inayama E, Murakami K, Sakai T, et al. Occult hepatitis B virus infection in Japanese chronic hemodialysis patients. Ther Apher Dial. 2013 Jun;17(3):289-92. Doi: 10.1111/1744-9987.12006 [Link] [ Links ]
78 Martinez MC, Kok CC, Baleriola C, Robertson P, Rawlinson WD. Investigation of occult hepatitis B virus infection in anti-HBc positive patients from a liver clinic. PLoS One. 2015 Mar;10(3):e0117275. Doi: 10.1371/journal.pone.0117275 [Link] [ Links ]
79 Zhang Z, Zhang L, Dai Y, Jin L, Sun B, Su Q, et al. Occult hepatitis B virus infection among people with a family history of chronic hepatitis B virus infection. J Med Virol. 2015 Nov;87(11):1890-8. Doi: 10.1002/jmv.24245 [Link] [ Links ]
Cómo citar este artículo / How to cite this article: Nunes HM, Soares MCP, Sarmento VP, Malheiros AP, Nunes MRT. Infección oculta por el virus de la hepatitis B en comunidad amazónica sometida a intenso flujo migratorio, estado de Pará, Brasil. Rev Pan-Amaz Saude. 2017 jul-sept;8(3):1-15. Doi: http://dx.doi.org/10.5123/S2176-62232017000300005
Recibido: 25 de Abril de 2016; Aprobado: 07 de Diciembre de 2016











 texto em
texto em 


