INTRODUÇÃO
As larvas de trematódeos, também denominadas de cercárias, são organismos de vida livre que emergem de moluscos aquáticos, geralmente em grande quantidade, fazendo parte do zooplâncton. Ao longo da sua evolução, diversas adaptações biológicas foram surgindo para potencializar ao máximo o encontro das cercárias com seus respectivos hospedeiros. Entre essas adaptações estão a grande replicação desses organismos no interior dos moluscos, a liberação sincronizada das cercárias em momentos que favoreçam o encontro com os seus hospedeiros definitivos e o desenvolvimento de respostas a estímulos físicos, químicos e ambientais em associação à presença desses hospedeiros1,2,3,4.
Os ciclos de vida dos trematódeos digenéticos são complexos, havendo duas principais etapas: a reprodução sexuada nos hospedeiros definitivos (em sua maioria vertebrados); e a reprodução assexuada em hospedeiros intermediários (principalmente gastrópodes aquáticos)5. Essas larvas são formadas durante a etapa de reprodução assexuada, por meio da formação de rédias e/ou esporocistos, por um processo denominado de poliembrionia2,6.
Diversos tipos e formas larvais de trematódeos oriundos de diferentes espécies de moluscos de água doce no Brasil foram descritos e caracterizados inicialmente por diferentes autores7,8,9,10,11, principalmente nos estados das Regiões Sul e Sudeste12,13,14,15,16. Desses moluscos, destaca-se o caramujo do gênero Biomphalaria, pois ele atua como hospedeiro intermediário do Schistosoma mansoni, agente etiológico da esquistossomose mansônica, além de albergar outros tipos de larvas emergentes17.
Entretanto, diferentes cercárias, já identificadas atualmente, apresentam importância médica e veterinária, podendo transmitir dois grupos de doenças: as que possuem transmissão através da penetração direta na pele, como a esquistossomose18; e as que são transmitidas pelo consumo de água e alimentos crus ou malcozidos contendo esses parasitos, como a clonorquiose, a heterofiose e a paragonimose19,20.
Para a região da Amazônia Legal brasileira, poucos estudos foram realizados tentando conhecer a biodiversidade das larvas de trematódeos, a exemplo da pesquisa realizada por Cantanhede et al.21. Essa área abrange os estados da Região Norte, além dos estados do Mato Grosso e Maranhão, a oeste do Meridiano 4422; e é detentora de uma imensa variedade biológica de espécies, ecossistemas e recursos energéticos23.
Na porção leste dessa Região, onde o estado do Maranhão está localizado, encontram-se alguns biomas, como os campos alagados da Baixada Ocidental e o Litoral Norte do Estado, que, devido aos seus aspectos sociais, naturais e geomorfológicos, favorecem a manutenção e abundância de moluscos límnicos, o que consequentemente aumenta as possibilidades de se tornarem potenciais hospedeiros de trematódeos digenéticos24. Sendo assim, a riqueza taxonômica de larvas de helmintos parasitos, para a região, encontra-se subestimada. Desse modo, objetivou-se realizar o levantamento da biodiversidade de larvas de trematódeos eliminadas pelos caramujos Biomphalaria spp., obtidos de criadouros naturais de duas localidades do Maranhão, na Amazônia Legal, Brasil.
MATERIAIS E MÉTODOS
O presente estudo foi realizado durante o período de fevereiro de 2015 a janeiro de 2016 em dois municípios do estado do Maranhão que pertencem à porção leste da Amazônia Legal brasileira: São Bento e São Luís. O município de São Bento (2°40'00"S e 44°43"O) está localizado na microrregião da Baixada Ocidental maranhense e mesorregião Norte maranhense, possuindo uma área de 585,3 km2 e ambiente caracterizado por apresentar campos naturalmente alagados e clima tropical úmido, destacando-se duas estações climáticas: uma chuvosa, entre janeiro e julho; e outra seca, entre agosto e dezembro25. O município de São Luís (2º31'LS e 44º18'LO) está localizado entre as baías de São Marcos e São José de Ribamar, possui área de 822,1 km² e apresenta clima tropical quente e úmido, com duas estações: a chuvosa (janeiro a junho) e a de estiagem (julho a dezembro)26 (Figura 1). Ambos os municípios apresentam bairros periféricos com condições precárias de vida, entre as quais se destacam a falta de saneamento básico, a grande concentração populacional e a presença de coleções hídricas contendo elevado número de caramujos Biomphalaria spp.27.
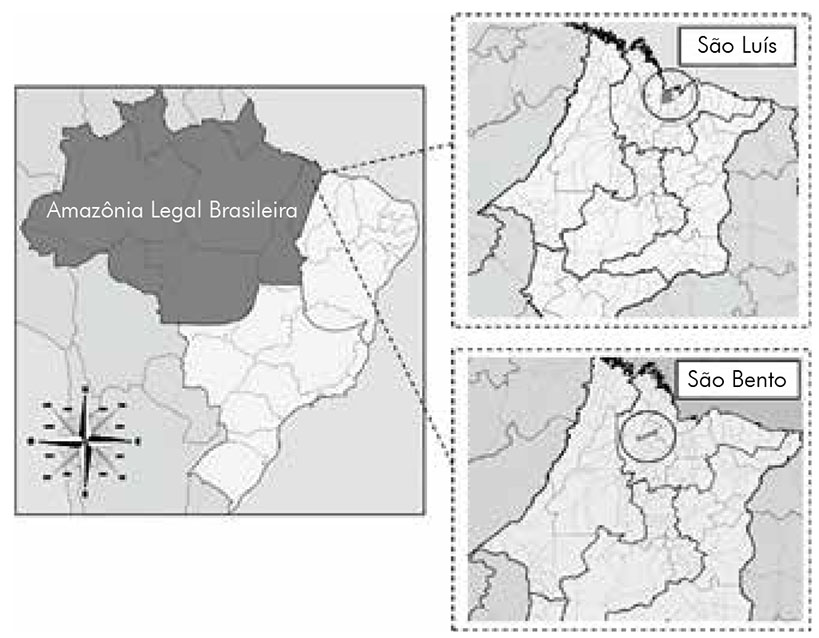
Fonte: Adaptado de IBGE, 201019.
Figura 1 - Localização da área de estudo, estado do Maranhão, porção leste da Amazônia Legal brasileira, com destaque para os dois municípios onde foram realizadas as coletas
A coleta dos moluscos foi realizada bimestralmente, durante 30 min, em três pontos (área de 15 a 20 m) distintos em cada município, com auxílio de conchas de capturas apropriadas e pinças metálicas. A escolha dos pontos de coleta foi feita de modo a se obter maior diversidade de ambientes que poderiam funcionar como criadouros. As coordenadas geográficas foram obtidas por meio de sistema de posicionamento global (global positioning system - GPS). Os moluscos coletados foram armazenados em recipientes plásticos, que foram etiquetados e conduzidos ao Laboratório de Parasitologia Humana da Universidade Estadual do Maranhão (UEMA), onde foram mantidos em aquários de vidro com água desclorada e alimentados adequadamente com folhas de alface, segundo o que preconiza Malek28. Aproximadamente 10% de exemplares vivos foram sacrificados em água a 70 °C, para possibilitar a retirada das partes moles, que foram fixadas em solução de Railliet-Henry, que posteriormente foram dissecadas sob estereomicroscópio. Para a identificação das espécies, foram considerados parâmetros conquiliológicos e morfológicos internos29,30.
Para a constatação da eliminação de larvas de trematódeos, os moluscos foram individualmente colocados em recipientes de vidro, com cerca de 5 mL de água desclorada, e expostos à luz e ao calor de três lâmpadas incandescentes (de 60 W) durante 4 h31. Para a exposição no escuro, foram deixados dentro de uma caixa de isopor sem tampa, na ausência de luz e calor durante 12 h e, em seguida, analisados em lupa microscópica. Os moluscos negativos ao teste foram expostos aos mesmos procedimentos semanalmente, durante 30 dias.
As larvas encontradas foram coletadas com auxílio de micropipeta e utilizadas para a confecção de preparações a fresco, que foram coradas com solução de lugol diluída e por corantes vitais31, sendo, em seguida, montadas sob lâmina e lamínula. Após isso, foram conduzidas ao microscópio óptico para caracterização e identificação morfológica, segundo chaves de identificação taxonômicas de diferentes autores5,32,33,34,35,36. Todas as coletas foram autorizadas pelo Instituto Chico Mendes de Conservação da Biodiversidade, por meio do Sistema de Autorização e Informação em Biodiversidade, de acordo com a licença n° 40025/1 e o registro no 54354, válidos para o período de 2015/2016.
RESULTADOS
Foram coletados moluscos em três pontos de cada município, sendo registradas as seguintes coordenadas geográficas para São Luís: P1 (Bairro Tirirical - 2º33'32.5"S 44º12'54.9"O), caracterizado pela presença de alterações antrópicas visíveis, como assoreamento, poluição por dejetos urbanos e retirada de mata ciliar (Figura 2A); P2 (Bairro Aurora - 2º34'09.0"S 44º13'24.5"O), que apresenta características ambientais mais conservadas, como a presença de mata ciliar do tipo secundária, a ausência de erosão nas margens e assoreamento, além de poluição do tipo urbana pouco evidente (Figura 2B); e P3 (Bairro Sá Viana - 2º32'47.5"S 44º14'06.9"O), local com um acentuado aglomerado urbano, com a presença de grande quantidade de resíduos domésticos (Figura 2C). Em São Bento: P1 (Porto Grande - 2º42'0"S 44º49'13"O), localizado às margens de um dos grandes lagos naturalmente alagáveis do Município, mas onde, devido à proximidade de casas nos arredores, o despejo de esgoto doméstico era evidente, bem como a presença de resíduos urbanos diversos (Figura 3A); P2 (Outra Banda - 2º41'42"S 44º49'24"O), um terreno baldio caracterizado por apresentar moderada quantidade de resíduos domésticos, bem como a presença de grande quantidade de habitações próximas (Figura 3B); e P3 (Aeroporto - 2º42'17"S 44º50'30"O), que apresentou características ambientais visualmente conservadas (Figura 3C).

A: Ponto 1 - Bairro Tirirical; B: Ponto 2 - Bairro Aurora; C: Ponto 3 - Bairro Sá Viana.
Figura 2 - Pontos de coleta nos criadouros naturais de Biomphalaria spp. do município de São Luís, estado do Maranhão, Brasil

A: Ponto 1 - Bairro Porto Grande; B: Ponto 2 - Bairro Outra Banda; C: Ponto 3 - Bairro Aeroporto.
Figura 3 - Pontos de coleta nos criadouros naturais de Biomphalaria spp. do município de São Bento, estado do Maranhão, Brasil
Em São Luís, coletou-se um total de 2.661 moluscos, que estavam distribuídos nos pontos de coleta da seguinte forma: P1, 432 (16,23%); P2, 172 (6,46%); e P3, 2.057 (77,31%). No município de São Bento, 1.726 moluscos foram capturados e registrados, como se segue: P1, 326 (18,89%); P2, 1.214 (70,33%); e P3, 186 (10,78%). Em ambos os municípios, foram encontrados exemplares de duas espécies de Biomphalaria (Biomphalaria straminea e Biomphalaria glabrata).
A positividade desses moluscos para larvas de trematódeos, em São Luís, foi em 99/2.661 (3,72%) exemplares, com percentuais específicos nos criadouros: P1, 31/432 (7,17%), P2, 7/172 (4,07%) e P3, 61/2.057 (2,96%). Em São Bento, com 84/1.726 (4,87%) exemplares, distribuídos em percentuais específicos: P1, 29/326 (8,89%) e P2, 55/1.214 (4,53%); não houve moluscos positivos em P3 nessa localidade. Também não foram observados casos de coinfecção entre diferentes larvas de trematódeos nos moluscos dos Municípios.
A helmintofauna da região foi representada por seis famílias de larvas de trematódeos: Clinostomidae, Diplostomidae, Echinostomatidae, Schistosomatidae, Spirorchiidae e Strigeidae. Em São Luís, foram registradas todas essas, mas em São Bento não se obteve o registro das famílias Clinostomidae e Diplostomidae (Figura 4). Ressalta-se ainda que as cercárias da família Schistosomatidae identificadas em São Luís no P3 e em São Bento em P1 e P2 eram todas da espécie S. mansoni, o que constitui uma realidade preocupante para a população, por se tratarem de pontos próximos a residências.
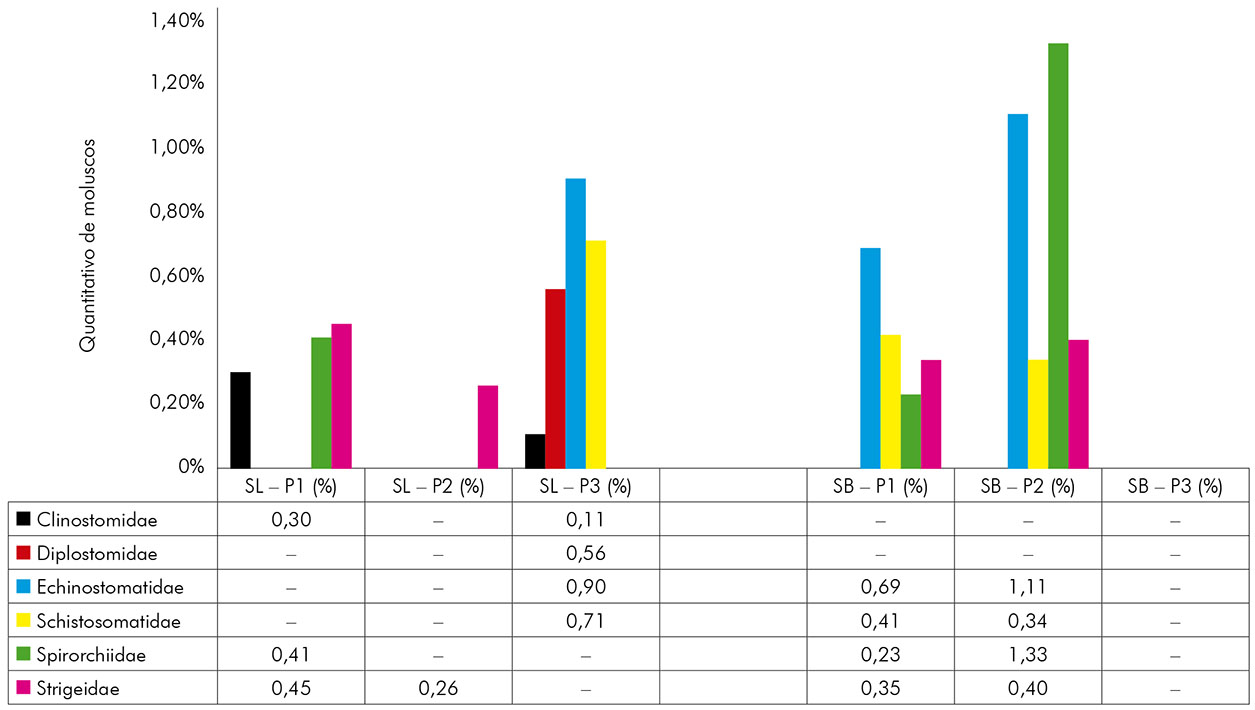
SL: São Luís; SB: São Bento; Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
Figura 4 - Percentual de moluscos positivos para seis famílias de larvas de trematódeos encontradas nos municípios de São Luís e São Bento, estado do Maranhão, Brasil, durante o período de fevereiro de 2015 a janeiro de 2016
As larvas de trematódeos, em São Luís, foram eliminadas com um percentual de 1,95% (52/2.661) de B. straminea e 1,76% (47/2.661) de B. glabrata. Por sua vez, em São Bento, foram eliminadas com percentual de 4,46% (77/1.726) de B. glabrata e 0,40% (7/1.726) de B. straminea (Tabela 1). Todas as formas larvais de trematódeos identificadas neste estudo, com exceção da cercária de S. mansoni, são consideradas primeiros registros para o município de São Luís, enquanto que, para o município de São Bento, obteve-se o primeiro relato para a família Strigeidae.
Tabela 1 - Percentual de diferentes larvas de trematódeos encontrados em exemplares de Biomphalaria spp. coletados nos municípios de São Luís e São Bento, estado do Maranhão, Brasil, entre fevereiro de 2015 e janeiro de 2016
| Larvas de trematódeos | Local | Molusco | Percentual de infecção |
|---|---|---|---|
| Clinostomidae | São Luís | B. straminea | 0,41% (11/2.661) |
| Diplostomidae | São Luís | B. straminea | 0,56% (15/2.661) |
| Echinostomatidae | São Luís | B. glabrata | 0,90% (24/2.661) |
| São Bento | B. glabrata | 1,80% (31/1.726) | |
| Schistosomatidae | São Luís | B. glabrata | 0,71% (19/2.661) |
| São Bento | B. glabrata | 0,75% (13/1.726) | |
| Spirorchiidae | São Luís | B. straminea B. glabrata | 0,26% (7/2.661) 0,15% (4/2.661) |
| São Bento | B. straminea B. glabrata | 0,40% (7/1.726) 1,16% (20/1.726) | |
| Strigeidae | São Luís | B. straminea | 0,71% (19/2.661) |
| São Bento | B. glabrata | 0,75% (13/1.726) |
DISCUSSÃO
Os pontos que apresentaram maior quantidade de caramujos coletados e maior índice de positividade para algum tipo de cercária, tanto em São Luís quanto em São Bento, foram os pontos (P3 e P2, respectivamente) localizados próximos às residências, sendo encontrados caramujos até mesmo em valas e córregos das calçadas de concreto (criadouro artificial). A elevada abundância de caramujos nesses locais pode estar correlacionada com sua preferência por habitat antropogênicos, ricos em matéria orgânica37,38. Em relação aos criadouros que apresentaram baixa abundância de caramujos, pode ser devido a fatores como a presença de substrato sujeito a modificações - por exemplo, a ocorrência de forte correnteza, evidenciada em P2 (São Luís) e P3 (São Bento) - possuindo, dessa forma, baixa disponibilidade de matéria orgânica, o que provavelmente estaria interferindo na oferta de alimento e, consequentemente, em uma menor colonização do criadouro39.
Em São Luís, houve maior percentual de moluscos eliminando cercárias das famílias Echinostomatidae (0,90%), Strigeidae (0,71%) e Schistosomatidae (0,71%), sendo essa última representada somente por cercárias causadoras da doença esquistossomose mansônica. Essas cercárias foram encontradas somente em P3, que ficava localizado em um bairro periférico da zona urbana de São Luís. Nesse mesmo local, Oliveira et al.40 realizaram um inquérito malacológico e detectaram seis planorbídeos contaminados pelo parasito, relatando a presença dessa parasitose na área.
Em P3 de São Luís, constatou-se uma maior biodiversidade de larvas, sendo encontrados quatro tipos distintos. Segundo Hudson et al.41 e Minguez et al.42, essa elevada diversidade e abundância de trematódeos em moluscos pode estar relacionada à presença de vários outros táxons de vertebrados necessários para a manutenção dos respectivos ciclos biológicos heteróxenos de diversos parasitos, indicando uma condição ambiental favorável em relação ao funcionamento trófico. Tal condição ambiental foi observada no referido ponto de coleta, o que provavelmente confirma essa hipótese.
Em São Bento, houve maior percentual de caramujos eliminando cercárias das famílias Echinostomatidae (1,80%) e Spirorchiidae (1,56%). Para o P2 desse município, verificou-se uma maior quantidade de eliminação dessas cercárias pelos moluscos. Desses planorbídeos, 0,75% (13/1.726) encontravam-se positivos para S. mansoni (Schistosomatidae), notificando também a presença da esquistossomose mansônica nessa localidade. Para esse município, Cantanhede et al.21 verificaram a biodiversidade de moluscos e de larvas de trematódeos, encontrando 0,22% (1/444) de B. glabrata eliminando cercárias de S. mansoni. Confirmou-se, assim como em São Luís, a presença desse parasito.
As taxas de eliminação de cercárias de S. mansoni por moluscos Biomphalaria spp., verificadas nesta pesquisa para P1 e P2 de São Bento, considerada uma área endêmica para a esquistossomose24,43, não foram elevadas quando comparadas às taxas de eliminação dessas mesmas cercárias pelos moluscos do P3 em São Luís. Isso pode estar relacionado com a elevada presença de larvas da família Echinostomatidae, eliminadas por moluscos desses pontos em São Bento, pois, segundo alguns autores44,45,46,47,48, cercárias dessa família podem interferir negativamente no ciclo biológico das formas larvais de S. mansoni, provocando alterações fisiológicas nos moluscos vetores que, possivelmente, impedem a instalação e evolução do miracídio, possuindo, assim, uma relação de antagonismo direto e/ou indireto com o mesmo.
Todavia, como a doença é constatada desde 1920 no município de São Bento, segundo Alvim43, a baixa ocorrência do parasito pode estar relacionada com a maioria da população vivendo com baixos níveis de parasitismo, devido a sucessivas reinfecções, não apresentando, assim, quantidade suficiente de ovos eliminados nas fezes, o que poderia diminuir a probabilidade de infecção dos caramujos.
Nos estudos de Souza et al.16 e Pinto e Melo5, as cercárias Strigeidae, Clinostomidae, Echinostomatidae e Spirorchiidae foram eliminadas de até três espécies de Biomphalaria (B. glabrata, B. straminea e Biomphalaria tenagophila). Já nos estudos de Silva e Melo49, Strigeidae e Diplostomidae foram eliminadas de B. glabrata e B. tenagophila. Em outros levantamentos e estudos, Schistosomatidae, Strigeidae e Diplostomatidae foram eliminadas somente de B. glabrata13,50; e Echinostomatidae e Strigeidae, de B. tenagophila17,51.
CONCLUSÃO
A porção oriental da Amazônia Legal brasileira, representada neste estudo pelos municípios maranhenses, São Bento e São Luís, apresentou elevada biodiversidade de larvas de trematódeos, sendo que os criadouros naturais que continham maior quantidade de caramujos infectados foram os mais próximos das residências. Não houve diferenças na diversidade das famílias de trematódeos eliminadas entre as duas espécies de Biomphalaria identificadas na região. Nesta pesquisa, foram relatados os primeiros registros de diferentes cercárias para ambos os municípios. Desse modo, maiores esforços para ampliação do conhecimento sobre essas formas evolutivas de trematódeos digenéticos na Região Amazônica devem ser realizados.










 texto em
texto em