INTRODUÇÃO
No mundo, a doença diarreica aguda (DDA) ainda se configura como um importante problema de saúde pública, representando uma das principais causas de morte em menores de 5 anos de idade1. Estudos afirmam que as taxas globais de mortes causadas por diarreia vêm declinando, em diversas regiões do mundo; porém, tal redução não é observada nas taxas de incidência da doença, uma vez que essa permanece diretamente relacionada às desigualdades socioeconômicas das populações2,3.
Os agentes causadores da DDA em crianças podem ser vírus, bactérias ou protozoários1,2. No Brasil, os agentes etiológicos de maior relevância clínica e epidemiológica são: Escherichia coli diarreiogênicas, rotavírus, Salmonella spp., Shigella spp., Campylobacter jejuni e Campylobacter coli, Cryptosporidium spp., Entamoeba histolytica e Giardia lamblia. No entanto, a etiologia das bactérias causadoras de diarreia difere dependendo da área geográfica e dos diferentes níveis de desenvolvimento econômico entre as regiões4,5,6,7,8.
Embora a diarreia seja um problema de saúde pública em todo o Brasil, as diferentes regiões do País apresentam variações nos registros da doença, sendo as Regiões Nordeste e Norte as que apresentam maior prevalência9. Ainda assim, no que se refere à Região Norte, os dados na literatura são raros10.
Em 2005, a vigilância epidemiológica do estado do Acre registrou um aumento considerável no número de casos de DDA no município de Rio Branco, caracterizando um surto da doença. Nesse ano, foram notificados 23.195 casos, num período de 10 meses, em uma área abrangente do Estado, sendo a maioria na capital. Observou-se, ainda, que 67,5% do total de notificações ocorreram entre crianças menores de 5 anos de idade, com o registro de 57 óbitos11.
Entre dezembro de 2011 e janeiro de 2012, a DDA voltou a ter destaque no cenário das doenças infecciosas ocorrentes no Acre, quando 12 crianças indígenas, entre 7 e 23 meses de idade, das etnias Kulina e Kaxinawá, foram a óbito por diarreia, atribuído a rotavírus, associado ao baixo peso e ao risco nutricional12.
É notória a participação dos enteropatógenos bacterianos na gênese das gastroenterites no mundo; todavia, dados desses agentes na epidemiologia da DDA, na Região Norte do Brasil, em especial no estado do Acre, ainda são bastante escassos. Assim, este estudo objetivou investigar a ocorrência de enteropatógenos bacterianos e sua importância na etiologia da DDA em crianças menores de 5 anos de idade, atendidas em unidades de saúde do município de Rio Branco em 2012.
MATERIAIS E MÉTODOS
Foram incluídas no estudo as crianças atendidas no projeto intitulado "Avaliação epidemiológica, clínica e molecular de enteropatógenos causadores de diarreia
aguda em crianças atendidas no Hospital da Criança e na Unidade de Pronto Atendimento do I e II Distrito, Rio Branco, Acre", realizado em 2012, através de cinco expedições de equipes do Instituto Evandro Chagas ao município de Rio Branco.
Participaram crianças com ou sem sintomas de DDA, menores de 5 anos de idade, que não haviam recebido qualquer tipo de antibioticoterapia no período de, no mínimo, 15 dias, antes da coleta das fezes. Foram considerados como DDA casos em que as crianças tiveram um aumento no número de evacuações diárias (três ou mais), de consistência líquida ou semilíquida, com duração entre 13 e 17 dias. A amostragem foi obtida nos seguintes pontos de coleta: Unidades de Pronto Atendimento dos Distritos I e II, Hospital da Criança de Rio Branco, o programa Estratégia Saúde da Família e Unidades Básicas de Saúde, todos localizados no município de Rio Branco, de janeiro a dezembro de 2012. Os períodos de coleta foram: 17 de janeiro a 2 de fevereiro (primeira coleta); 27 de março a 10 de abril (segunda coleta); 19 de junho a 2 de julho (terceira coleta); 20 de agosto a 2 de setembro (quarta coleta); e 26 de novembro a 8 de dezembro (quinta coleta).
As fezes in natura foram coletadas em frascos descartáveis de polipropileno com tampa de rosca, limpos, secos e isentos de substâncias conservantes, acondicionados em caixas isotérmicas, enviadas ao Laboratório de Apoio do Instituto Evandro Chagas (IEC), localizado na sede da Fundação Nacional de Saúde de Rio Branco, onde foram submetidas aos procedimentos iniciais de isolamento. Os isolados obtidos foram encaminhados ao Laboratório de Enteroinfecções Bacterianas do IEC, em Ananindeua, no estado do Pará, para os demais procedimentos de identificação.
Para isolamento de membros da família Enterobacteriaceae, o material fecal, em suspensão, foi semeado em meios ágar MacConkey (Difco, EUA) e ágar Salmonella-Shigella (Difco, EUA) e inoculado em meio de enriquecimento Selenito-Cistina (Difco, EUA). Os três meios foram incubados à temperatura de 35-37 ºC por 18-24 h. Posteriormente, o meio Selenito-Cistina foi semeado em meio seletivo Salmonella-Shigella nas mesmas condições de temperatura e tempo descritas acima. As colônias suspeitas foram submetidas aos meios de triagem Triple Sugar Iron Agar (Difco, EUA). As caracterizações bioquímica e sorológica foram realizadas seguindo recomendações de Ewing13 e Kauffmann14. Na caracterização sorológica, foram utilizados antissoros polivalentes e monovalentes (Bio-Rad, EUA) para identificar Shigella spp. e Salmonella spp. Os isolados de E. coli foram submetidos à técnica de reação em cadeia da polimerase multiplex, para identificação das categorias de E. coli diarreiogênicas, de acordo com o protocolo de Aranda et al.15. A pesquisa de C. jejuni e C. coli nas fezes foi feita utilizando o método imunoenzimático (RIDASCREEN®, Alemanha), obedecendo ao protocolo do fabricante.
As informações do presente estudo foram obtidas pela pesquisa nas fichas clínico-epidemiológicas das crianças (grupo diarreico e grupo controle), bem como do banco de dados no Microsoft Excel, constando dos registros de todas as crianças que participaram do projeto de 2012.
A frequência de cada enteropatógeno pesquisado nos grupos diarreico (crianças com DDA) e controle (crianças sem DDA) bem como a associação desses agentes com as condições socioeconômicas dos participantes, obtidas das fichas clínico-epidemiológicas, foram verificadas, em 2014, por meio dos testes qui-quadrado e teste exato de Fisher, adotando-se um nível de significância de 0,05 (5%) e utilizando-se o programa BioEstat v5.016. Foram utilizadas as seguintes variáveis: sexo, idade, renda familiar, tipo de edificação da residência, terreno no qual a residência está edificada, tratamento da água consumida na residência, destino dos dejetos, frequência em que o lixo é coletado e presença de vala próxima à residência. Além das abordagens socioeconômicas e sanitárias dos participantes, foi feita a análise da associação entre a idade materna e a ocorrência de diarreia, uma vez que a baixa idade das mães pode apresentar-se como um preditor negativo nos cuidados executados pelas mesmas17.
O projeto "Avaliação epidemiológica, clínica e molecular de enteropatógenos causadores de diarreia aguda em crianças atendidas no Hospital da Criança e na Unidade de Pronto Atendimento do I e II Distritos, Rio Branco, Acre" foi aprovado em 22 de setembro de 2011 pelo Comitê de Ética em Pesquisa do
Instituto Evandro Chagas, CAAE: 0029.0.072.000-11, e este subprojeto foi aprovado em 29 de janeiro de 2014 pelo Comitê de Ética do Instituto de Ciências da Saúde da Universidade Federal do Pará, CAAE: 24427713.9.0000.0018.
RESULTADOS
A amostra foi constituída por 502 crianças na faixa etária de 0 a 5 anos de idade. A DDA esteve presente em 272 crianças (grupo diarreico) e 230 sem DDA (grupo controle). A DDA foi mais frequente em menores de 1 ano de idade do gênero masculino, observando-se uma diminuição da ocorrência da doença com o aumento da idade (Tabela 1).
Tabela 1 - Distribuição dos participantes do estudo de acordo com a faixa etária, o gênero e grupo clínico em Rio Branco, estado do Acre, Brasil
| Faixa etária (anos) | Gênero | Total | ||||
|---|---|---|---|---|---|---|
| Feminino | Masculino | |||||
| Diarreico | Controle | Diarreico | Controle | Diarreico | Controle | |
| 0-1 | 47 | 30 | 52 | 30 | 99 | 60 |
| 1-2 | 41 | 20 | 48 | 37 | 89 | 57 |
| 2-3 | 12 | 18 | 20 | 13 | 32 | 31 |
| 3-4 | 16 | 20 | 13 | 23 | 29 | 43 |
| 4-5 | 10 | 23 | 13 | 16 | 23 | 39 |
| Total | 126 | 111 | 146 | 119 | 272 | 230 |
Do total de amostras coletadas, 177 (35,3%) foram positivas para as enterobactérias pesquisadas, sendo 76,8% de crianças do grupo diarreico e 23,2% do grupo controle, observando-se relação significativa entre a ocorrência de DDA e a presença desses agentes (p < 0,001) (Tabela 2).
Tabela 2 - Distribuição das bactérias enteropatogênicas isoladas de menores de 5 anos, de acordo com o grupo clínico em Rio Branco, estado do Acre, Brasil
| Patógeno | Amostras positivas | Diarreico | Controle | Razão de prevalência (IC 95%) | p | |||
|---|---|---|---|---|---|---|---|---|
| N | % | N | % | N | % | |||
| E. coli | 142 | 80,2 | 109 | 61,6 | 33 | 18,7 | 2,79 (1,97-3,95) | < 0,001* |
| Aeromonas sobria | 1 | 0,6 | - | - | 1 | 0,6 | - | 0,45† |
| Salmonella spp. | 7 | 4,0 | 4 | 2,2 | 3 | 1,7 | 1,05 (0,55-2,01) | 0,59† |
| C. jejuni e C. coli | 16 | 9,0 | 12 | 6,8 | 4 | 2,2 | 1,40 (1,04-1,88) | 0,04‡ |
| Shigella spp. | 10 | 5,6 | 10 | 5,6 | - | - | 1,87 (1,72-2,04) | 0,002† |
| Plesiomonas shigelloides | 1 | 0,6 | 1 | 0,6 | - | - | 1,84 (1,70-2,00) | 0,54† |
| Total | 177 | 100,0 | 136 | 76,8 | 41 | 23,2 | ||
* Qui-quadrado; † Teste exato de Fischer; ‡ Mid-p; Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
Dentre as enterobactérias identificadas, a E. coli foi a espécie mais frequente (80,2% dos isolados), sendo mais comum no grupo diarreico (61,6%) que no controle (18,7%), mostrando uma associação estatisticamente significativa (p < 0,001) com a DDA. A ocorrência da doença também esteve associada à presença de Shigella spp. e C. jejuni e C. coli, embora essas últimas tenham tido menor significância estatística. Os demais patógenos não apresentaram diferenças significativas entre diarreicos e controles (Tabela 2).
A identificação molecular das categorias de E. coli diarreiogênicas mostrou 142 amostras (52 E. coli enterotoxigênica - ETEC; 51 E. coli enteropatogênica - EPEC; 34 E. coli enteroagregativa - EAEC; quatro E. coli enteroinvasiva - EIEC; e uma E. coli produtora de toxina Shiga - STEC), sendo a EPEC mais frequente no grupo diarreico (45,9%) do que no controle (3,0%), apesar
das categorias ETEC (57,6%) e EAEC (39,4%) terem sido mais observadas no grupo controle (Figura 1).
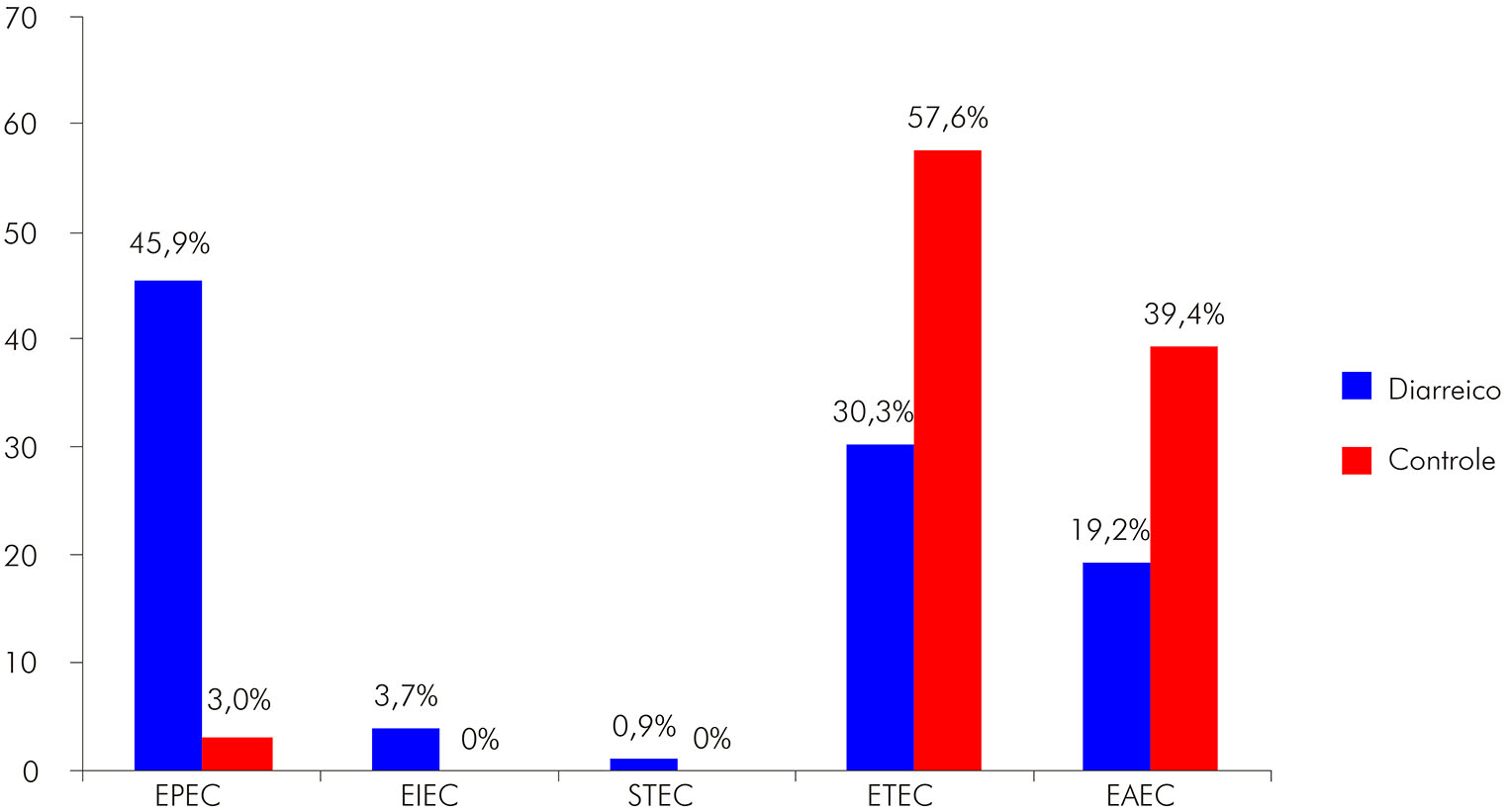
Figura 1 - Frequências das categorias de E. coli diarreiogênicas isoladas de crianças menores de 5 anos de idade, de acordo com o grupo clínico em Rio Branco, estado do Acre, Brasil
Na figura 2, observa-se a distribuição sazonal das bactérias envolvidas na DDA, destacando-se um pico na incidência de E. coli diarreiogênica durante os meses de novembro e dezembro (quinta coleta), meses esses que correspondem ao início do período chuvoso no estado do Acre.
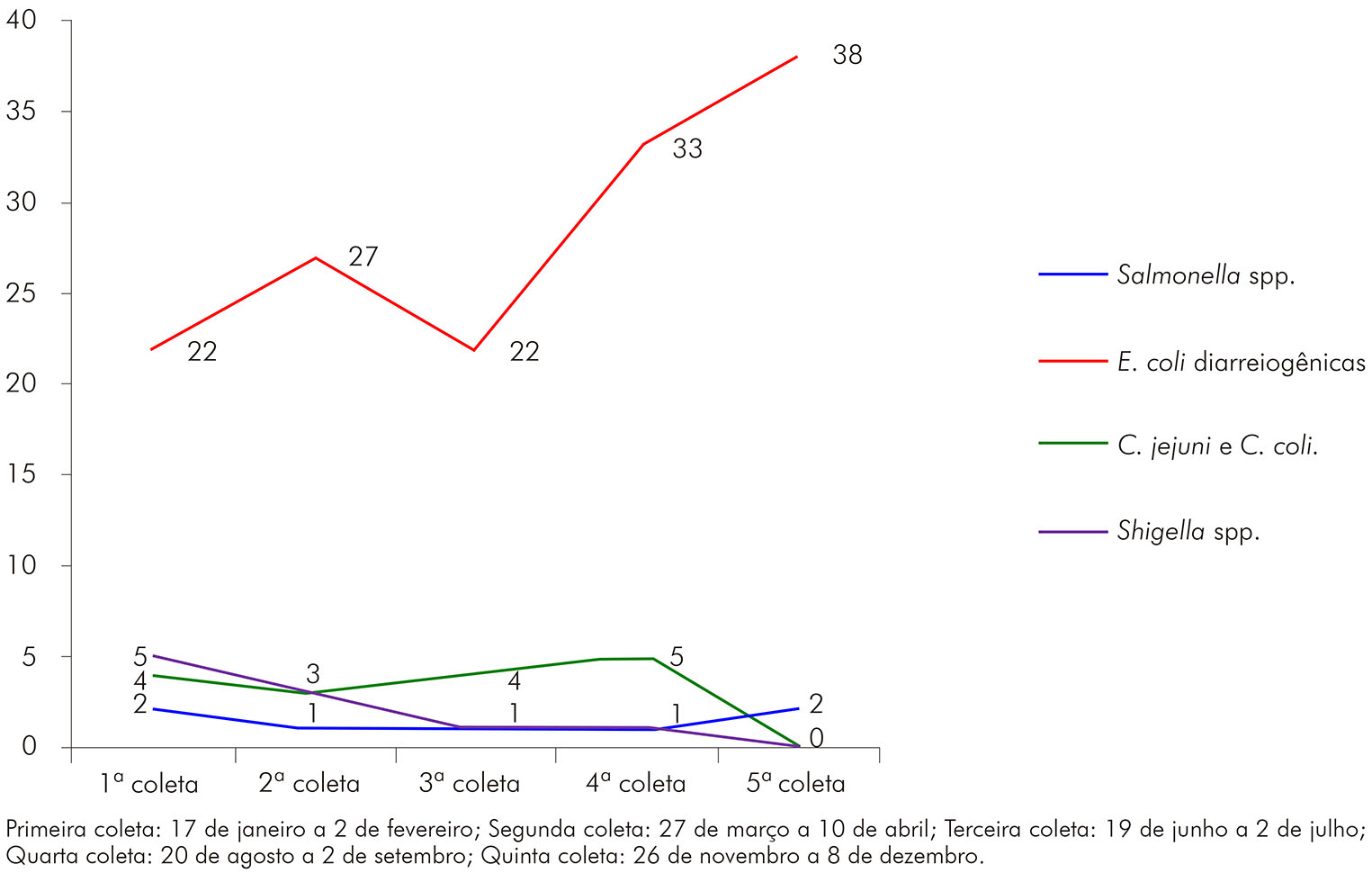
Figura 2 - Distribuição sazonal dos principais enteropatógenos bacterianos durante o período de janeiro a dezembro de 2012 em Rio Branco, estado do Acre, Brasil
A abordagem analítica apresentada na tabela 3 corresponde ao odds ratio (OR) da associação entre a idade materna e a ocorrência de diarreia entre os grupos diarreico e controle. Tal associação mostrou-se estatisticamente significativa (p < 0,00005), identificando que o risco da criança desenvolver DDA era maior quando a mãe tinha entre 14 e 19 anos de idade. Ressalta-se que, do total avaliado, 12 diarreicos e oito controles não foram considerados por falta de informações nas fichas epidemiológicas.
Tabela 3 - Relação entre a faixa etária materna e os grupos diarreicos e controle de crianças menores de 5 anos de idade em Rio Branco, estado do Acre, Brasil
| Faixa etária (anos) | Diarreico | Controle | OR |
|---|---|---|---|
| 14-19 | 55 | 24 | 1,000 |
| 20-29 | 145 | 106 | 0,597 |
| 30-39 | 36 | 50 | 0,314 |
| 40-49 | 8 | 14 | 0,249 |
| 50-59 | 16 | 28 | 0,249 |
| Total | 260 | 222 |
Em relação à renda familiar, em ambos os grupos, a maioria dos pais/responsáveis relatou ter renda mensal de um a dois salários mínimos (56,0%), seguido pela de dois a três salários (28,7%). Percebeu-se que essa associação foi estatisticamente significativa (p < 0,00051), revelando que quanto menor a renda familiar maior é o risco de a criança apresentar DDA (Tabela 4). Ressalta-se que, do total avaliado, cinco diarreicos e nove controles não foram considerados por falta de informações nas fichas epidemiológicas.
Tabela 4 - Relação entre renda familiar e os grupos diarreicos e controle de crianças menores de 5 anos de idade em Rio Branco, estado do Acre, Brasil
| Renda familiar (salário mínimo) | Diarreico | Controle | Total | OR | |||
|---|---|---|---|---|---|---|---|
| N | % | N | % | N | % | ||
| < 1 | 35 | 13,1 | 11 | 5,0 | 46 | 9,4 | 1,000 |
| 1-2 | 158 | 59,2 | 115 | 52,0 | 273 | 56,0 | 0,432 |
| 2-3 | 63 | 23,6 | 77 | 34,8 | 140 | 28,7 | 0,257 |
| 3-4 | 11 | 4,1 | 18 | 8,2 | 29 | 5,9 | 0,157 |
| Subtotal | 267 | 100,0 | 221 | 100,0 | 488 | 100,0 | |
Na tabela 5, estão representadas as associações bivariadas e multivariadas dos dados quanto às condições de moradia. Observa-se que, na análise bivariada, a frequência da coleta de lixo (OR = 3,98; IC 95% 1,87-8,47) e o destino dos dejetos (OR = 2,22; IC 95% 1,54-3,21) foram as variáveis de maior relevância na associação à diarreia; enquanto que, na multivariada, tanto a frequência da coleta de lixo (OR = 3,48; IC 95% 1,52-7,97) quanto o destino dos dejetos (OR = 2,00; IC 95% 1,32-3,04) permaneceram em destaque quando associadas à ocorrência de diarreia. Na referida relação, as variáveis tipos de edificação (p = 0,1123), tipo de terreno (p = 0,2872), tipo de tratamento da água para consumo (p = 0,1095) e presença de vala (p = 0,1024) não apresentaram significância estatística.
Tabela 5 - Associação entre variáveis sociodemográficas e crianças menores de 5 anos de idade com DDA em Rio Branco, estado do Acre, Brasil
| Variável | OR bruto | IC 95% | OR ajustado | IC 95% |
|---|---|---|---|---|
| Edificação | 2,0923 | 1,4511-3,0168 | 1,4153 | 0,9218-2,1730 |
| Terreno | 2,1026 | 1,3660-3,2363 | 1,3236 | 0,7899-2,2179 |
| Tratamento | 2,0902 | 1,3877-3,1484 | 1,4604 | 0,9184-2,3222 |
| Dejetos | 2,2297 | 1,5442-3,2196 | 2,0043 | 1,3208-3,0416 |
| Lixo | 3,9810 | 1,8711-8,4703 | 3,4820 | 1,5201-7,9759 |
| Vala | 1,5230 | 1,0225-2,2685 | 1,4562 | 0,9276-2,2859 |
Edificação: Tipo de edificação da residência; Terreno: Terreno no qual a residência está edificada; Tratamento: Tratamento da água consumida na residência; Dejetos: Destino dos dejetos (ausência de esgotamento); Lixo: Frequência com que o lixo é coletado (coleta irregular); Vala: Presença de vala próxima à residência.
DISCUSSÃO
As características das crianças envolvidas neste estudo revelaram que os menores de 2 anos são mais suscetíveis à ocorrência da DDA. Estudos mostraram que as crianças mais jovens possuem maiores chances de adoecimento por gastroenterites infecciosas, sobretudo quando se encontram em condições socioeconômicas desfavoráveis18.
No período de 1995 a 2005, Oliveira e Latorre19, avaliando as internações e a mortalidade infantil causadas por diarreia em menores de 1 ano de idade no Brasil, observaram que 13 capitais brasileiras (Macapá, Palmas, Fortaleza, Natal, João Pessoa, Salvador, Maceió, Belo Horizonte, Rio de Janeiro, Curitiba, Porto Alegre, Campo Grande e Cuiabá) apresentaram redução tanto nas internações quanto na mortalidade infantil por diarreia. Já nas capitais Boa Vista, Belém, Teresina, Recife, Aracajú, São Paulo, Florianópolis e Goiânia houve queda somente na mortalidade por diarreia, enquanto que Rio Branco, Porto Velho e São Luís apresentaram decréscimo somente nas taxas de internação por diarreia. Entretanto, apesar da significativa redução nesses índices, a diarreia continua a representar um importante problema de saúde pública para parte do País.
Imada et al.18, utilizando dados de dois inquéritos realizados no município de Jordão, estado do Acre, um em 2005 e o outro em 2012, avaliaram 466 e 826 crianças menores de 5 anos de idade, respectivamente, em relação à diarreia. Foram aplicados questionários sobre as condições socioeconômicas, construção dos domicílios, hábitos higiênicos e alimentares e saneamento ambiental, nos quais observaram que a prevalência de diarreia em crianças residentes nesse município passou de 45,1%, em 2005, para 35,4%, em 2012, ou seja, uma redução de 9,7% na ocorrência desse agravo; mas que ainda era elevada e superior aos estudos realizados em Rio Branco (33,3%), São Paulo (4,7%), Recife e Olinda (10,2%) e Região Metropolitana de Recife (16,9%)20,21,22,23. Tal redução é observada em todas as regiões; no entanto, não ocorre de maneira igualitária, permanecendo ainda as discrepâncias regionais e dos grupos socioeconômicos23.
Neste estudo, as maiores positividades relacionadas aos grupos diarreico (61,6%) e controle (18,7%) foram representadas significativamente pelas E. coli diarreiogênicas, ratificando o que já foi encontrado em outros estudos20,21. Nos pacientes com DDA, a EPEC (45,9%) foi a mais frequente, seguida de ETEC (30,3%) e EAEC (19,2%), o que corrobora a maioria dos estudos em que a frequência das E. coli diarreiogênicas nos pacientes com DDA foi superior, comparando-se com os indivíduos sem diarreia24,25,26,27,28. Além disso, a EPEC tem sido mostrada como um dos enteropatógenos responsáveis pelos episódios pediátricos de diarreia, especialmente nos países pouco desenvolvidos, onde as condições sanitárias ainda são precárias24,26,27,29,30.
A presença de ETEC no grupo diarreico foi de 30,3% e de 57,6% no grupo controle, entretanto, na maioria dos estudos, a ETEC está fortemente associada aos pacientes do grupo diarreico24,25,27,28,31; também é considerada um importante patógeno de diarreia na infância de 0 a 5 anos, especialmente durante os primeiros 6 meses de vida24,27.
Nos indivíduos do grupo diarreico, a EAEC foi a terceira categoria mais frequente (19,2%) e, no grupo controle, a segunda (39,4%). Esses resultados foram semelhantes ao de Nguyen et al.24, no qual a EAEC foi a bactéria mais frequente nos controles (7,2%). A EAEC tem sido cada vez mais reconhecida como um importante patógeno entérico emergente, amplamente distribuída em todo o mundo32,33.
As E. coli diarreiogênicas são reconhecidas como patógenos de etiologia emergente e causa de diarreia na infância, especialmente nos países em desenvolvimento, sendo que o significado epidemiológico de cada um dos tipos varia com a área geográfica24,27.
Em relação à frequência de C. jejuni e C. coli (9,0%), pôde-se observar que tais agentes têm importância epidemiológica quando comparados aos resultados encontrados em estudo realizado em outros países onde a prevalência de infecção por Campylobacter spp. foi similar ao encontrado neste estudo. Crianças com diarreia aguda apresentaram taxas de infecção de 9,3% em Uganda e Zimbabwe, 9,0% no Egito, 11,0% no Quênia e 18,0% na Tanzânia34.
A prevalência de Shigella spp. entre crianças do grupo diarreico foi de 5,6%, enquanto que no controle não houve positividade. Por outro lado, um estudo realizado por Loureiro et al.4, no estado do Pará, encontrou a prevalência de Shigella spp. em 13,7% das amostras. As divergências encontradas neste estudo, podem ser explicadas pelas diferenças regionais, demográficas e ambientais que envolveram as populações pesquisadas.
Em relação à Samonella spp., o presente estudo revelou uma positividade de 2,2% no grupo diarreico, enquanto que no controle a taxa foi de 1,7%. No entanto, Souza et al.35 identificaram uma incidência de 0,7% em suas amostras, enquanto que Pontual et al.36 não observaram qualquer caso positivo para Salmonella em crianças atendidas em Recife, diferenças explicáveis também por questões regionais, demográficas e ambientais.
Quanto ao número de enteropatógenos detectados, no período do estudo, nos meses de novembro e dezembro, houve um pico na incidência de E. coli diarreiogênica, meses esses que correspondem ao início do período chuvoso no Acre. De acordo com Amaral et al.37, o aumento do índice de contaminação bacteriológica de águas de poços do lençol freático superficial está associado ao escoamento das águas da chuva contaminadas com fezes humanas e animais, e o uso dessa água não tratada aumenta a frequência de diarreias no período chuvoso.
A associação entre a idade materna e a ocorrência de diarreia entre os grupos mostrou-se estatisticamente significativa (p < 0,00005), demonstrando que quanto mais jovem é a mãe maior é o risco da criança apresentar doença diarreica. Estudos realizados por diversos autores36,38,39,40,41,42,43 mostraram que a morbimortalidade infantil por diarreia está associada à idade da mãe, principalmente quando acompanhada de riscos relacionados a fatores socioeconômicos.
A verificação da importância do poder aquisitivo demonstra o envolvimento direto desse aspecto na casuística da DDA41,44. Os percentuais encontrados neste estudo são similares aos de Souza et al.35 em estudo conduzido em São Paulo, no qual identificaram percentuais de 51,3% nos casos sintomáticos e de 21,4% nos casos controle. Toporovski et al.45 afirmaram que, em áreas caracterizadas pelas péssimas condições de saneamento, os enteropatógenos são identificados nos grupos controle em proporções que variam de 25 a 45%, portanto, superiores ao que foi encontrado neste estudo.
A associação bivariada, realizada a partir dos fatores relacionados às condições de moradia, mostrou a frequência da coleta de lixo e o destino dos dejetos como as variáveis de maior relevância na ocorrência da diarreia infantil. Nessa perspectiva, crianças residentes em domicílios com coleta de lixo irregular apresentaram maior risco de desenvolver diarreia do que aquelas com coleta regular. Quanto ao destino dos dejetos, constatou-se que a ausência de rede geral de esgoto é um fator de risco significativo para a população estudada. Ainda considerando a análise multivariada, foi possível perceber que as variáveis tipo de edificação, tipo de terreno, tipo de tratamento da água para consumo e presença de vala perderam sua significância no processo de adoecimento por diarreia.
Moraes46 observou relação semelhante, verificando que o acondicionamento de resíduos sólidos expressa
influência significativa na incidência de diarreia, percebendo que os casos dessa patologia sempre são maiores nas crianças residentes em domicílios que não dispõem de coleta de resíduos sólidos. Catapreta e Heller47 sugeriram que a inexistência de coleta de resíduos sólidos domiciliares define fortemente o risco para a saúde de diarreicos e controles quando relacionados à doença diarreica. No que tange o destino dos dejetos, outros estudos demonstraram também que a ausência da coleta de esgoto representa risco aumentado à presença de diarreia48,49,50.
A principal limitação deste estudo foi a ausência de investigação de outros patógenos intestinais virais e parasitários que poderiam ter contribuído para o fenômeno observado ou mesmo ter sido o agente causador da DDA nas crianças investigadas. No entanto, são poucos os dados relativos ao comportamento das gastroenterites no estado do Acre, mas sabe-se que esse conhecimento é fundamental para a construção de indicadores epidemiológicos que possibilitem a implementação de políticas que contemplem a região.
CONCLUSÃO
Ressalta-se a presença de enterobactérias na população infantil do estado do Acre, inclusive com a ocorrência de agentes emergentes, demonstrando que a população se encontra sob potencial risco de desenvolver DDA, em função das precárias condições de saneamento básico. Além disso, o presente estudo fornece dados que ampliam o conhecimento acerca da DDA na Região Norte, que são importantes para o desenvolvimento das ações locais, destacando-se a necessidade da manutenção de um serviço permanente de vigilância aos agentes causadores de diarreia, especialmente os bacterianos, até mesmo pelo elevado potencial epidêmico de alguns deles.











 text in
text in 
 Curriculum ScienTI
Curriculum ScienTI

