Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Pan-Amazônica de Saúde
Print version ISSN 2176-6223On-line version ISSN 2176-6223
Rev Pan-Amaz Saude vol.8 no.4 Ananindeua Oct./Dec. 2017
http://dx.doi.org/10.5123/s2176-62232017000400008
ARTÍCULO ORIGINAL
Aspectos epidemiológicos de las enteroinfecciones bacterianas en menores de 5 años de edad en Rio Branco, estado de Acre, Brasil*
1Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
OBJETIVO:
Investigar los episodios de enteropatógenos bacterianos en la etiología de la enfermedad diarreica aguda (EDA), asociando variables clínico-epidemiológicas, en menores de 5 años de edad, atendidos en unidades de salud del municipio de Rio Branco, estado de Acre, Brasil, en 2012.
MATERIALES Y MÉTODOS:
El estudio involucró el análisis de datos obtenidos de las fichas clínico-epidemiológicas de 502 niños, siendo 272 casos de EDA y 230 controles. La frecuencia de cada enteropatógeno investigado y la asociación de esos agentes con las condiciones socioeconómicas de los niños se verificaron con las pruebas de chi-cuadrado y prueba exacta de Fisher, adoptándose un nivel de significación de 0,05 (5%) y utilizando el programa BioEstat v5.0.
RESULTADOS:
Las bacterias más frecuentes en ambos grupos fueron Escherichia coli diarreogénicas (80,2%), Campylobacter jejuni y Campylobacter coli (9,0%), Shigella spp. (5,6%) y Salmonella spp. (4,0%). Hubo una asociación significativa entre el E. coli y la presencia de EDA (p < 0,001). La distribución temporal de las E. coli diarreogénicas fue mayor en los meses de noviembre y diciembre (período lluvioso). La asociación entre la renta familiar y el grupo clínico fue estadísticamente significativa (p < 0,00051). Con relación a las condiciones de habitación, se observó un mayor riesgo cuando la frecuencia de la colecta de basura era irregular. Se constató que el riesgo de que el niño desenvolviera EDA era mayor cuando la madre tenía entre 14 y 19 anos de edad.
CONCLUSIÓN:
Se verificó que los casos de EDA en menores de 5 años de edad, en Rio Branco, estaban relacionados a la circulación de enteropatógenos bacterianos, en especial a E. coli diarreogénica.
Palabras clave: Gastroenteritis; Enterobacterias; Niños
INTRODUCCIÓN
A nivel mundial, la enfermedad diarreica aguda (EDA) sigue representando un importante problema de salud pública, lo que representa una de las principales causas de muerte en niños menores de 5 años de edad1. Los estudios afirman que las tasas globales de muertes causadas por diarrea vienen declinando, en diversas regiones del mundo; sin embargo, tal reducción no se observa en las tasas de incidencia de la enfermedad, ya que ésta permanece directamente relacionada con las desigualdades socioeconómicas de las poblaciones2,3.
Los agentes causantes de EDA en niños pueden ser virus, bacterias o protozoos1,2. En Brasil, los agentes etiológicos de mayor relevancia clínica y epidemiológica son: Escherichia coli diarreogénica, rotavirus, Salmonella spp., Shigella spp., Campylobacter jejuni y Campylobacter coli, Cryptosporidium spp., Entamoeba histolytica y Giardia lamblia. Sin embargo, la etiología de las bacterias causantes de diarrea difiere dependiendo del área geográfica y de los diferentes niveles de desarrollo económico entre las regiones4,5,6,7,8.
Aunque la diarrea es un problema de salud pública en todo Brasil, las diferentes regiones del país presentan variaciones en los registros de la enfermedad, siendo las Regiones Nordeste y Norte las que presentan mayor prevalencia9. Sin embargo, en lo que se refiere a la Región Norte, los datos en la literatura son raros10.
En 2005, la vigilancia epidemiológica del estado de Acre registró un aumento considerable en el número de casos de EDA en el municipio de Rio Branco, caracterizando un brote de la enfermedad. En ese año, se notificaron 23.195 casos, en un período de 10 meses, en un área amplia del Estado, siendo la mayoría en la capital. Se observó, además, que el 67,5% del total de notificaciones ocurrieron entre niños menores de 5 años de edad, con registro de 57 óbitos11.
Entre diciembre de 2011 y enero de 2012, la EDA volvió a tener destaque en el escenario de las enfermedades infecciosas en Acre, cuando 12 niños indígenas, entre 7 y 23 meses de edad, de las etnias Kulina y Kaxinawá, murieron por diarrea, el rotavirus, asociado al bajo peso y al riesgo nutricional12.
Es notoria la participación de los enteropatógenos bacterianos en la génesis de las gastroenteritis en el mundo; sin embargo, datos de esos agentes en la epidemiología de la EDA, en la Región Norte de Brasil, en especial en el estado de Acre, todavía son bastante escasos. Así, este estudio tuvo como objetivo investigar la incidencia de enteropatógenos bacterianos y su importancia en la etiología de la EDA en niños menores de 5 años de edad, atendidas en unidades de salud del municipio de Rio Branco en 2012.
MATERIALES Y MÉTODOS
Se incluyeron en el estudio los niños atendidos en el proyecto titulado "Evaluación epidemiológica, clínica y molecular de enteropatógenos causantes de diarrea aguda en niños atendidos en el Hospital del Niño y en la Unidad de Pronta Atención del I y II Distrito, Rio Branco, Acre", a través de cinco expediciones de equipos del Instituto Evandro Chagas al municipio de Rio Branco.
Participaron niños con o sin síntomas de EDA, menores de 5 años de edad, que no habían recibido ningún tipo de antibioticoterapia en el período de, mínimo,15 días antes de la recolección de las heces. Se consideraron como EDA casos en que los niños tuvieron un aumento en el número de evacuaciones diarias (tres o más), de consistencia líquida o semilíquida, con duración entre 13 y 17 días. El muestreo fue obtenido en los siguientes puntos de recolección: Unidades de Pronta Atención de los Distritos I y II, Hospital del Niño de Rio Branco, el programa Estrategia Salud de la Familia y Unidades Básicas de Salud, todos ubicados en el municipio de Rio Branco, de enero a diciembre de 2012. Los períodos de recolección fueron: 17 de enero al 2 de febrero (primera recolección); 27 de marzo al 10 de abril (segunda recolección); 19 de junio al 2 de julio (tercera recolección); 20 de agosto al 2 de septiembre (cuarta recolección); y el 26 de noviembre al 8 de diciembre (quinta recolección).
Las heces in natura fueron recolectadas en frascos desechables de polipropileno con tapa de rosca, limpios, secos y exentos de sustancias conservantes, acondicionados en cajas isotérmicas, enviadas al Laboratorio de Apoyo del Instituto Evandro Chagas (IEC), ubicado en la sede de la Fundación Nacional de Salud de Rio Branco, donde fueron sometidas a los procedimientos iniciales de aislamiento. Los aislados obtenidos se encaminaron al Laboratorio de Enteroinfecciones Bacterianas del IEC, en Ananindeua, en el estado de Pará, para los demás procedimientos de identificación.
Para aislamiento de miembros de la familia Enterobacteriaceae, el material fecal, en suspensión, fue sembrado en medios agar MacConkey (Difco, EE.UU.) y agar Salmonella-Shigella (Difco, EE.UU.) e inoculado en medio de enriquecimiento Selenito-Cistina (Difco, EE.UU.). Los tres medios fueron incubados a una temperatura de 35-37 ºC por 18-24 h. Posteriormente, el medio Selenito-Cistina fue sembrado en medio selectivo Salmonella-Shigella en las mismas condiciones de temperatura y tiempo arriba descritas. Las colonias sospechosas fueron sometidas a los medios de clasificación Triple Sugar Iron Agar (Difco, EE.UU.). Las caracterizaciones bioquímica y serológica se realizaron siguiendo recomendaciones de Ewing13 y Kauffmann14. En la caracterización serológica, se utilizaron antisueros polivalentes y monovalentes (Bio-Rad, EE.UU.) para identificar la Shigella spp. y la Salmonella spp. Los aislados de E. coli fueron sometidos a la técnica de reacción en cadena de la polimerasa múltiplex, para identificar las categorías de E. coli diarreogénicas, de acuerdo con el protocolo de Aranda et al.15. La investigación de C. jejuni y C. coli en las heces se hizo utilizando el método inmunoenzimático (RIDASCREEN®, Alemania), obedeciendo al protocolo del fabricante.
Las informaciones del presente estudio se obtuvieron por la investigación en las fichas clínico-epidemiológicas de los niños (grupo diarreico y grupo control), así como de la base de datos en Microsoft Excel, constando de los registros de todos los niños que participaron del proyecto de 2012.
La frecuencia de cada enteropatógeno investigado en los grupos diarreico (niños con EDA) y control (niños sin EDA) así como la asociación de estos agentes con las condiciones socioeconómicas de los participantes, obtenidas de las fichas clínico-epidemiológicas, fueron verificadas, en 2014, por las pruebas de Chi cuadrado y la prueba exacta de Fisher, adoptando un nivel de significancia de 0,05 (5%) y utilizando el programa BioEstat v5.016. Se utilizaron las siguientes variables: sexo, edad, renta familiar, tipo de edificación de la residencia, terreno en el cual la residencia está edificada, tratamiento del agua consumida en la residencia, destino de los desechos, frecuencia en que la basura es recolectada y presencia de fosa séptica próxima a la residencia. Además de los abordajes socioeconómicos y sanitarios de los participantes, se hizo el análisis de la asociación entre la edad materna y el episodio de diarrea, ya que la baja edad de las madres puede presentarse como un predictor negativo en los cuidados ejecutados por las mismas17.
El proyecto "Evaluación epidemiológica, clínica y molecular de enteropatógenos causantes de diarrea aguda en niños atendidos en el Hospital del Niño y en la Unidad de Pronta Atención del I y II Distritos, Rio Branco, Acre" fue aprobado el 22 de septiembre de 2011 por el Comité de Ética en Investigación del Instituto Evandro Chagas, CAAE: 0029.0.072.000-11, y este subproyecto fue aprobado el 29 de enero de 2014 por el Comité de Ética del Instituto de Ciencias de la Salud de la Universidad Federal de Pará, CAAE: 24427713.9.0000.0018.
RESULTADOS
La muestra estuvo constituida por 502 niños en el grupo de edad de 0 a 5 años de edad. La EDA estuvo presente en 272 niños (grupo diarreico) y 230 sin EDA (grupo control). La EDA fue más frecuente en menores de 1 año de edad del género masculino, observándose una disminución de la enfermedad con el aumento de la edad (Tabla 1).
Tabla 1 - Distribución de los participantes del estudio de acuerdo con el grupo de edad, el género y el grupo clínico, Rio Branco, estado de Acre, Brasil
| Grupo de edad (años) | Género | Total | ||||
|---|---|---|---|---|---|---|
| Femenino | Masculino | |||||
| Caso | Control | Caso | Control | Caso | Control | |
| 0-1 | 47 | 30 | 52 | 30 | 99 | 60 |
| 1-2 | 41 | 20 | 48 | 37 | 89 | 57 |
| 2-3 | 12 | 18 | 20 | 13 | 32 | 31 |
| 3-4 | 16 | 20 | 13 | 23 | 29 | 43 |
| 4-5 | 10 | 23 | 13 | 16 | 23 | 39 |
| Total | 126 | 111 | 146 | 119 | 272 | 230 |
En el total de muestras recogidas, 177 (35,3%) fueron positivas para las enterobacterias investigadas, siendo 76,8% de niños del grupo diarreico y 23,2% del grupo control, observándose una relación significativa entre la EDA y la presencia de estos agentes (p < 0,001) (Tabla 2).
Tabla 2 - Distribución de las bacterias enteropatógenas aisladas de menores de 5 años, de acuerdo con el grupo clínico, en Rio Branco, estado de Acre, Brasil
| Patógeno | Muestras positivas | Caso | Control | Razón de prevalencia (IC 95%) | p | |||
|---|---|---|---|---|---|---|---|---|
| N | % | N | % | N | % | |||
| E. coli | 142 | 80,2 | 109 | 61,6 | 33 | 18,7 | 2,79 (1,97-3,95) | < 0,001* |
| Aeromonas sobria | 1 | 0,6 | - | - | 1 | 0,6 | - | 0,45† |
| Salmonella spp. | 7 | 4,0 | 4 | 2,2 | 3 | 1,7 | 1,05 (0,55-2,01) | 0,59† |
| C. jejuni/C. coli | 16 | 9,0 | 12 | 6,8 | 4 | 2,2 | 1,40 (1,04-1,88) | 0,04‡ |
| Shigella spp. | 10 | 5,6 | 10 | 5,6 | - | - | 1,87 (1,72-2,04) | 0,002† |
| Plesiomonas shigelloides | 1 | 0,6 | 1 | 0,6 | - | - | 1,84 (1,70-2,00) | 0,54† |
| Total | 177 | 100,0 | 136 | 76,8 | 41 | 23,2 | ||
* Chi-cuadrado; † Test exacto de Fischer; ‡ Mid-p; Señal convencional utilizada - Dato numérico igual a cero, no resultante de redondeo.
Entre las enterobacterias identificadas, la E. coli fue la especie más frecuente (80,2% de los aislados), siendo más común en el grupo diarreico (61,6%), que en el control (18,7%), mostrando una asociación estadísticamente significativa (p < 0,001) con la EDA. La aparición de la enfermedad también estuvo asociada a la presencia de Shigella spp. y C. jejuni y C. coli, aunque estas últimas hayan tenido menor significación estadística. Los demás patógenos no presentaron diferencias significativas entre diarreicos y controles (Tabla 2).
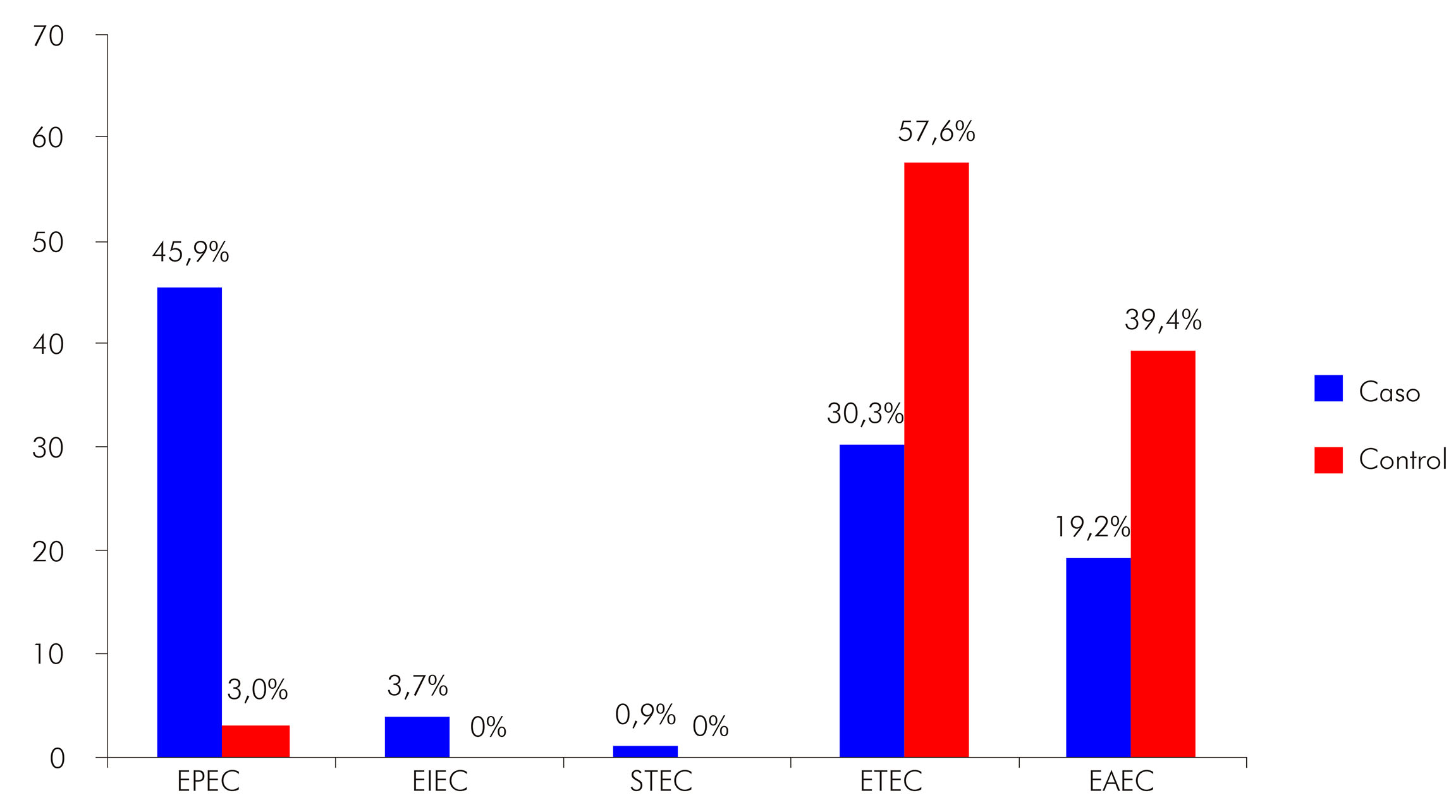
La identificación molecular de las categorías de E. coli diarreogénicas mostró 142 muestras (52 E. coli enterotoxigénica - ETEC, 51 E. coli enteropatógena - EPEC, 34 E. coli enteroagregativa - EAEC, cuatro E. coli enteroinvasiva - EIEC, y una E. coli productora de toxina Shiga - STEC), la más frecuente en el grupo diarreico fue la EPEC (45,9%) más que en el grupo control (3,0%), a pesar de que las categorías ETEC (57,6%) y EAEC (39,4%) fueron más observadas en el grupo control (Figura 1).
Figura 1 - Frecuencias de las categorías de E. coli diarreogénicas aisladas de niños menores a 5 años de edad, de acuerdo con el grupo clínico, en Rio Branco, estado de Acre, Brasil
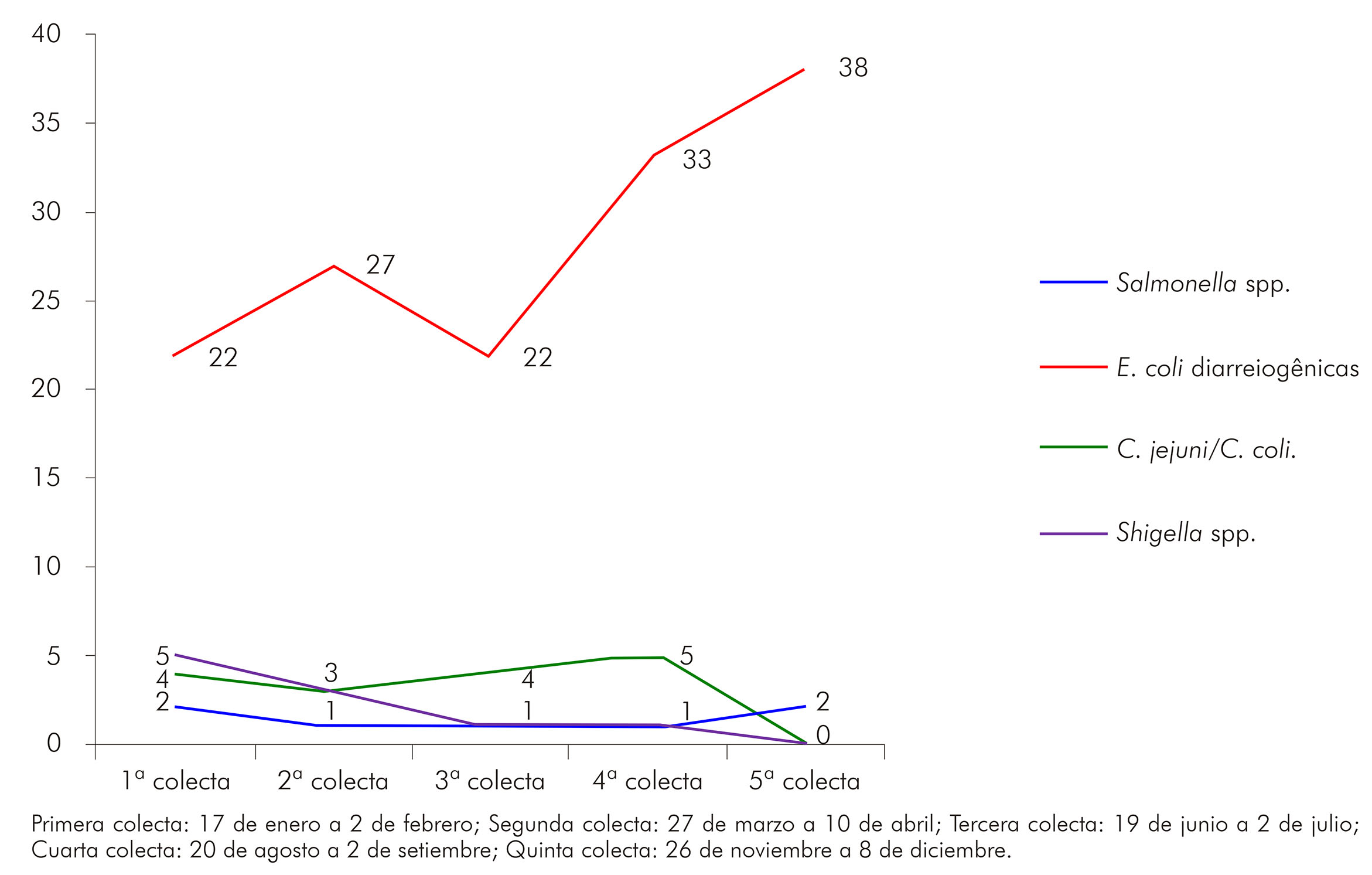
En la figura 2, se observa la distribución estacional de las bacterias involucradas en la EDA, destacándose un pico en la incidencia de E. coli diarreogénica durante los meses de noviembre y diciembre (quinta recolección), meses que corresponden al inicio del período lluvioso el estado de Acre.
Primera colecta: 17 de enero a 2 de febrero; Segunda colecta: 27 de marzo a 10 de abril; Tercera colecta: 19 de junio a 2 de julio; Cuarta colecta: 20 de agosto a 2 de setiembre; Quinta colecta: 26 de noviembre a 8 de diciembre.
Figura 2 - Distribución estacional de los principales enteropatógenos bacterianos durante el período de enero a diciembre de 2012 en Rio Branco, estado de Acre, Brasil
El abordaje analítico presentado en la tabla 3 corresponde al odds ratio (OR) de la asociación entre la edad materna y la incidencia de diarrea entre los grupos diarreico y control. Esta asociación se mostró estadísticamente significativa (p < 0,00005), identificando que el riesgo del niño de desarrollar EDA era mayor cuando la madre tenía entre 14 y 19 años de edad. Se destaca que, del total evaluado, 12 diarreicos y 8 controles no fueron considerados por falta de informaciones en las fichas epidemiológicas.
Tabla 3 - Relación entre el grupo de edad materna y lo grupos diarreicos y control de niños menores de 5 años de edad en Rio Branco, estado de Acre, Brasil
| Grupo de edad (años) | Caso | Control | Odds ratio |
|---|---|---|---|
| 14-19 | 55 | 24 | 1,000 |
| 20-29 | 145 | 106 | 0,597 |
| 30-39 | 36 | 50 | 0,314 |
| 40-49 | 8 | 14 | 0,249 |
| 50-59 | 16 | 28 | 0,249 |
| Total | 260 | 222 |
En relación a la renta familiar, en ambos grupos, la mayoría de los padres/responsables reportaron tener ingresos mensuales de uno a dos sueldos mínimos (56,0%), seguido por la de dos a tres sueldos (28,7%). Se observó que esta asociación fue estadísticamente significativa (p < 0,00051), revelando que a menor renta familiar mayor el riesgo de que el niño presente EDA (Tabla 4). Se destaca que, del total evaluado, cinco diarreicos y nueve controles no fueron considerados por falta de información en las fichas epidemiológicas.
Tabla 4 - Relación entre renta familiar y los grupos diarreicos y control de niños menores de 5 años de edad en Rio Branco, estado de Acre, Brasil
| Renta familiar (sueldo mínimo) | Casos | Control | Total | Odds ratio | |||
|---|---|---|---|---|---|---|---|
| N | % | N | % | N | % | ||
| < 1 | 35 | 13,1 | 11 | 5,0 | 46 | 9,4 | 1,000 |
| 1-2 | 158 | 59,2 | 115 | 52,0 | 273 | 56,0 | 0,432 |
| 2-3 | 63 | 23,6 | 77 | 34,8 | 140 | 28,7 | 0,257 |
| 3-4 | 11 | 4,1 | 18 | 8,2 | 29 | 5,9 | 0,157 |
| Subtotal | 267 | 100,0 | 221 | 100,0 | 488 | 100,0 | |
En la tabla 5, están representadas las asociaciones bivariadas y multivariadas de los datos en cuanto a las condiciones de vivienda. En el análisis bivariado, se observó que la frecuencia de la recolección de basura (OR = 3,98, IC 95% 1,87-8,47) y el destino de los desechos (OR = 2,22, IC 95% 1,54-3,21) fueron las variables de mayor relevancia en asociación con la diarrea, mientras que en la multivariada, tanto la frecuencia de la recolección de basura (OR = 3,48, IC 95% 1,52-7,97) como el destino de los desechos (OR = 2,00, IC 95% 1,32-3,04) permanecieron en destaque cuando se asociaron a la aparición de diarrea. En la referida relación, las variables tipos de edificación (p = 0,1123), tipo de terreno (p = 0,2872), tipo de tratamiento del agua para consumo (p = 0,1095) y presencia de zanja (p = 0,1024) no presentaron significancia estadística.
Tabla 5 - Asociación entre variables sociodemográficas y niños menores a 5 años de edad con EDA en Rio Branco, estado de Acre, Brasil
| Variable | Odds ratio bruto | IC 95% | Odds ratio ajustado | IC 95% |
|---|---|---|---|---|
| Edificación | 2,0923 | 1,4511-3,0168 | 1,4153 | 0,9218-2,1730 |
| Terreno | 2,1026 | 1,3660-3,2363 | 1,3236 | 0,7899-2,2179 |
| Tratamiento | 2,0902 | 1,3877-3,1484 | 1,4604 | 0,9184-2,3222 |
| Detritos | 2,2297 | 1,5442-3,2196 | 2,0043 | 1,3208-3,0416 |
| Basura | 3,9810 | 1,8711-8,4703 | 3,4820 | 1,5201-7,9759 |
| Zanja | 1,5230 | 1,0225-2,2685 | 1,4562 | 0,9276-2,2859 |
Edificación: Tipo de edificación del domicilio; Terreno: Terreno en el cual el domicilio está edificado; Tratamiento: Tratamiento del agua consumida en el domicilio; Detritos: Destino de los detritos (ausencia de sumideros); Basura: Frecuencia con la que la basura es colectada (recolección irregular); Zanja: Presencia de zanja próxima al domicilio.
DISCUSIÓN
Las características de los niños involucrados en este estudio revelaron que los menores de 2 años son más susceptibles a la ocurrencia de EDA. Los estudios mostraron que los niños más chicos tienen mayores posibilidades de enfermar por gastroenteritis infecciosas, sobre todo cuando se encuentran en condiciones socioeconómicas desfavorables18.
En el período de 1995 a 2005, Oliveira y Latorre19, evaluando las internaciones y la mortalidad infantil causadas por diarrea en menores de 1 año de edad en Brasil, observaron que 13 capitales brasileñas (Macapá, Palmas, Fortaleza, Natal, João Pessoa, Salvador, Maceió, Belo Horizonte, Rio de Janeiro, Curitiba, Porto Alegre, Campo Grande y Cuiabá) presentaron reducción tanto en las internaciones como en la mortalidad infantil por diarrea. En las capitales Boa Vista, Belém, Teresina, Recife, Aracajú, São Paulo, Florianópolis y Goiânia hubo disminución solamente en la mortalidad por diarrea, mientras que Rio Branco, Porto Velho y São Luís presentaron un decrecimiento solamente en las tasas de internación por diarrea. Sin embargo, a pesar de la significativa reducción en esos índices, la diarrea sigue representando un importante problema de salud pública para parte del país.
Imada et al.18, utilizando datos de dos cuestionarios realizados en el municipio de Jordão, estado de Acre, uno en 2005 y el otro en 2012, evaluaron 466 y 826 niños menores de 5 anos de edad, respectivamente, en relación a la diarrea. Se aplicaron cuestionarios sobre las condiciones socioeconómicas, construcción de las casas, hábitos higiénicos y alimentares y saneamiento ambiental, en los que se observó que la prevalencia de diarrea en niños residentes en ese municipio pasó de 45,1%, en 2005, para 35,4%, en 2012, o sea, una reducción de 9,7% en la incidencia de ese agravamiento, pero que todavía era elevada y superior a los estudios realizados en Rio Branco (33,3%), São Paulo (4,7%), Recife y Olinda (10,2%) y Región Metropolitana de Recife (16,9%)20,21,22,23. Tal reducción se observa en todas las regiones; sin embargo no sucede de modo igualitaria, permaneciendo aún las discrepancias regionales y de los grupos socioeconómicos23.
En este estudio, las mayores reacciones positivas relacionadas con los grupos diarreico (61,6%) y control (18,7%) estuvieron representadas significativamente por los E. coli diarreogénicos, ratificando lo que ya se ha encontrado en otros estudios20,21. En los pacientes con EDA, la EPEC (45,9%) fue la más frecuente, seguida de ETEC (30,3%) y EAEC (19,2%), lo que corrobora la mayoría de los estudios en los que la frecuencia de las E. coli diarreogénicas en los pacientes con EDA fue superior, comparándose con los individuos sin diarrea24,25,26,27,28. Además, la EPEC se ha mostrado como uno de los enteropatógenos responsables por los episodios pediátricos de diarrea, especialmente en los países poco desarrollados, donde las condiciones sanitarias siguen siendo precarias24,26,27,29,30.
La presencia de ETEC en el grupo diarreico fue del 30,3% y del 57,6% en el grupo control, sin embargo, en la mayoría de los estudios, la ETEC está fuertemente asociada a los pacientes del grupo diarreico24,25,27,28,31; también se considera un importante patógeno de diarrea en la infancia de 0 a 5 años, especialmente durante los primeros 6 meses de vida24,27.
En los individuos del grupo diarreico, la EAEC fue la tercera categoría más frecuente (19,2%) y, en el grupo control, la segunda (39,4%). Estos resultados fueron similares al de Nguyen et al.24, en el cual la EAEC fue la bacteria más frecuente en los controles (7,2%). La EAEC ha sido cada vez más reconocida como un importante patógeno entérico emergente, ampliamente distribuido en todo el mundo32,33.
Las E. coli diarreogénicas son reconocidas como patógenos de etiología emergente y causa de diarrea en la infancia, especialmente en los países en desarrollo, siendo que el significado epidemiológico de cada uno de los tipos varía con la zona geográfica24,27.
En relación a la frecuencia de C. jejuni y C. coli (9,0%), se pudo observar que tales agentes tienen importancia epidemiológica en comparación con los resultados encontrados en un estudio realizado en otros países donde la prevalencia de infección por Campylobacter spp. fue similar al encontrado en este estudio. Los niños con diarrea aguda presentaron tasas de infección del 9,3% en Uganda y Zimbabwe, el 9,0% en Egipto, el 11,0% en Kenia y el 18,0% en Tanzania34.
La prevalencia de Shigella spp. entre los niños del grupo diarreico fue del 5,6%, mientras que en el control no hubo positividad. Por otro lado, un estudio realizado por Loureiro et al.4, en el estado de Pará encontró la prevalencia de Shigella spp. en 13,7% de las muestras. Las divergencias encontradas en este estudio, pueden ser explicadas por las diferencias regionales, demográficas y ambientales que involucran a las poblaciones encuestadas.
En relación a Salmonella spp., El presente estudio reveló una positividad del 2,2% en el grupo diarreico, mientras que en el grupo control la tasa fue del 1,7%. Sin embargo, Souza et al.35 identificaron una incidencia del 0,7% en sus muestras, mientras que Pontual et al.36 no observaron ningún caso positivo para Salmonella en niños atendidos en Recife, diferencias explicables también por cuestiones regionales demográficas y medioambientales.
En cuanto al número de enteropatógenos detectados, en el período del estudio, en los meses de noviembre y diciembre, hubo un pico en la incidencia de E. coli diarreogénica, meses que corresponden al inicio del período lluvioso en Acre. De acuerdo con Amaral et al.37, el aumento del índice de contaminación bacteriológica de aguas de pozos de la capa freática superficial está asociado al flujo de las aguas de lluvia contaminadas con heces humanas y animales, y el uso de esa agua no tratada aumenta la frecuencia de las diarreas en el período lluvioso.
La asociación entre la edad materna y la ocurrencia de diarrea entre los grupos se mostró estadísticamente significativa (p < 0,00005), demostrando que cuanto más joven es la madre mayor es el riesgo del niño presentar enfermedad diarreica. Los estudios realizados por diversos autores36,38,39,40,41,42,43 mostraron que la morbilidad y la mortalidad infantil por diarrea están asociadas a la edad de la madre, principalmente cuando se acompaña de riesgos relacionados con factores socioeconómicos.
La verificación de la importancia del poder adquisitivo demuestra la implicación directa de este aspecto en la casuística de la EDA41,44. Los porcentajes encontrados en este estudio son similares a los de Souza et al.35 en un estudio conducido en São Paulo, en el cual identificaron porcentajes del 51,3% en los casos sintomáticos y del 21,4% en los casos control. Toporovski et al.45 afirmaron que en las áreas caracterizadas por las pésimas condiciones de saneamiento, los enteropatógenos son identificados en los grupos control en proporciones que varían de 25 a 45%, por lo tanto, superiores a lo que se encontró en este estudio.
La asociación bivariada realizada a partir de los factores relacionados a las condiciones de vivienda, mostró la frecuencia de la recolección de basura y el destino de los desechos como las variables de mayor relevancia en la ocurrencia de la diarrea infantil. En esa perspectiva, niños residentes en domicilios con recolección de basura irregular presentaron mayor riesgo de desarrollar diarrea que los con recolección regular. En cuanto al destino de los desechos, se constató que la ausencia de red general de alcantarillado es un factor de riesgo significativo para la población estudiada. En el análisis multivariado, fue posible percibir que las variables tipo de edificación, tipo de terreno, tipo de tratamiento del agua para consumo y presencia de zanja perdieron su significancia en el proceso de enfermedad por diarrea.
Moraes46 observó relación similar, verificando que el envasado de residuos sólidos expresa la influencia significativa en la incidencia de diarrea, percibiendo que los casos de esta patología siempre son mayores en los niños residentes en domicilios que no disponen de recolección de residuos sólidos. Catapreta y Heller47 sugirieron que la inexistencia de recolección de residuos sólidos domiciliarios define, de modo importante, el riesgo para la salud de diarreicos y controles cuando relacionados con la enfermedad diarreica. En lo que se refiere al destino de los desechos, otros estudios demostraron también que la ausencia de recolección de aguas residuales representa un riesgo aumentado a la presencia de diarrea48,49,50.
La principal limitación de este estudio fue la ausencia de investigación de otros patógenos intestinales virales y parasitarios que podrían haber contribuido al fenómeno observado o incluso haber sido el agente causante de la EDA en los niños investigados. Sin embargo, son pocos los datos relativos al comportamiento de las gastroenteritis en el estado de Acre, pero se sabe que ese conocimiento es fundamental para la construcción de indicadores epidemiológicos que posibiliten la implementación de políticas que contemplen la región.
CONCLUSIÓN
Se destaca la presencia de enterobacterias en la población infantil del estado de Acre, incluso con la incidencia de agentes emergentes, demostrando que la población se encuentra en riesgo potencial de desarrollar EDA, en función de las precarias condiciones de saneamiento básico. Además, el presente estudio suministra datos que amplían el conocimiento sobre la EDA en la Región Norte, que son importantes para el desarrollo de las acciones locales, destacándose la necesidad de la manutención de un servicio permanente de vigilancia de los agentes causadores de diarrea, especialmente los bacterianos, incluso por el elevado potencial epidémico de algunos.
REFERENCIAS
1 Kotloff KL, Nataro JP, Blackwelder WC, Nasrin D, Farag TH, Panchalingam S, et al. Burden and aetiology of diarrhoeal disease in infants and young children in developing countries (the Global Enteric Multicenter Study, GEMS): a prospective, case-control study. Lancet. 2013 Jul;382(9888):209-22. Doi: 10.1016/S0140-6736(13)60844-2 [Link] [ Links ]
2 Lanata CF, Fischer-Walker CL, Olascoaga AC, Torres CX, Aryee MJ, Black RE, et al. Global causes of diarrheal disease mortality in children <5 years of age: a systematic review. PLoS One. 2013 Sep;8(9):e72788. Doi: 10.1371/journal.pone.0072788 [Link] [ Links ]
3 Liu L, Johnson HL, Cousens S, Perin J, Scott S, Lawn JE, et al. Global, regional, and national causes of child mortality: an updated systematic analysis for 2010 with time trends since 2000. Lancet. 2012 Jun;379(9832):2151-61. Doi: 10.1016/S0140-6736(12)60560-1 [Link] [ Links ]
4 Loureiro ECB, Souza CO, Sousa EB, Santos DV, Rocha DCC, Ramos FLP, et al. Detecção de bactérias enteropatogênicas e enteroparasitas em pacientes com diarreia aguda em Juruti, Pará, Brasil. Rev Pan-Amaz Saude. 2010 mar;1(1):143-8. Doi: 10.5123/S2176-62232010000100020 [Link] [ Links ]
5 Sánchez-Capilla AD, Sorlózano-Puerto A, Rodríguez-Granger J, Martínez-Brocal A, Navarro-Marí JM, Gutiérrez-Fernández J. Infectious etiology of diarrheas studied in a third-level hospital during a five-year period. Rev Esp Enferm Dig. 2015 Feb;107(2):89-97. [Link] [ Links ]
6 Vasco G, Trueba G, Atherton R, Calvopiña M, Cevallos W, Andrade T, et al. Identifying etiological agents causing diarrhea in low income Ecuadorian communities. Am J Trop Med Hyg. 2014 Sep;91(3):563-9. Doi: 10.4269/ajtmh.13-0744 [Link] [ Links ]
7 Bicer S, Col D, Erdag GC, Giray T, Gurol Y, Yilmaz G, et al. A retrospective analysis of acute gastroenteritis agents in children admitted to a university hospital pediatric emergency unit. Jundishapur J Microbiol. 2014 Apr;7(4):e9148. Doi: 10.5812/jjm.9148 [Link] [ Links ]
8 Wang X, Wang J, Sun H, Xia S, Duan R, Liang J, et al. Etiology of childhood infectious diarrhea in a developed region of China: compared to childhood diarrhea in a developing region and adult diarrhea in a developed region. PLoS One. 2015 Nov;10(11):e0142136. Doi: 10.1371/journal.pone.0142136 [Link] [ Links ]
9 Liu L, Oza S, Hogan D, Perin J, Rudan I, Lawn JE, et al. Global, regional, and national causes of child mortality in 2000-13, with projections to inform post-2015 priorities: an updated systematic analysis. Lancet. 2015 Jan;385(9966):430-40. Doi: 10.1016/S0140-6736(14)61698-6 [Link] [ Links ]
10 Bühler HF, Ignotti E, Neves SMAS, Hacon SS. Análise espacial de indicadores integrados determinantes da mortalidade por diarreia aguda em crianças menores de 1 ano em regiões geográficas. Cienc Saude Coletiva. 2014 out;19(10):4131-40. Doi: 10.1590/1413-812320141910.09282014 [Link] [ Links ]
11 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Surto de doença diarréica aguda em municípios dos estados do Acre e Amazonas, nota técnica. Brasília: Ministério da Saúde; 2005. [ Links ]
12 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Coordenação de Informação Estratégica de Vigilância em Saúde. Óbitos por diarreia aguda em crianças indígena no Acre. Brasília: Ministério da Saúde; 2012. [ Links ]
13 Ewing WH. Edwards and Ewind’s identification of Enterobacteriaceae. 4th ed. New York: Elsevier Science Publishing; 1986. 536 p. [ Links ]
14 Kauffmann F. Enterobacteriaceae. 2nd ed. Copenhagem: Munksgaard; 1954. [ Links ]
15 Aranda KRS, Fabbricotti SH, Fagundes-Neto U, Scaletsky ICA. Single multiplex assay to identify simultaneously enteropathogenic, enteroaggregative, enterotoxigenic, enteroinvasive and Shiga toxin-producing Escherichia coli strains in Brazilian children. FEMS Microbio Lett. 2007 Jan;267(2):145-50. Doi: 10.1111/j.1574-6968.2006.00580.x [Link] [ Links ]
16 Ayres M, Ayres MJ, Ayres DL, Santos AS. BioEstat 5.0: aplicações estatísticas nas áreas das ciências biológicas e médicas. Belém: Sociedade Civil Mamirauá; 2006. [Link] [ Links ]
17 Centers for Disease Control and Prevention. Epi Info (TM): software de banco de dados e estatística para profissionais de saúde pública. Versão 7.0. Atlanta: CDC; 2016. [ Links ]
18 Imada KS, Araújo TS, Muniz PT, Pádua VL. Fatores socioeconômicos, higiênicos e de saneamento na redução de diarreia na Amazônia. Rev Saude Publica. 2016 dez;50:77. Doi: 10.1590/s1518-8787.2016050006505 [Link] [ Links ]
19 Oliveira TCR, Latorre MRDO. Tendências da internação e da mortalidade infantil por diarréia: Brasil, 1995 a 2005. Rev Saude Publica. 2010 fev;44(1):102-11. Doi: 10.1590/S0034-89102010000100011 [Link] [ Links ]
20 Cesario RR, Tavares-Neto J. Prevalência de diarréia na população do Distrito Docente-Assistencial do Tucumã, Rio Branco, Estado do Acre, Brasil, em 2003. Epidemiol Serv Saude. 2006 set;15(3):19-28. Doi: 10.5123/S1679-49742006000300003 [Link] [ Links ]
21 Benicio MHD’A, Monteiro CA. Tendência secular da doença diarréica na infância na cidade de São Paulo (1984-1996). Rev Saude Publica. 2000 dez:34(6 supl):83-90. Doi: 10.1590/S0034-89102000000700011 [Link] [ Links ]
22 Vázquez ML, Mosquera M, Cuevas LE, González ES, Veras ICL, Luz EO, et al. Incidência e fatores de risco de diarréia e infecções respiratórias agudas em comunidades urbanas de Pernambuco, Brasil. Cad Saude Publica. 1999 jan-mar;15(1):163-72. Doi: 10.1590/S0102-311X1999000100016 [Link] [ Links ]
23 Vasconcelos MJOB, Batista Filho M. Doenças diarréicas em menores de cinco anos no Estado de Pernambuco: prevalência e utilização de serviços de saúde. Rev Bras Epidemiol. 2008 mar;11(1):128-38. Doi: 10.1590/S1415-790X2008000100012 [Link] [ Links ]
24 Nguyen TV, Le Van P, Le Huy C, Gia KN, Weintraub A. Detection and characterization of diarrheagenic Escherichia coli from young children in Hanoi, Vietnam. J Clin Microbiol. 2005 Feb;43(2):755-60. Doi: 10.1128/JCM.43.2.755-760.2005 [Link] [ Links ]
25 Rappelli P, Folgosa E, Solinas ML, Costa JL, Pisanu C, Sidat M, et al. Pathogenic enteric Escherichia coli in children with and without diarrhea in Maputo, Mozambique. FEMS Immunol Med Microbiol. 2005 Jan;43(1):67-72. Doi: 10.1016/j.femsim.2004.07.006 [Link] [ Links ]
26 Orlandi PP, Magalhães GF, Matos NB, Silva T, Penatti M, Nogueira PA, et al. Etiology of diarrheal infections in children of Porto Velho (Rondonia, Western Amazon region, Brazil). Braz J Med Biol Res. 2006 Apr;39(4):507-17. Doi: 10.1590/S0100-879X2006000400011 [Link] [ Links ]
27 Paniagua GL, Monroy E, García-González O, Alonso J, Negrete E, Vaca S. Two or more enteropathogens are associated with diarrhoea in Mexican children. Ann Clin Microbiol Antimicrob. 2007 Dec;6(17):1-8. Doi: 10.1186/1476-0711-6-17 [Link] [ Links ]
28 Hien BT, Trang DT, Scheutz F, Cam PD, Molbak K, Dalsgaard A. Diarrheagenic Escherichia coli and other causes of childhood diarrhea: a case-control study in children living in a wastewater use area in Hanoi, Vietnam. J Med Microbiol. 2007 Aug;56(Pt 8):1086-96. Doi: 10.1099/jmm.0.47093-0 [Link] [ Links ]
29 Alikhani MY, Mirsalehian A, Aslani MM. Detection of typical and atypical enteropathogenic Escherichia coli (EPEC) in Iranian children with and without diarrhoea. J Med Microbiol. 2006 Sep;55(Pt 9):1159-63. Doi: 10.1099/jmm.0.46539-0 [Link] [ Links ]
30 Ochoa TJ, Barletta F, Contreras C, Mercado E. New insights into the epidemiology of enteropathogenic Escherichia coli infection. Trans R Soc Trop Med Hyg. 2008 Sep;102(9):852-6. Doi: 10.1016/j.trstmh.2008.03.017 [Link] [ Links ]
31 Al-Gallas N, Bahri O, Bouratbeen A, Ben Haasen A, Ben Aissa R. Etiology of acute diarrhea in children and adults in Tunis, Tunisia, with emphasis on diarrheagenic Escherichia coli: prevalence, phenotyping, and molecular epidemiology. Am J Trop Med Hyg. 2007 Sep;77(3):571-82. Doi: 10.4269/ajtmh.2007.77.571 [Link] [ Links ]
32 Okeke IN, Ojo O, Lamikanra A, Kaper JB. Etiology of acute diarrhea in adults in southwestern Nigeria. J Clin Microbiol. 2003 Oct;41(10):4525-30. Doi: 10.1128/JCM.41.10.4525-4530.2003 [Link] [ Links ]
33 Huang DB, Nataro JP, DuPont HL, Kamat PP, Mhatre AD, Okhuysen PC, et al. Enteroaggregative Escherichia coli is a cause of acute diarrheal illness: a meta-analysis. Clin Infect Dis. 2006 Sep;43(5):556-63. Doi: 10.1086/505869 [Link] [ Links ]
34 Mshana SE, Joloba M, Kakooza A, Kaddu-Mulindwa D. Campylobacter spp among children with acute diarrhea attending Mulago hospital in Kampala -Uganda. Afr Health Sci. 2009 Sep;9(3):201-5. [Link] [ Links ]
35 Souza EC, Martinez MB, Taddei CR, Mukai L, Gilio AE, Racz ML, et al. Perfil etiológico das diarréias agudas de crianças atendidas em São Paulo. J Pediatr. 2002 jan-fev;78(1):31-8. Doi: 10.1590/S0021-75572002000100008 [Link] [ Links ]
36 Pontual JPS, Falbo AR, Gouveia JS. Estudo etiológico da diarréia em crianças hospitalizadas no Instituto Materno Infantil Prof. Fernando Figueira, IMIP, em Recife, Pernambuco. Rev Bras Saude Mater Infant. 2006 mai;6 supl 1:S11-7. Doi: 10.1590/S1519-38292006000500002 [Link] [ Links ]
37 Amaral LA, Nader Filho A, Rossi Junior OD, Ferreira FLA, Barros LSS. Água de consumo humano como fator de risco à saúde em propriedades rurais. Rev Saude Publica. 2003 ago;37(4):510-4. Doi: 10.1590/S0034-89102003000400017 [Link] [ Links ]
38 Fuchs SC, Victora CG, Fachel J. Modelo hierarquizado: uma proposta de modelagem aplicada à investigação de fatores de risco para diarréia grave. Rev Saude Publica. 1996 abr;30(2):168-78. Doi: 10.1590/S0034-89101996000200009 [Link] [ Links ]
39 Fuchs SC, Victora CG. Risk and prognostic factors for diarrheal disease in Brazilian infants: a special case-control design application. Cad Saude Publica. 2002 May-Jun;18(3):773-82. Doi: 10.1590/S0102-311X2002000300021 [Link] [ Links ]
40 Lira PIC, Lima MC, Silva GAP, Romani SAM, Eickmann SH, Alessio MLM, et al. Saúde e nutrição de crianças de áreas urbanas da Zona da Mata Meridional de Pernambuco: resultados preliminares de um estudo de coorte. Rev Bras Saude Mater Infant. 2003 out-dez;3(4):463-72. Doi: 10.1590/S1519-38292003000400011 [Link] [ Links ]
41 Vanderlei LCM, Silva GAP, Braga JU. Fatores de risco para internamento por diarréia aguda em menores de dois anos: estudo de caso-controle. Cad Saude Publica. 2003 mar-abr;19(2):455-63. Doi: 10.1590/S0102-311X2003000200012 [Link] [ Links ]
42 Ferrer SR, Strina A, Jesus SR, Ribeiro HC, Cairncross S, Rodrigues LC, et al. A hierarchical model for studying risk factors for childhood diarrhea: a case-control study in a middle-income country. Int J Epidemiol. 2008 Aug;37(4):805-15. Doi: 10.1093/ije/dyn093 [Link] [ Links ]
43 Geib LTC, Fréu CM, Brandão M, Nunes ML. Determinantes sociais e biológicos da mortalidade infantil em coorte de base populacional em Passo Fundo, Rio Grande do Sul. Cienc Saude Coletiva. 2010 mar;15(2):363-70. Doi: 10.1590/S1413-81232010000200011 [Link] [ Links ]
44 França E, Souza JM, Guimarães MDC, Goulart EMA, Colosimo E, Antunes CMF. Associação entre fatores sócio-econômicos e mortalidade infantil por diarréia, pneumonia e desnutrição em região metropolitana do Sudeste do Brasil: um estudo caso-controle. Cad Saude Publica. 2001 nov-dez;17(6):1437-47. Doi: 10.1590/S0102-311X2001000600014 [Link] [ Links ]
45 Toporovski MS, Mimica IM, Chieffi PP, Paschoalotti MA, Dias AMG, Silva CB. Diarréia aguda em crianças menores de 3 anos de idade: recuperação de enteropatógenos nas amostras fecais de pacientes comparada à de grupo controle. J Pediatr. 1999 mar-abr:75(2):97-104. Doi: 10.2223/JPED.265 [Link] [ Links ]
46 Moraes LRS. Acondicionamento e coleta de resíduos sólidos domiciliares e impactos na saúde de crianças residentes em assentamentos periurbanos de Salvador, Bahia, Brasil. Cad Saude Publica. 2007 abr;23 supl 4:S643-9. Doi: 10.1590/S0102-311X2007001600024 [Link] [ Links ]
47 Catapreta CAA, Heller L. Associação entre coleta de resíduos sólidos domiciliares e saúde, Belo Horizonte (MG), Brasil. Rev Panam Salud Publica. 1999 fev;5(2):88-96. Doi: 10.1590/S1020-49891999000200003 [Link] [ Links ]
48 Genser B, Strina A, Santos LA, Teles CA, Prado MS, Cairncross S, et al. Impact of a city-wide sanitation intervention in a large urban centre on social, environmental and behavioural determinants of childhood diarrhoea: analysis of two cohort studies. Int J Epidemiol. 2008 Aug;37(4):831-40. Doi: 10.1093/ije/dyn101 [Link] [ Links ]
49 Cairncross S, Hunt C, Boisson S, Bostoen K, Curtis V, Fung ICH, et al. Water, sanitation and hygiene for the prevention of dirrhoea. Int J Epidemiol. 2010 Apr;39 Suppl 1:i193-205. Doi: 10.1093/ije/dyq035 [Link] [ Links ]
50 Paz MGA, Almeida MF, Günther WMR. Prevalência de diarreia em crianças e condições de saneamento e moradia em áreas periurbanas de Guarulhos, SP. Rev Bras Epidemiol. 2012 mar;15(1):188-97. Doi: 10.1590/S1415-790X2012000100017 [Link] [ Links ]
*Artículo resultado de disertación presentada al Programa de Posgrado en Biología de Agentes Infecciosos y Parasitarios del Instituto de Ciencias Biológicas de la Universidad Federal do Pará, bajo la orientación del Prof. Dr. Edvaldo Carlos Brito Loureiro, como requisito para obtener el grado de Magíster en Biología de Agentes Infecciosos y Parasitarios, el 9 de mayo de 2014. Belém, Pará, Brasil
Se refiere al doi: 10.5123/S2176-62232017000400008, publicado originalmente en portugués. Traducido por: Lota Moncada
Cómo citar este artículo / How to cite this article: Gomes LO, Matos HJ, Silva MCM, Loureiro ECB, Macarenhas JDP, Gabbay YB, et al. Aspectos epidemiológicos de las enteroinfecciones bacterianas en menores de 5 años de edad en Rio Branco, estado de Acre, Brasil. Rev Pan-Amaz Saude. 2017 oct-dic;8(4):1-9. Doi: http://dx.doi.org/10.5123/S2176-62232017000400008
Recibido: 13 de Octubre de 2016; Aprobado: 06 de Marzo de 2017











 text in
text in 
 Curriculum ScienTI
Curriculum ScienTI