INTRODUÇÃO
As gastroenterites são causas relevantes de doença infantil em todo o mundo e constituem um grave problema para a saúde pública mundial1. Nos países em desenvolvimento, as doenças diarreicas afetam sobretudo os menores de 5 anos de idade e representam fator importante de mortalidade infantil2,3.
No Brasil, entre os anos de 2000 e 2010, houve 22.933 mortes de menores de 5 anos de idade devido às doenças diarreicas (80,3% em menores de 1 ano) e 1.209.622 internações (62,6% entre 1 e 4 anos)4. As microrregiões com maiores índices de mortalidade por doença diarreica aguda, na faixa etária entre os menores de 1 ano de idade, em 2009, estavam situadas nas Regiões Norte e Nordeste, que apresentaram, respectivamente, cinco e quatro vezes mais óbitos que a Região Sul5.
Dentre as principais causas de gastroenterite aguda estão os agentes de origem infecciosa que colonizam a mucosa intestinal e alteram a absorção de água, eletrólitos e nutrientes, o que resulta em desidratação grave e possível evolução para óbito6. Mais de 20 tipos diferentes de vírus são reconhecidos como importantes causadores de doenças diarreicas no mundo, o que provoca um grande impacto na população, principalmente em crianças7. Entre esses vírus, destacam-se os rotavírus (RV), os adenovírus humanos (HAdV), os astrovírus e os norovírus8.
Os HAdV estão amplamente distribuídos no mundo e se relacionam a vários processos mórbidos, incluindo doenças respiratórias, conjuntivite, uretrite e gastroenterite9.
A circulação de HAdV, causando diarreia, já foi demonstrada com taxas de incidência entre 1,2 e 12% em crianças do mundo todo10. As menores de 2 anos de idade e os pacientes imunocomprometidos de qualquer faixa etária são os indivíduos mais acometidos, podendo levar à morte8,11. De acordo com um estudo conduzido em Manchester, Inglaterra, 61,3% dos pacientes infectados com HAdV eram menores de 5 anos, 24,2% eram adultos e 5,6% tinham entre 5 e 18 anos de idade12.
Os HAdV são vírus não envelopados que possuem simetria icosaédrica e diâmetro de aproximadamente 90 nm. Seu genoma é constituído por DNA de fita dupla, linear e não segmentado, com 30 a 38 Kb13. O capsídio é formado por 252 capsômeros. Desses, 240 são hexagonais (hexons) e 12 são pentagonais, a partir dos quais se projetam os 12 filamentos (fibra). Os determinantes antigênicos estão localizados no hexon e na fibra. Pertencem à família Adenoviridae, gênero Mastadenovirus e são classificados em 57 sorotipos, distribuídos em sete espécies divididas de A a G14.
Várias estratégias para a diminuição do impacto do RV na saúde pública já foram adotadas no Brasil. Entre essas, deve-se destacar o desenvolvimento e a implantação, em larga escala, de uma vacina na rede pública. Desde março de 2006, a vacina oral de rotavírus humano (VORH), Rotarix®, fabricada pela GlaxoSmithKline (Bélgica), faz parte do calendário básico de imunizações para crianças e obteve resultados satisfatórios contra gastroenterites graves e hospitalizações por tais vírus no Brasil15,16,17,18.
Após a implementação da Rotarix®, diversos agentes virais, como os HAdV, passaram a adquirir maior importância como agentes causadores de gastroenterites. Isso porque, a partir do momento em que as crianças estão imunizadas contra RV e continuam adoecendo por gastrenterite, observa-se uma mudança no perfil epidemiológico das infecções, a qual pode ter acontecido por diminuição dos casos de rotavírus em números absolutos, o que diminui a proporção de infectados e faz com que outros agentes virais, como os HAdV assumam uma significância maior. Por isso, existe a necessidade do estabelecimento de uma vigilância epidemiológica com a definição do agente etiológico, objetivando a elaboração de medidas que proporcionem melhorarias nas condições de saneamento da população.
A literatura apresenta lacunas de tempo na pesquisa de HAdV, pois são poucos os estudos que, além da detecção, têm como objetivo a caracterização dos sorotipos detectados, o que ampliaria a visão epidemiológica da doença10.
O presente trabalho objetivou identificar a presença e definir os tipos de HAdV em amostras fecais de 1.160 crianças de até 3 anos de idade, participantes de dois projetos de pesquisa em gastroenterites virais, realizados em Belém, estado do Pará, pré e pós-introdução da vacina contra RV no Brasil.
MATERIAIS E MÉTODOS
PARTICIPANTES DA PESQUISA
Foram testados 1.160 espécimes clínicos, oriundos de dois projetos de pesquisa em gastroenterites virais realizados em Belém, estado do Pará, antes e após a introdução da vacina contra RV no Brasil.
O grupo pré-vacinação envolveu 760 amostras de crianças, na faixa etária de 0 a 3 anos de idade, com diarreia aguda que participaram de um estudo de vigilância hospitalar/ambulatorial, coletadas entre março e setembro de 2003, diariamente, em 26 hospitais e 23 unidades de saúde. Todas as crianças se encontravam com quadro de gastroenterite moderada a grave. No momento da coleta, foram preenchidas fichas de identificação contendo informações clínicas e epidemiológicas.
A análise das amostras do período pós-vacinação contra RV partiu do estudo "Rotavírus Caso-Controle", realizado para avaliar primariamente a efetividade da vacina contra RV em Belém, com crianças hospitalizadas, nascidas após 6 de março de 2006. Conduziu-se tal investigação no período de maio de 2008 a abril de 2009, quando se coletaram cerca de 4.000 espécimes fecais de crianças na faixa etária de 3 meses a 3 anos, internadas em quatro hospitais da cidade. Para o estudo sobre HAdV, foram selecionadas 400 amostras, utilizando-se como critério o "sorteio aleatório" do programa BioEstat v5.019.
A presente investigação foi aprovada pelo Comitê de Ética em Pesquisa com Seres Humanos do Instituto Evandro Chagas, em 17 de outubro de 2011, sob o no CAAE: 0013.0.72.000-11, em respeito às normas nacionais e internacionais que regulamentam tal atividade.
MÉTODOS LABORATORIAIS
A detecção de HAdV foi realizada utilizando-se suspensões fecais a 10%, testadas pela técnica de ensaio imunoenzimático (EIA), por meio do método Premier® Adenoclone® (Meridian Bioscience, Ohio, EUA). Esse método continha orifícios sensibilizados com anticorpos monoclonais específicos, dirigidos contra os antígenos reativos compartilhados por todos os grupos de HAdV. Os resultados positivos foram obtidos através de leitura visual e quantitativamente com a utilização do espectrofotômetro (filtro A450), conforme especificações do método20.
Todas as amostras positivas obtidas pelo EIA foram sorotipadas para adenovírus entérico (EAdV) pelo método Premier® Adenoclone® - Type 40/41 (Meridian Bioscience, Ohio, EUA). Essa técnica tem o mesmo fundamento do EIA global, no entanto consiste em detectar apenas os antígenos específicos da porção de EAdV 40/41.
A extração do DNA viral foi realizada nas amostras positivas obtidas pelo EIA, utilizando-se o método QIAamp® DNA Stool Mini Kit (QIAGEN, Valencia, EUA), que consiste na extração e purificação do DNA da amostra, deixando-a livre de impurezas que possam causar dificuldades à reação em cadeia da polimerase (PCR). Em seguida, esse material foi encaminhado para tipagem por meio de biologia molecular.
Para a PCR espécie-específico, utilizaram-se iniciadores consensuais21. A reação foi realizada em termociclador automático, com desnaturação a 94 ºC durante 900 s, seguindo-se 40 ciclos de desnaturação (91 ºC por 40 s), anelamento (40 ºC por 20 s) e extensão (72 ºC por 40 s); realizou-se a extensão final a 72 ºC por 420 s.
Foi utilizado gel de agarose corado com SYBR Safe® (Applied Biosystems, Waltham, MA, EUA) e concentração de 1,5% para a análise do produto de amplificação da PCR, por meio do método de eletroforese horizontal em tampão TBE 1X pH 8,4 (120 V por 35 min). A visualização dos produtos amplificados foi efetuada em aparelho de fotodocumentação Gel-Doc 1000® (Vilber Lourmat, França), em sistema de captura de imagem BioCapt®.
Após a caracterização dos genótipos, o DNA foi purificado a partir do produto da PCR, visando o sequenciamento de nucleotídeos, utilizando-se o kit QIAquick PCR Purification (QIAGEN, Valencia, CA, EUA), segundo protocolo descrito pelo fabricante.
A quantificação do DNA para a determinação de sua concentração foi realizada com o uso do marcador de peso molecular Low DNA Mass Ladder (Invitrogen, São Paulo, SP, Brasil). Após a eletroforese horizontal, as bandas de interesse no gel foram comparadas com o peso molecular, segundo a intensidade da banda, e a concentração do DNA - expressa em nanogramas (ng) - serviu de parâmetro para a reação de sequenciamento.
Para a reação de sequenciamento de nucleotídeos, foram utilizados os iniciadores hex1deg (5'-GCC SCA RTG GKC WTA CAT GCA CAT C-3') e hex2deg (5'-CAG CAC SCC ICG RAT GTC AAA-3')22; a reação foi conduzida segundo o protocolo descrito pelo fabricante do kit BigDye Terminator (Applied Biosystems, MA, EUA). As condições de termociclagem foram as seguintes: 25 ciclos de 96 °C por 30 s (desnaturação), 50 °C por 15 s (hibridização) e 60 °C por 3 min (extensão).
O produto da reação foi purificado por precipitação com isopropanol e foi centrifugado a 14.000 rpm por 30 min; o sobrenadante foi descartado e o sedimento foi seco em aparelho Speedvac (Eppendorf, Hamburgo, Alemanha) a 60 ºC por 15 min. A seguir, os produtos foram armazenados a -20 ºC, protegidos da luz para posterior eletroforese. As amostras foram ressuspensas em 10 µL de formamida, transferidas para uma placa de 96 orifícios, desnaturadas a 96 ºC por 5 min em termociclador e colocadas em banho de gelo a 0 ºC por 3 min. Em seguida, a placa foi colocada no sequenciador automático ABI PRISM 3130xl (Applied Biosystems, MA, EUA), para a realização da eletroforese e obtenção das sequências.
Após o término da eletroforese, foram obtidas as sequências dos genes, os quais foram alinhados e editados no programa BioEdit v6.05, obtendo-se uma sequência consenso para cada amostra. Em seguida, foi realizada uma pesquisa no banco de genes (http://www.ncbi.nlm.nih.gov) no programa BLAST (http://www.ncbi.nlm.nih.gov/blast) para comparar as sequências de HAdV. As árvores filogenéticas foram construídas, a partir das sequências alinhadas obtidas, em programa Mega v5.0 (análise neighbor-joining), com boodstrap de 2.500 réplicas.
ANÁLISE ESTATÍSTICA
Os resultados deste estudo foram organizados em gráficos nos programas Microsoft Office Excel 2010 e Harvard Graphics 98. As medidas de frequência foram analisadas utilizando-se o programa BioEstat v5.0, aplicando-se o teste estatístico do qui-quadrado (χ2), para os resultados de prevalência e gênero dos participantes; e o teste de partição, para análise de série de dados, tais como as medidas de sazonalidade e diferenças de faixa etária. Adotou-se o nível de significância naquelas amostras de grupos que apresentaram valores de p menores que 5% (p < 0,05)19.
RESULTADOS
Entre as 1.160 amostras envolvidas nos dois estudos dos períodos pré e pós-vacinação contra RV, obteve-se uma positividade de 7,2% (84/1.160) quanto à presença de HAdV e de 5,0% (58/1.160) de EAdV, correspondendo a 69,0% (58/84) do total de positivas.
Os HAdV foram detectados em 5,8% (44/760) dos espécimes testados por EIA provenientes do estudo pré-vacinação e em 10,0% (40/400) dos espécimes provenientes do estudo pós-vacinação (p = 0,0120).
Os EAdV estavam presentes em 3,3% (25/760) das amostras do estudo pré-vacinação e em 8,2% (33/400) dos espécimes do pós-vacinação (p = 0,0004). Considerando-se somente as amostras positivas para HAdV, os EAdV estiveram presentes em 56,8% (25/44) do pré-vacinação e em 82,5% (33/40) do pós-vacinação (p = 0,0211).
Na análise quanto ao gênero das crianças afetadas da fase pré-vacinal, observou-se 6,4% (26/403) de infecção por HAdV no gênero masculino e 5,0% (18/357) no feminino. Na fase pós-vacinal, a incidência de infecção por HAdV no masculino foi de 10,5% (22/209) e no feminino, de 9,4% (18/191). Essa diferença de positividade não foi estatisticamente significativa.
Quanto à distribuição por faixa etária da fase pré-vacinação, destacaram-se as frequências de 11,5% (14/122) de positividade para os HAdV entre 18 e 24 meses de idade e de 3,1% (2/64) entre 0 e 6 meses. Na fase pós-vacinação, nenhuma faixa etária mostrou diferença estatisticamente significativa (p > 0,05) de positividade para HAdV (Tabela 1).
Tabela 1 Frequência de HAdV, de acordo com a faixa etária das crianças, em amostras coletadas nos estudos pré e pós-vacinação, em Belém, estado do Pará, Brasil
| Faixa etária (meses) | Estudo pré-vacinação* | Estudo pós-vacinação† | ||
|---|---|---|---|---|
| Frequência | p | Frequência | p | |
| 0-6 | 3,1% (2/64) | 0,0122 | 6,2% (2/32) | 0,7039 |
| 6-12 | 6,7% (15/222) | 0,2731 | 11,9% (12/101) | 0,3548 |
| 12-18 | 3,8% (8/210) | 0,3145 | 12,0% (14/117) | 0,7050 |
| 18-24 | 11,5% (14/122) | 0,0064 | 8,7% (7/80) | 0,5249 |
| Acima de 24 | 2,3% (3/128) | 0,0803 | 7,1% (5/70) | 0,3803 |
| Não consta data de nascimento | 14,3% (2/14) | 0,1695 | - | - |
| Total | 5,8% (44/760) | 0,0122 | 10% (40/400) | 0,7039 |
Período de coleta: * março a setembro de 2003; † maio de 2008 a abril de 2009. Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arrendondamento.
Na distribuição temporal dos HAdV, no estudo pré-vacinação, a prevalência de casos positivos foi de 6,7% (29/431) nos meses chuvosos (março a junho), contra 4,9% (16/329) nos meses menos chuvosos (julho a setembro) (p = 0,3553). Para o período pós-vacinação, a prevalência nos meses menos chuvosos (julho a dezembro) foi de 10,4% (19/183), contra 9,7% (21/217) nos meses mais chuvosos (maio a junho/2008 e janeiro a abril/2009) (p = 0,9467) (Figura 1).

Figura 1 - Distribuição mensal e anual dos HAdV detectados em 1.160 espécimes fecais provenientes de estudos pré e pós-vacinação contra RV, conduzidos no período de março a setembro de 2003 e de maio de 2008 a abril de 2009 em Belém, estado do Pará, Brasil
A PCR identificou 24 amostras positivas para a espécie F (54,6%; 24/44), e uma amostra positiva tanto para a espécie C quanto para a F (2,3%; 1/44). Um total de cinco amostras não foi tipado por nenhum dos iniciadores testados (11,4%; 5/44) (Tabela 2).
Tabela 2 Resultados dos testes específicos para tipagem de HAdV, utilizando-se a PCR em amostras positivas provenientes de estudo pré-vacinação contra RV, conduzido no período de março a setembro de 2003, em Belém, estado do Pará, Brasil
| Espécie | Sorotipo | Frequência |
|---|---|---|
| A | 12, 18 e 31 | 4,5% (2/44) |
| B | 3, 7, 11, 14, 16, 21, 34, 35 e 50 | 13,6% (6/44) |
| C | 1, 2, 5 e 6 | 9,1% (4/44) |
| D | 8, 9, 10, 13, 15, 17, 19, 20, 22, 23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 36, 37, 38, 39, 42, 43, 44, 45, 46, 47, 48, 49 e 51 | 4,5% (2/44) |
| E | 4 | 2,3% (1/44) |
| F | 40, 41 | 52,3% (23/44) |
| F e C | 2,3% (1/44) | |
| Não tipadas | 11,4% (5/44) |
Um total de 30 amostras positivas para HAdV foi definido pela técnica de sequenciamento de nucleotídeos. O resultado apontou 70,0% (21/30) positivas para a espécie F, sendo 85,7% (18/21) do subtipo 41 e 14,3% (3/21) pertencentes ao subtipo 40. Observou-se um percentual de 30,0% (9/30) das crianças infectadas com HAdV do tipo não entérico, sendo 20,0% (6/30) da espécie A e 10,0% (3/30) agrupadas com a espécie C. Entre as que foram positivas para espécie A, três eram do tipo 31, duas do tipo 12 e uma amostra do tipo 18. Por sua vez, entre as agrupadas com a espécie C, duas eram do tipo 2 e uma do tipo 1 (Figura 2).
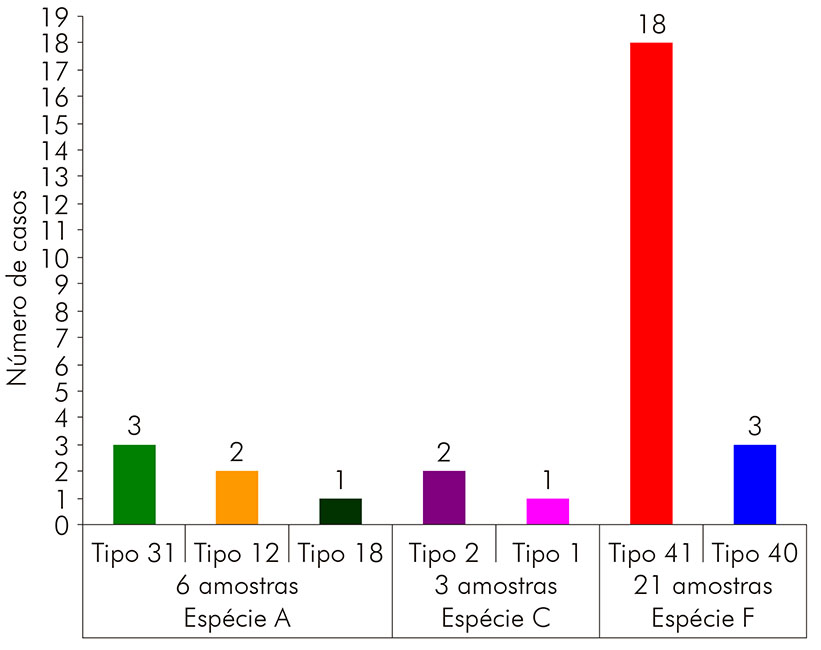
Figura 2 - Resultado da genotipagem por espécie e tipo de HAdV pela técnica de sequenciamento de nucleotídeos, de 30 amostras positivas para HAdV oriundas de projetos pré e pós-vacinação contra RV, em Belém, estado do Pará, Brasil, nos períodos de março a setembro de 2003 e de maio de 2008 a abril de 2009, respectivamente
A reação de sequenciamento de nucleotídeos foi realizada com a seleção de seis amostras provenientes do estudo pré-vacinação, para comparação de similaridade com 16 amostras sequenciadas do pós-vacinação, utilizando-se os iniciadores hex1deg e hex2deg. Os resultados da análise filogenética desses espécimes estão representados na figura 3 e demonstram o agrupamento das amostras selecionadas entre as espécies A (tipos 31, 12 e 18), C (tipos 1 e 2) e F (tipos 40 e 41).
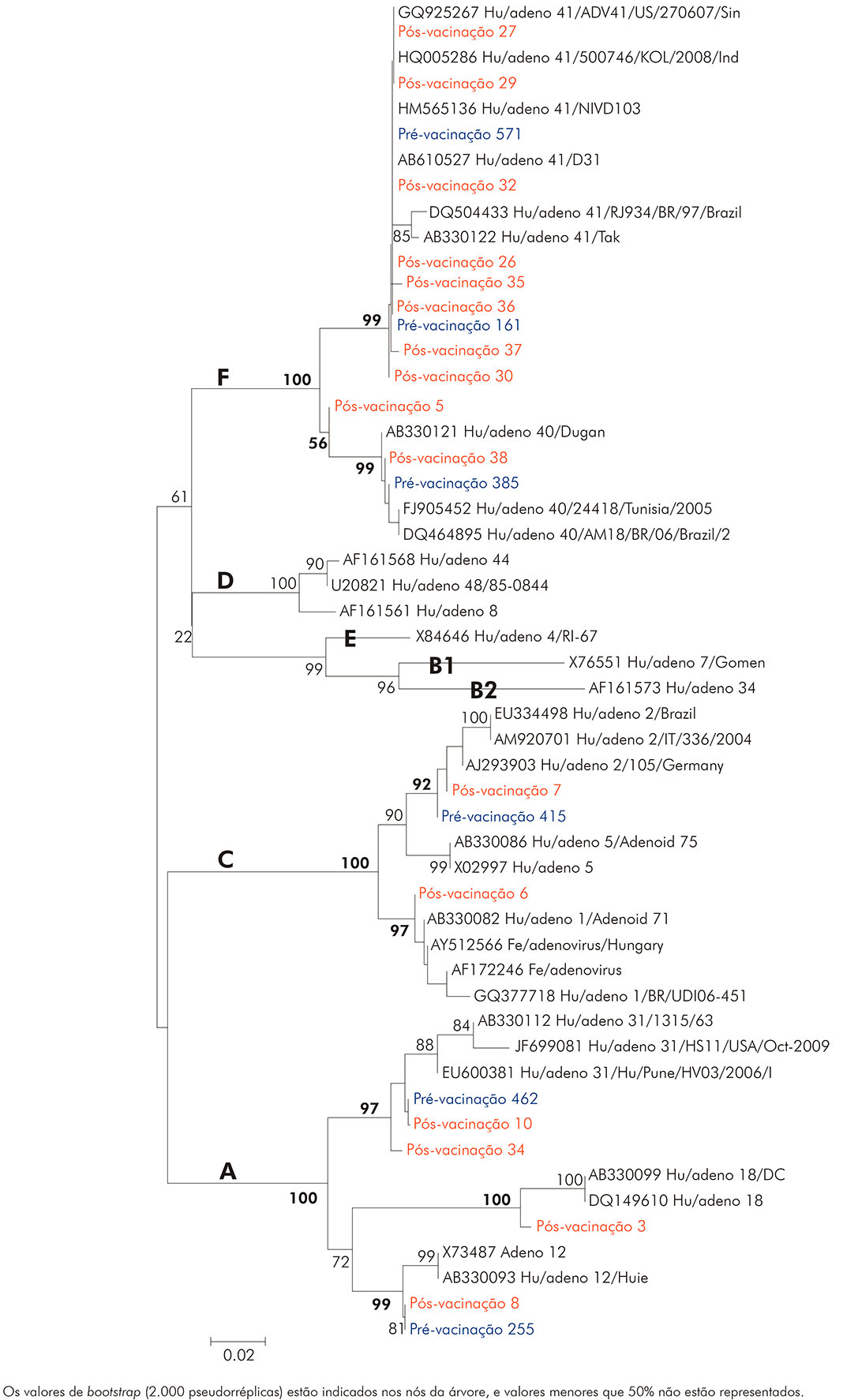
Figura 3 - Análise filogenética baseada na sequência nucleotídica do gene hexon, envolvendo 22 amostras positivas para HAdV provenientes de projetos pré e pós-vacinação contra RV, em Belém, estado do Pará, Brasil, nos períodos de março a setembro de 2003 e de maio de 2008 a abril de 2009, respectivamente
Houve oito amostras (cinco pré e três pós-vacinação) que foram sequenciadas e não puderam ser agrupadas na árvore filogenética demonstrada na figura 3. Isso ocorreu porque foram sequenciadas utilizando-se os iniciadores hex1 e hex2, os quais amplificam uma região após o nucleotídeo 321 do gene hexon, aproximadamente do nucleotídeo 356 ao 842. No entanto, também houve a possibilidade de se diferenciar as espécies e respectivos tipos de amostras positivas para HAdV. Os resultados da análise filogenética dessas oito amostras podem ser visualizados na figura 4.

Figura 4 - Análise filogenética baseada na sequência nucleotídica do gene hexon, envolvendo oito amostras positivas para HAdV provenientes de projetos pré e pós-vacinação contra RV, em Belém, estado do Pará, Brasil, nos períodos de março a setembro de 2003 e de maio de 2008 a abril de 2009, respectivamente
As amostras caracterizadas como tipo 41 apresentaram-se bem coesas em um braço da árvore, com similaridade de nucleotídeo entre elas, variando de 94,0% a 100,0%, e o valor de confiabilidade do agrupamento inferido por bootstrap foi de 99,0%. Ao comparar essas amostras do tipo 41 com amostras obtidas no Brasil (DQ504433/RJ/97), a similaridade de nucleotídeos foi de 98,0%. Com relação às amostras do tipo 40, quando relacionadas às descritas na Tunísia (FJ905452/2005)23, a similaridade de nucleotídeos observada foi de 98,6%.
Ao comparar as amostras do presente estudo, nos períodos pré e pós-vacinação contra RV, observadas nas figuras 3 e 4, constatou-se que a similaridade entre essas variou de 97,5% a 100,0%, o que demonstra que, apesar de pertencerem a diferentes espécies de HAdV e terem sido coletadas em diferentes períodos, não apresentaram grandes divergências entre si.
DISCUSSÃO
Os HAdV foram detectados em 7,2% das amostras testadas, sendo 5,0% destas EAdV; trata-se, portanto, de parcela relativamente expressiva das amostras testadas. Vale ressaltar que as amostras deste estudo eram provenientes de crianças com quadro de gastroenterite moderada a grave, logo, já eram esperados resultados mais elevados para EAdV.
Estudos anteriores conduzidos em Belém, envolvendo dados obtidos em trabalhos realizados na comunidade e no hospital, exibiram uma positividade menor de EAdV de 2,4% e 2,2%, respectivamente24,25. Analogamente, em estudos realizados em outras cidades brasileiras, com amostras de crianças diarreicas provenientes do Rio de Janeiro (Rio de Janeiro), Niterói (Rio de Janeiro), Londrina (Paraná) e Juiz de Fora (Minas Gerais), obteve-se uma positividade de 1,55% para EAdV26. Isso também foi verificado em amostras de crianças diarreicas provenientes de duas cidades da Argentina: Córdoba, com 1,5% de frequência para EAdV27; e Buenos Aires, com 3% de positividade28.
Um trabalho realizado em Paris, França, por dois anos, mostrou uma positividade de 3,5% para os HAdV dos tipos 40/4129, também inferior aos encontrados nas amostras utilizadas neste estudo. No entanto, os EAdV foram encontrados em percentuais mais elevados na cidade de Shenzhen na China (9,65%), no Iran (6,7%) e em Berlim na Alemanha (14%), infectando crianças diarreicas hospitalizadas30,31,32. Outro estudo, realizado na Tunísia, encontrou uma positividade de 6% para HAdV, com os EAdV correspondendo a 57% (20/35) das amostras positivas33.
A comparação de positividade entre a detecção de HAdV e de EAdV mostrou que os espécimes testados provenientes do estudo pré-vacinação contra RV tiveram resultados menores que os do pós-vacinação, que foram significativamente mais elevados. Esse resultado leva a refletir sobre a importância da implementação e do uso, em larga escala, da vacina contra RV a partir de 2006, uma vez que todas as crianças participantes do estudo "Rotavírus Caso-Controle" haviam sido imunizadas com a vacina Rotarix®. Nesse caso, pode ser que a gastroenterite que levou à hospitalização desses menores fosse causada, de fato, pelos HAdV, uma vez que apenas um caso de coinfecção de EAdV com RV foi identificado no estudo pós-vacinação. No entanto, deve-se considerar também o fato de que todas as crianças participantes do estudo pós-vacinação estavam hospitalizadas, enquanto as participantes do pré-vacinação eram pacientes ambulatoriais e hospitalares. Isso leva a postular que já eram esperados percentuais maiores no segundo estudo, uma vez que havia uma gravidade maior de gastroenterite entre as 400 crianças incluídas no estudo pós-vacinação.
Abordando a técnica de PCR, detectou-se maior prevalência de HAdV da espécie F (54,6%). Um caso de coinfecção por F/C foi detectado. Os dados obtidos no presente estudo são semelhantes a outro realizado nos estados do Rio de Janeiro e da Bahia, onde os espécimes positivos foram testados por PCR e, desses, 65% foram positivos para a espécie F. Vários casos de coinfecção foram detectados, entre esses por F/C34,35.
A caracterização molecular das amostras positivas para HAdV, neste estudo, demonstrou a maior prevalência da espécie F (70,0%), com clara predominância do tipo 41 (85,7%). Esse resultado está de acordo com o observado em outros estudos conduzidos em vários países, os quais demonstram o predomínio do tipo 41 em relação ao 4036,37,38,39. O tipo 41 esteve presente em 32 de 37 amostras de HAdV de um estudo conduzido no Vietnã40; além disso, representou 94,5% do total de amostras positivas na Tunísia23. Na Austrália, a frequência do tipo 41 aumentou bastante no período de 1981 a 1992, passando de 25% em 1981 até atingir 100% em 199241. No entanto, um estudo realizado com crianças alemãs demonstrou um perfil similar de circulação entre os dois sorotipos, 40 e 4142. Ao contrário do que foi observado no presente estudo, os resultados obtidos em pesquisa efetuada com crianças egípcias demonstraram os EAdV tipo 40 como mais frequentes43.
Os HAdV da espécie A corresponderam a 20,0% das amostras sequenciadas, sendo três do tipo 31, duas do 12 e uma do 18. Esse resultado está próximo ao observado por outro estudo, conduzido em Ghana, o qual obteve 17,8% das amostras positivas agrupadas com a espécie A dos HAdV44. As manifestações clínicas causadas por esses tipos de HAdV ainda não estão muito bem elucidadas; no entanto, a espécie A, assim como a F, tem sido relacionada à etiologia da gastroenterite aguda, sobretudo os tipos 31, 12 e 18 obtidos em amostras fecais de crianças45.
Este estudo também encontrou um percentual de 10,0% das amostras agrupadas com a espécie C, sendo esse valor menor que o observado em 2008, em Gana, o qual obteve 15,1% de cepas da espécie C de HAdV45. Essa espécie está relacionada à etiologia de manifestações respiratórias e infecções latentes do tecido linfoide. Portanto, pode ter havido excreção de maneira assintomática por meio das fezes dessas crianças participantes da investigação pós-vacinação contra RV no Brasil.
Todos os 1.160 espécimes incluídos no estudo foram previamente testados quanto à presença de RV. Os resultados obtidos apresentaram o percentual de 0,4% de casos de infecção mista (HAdV e RV), ou 5,9% do total de amostras positivas, sendo quatro no estudo pré-vacinação e apenas um caso no pós-vacinação contra RV. Esse dado sugere que essas crianças provavelmente estavam excretando HAdV de maneira assintomática, já que a diarreia pode também ter sido causada pela infecção por RV. Os resultados obtidos na avaliação dos casos de coinfecção deste trabalho foram menores que o esperado, quando comparados aos observados em outro estudo realizado no estado de Rondônia, o qual encontrou 10,1% e 1,7% de amostras contendo HAdV e RV, respectivamente46. Do mesmo modo, foram mais altos os índices de coinfecção encontrados na cidade de Mersi, na costa da Turquia, em estudo que obteve 7,2% e amostras positivas tanto para RV quanto para HAdV47.
Em relação às diferenças quanto ao gênero das crianças participantes deste trabalho, foi observado que ambos os estudos pré-vacinação e pós-vacinação mostraram uma positividade maior no gênero masculino. No entanto, essa diferença entre os dados obtidos não se revelou estatisticamente significativa. Esse fato está de acordo com o observado no estudo realizado na Turquia, o qual também obteve resultados mais prevalentes de HAdV para crianças do gênero masculino, mas o valor não chegou a ser estatisticamente significativo47.
Os resultados da distribuição por idade do estudo pré-vacinação demonstraram que a faixa etária mais acometida por HAdV foi a compreendida entre 18 e 24 meses, com 11,5%. Semelhante resultado foi obtido em um estudo realizado no estado do Maranhão, o qual demonstrou que a faixa etária mais acometida para HAdV foi a de 12 a 18 meses, com 14,3%48. Outro estudo, conduzido em Goiânia, estado de Goiás, mostrou que a faixa etária de maior prevalência para HAdV estava entre 1 e 3 anos, diferentemente dos RV, em que a maior frequência foi na faixa entre 1 e 11 meses de idade49. No entanto, entre as crianças participantes do estudo pós-vacinação, não houve diferença estatisticamente significativa no que concerne à positividade para HAdV por faixa etária. Esse dado corrobora um estudo realizado em Botsuana, o qual também não demonstrou diferença entre as idades das crianças com amostras positivas para HAdV50.
A análise quanto à distribuição temporal de positividade dos HAdV mostrou que, no estudo pré-vacinação, o mês de março apresentou maior percentual, com 8,7%. Cabe registrar, contudo, a limitação para se avaliar esse parâmetro, uma vez que este estudo de vigilância hospitalar e ambulatorial aconteceu no período de março a setembro de 2003, não abrangendo os 12 meses do ano. No entanto, a seleção das 400 amostras provenientes do estudo "Rotavírus Caso-Controle" ano I abrangeu a cobertura diária ao longo dos 12 meses, tornando mais fidedigna a avaliação do parâmetro em análise. Os resultados dessa variável (distribuição mensal), no estudo pós-vacinação, foram divergentes em relação aos dados apresentados pelo pré-vacinação, pois mostraram que o período de maior prevalência foi o mês de junho de 2008, com 21,0% dos casos positivos. Essa diferença de positividade observada ao longo dos meses, em ambos os estudos, não foi estatisticamente significativa.
O estado do Pará não apresenta diferença entre as quatro estações climáticas (verão, outono, inverno e primavera), conforme se observa em outras partes do Brasil. Por conseguinte, a divisão sazonal nessa área segue os critérios relativos aos índices de precipitação pluviométrica, com períodos de mais ou menos chuvas, além de variação da temperatura, com épocas de mais ou menos calor. Na avaliação do perfil sazonal de distribuição de HAdV, observou-se que sua prevalência, na cidade de Belém, não sofre alterações significativas quanto às variáveis de temperatura e precipitação pluviométrica observados na região.
Os dados apresentados anteriormente estão de acordo com os resultados obtidos por outros estudos, os quais não demonstraram sazonalidade para esse vírus, como já relatado em investigações conduzidas em países de clima temperado, onde se configurou um caráter endêmico dessa patologia51,52,53. Também se observou similaridade dos dados locais com os de outros estudos realizados no Rio de Janeiro e na Bahia, onde não houve variação sazonal significativa34,35. Resultados obtidos em Botsuana a respeito da prevalência de HAdV em crianças de baixa idade também não demonstraram diferença estatisticamente significativa entre a positividade de HAdV ao longo dos meses do ano50.
CONCLUSÃO
Não houve diferença estatisticamente significativa de positividade para HAdV em relação às distribuições temporal, sazonal e entre o gênero das crianças participantes de ambos os estudos. Apesar do significativo aumento da prevalência de HAdV após a implantação da vacina contra RV, não houve diferença na epidemiologia molecular das amostras circulantes nos períodos pré e pós-vacinação contra RV.
Os resultados positivos em relação à presença de HAdV, em Belém, infectando crianças e causando gastroenterite com e sem hospitalização, refletem a ocorrência de outros agentes virais, além de RV. Esse fato ressalta a necessidade de uma contínua vigilância, em longo prazo, a qual avaliará o impacto da implementação da vacina contra RV, a etiologia das gastroenterites virais e contribuirá para a elaboração de medidas higiênicas e sanitárias preventivas, visando à diminuição dos quadros de diarreia aguda infantil.
Os achados desta análise servirão de apoio a estudos posteriores, principalmente os relacionados à implantação de vacinas contra RV e às possíveis modificações epidemiológicas geradas pelo uso, em larga escala, das vacinas.











 text in
text in 


