Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6223versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude vol.8 no.4 Ananindeua out./dez. 2017
http://dx.doi.org/10.5123/s2176-62232017000400010
ARTÍCULO ORIGINAL
Prevalencia y diversidad molecular de adenovirus en niños con gastroenteritis aguda grave, en Belém, estado de Pará, antes y después de la introducción de la vacuna contra rotavirus en Brasil
1Instituto Evandro Chagas/SVS/MS, Seção de Virologia, Ananindeua, Pará, Brasil
2Universidade Federal do Pará, Programa de Pós-Graduação em Doenças Tropicais, Belém, Pará, Brasil
3Universidade Federal do Amapá, Coordenação de Farmácia, Macapá, Amapá, Brasil
OBJETIVOS:
Detectar la presencia y definir los tipos de adenovirus humanos (HAdV) en individuos menores de 3 años de edad, participantes de dos proyectos de investigación sobre gastroenteritis virales, realizados en Belém, estado de Pará, Brasil: el primero, un estudio de vigilancia hospitalaria y de ambulatorio, pre-vacunación contra rotavirus (RV), realizado por el Instituto Evandro Chagas en el período de marzo a setiembre de 2003; y el segundo, el proyecto "Rotavirus Caso Control", post-vacunación, con niños hospitalizados que presentaban cuadro de gastroenteritis aguda en el período de mayo de 2008 a abril de 2009.
MATERIALES Y MÉTODOS:
Se comprobaron muestras fecales de 1.160 niños, utilizando las técnicas de ensayo inmunoenzimático e inmunocromatografía para selección, la reacción en cadena de la polimerasa y secuenciación de nucleótidos para tipado e identificación molecular.
RESULTADOS:
Los HAdV se hallaron en 7,2% (84/1.160) de las muestras y los adenovirus entéricos en 5,0% (58/1.160), equivaliendo al 69,0% (58/84) de los casos positivos. De esos, 3,3% (25/760) era del estudio pre-vacunación contra el RV y 8,2% (33/400) del post-vacunación. La reacción de secuenciación caracterizó la especie F como la más prevalente en la región, equivaliendo a 70,0% (21/30), con el tipo 41 encontrado en 85,7% (18/21) de los casos positivos.
CONCLUSIÓN:
Esos resultados evidenciaron la circulación de HAdV entre la población infantil de Belém, demostrando su importancia como causa de gastroenteritis con o sin hospitalización, tanto antes como después de la introducción de la vacuna contra el RV en la red pública de salud en Brasil.
Palabras clave: Gastroenteritis; Adenovirus Humanos; Técnicas Inmunoenzimáticas; Biología Molecular
INTRODUCCIÓN
Las gastroenteritis son causas importantes de enfermedad infantil en todo el mundo y se constituyen en un problema importante para la salud pública mundial1. En los países en desarrollo, las enfermedades diarreicas afectan sobre todo a los menores de 5 años y representan un factor importante de mortalidad infantil2,3.
En Brasil, entre los años 2000 y 2010, hubo 22.933 muertes de menores de 5 años de edad debido a las enfermedades diarreicas (80,3% en menores de 1 año) y 1.209.622 internaciones (62,6% entre 1 y 4 años)4. Las microrregiones con mayores índices de mortalidad por enfermedad diarreica aguda, en el grupo de edad entre los menores de 1 año, en 2009, estaban situadas en las Regiones Norte y Nordeste, que presentaron, respectivamente, cinco y cuatro veces más muertes que la Región Sur5.
Entre las principales causas de gastroenteritis aguda están los agentes de origen infeccioso que colonizan la mucosa intestinal y alteran la absorción de agua, electrolitos y nutrientes, lo que resulta en deshidratación grave y posible evolución a óbito6. Más de 20 tipos diferentes de virus son reconocidos como importantes causantes de enfermedades diarreicas en el mundo, lo que provoca un gran impacto en la población, principalmente en niños7. Entre estos virus, se destacan los rotavirus (RV), los adenovirus humanos (HAdV), los astrovirus y los norovirus8.
Los HAdV están ampliamente distribuidos en el mundo y se relacionan con varios procesos mórbidos, incluyendo enfermedades respiratorias, conjuntivitis, uretritis y gastroenteritis9.
La circulación de HAdV, causando diarrea, ya se ha demostrado con tasas de incidencia entre 1,2 y 12% en niños de todo el mundo10. Los menores de 2 años de edad y los pacientes inmunocomprometidos de cualquier grupo de edad son los individuos más acometidos, pudiendo llevar a la muerte8,11. De acuerdo con un estudio conducido en Manchester, Inglaterra, el 61,3% de los pacientes infectados con HAdV eran menores de 5 años, el 24,2% eran adultos y el 5,6% tenía entre 5 y 18 años de edad12.
Los HAdV son virus envueltos que tienen simetría icosaédrica y un diámetro de aproximadamente 90 nm. Su genoma está constituido por ADN de cinta doble, lineal y no segmentada, con 30 a 38 Kb13. La cápside está formada por 252 capsómeros. De ellos, 240 son hexagonales (hexores) y 12 son pentagonales, a partir de los cuales se proyectan los 12 filamentos (fibra). Los determinantes antigénicos se encuentran en el héxon y en la fibra. Pertenecen a la familia Adenoviridae, género Mastadenovirus y se clasifican en 57 serotipos, distribuidos en siete especies divididas de A a G14.
Varias estrategias para la disminución del impacto del RV en la salud pública ya fueron adoptadas en Brasil. Entre ellas, se debe destacar el desarrollo y la implantación a gran escala de una vacuna en la red pública. Desde marzo de 2006, la vacuna oral de rotavirus humano (VORH), Rotarix®, fabricada por GlaxoSmithKline (Bélgica), forma parte del calendario básico de inmunizaciones para niños y obtuvo resultados satisfactorios contra gastroenteritis graves y hospitalizaciones por estos virus en Brasil15,16,17,18.
Después de la implementación de Rotarix®, diversos agentes virales, como los HAdV, adquirieron mayor importancia como agentes causantes de gastroenteritis. Esto se debe a que, desde el momento en que los niños están inmunizados contra RV y continúan enfermando por gastroenteritis, se observa un cambio en el perfil epidemiológico de las infecciones, que puede haber ocurrido por disminución de los casos de rotavirus en números absolutos, lo que disminuye la proporción de infectados y hace que otros agentes virales, como los HAdV asuman una significación mayor. Por eso, existe la necesidad de establecer una vigilancia epidemiológica con la definición del agente etiológico, con el objetivo de elaborar medidas que proporcionen mejoras en las condiciones de saneamiento de la población.
La literatura presenta lagunas de tiempo en la investigación de HAdV, pues son pocos los estudios que, además de la detección, tienen como objetivo la caracterización de los serotipos detectados, lo que ampliaría la visión epidemiológica de la enfermedad10.
El presente trabajo tuvo como objetivo identificar la presencia y definir los tipos de HAdV en muestras fecales de 1.160 niños de hasta 3 años de edad, participantes de dos proyectos de investigación en gastroenteritis virales, realizados en Belém, estado de Pará, pre y post-introducción vacuna contra RV en Brasil.
MATERIALES Y MÉTODOS
PARTICIPANTES DE LA INVESTIGACIÓN
Se evaluaron 1.160 especímenes clínicos, provenientes de dos proyectos de investigación en gastroenteritis virales realizados en Belém, estado de Pará, antes y después de la introducción de la vacuna contra RV en Brasil.
El grupo de pre-vacunación abarcó 760 muestras de niños en el grupo de edad de 0 a 3 años, con diarrea aguda que participaron en un estudio de vigilancia hospitalaria/ambulatoria, recogidas entre marzo y septiembre de 2003, diariamente, en 26 hospitales y 23 unidades de salud. Todos los niños se encontraban con un cuadro de gastroenteritis moderada a grave. En el momento de la recolección, se llenaron fichas de identificación que contenían informaciones clínicas y epidemiológicas.
El análisis de las muestras del período post-vacunación contra el RV partió del estudio "Rotavirus Caso-Control", realizado para evaluar primariamente la efectividad de la vacuna contra el RV en Belém, con niños hospitalizados, nacidos después del 6 de marzo de 2006. Se llevó a cabo tal investigación en el período de mayo de 2008 a abril de 2009, cuando se recogieron cerca de 4.000 especímenes fecales de niños en el grupo de edad de 3 meses a 3 años, internados en cuatro hospitales de la ciudad. Para el estudio sobre HAdV, se seleccionaron 400 muestras, utilizando como criterio el "sorteo aleatorio" del programa BioEstat v5.019.
La presente investigación fue aprobada por el Comité de Ética en Investigación con Seres Humanos del Instituto Evandro Chagas, el 17 de octubre de 2011, bajo el n° CAAE: 0013.0.72.000-11, en respeto a las normas nacionales e internacionales que regulan tal actividad.
MÉTODOS DE LABORATORIO
La detección de HAdV se realizó utilizando suspensiones fecales al 10%, probadas por la técnica de ensayo inmunoenzimático (EIA), a través del método Premier® Adenoclone® (Meridian Bioscience, Ohio, EE.UU.). Este método contenía orificios sensibilizados con anticuerpos monoclonales específicos, dirigidos contra los antígenos reactivos compartidos por todos los grupos de HAdV. Los resultados positivos se obtuvieron mediante lectura visual y cuantitativamente con la utilización del espectrofotómetro (filtro A450), según las especificaciones del método20.
Todas las muestras positivas obtenidas por EIA fueron serotipadas para adenovirus entérico (EAdV) mediante el método Premier® Adenoclone® - Type 40/41 (Meridian Bioscience, Ohio, EE.UU.). Esta técnica tiene el mismo fundamento del EIA global, sin embargo consiste en detectar sólo los antígenos específicos de la porción de EAdV 40/41.
La extracción del ADN viral se realizó en las muestras positivas obtenidas por el EIA, utilizando el método QIAamp® DNA Stool Mini Kit (QIAGEN, Valencia, EE.UU.), que consiste en la extracción y purificación del ADN de la muestra, dejándola libre de impurezas que puedan causar dificultades a la reacción en cadena de la polimerasa (PCR). A continuación, ese material fue encaminado a tipado por biología molecular.
Para la PCR especie-específica, se utilizaron iniciadores (primers) consensuales21. La reacción fue realizada en termociclador automático, con desnaturalización a 94 ºC durante 900 s, seguido de 40 ciclos de desnaturalización (91 ºC por 40 s), anulación (40 ºC por 20 s) y extensión (72 ºC por 40 s); se realizó la extensión final a 72 ºC por 420 s.
Se utilizó gel de agarosa teñido con SYBR Safe® (Applied Biosystems, Waltham, MA, EE.UU.) y concentración del 1,5% para el análisis del producto de amplificación de la PCR, por medio del método de electroforesis horizontal en tampón TBE 1X pH 8,4 (120 V por 35 min). La visualización de los productos amplificados fue efectuada en un aparato de fotodocumentación Gel-Doc 1000® (Vilber Lourmat, Francia), en sistema de captura de imagen BioCapt®.
Después de la caracterización de los genotipos, el ADN fue purificado a partir del producto de la PCR, buscando la secuenciación de nucleótidos, utilizando el kit QIAquick PCR Purification (QIAGEN, Valencia, CA, EE.UU.), según protocolo descrito por el fabricante.
La cuantificación del ADN para determinar su concentración se realizó con el uso del marcador de peso molecular Low DNA Mass Ladder (Invitrogen, São Paulo, SP, Brasil). Después de la electroforesis horizontal, las bandas de interés en el gel fueron comparadas con el peso molecular, según la intensidad de la banda, y la concentración del ADN - expresada en nanogramas (ng) - sirvió de parámetro para la reacción de secuenciación.
Para la reacción de secuenciación de nucleótidos, se utilizaron los iniciadores hex1deg (5'-GCC SCA RTG GKC WTA CAT GCA CAT C-3 ') y hex2deg (5'-CAG CAC SCC ICG RAT GTC AAA-3')22; la reacción fue conducida según el protocolo descrito por el fabricante del kit BigDye Terminator (Applied Biosystems, MA, EE.UU.). Las condiciones en el termociclador fueron las siguientes: 25 ciclos de 96 °C por 30 s (desnaturalización), 50 °C por 15 s (hibridación) y 60 °C durante 3 min (extensión).
El producto de la reacción fue purificado por precipitación con isopropanol y se centrifugó a 14.000 rpm durante 30 min; el sobrenadante fue descartado y el sedimento secado en aparato Speedvac (Eppendorf, Hamburgo, Alemania) a 60 ºC por 15 min. A continuación, los productos fueron almacenados a -20º C, protegidos de la luz para posterior electroforesis. Las muestras fueron resuspendidas en 10 μl de formamida, transferidas a una placa de 96 orificios, desnaturadas a 96 ºC por 5 min en termociclador y colocadas en baño de hielo a 0 ºC por 3 min. A continuación, la placa se colocó en el secuenciador automático ABI PRISM 3130xl (Applied Biosystems, MA, EE.UU.), para realizar la electroforesis y la obtención de las secuencias.
Después del término de la electroforesis, se obtuvieron las secuencias de los genes, los cuales fueron alineados y editados en el programa BioEdit v6.05, obteniéndose una secuencia consenso para cada muestra. A continuación, se realizó una investigación en el banco de genes (http://www.ncbi.nlm.nih.gov) en el programa BLAST (http://www.ncbi.nlm.nih.gov/blast) para comparar las secuencias de HAdV. Los árboles filogenéticos se construyeron a partir de las secuencias alineadas obtenidas, en programa Mega v5.0 (análisis neighbor-joining ), con bootstrap de 2.500 réplicas.
ANÁLISIS ESTADÍSTICO
Los resultados de este estudio se organizaron en gráficos en los programas Microsoft Office Excel 2010 y Harvard Graphics 98. Las medidas de frecuencia se analizaron utilizando el programa BioEstat v5.0, aplicando la prueba estadística del chi-cuadrado (χ2), para los resultados de prevalencia y género de los participantes; y la prueba de partición, para análisis de serie de datos, tales como las medidas de estacionalidad y diferencias de grupo de edad. Se adoptó el nivel de significación en aquellas muestras de grupos que presentaron valores de p menores que 5% (p <0,05)19.
RESULTADOS
Entre las 1.160 muestras involucradas en los dos estudios de los períodos pre y post-vacunación contra el RV, se obtuvo una positividad del 7,2% (84/1.160) con relación a la presencia de HAdV y del 5,0% (58/1.160) EAdV, correspondiendo al 69,0% (58/84) del total de positivas.
Los HAdV se detectaron en el 5,8% (44/760) de los especímenes probados por EIA procedentes del estudio pre-vacunación y en el 10,0% (40/400) de los especímenes procedentes del estudio post-vacunación (p = 0,0120 ).
Los EAdV estaban presentes en el 3,3% (25/760) de las muestras del estudio pre-vacunación y en el 8,2% (33/400) de los especímenes post-vacunación (p = 0,0004). Considerando solamente las muestras positivas para HAdV, los EAdV estuvieron presentes en 56,8% (25/44) del pre-vacunación y en 82,5% (33/40) del post-vacunación (p = 0,0211).
En el análisis en cuanto al género de los niños afectados de la fase pre-vacunal, se observó un 6,4% (26/403) de infección por HAdV en el género masculino y el 5,0% (18/357) en el femenino. En la fase post-vacunal, la incidencia de infección por HAdV en el masculino fue del 10,5% (22/209) y en el femenino, del 9,4% (18/191). Esta diferencia de positividad no fue estadísticamente significativa.
En cuanto a la distribución por grupo de edad de la fase pre-vacunación, se destacaron las frecuencias del 11,5% (14/122) de positividad para los HAdV entre 18 y 24 meses de edad y del 3,1% (2/64) entre 0 y 6 meses. En la fase post-vacunación, ningún grupo de edad mostró diferencia estadísticamente significativa (p> 0,05) de positividad para HAdV (Tabla 1).
Tabla 1 - Frecuencia de HAdV, de acuerdo con el grupo de edad de los niños, en muestras recolectadas en el período de marzo a setiembre de 2003, en Belém, estado de Pará, Brasil
| Grupo de edad (meses) | Estudio pre-vacunación* | Estudio post-vacunación† | ||
|---|---|---|---|---|
| Frecuencia | p | Frecuencia | p | |
| 0-6 | 3,1% (2/64) | 0,0122 | 6,2% (2/32) | 0,7039 |
| 6-12 | 6,7% (15/222) | 0,2731 | 11,9% (12/101) | 0,3548 |
| 12-18 | 3,8% (8/210) | 0,3145 | 12,0% (14/117) | 0,7050 |
| 18-24 | 11,5% (14/122) | 0,0064 | 8,7% (7/80) | 0,5249 |
| Superior a 24 | 2,3% (3/128) | 0,0803 | 7,1% (5/70) | 0,3803 |
| No consta fecha de nacimiento | 14,3% (2/14) | 0,1695 | - | - |
| Total | 5,8% (44/760) | 0,0122 | 10% (40/400) | 0,7039 |
Período de recolección: * marzo a setiembre de 2003; † mayo de 2008 a abril de 2009. Señal convencional utilizada: - Dato numérico igual a cero, no resultante de redondeo.
En la distribución temporal de los HAdV, en el estudio pre-vacunación, la prevalencia de casos positivos fue del 6,7% (29/431) en los meses lluviosos (marzo a junio), contra 4,9% (16/329) en los meses menos lluviosos (julio a septiembre) (p = 0,3553). Para el período post-vacunación, la prevalencia en los meses menos lluviosos (julio a diciembre) fue del 10,4% (19/183), contra 9,7% (21/217) en los meses más lluviosos (mayo a junio / 2008 y enero a abril / 2009) (p = 0,9467) (Figura 1).

Muestras positivas de acuerdo con la fecha de colecta.
Figura 1 - Distribución mensual y anual de los HAdV detectados en 1.160 especímenes fecales provenientes de estudios pre y post-vacunación contra RV, conducidos en el período de marzo a setiembre de 2003 y de mayo de 2008 a abril de 2009 en Belém, estado de Pará, Brasil
La PCR identificó 24 muestras positivas para la especie F (54,6%, 24/44), y una muestra positiva tanto para la especie C como para la F (2,3%, 1/44). Un total de cinco muestras no fue tipado por ninguno de los iniciadores probados (11,4%, 5/44) (Tabla 2).
Tabla 2 - Resultados de las pruebas específicas para tipado de los HAdV, utilizando la PCR en muestras positivas provenientes de estudio pre-vacunación contra RV conducido en el período de marzo a setiembre de 2003 en Belém, estado de Pará, Brasil
| Especie | Serotipo | Frecuencia |
|---|---|---|
| A | 12, 18 e 31 | 4,5% (2/44) |
| B | 3, 7, 11, 14, 16, 21, 34, 35 e 50 | 13,6% (6/44) |
| C | 1, 2, 5 e 6 | 9,1% (4/44) |
| D | 8, 9, 10, 13, 15, 17, 19, 20, 22, 23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 36, 37, 38, 39, 42, 43, 44, 45, 46, 47, 48, 49 e 51 | 4,5% (2/44) |
| E | 4 | 2,3% (1/44) |
| F | 40, 41 | 52,3% (23/44) |
| F y C | 2,3% (1/44) | |
| No tipadas | 11,4% (5/44) |
Un total de 30 muestras positivas para HAdV fue definido por la técnica de secuenciación de nucleótidos. El resultado apuntó 70,0% (21/30) positivas para la especie F, siendo 85,7% (18/21) del subtipo 41 y 14,3% (3/21) pertenecientes al subtipo 40. Se observó un porcentaje del 30,0% (9/30) de niños infectados con HAdV del tipo no entérico, siendo el 20,0% (6/30) de la especie A y el 10,0% (3/30) agrupados con la especie C. Entre las que fueron positivas para especie A, tres eran del tipo 31, dos del tipo 12 y una muestra del tipo 18. Por su vez, entre las agrupadas con la especie C, dos eran del tipo 2 y una del tipo 1 (figura 2).
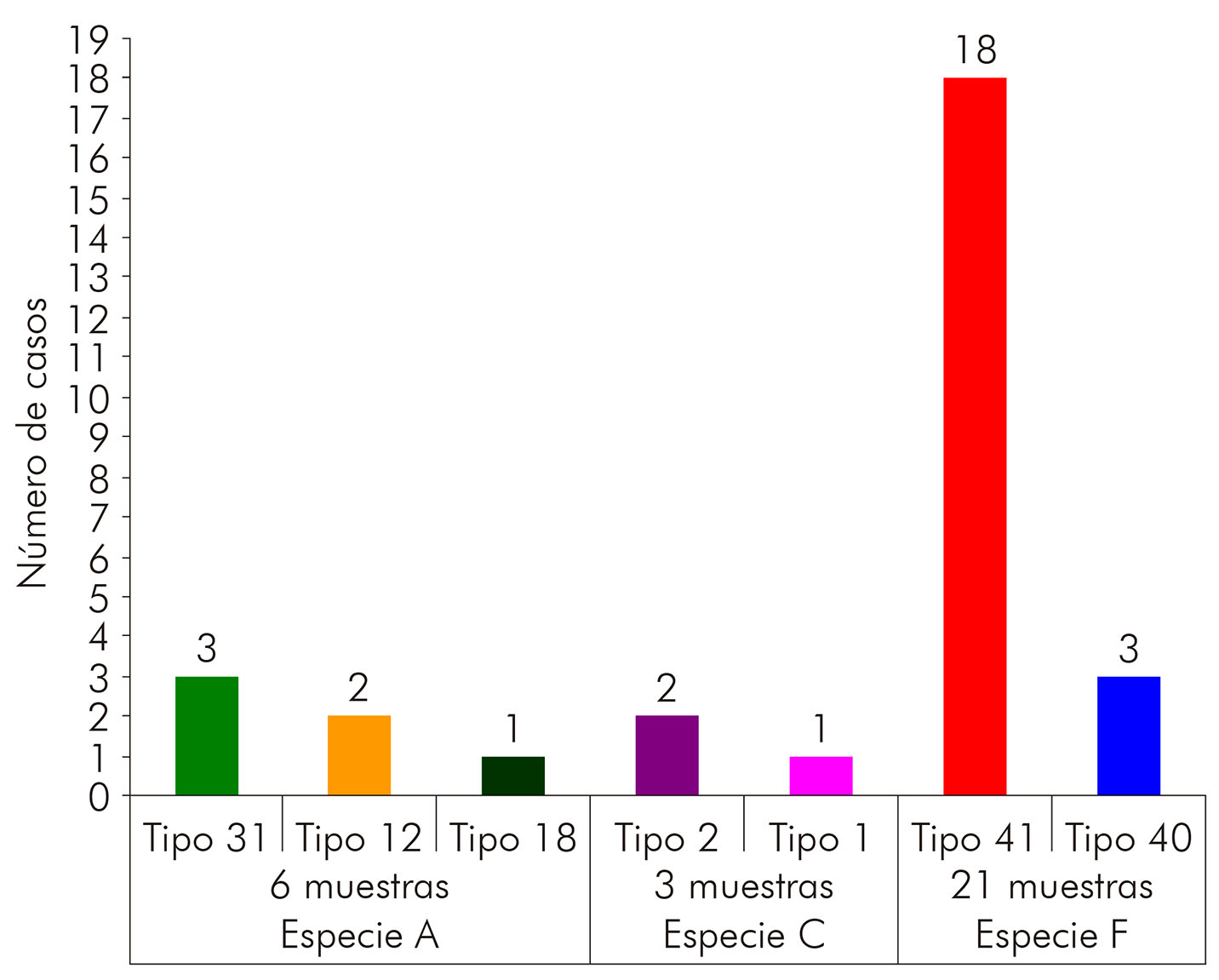
Figura 2 - Resultado del genotipado por especie y tipo de HAdV, por la técnica de secuenciación de nucleótidos, de 30 muestras positivas para HAdV oriundas de proyectos pre y post-vacunación contra RV en la ciudad de Belém, estado de Pará, Brasil, en los períodos de marzo a setiembre de 2003 y de mayo de 2008 a abril de 2009
La reacción de secuenciación de nucleótidos se realizó con la selección de seis muestras provenientes del estudio pre-vacunación, para comparación de similitud con 16 muestras secuenciadas del post-vacunación, utilizando los iniciadores hex1deg y hex2deg. Los resultados del análisis filogenético de estos especímenes están representados en la figura 3 y demuestran la agrupación de las muestras seleccionadas entre las especies A (tipos 31, 12 y 18), C (tipos 1 y 2) y F (tipos 40 y 41).
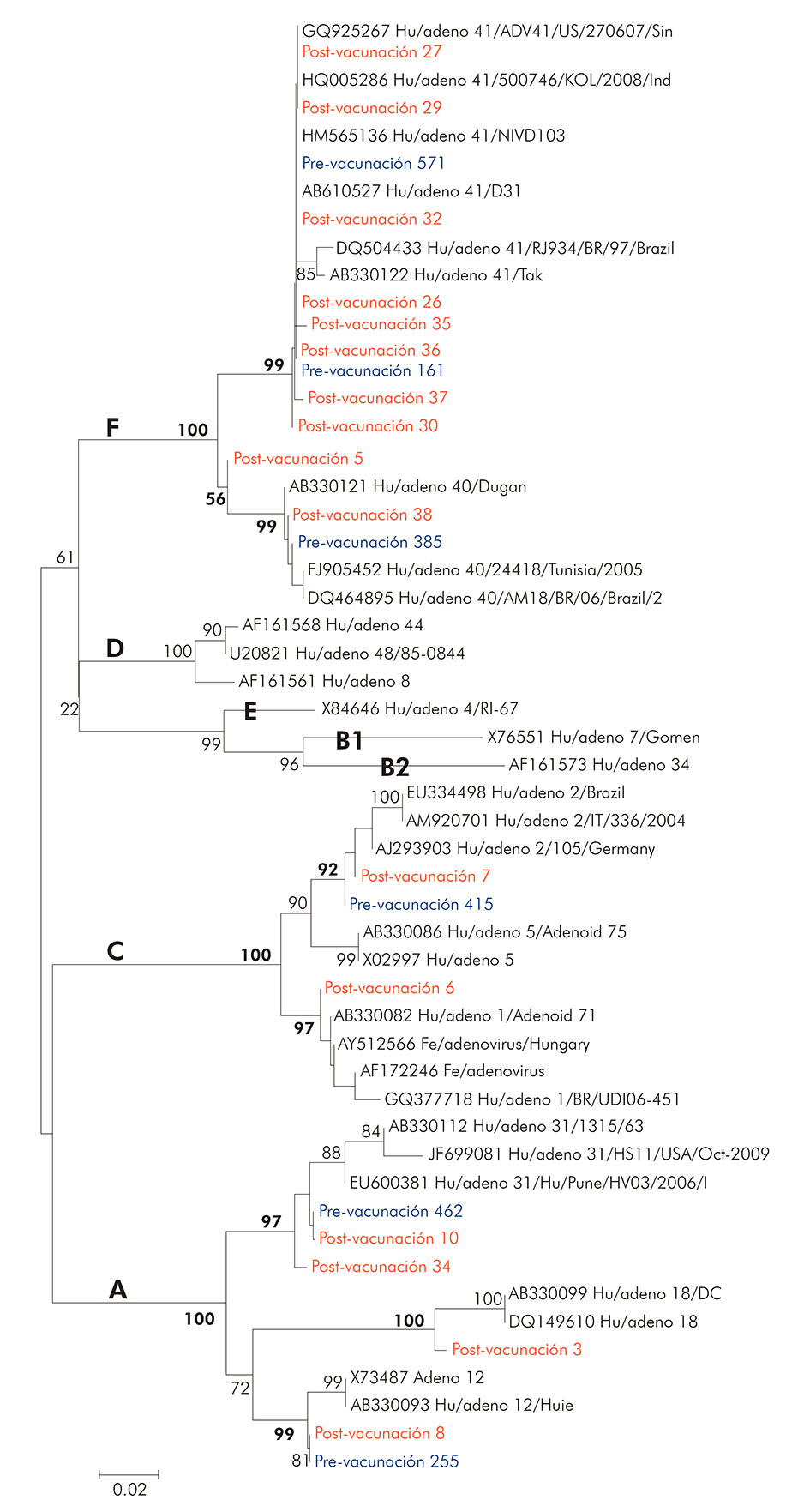
Los valores de bootstrap (2.000 pseudorréplicas) están indicados en los nudos del árbol, y valores menores que 50% no están representados.
Figura 3 - Análisis filogenético basado en la secuencia nucleótida del gen héxon abarcando 22 muestras positivas para HAdV provenientes de proyectos pre y post-vacunación contra RV en la ciudad de Belém, estado de Pará, Brasil, en los períodos de marzo a setiembre de 2003 y de mayo de 2008 a abril de 2009
Se realizaron ocho muestras (cinco pre y tres post-vacunación) que fueron secuenciadas y no pudieron ser agrupadas en el árbol filogenético demostrado en la figura 3. Esto ocurrió porque fueron secuenciadas utilizando los iniciadores hex1 y hex2, los cuales amplifican una región después del nucleótido 321 del gen héxon, aproximadamente del nucleótido 356 al 842. Sin embargo, también hubo la posibilidad de diferenciar las especies y sus tipos de muestras positivas para HAdV. Los resultados del análisis filogenético de estas ocho muestras se pueden ver en la figura 4.
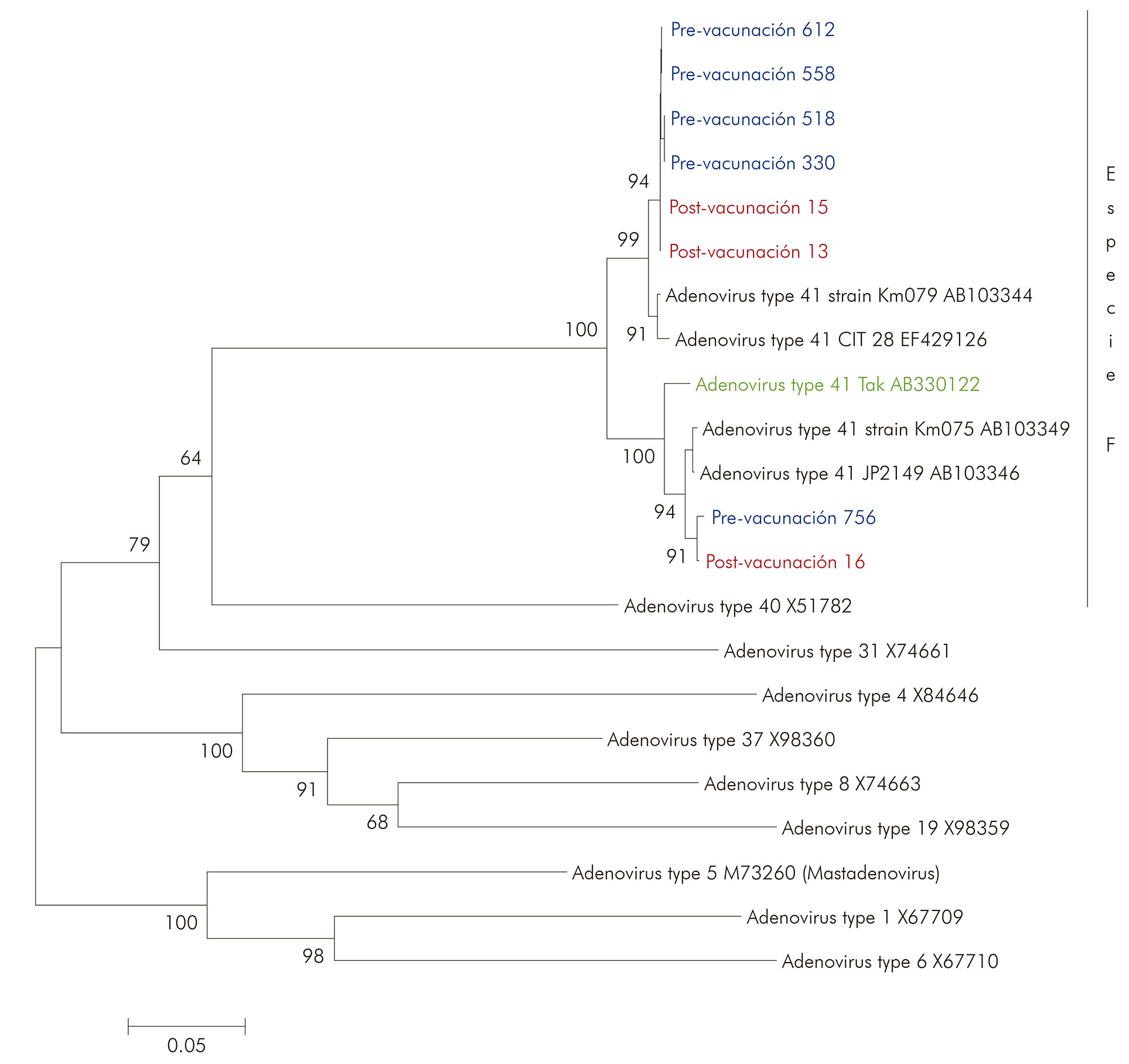
Los valores de bootstrap (2.000 pseudorréplicas) están indicados en los nudos del árbol, y valores menores que 50% no están representados.
Figura 4 - Análisis filogenético basado en la secuencia nucleótida del gen héxon abarcando 22 muestras positivas para HAdV provenientes de proyectos pre y post-vacunación contra RV en la ciudad de Belém, estado de Pará, Brasil, en los períodos de marzo a setiembre de 2003 y de mayo de 2008 a abril de 2009
Las muestras caracterizadas como tipo 41 se presentaron bien conexas en un brazo del árbol, con similitud de nucleótido entre ellas, variando del 94,0% al 100,0%, y el valor de confiabilidad del agrupamiento inferido por bootstrap fue del 99, 0%. Al comparar estas muestras del tipo 41 con muestras obtenidas en Brasil (DQ504433/RJ/97), la similitud de nucleótidos fue del 98,0%. Con respecto a las muestras del tipo 40, cuando se relacionan con las descritas en Túnez (FJ905452/2005)23, la similitud de los nucleótidos observada fue del 98,6%.
Al comparar las muestras del presente estudio, en los períodos pre y post-vacunación contra RV, observadas en las figuras 3 y 4, se constató que la semejanza entre ellas varía del 97,5% al 100,0%, lo que demuestra que, a pesar de pertenecer a diferentes especies de HAdV y haber sido recolectadas en diferentes períodos, no presentaron grandes divergencias entre sí.
DISCUSIÓN
Los HADV se detectaron en el 7,2% de las muestras probadas, siendo el 5,0% de estas EAdV; se trata, por lo tanto, de una proporción relativamente expresiva de las muestras probadas. Es importante destacar que las muestras de este estudio provenían de niños con cuadro de gastroenteritis moderada a grave, por lo que ya se esperaban resultados más elevados para EAdV.
Los estudios previos realizados en Belém, que involucra datos obtenidos en trabajos realizados en la comunidad y en el hospital, mostraron una positividad menor de EAdV del 2,4% y del 2,2%, respectivamente24,25. En los estudios realizados en otras ciudades brasileñas, con muestras de niños diarreicos provenientes de Rio de Janeiro (Rio de Janeiro), Niterói (Rio de Janeiro), Londrina (Paraná) y Juiz de Fora (Minas Gerais), se obtuvo una positividad del 1,55% para EAdV26. Esto también fue verificado en muestras de niños diarreicos provenientes de dos ciudades de Argentina: Córdoba, con 1,5% de frecuencia para EAdV27; y Buenos Aires, con un 3% de positividad28.
Un trabajo realizado en París, Francia, durante dos años, mostró un resultado positivo del 3,5% para los HAdV de los tipos 40/4129, también inferior a los encontrados en las muestras utilizadas en este estudio. Sin embargo, los EAdV fueron encontrados en porcentajes más altos en la ciudad de Shenzhen en China (9,65%), en Irán (6,7%) y en Berlín en Alemania (14%), infectando a niños diarreicos hospitalizados30,31,32. Otro estudio, realizado en Túnez, encontró una positividad del 6% para HAdV, con los EAdV correspondiendo al 57% (20/35) de las muestras positivas33.
La comparación de positividad entre la detección de HAdV y de EAdV mostró que los especímenes probados procedentes del estudio previo a la vacunación contra RV tuvieron resultados menores que los de post-vacunación, que fueron significativamente más elevados. Este resultado lleva a reflexionar sobre la importancia de la implementación y el uso a gran escala de la vacuna contra el RV desde 2006, ya que todos los niños participantes en el estudio "Rotavirus Caso-Control" habían sido inmunizados con la vacuna Rotarix®. En este caso, puede ser que la gastroenteritis que llevó a la hospitalización de estos menores fuera causada, realmente por los HAdV, ya que sólo un caso de coinfección de EAdV con RV fue identificado en el estudio post-vacunación. Sin embargo, se debe considerar también el hecho de que todos los niños participantes del estudio post-vacunación estaban hospitalizados, mientras que las participantes del pre-vacunación eran pacientes de ambulatorios y hospitales. Esto lleva a postular que ya se esperaban porcentajes mayores en el segundo estudio, ya que había una gravedad mayor de gastroenteritis entre los 400 niños incluidos en el estudio post-vacunación.
Abordando la técnica de PCR, se detectó una mayor prevalencia de HAdV de la especie F (54,6%). Se ha detectado un caso de coinfección por F/C. Los datos obtenidos en el presente estudio son similares a otro realizado en los estados de Rio de Janeiro y Bahia, donde los especímenes positivos fueron probados por PCR y, de ellos, el 65% fueron positivos para la especie F. Varios casos de coinfección fueron detectados, entre ellos por F/C34,35.
La caracterización molecular de las muestras positivas para HAdV en este estudio demostró la mayor prevalencia de la especie F (70,0%), con clara predominancia del tipo 41 (85,7%). Este resultado está de acuerdo con lo observado en otros estudios conducidos en varios países, los cuales demuestran el predominio del tipo 41 en relación al 4036,37,38,39. El tipo 41 estuvo presente en 32 de 37 muestras de HAdV de un estudio conducido en Vietnam40; además, representó el 94,5% del total de muestras positivas en Túnez23. En Australia, la frecuencia del tipo 41 aumentó bastante en el período 1981 a 1992, pasando del 25% en 1981 hasta alcanzar el 100% en 199241. Sin embargo, un estudio realizado con niños alemanes demostró un perfil similar de circulación entre los dos serotipos, 40 y 4142. Al contrario de lo que se observó en el presente estudio, los resultados obtenidos en investigación efectuada con niños egipcios demostraron los EAdV tipo 40 como los más frecuentes43.
Los HAdV de la especie A correspondieron al 20,0% de las muestras secuenciadas, siendo tres del tipo 31, dos del 12 y una del 18. Ese resultado está cerca del observado por otro estudio, conducido en Ghana, el cual obtuvo el 17,8% de las muestras positivas agrupadas con la especie A de los HAdV44. Las manifestaciones clínicas causadas por estos tipos de HAdV todavía no están muy bien dilucidadas; sin embargo, la especie A, así como la F, se ha relacionado con la etiología de la gastroenteritis aguda, sobre todo los tipos 31, 12 y 18 obtenidos en muestras fecales de niños45.
Este estudio también encontró un porcentaje del 10,0% de las muestras agrupadas con la especie C, siendo ese valor menor que el observado en 2008, en Ghana, el cual obtuvo el 15,1% de cepas de la especie C de HAdV45. Esta especie está relacionada con la etiología de manifestaciones respiratorias e infecciones latentes del tejido linfoide. Por lo tanto, puede haber habido excreción de modo asintomático a través de las heces de esos niños participantes de la investigación post-vacunación contra el RV en Brasil.
Todos los 1.160 especímenes incluidos en el estudio fueron previamente probados con relación a la presencia de RV. Los resultados obtenidos presentaron el porcentaje del 0,4% de casos de infección mixta (HAdV y RV), o el 5,9% del total de muestras positivas, siendo cuatro en el estudio pre-vacunación y sólo un caso en la post-vacunación contra RV. Este dato sugiere que estos niños probablemente estaban excretando HADV de modo asintomático, ya que la diarrea puede también haber sido causada por la infección por RV. Los resultados obtenidos en la evaluación de los casos de coinfección de este trabajo fueron menores de lo esperado, cuando se los compara a los observados en otro estudio realizado en el estado de Rondônia, el cual encontró el 10,1% y el 1,7% de muestras conteniendo HAdV y RV, respectivamente46. De la misma manera, fueron más altos los índices de coinfección encontrados en la ciudad de Mersi, en la costa de Turquía, en estudio que obtuvo el 7,2% y muestras positivas tanto para RV como para HAdV47.
En relación a las diferencias en cuanto al género de los niños participantes en este trabajo, se observó que ambos estudios pre-vacunación y post-vacunación mostraron una positividad mayor en el género masculino. Sin embargo, esta diferencia entre los datos obtenidos no resultó estadísticamente significativa. Este hecho está de acuerdo con lo observado en el estudio realizado en Turquía, el cual también obtuvo resultados más prevalentes de HAdV para niños del género masculino, pero el valor no llegó a ser estadísticamente significativo47.
Los resultados de la distribución por edad del estudio pre-vacunación demostraron que el grupo de edad más acometido por HAdV fue el comprendido entre 18 y 24 meses, con un 11,5%. El resultado se obtuvo en un estudio realizado en el estado de Maranhão, el cual demostró que la franja de edad más acometida para HAdV fue la de 12 a 18 meses, con un 14,3%48. Otro estudio, conducido en Goiânia, estado de Goiás, mostró que el grupo de edad de mayor prevalencia para HAdV estaba entre 1 y 3 años, a diferencia de los RV, en los que la mayor frecuencia fue en el rango entre 1 y 11 meses de edad49. Sin embargo, entre los niños participantes en el estudio post-vacunación, no hubo diferencia estadísticamente significativa en lo que concierne a la positividad para HAdV por grupo de edad. Este dato corrobora un estudio realizado en Botsuana, el cual tampoco mostró diferencia entre las edades de los niños con muestras positivas para HAdV50.
El análisis en cuanto a la distribución temporal de positividad de los HAdV mostró que, en el estudio pre-vacunación, el mes de marzo presentó un mayor porcentaje, con el 8,7%. Cabe señalar, sin embargo, la limitación para evaluar ese parámetro, una vez que este estudio de vigilancia hospitalaria y ambulatoria ocurrió en el período de marzo a septiembre de 2003, no abarcando los 12 meses del año. Sin embargo, la selección de las 400 muestras provenientes del estudio "Rotavirus Caso-Control" año I abarcó la cobertura diaria a lo largo de los 12 meses, haciendo más fidedigna la evaluación del parámetro en análisis. Los resultados de esta variable (distribución mensual), en el estudio post-vacunación, fueron divergentes en relación a los datos presentados por la pre-vacunación, pues mostraron que el período de mayor prevalencia fue el mes de junio de 2008, con el 21,0% de los casos positivos. Esta diferencia de positividad observada a lo largo de los meses, en ambos estudios, no fue estadísticamente significativa.
El estado de Pará no presenta diferencia entre las cuatro estaciones climáticas (verano, otoño, invierno y primavera), según se observa en otras partes de Brasil. Por lo tanto, la división estacional en esta área sigue los criterios relativos a los índices de precipitación pluviométrica, con períodos de más o menos lluvias, además de variación de la temperatura, con épocas de más o menos calor. En la evaluación del perfil estacional de distribución de HAdV, se observó que su prevalencia, en la ciudad de Belém, no sufre alteraciones significativas en cuanto a las variables temperatura y precipitación pluviométrica observadas en la región.
Los datos presentados anteriormente están de acuerdo con los resultados obtenidos por otros estudios, los cuales no mostraron estacionalidad para ese virus, como ya relatado en investigaciones conducidas en países de clima templado, donde se configuró un carácter endémico de esa patología51,52,53. También se observó similitud de los datos locales con los de otros estudios realizados en Río de Janeiro y Bahía, donde no hubo variación estacional significativa34,35. Los resultados obtenidos en Botsuana respecto a la prevalencia de HADV en niños de corta edad tampoco mostraron diferencia estadísticamente significativa entre la positividad de HAdV a lo largo de los meses del año50.
CONCLUSIÓN
No hubo diferencia estadísticamente significativa de positividad para HADV en relación a las distribuciones temporales, estacionales y entre el género de los niños participantes de ambos estudios. A pesar del significativo aumento de la prevalencia de HAdV después de la implantación de la vacuna contra RV, no hubo diferencia en la epidemiología molecular de las muestras circulantes en los períodos pre y post-vacunación contra RV.
Los resultados positivos en relación a la presencia de HAdV en Belém, infectando a niños y causando gastroenteritis con y sin hospitalización, reflejan la ocurrencia de otros agentes virales, además de RV. Este hecho resalta la necesidad de una continua vigilancia, a largo plazo, que evaluará el impacto de la implementación de la vacuna contra RV, la etiología de las gastroenteritis virales y contribuirá a la elaboración de medidas higiénicas y sanitarias preventivas, con vista a la disminución de los cuadros de diarrea aguda infantil.
Los hallazgos de este análisis servirán de apoyo a estudios posteriores, principalmente los relacionados a la implantación de vacunas contra RV y a las posibles modificaciones epidemiológicas generadas por el uso a gran escala de las vacunas.
REFERENCIAS
1 Black RE, Cousens S, Johnson HL, Lawn JE, Rudan I, Bassani DG, et al. Global, regional, and national causes of child mortality in 2008: a systematic analysis. Lancet. 2010 Jun;375(9730):1969-87. Doi: 10.1016/S0140-6736(10)60549-1 [Link] [ Links ]
2 Bern C, Glass RI. Impact of diarrhoeal disease worldwide. In: Kapikian AZ, editor. Viral infection of gastrointestinal tract. New York: Marcel Dekker; 1994. 26 p. [ Links ]
3 Kapikian AZ, Chanock RM. Rotaviruses. In: Knipe DM, Howley PM, Chanock RM, Melnick JL, Monath TP, Roizman B, et al. Fields virology. 3rd ed. Vol. 2. Philadelphia: Lippincott-Raven; 2007. p. 1657-708. [ Links ]
4 Mendes PSA, Ribeiro Jr HCR, Mendes CMC. Temporal trends of overall mortality and hospital morbidity due to diarrheal disease in Brazilian children younger than 5 years from 2000 to 2010. J Pediatr. 2013 May-Jun;89(3):315-25. Doi: 10.1016/j.jped.2012.10.002 [Link] [ Links ]
5 Bühler HF, Ignotti E, Neves SMAS, Hacon SS. Análise espacial de indicadores integrados determinantes da mortalidade por diarreia aguda em crianças menores de 1 ano em regiões geográficas. Cienc Saude Coletiva. 2014 out;19(10):4131-40. Doi: 10.1590/1413-812320141910.09282014 [Link] [ Links ]
6 Toporovski MS, Mimica IM, Chieffi PP, Paschoalotti MA, Dias AMG, Silva CB. Diarréia aguda em crianças menores de 3 anos de idade: recuperação de enteropatógenos nas amostras fecais de pacientes comparada à de grupo controle. J Pediatria. 1999 mar-abr;75(2):97-104. Doi: 10.2223/JPED.265 [Link] [ Links ]
7 Okitsu-Negishi S, Nguyen TA, Phan TG, Ushijima H. Molecular epidemiology of viral gastroenteritis in Asia. Pediatr Int. 2004 Apr;46(2):245-52. Doi: 10.1046/j.1442-200x.2004.01896.x [Link] [ Links ]
8 Wilhelmi I, Roman E, Sanchez-Fauquier A. Viruses causing gastroenteritis. Clin Microbiol Infect. 2003 Apr;9(4):247-62. Doi: 10.1046/j.1469-0691.2003.00560.x [Link] [ Links ]
9 Wold WSM, Ison MG. Adenoviruses. In: Knipe DM, Howley PM, editors. Fields virology. 6th ed. Philadelphia: Lippincott-Williams & Wilkins; 2013. p. 1732-62. [ Links ]
10 Santos NSO, Soares CC. Virologia clínica: viroses entéricas. In: Santos NSO, Romanos MTV, Wigg MD, editores. Virologia humana. 3. ed. Rio de Janeiro: Guanabara Koogan; 2015. p. 209-15. [ Links ]
11 Munoz FM, Piedra PA, Demmler GJ. Disseminated adenoviruses disease immunocompromised and immunocompetent children. Clin Infect Dis. 1998 Nov;27(5);1194-200. [Link] [ Links ]
12 Cooper RJ, Hallett R, Tullo AB, Klapper PE. The epidemiology of adenovirus infections in Greater Manchester, UK 1982-96. Epidemiol Infect. 2000 Oct;125(2):333-45. [Link] [ Links ]
13 Hall K, Zajdel MEB, Blair GE. Unity and diversity in the human adenoviruses: exploiting alternative entry pathways for gene therapy. Biochemical Journal. 2010 Nov;431(3):321-36. Doi: 10.1042/BJ20100766 [Link] [ Links ]
14 Berk AJ. Adenoviridae: classification, virion structure and perspectives. In: Knipe DM, Howley PM, editors. Fields virology. 6th ed. Vol. 2. Philadelphia: Lippincott-Williams & Wilkins ; 2013. p. 1704-28. [ Links ]
15 Linhares AC, Bresee JS. Rotavirus vaccines and vaccination in Latin America. Rev Panam Salud Publica. 2000 Nov;8(5):305-31. Doi: 10.1590/S1020-49892000001000002 [Link] [ Links ]
16 Linhares AC, Villa LL. Vaccines against rotavirus and human papillomavirus (HPV). J Pediatr. 2006 Jul;82(3 Suppl):S25-34. Doi: 10.1590/S0021-75572006000400004 [Link] [ Links ]
17 Mascarenhas JDP, Linhares AC. Rotavirus gastroenteritis and the urgent need for a vaccine in developing countries. Postgrad Doct Caribb. 2005;21(5):152-61. [ Links ]
18 Carvalho-Costa FA, Araújo IT, Assis RMS, Fialho AM, Martins CMMA, Bóia MN, et al. Rotavirus genotype distribution after vaccine introdution, Rio de Janeiro, Brazil. Emerging Infect Dis. 2009 Jan;15(1):95-7. Doi: 10.3201/eid1501.071136 [Link] [ Links ]
19 Ayres M, Ayres Junior M, Ayres DL, Santos AAS. BioEstat 5.0: aplicações estatísticas nas áreas das ciências biológicas e médicas. 5. ed. Belém: Sociedade Civil Mamirauá; 2007. [Link] [ Links ]
20 Cepko CL, Whetstone CA, Sharp PA. Adenovirus hexon monoclonal antibody that is group specific and potentially useful as a diagnostic reagent. J Clin Microbiol. 1983 Feb;17(2):360-4. [Link] [ Links ]
21 Pring-Åkerblom P, Trijssenaar FEJ, Adrian T, Hoyer H. Multiplex polymerase chain reaction for subgenus-specific detection of human adenoviruses in clinical samples. J Med Virol. 1999 May;58(1):87-92. Doi: 10.1002/(SICI)1096-9071(199905)58:1<87::AID-JMV14>3.0.CO;2-R [Link] [ Links ]
22 Allard A, Albinsson B, Wadell G. Rapid typing of human adenoviruses by a general PCR combined with restriction endonuclease analysis. J Clin Microbiol. 2001 Feb;39(2):498-505. Doi: 10.1128/JCM.39.2.498-505.2001 [Link] [ Links ]
23 Sdiri-Loulizi K, Gharbi-Khelifi H, Rougemont A, Hassine M, Chouchane S, Sakly N, et al. Molecular epidemiology of human astrovirus and adenovirus serotypes 40/41 strains related to acute diarrhea in Tunisian children. J Med Virol. 2009 Nov;81(11):1895-902. Doi: 10.1002/jmv.21586 [Link] [ Links ]
24 Gabbay YB, Mascarenhas JDP, Linhares AC, Freitas RB, Glass R. Freqüência de adenovírus em episódios diarréicos infantis na área de Belém: uma avaliação prospectiva. In: Resumos do Virológica 93: Encontro Regional de Virologia Abrangência Cone Sul; 1993 set 27- out 01; Porto Alegre, RS. [Brasília]: Sociedade Brasileira de Virologia; 1993. 318 p. [ Links ]
25 Gabbay YB, Gusmão RHP, Mascarenhas JDP, Monteiro TAF, Linhares AC. Adenovirus types 40/41 in hospitalized children, Belém, Brazil. In: Resumos do 8° Encontro Nacional de Virologia; 1996 nov 24-27; São Lourenço, MG. [Brasília]: Sociedade Brasileira de Virologia ; 1996. [ Links ]
26 Soares CC, Volotão EM, Albuquerque MCM, Silva FM, Carvalho TRB, Nozawa CM, et al. Prevalence of enteric adenoviruses among children with diarrhea in four Brazilian cities. J Clin Virol. 2002 Jan;23(3):171-7. Doi: 10.1016/S1386-6532(01)00220-7 [Link] [ Links ]
27 Giordano MO, Ferreyra LJ, Isa MB, Martinez LC, Yudowsky SI, Nates SV. The epidemiology of acute viral gastroenteritis in hospitalized children in Cordoba city, Argentina: an insight of disease burden. Rev Inst Med Trop Sao Paulo. 2001 Jul-Aug;43(4):193-7. Doi: 10.1590/S0036-46652001000400003 [Link] [ Links ]
28 Bereciartu A, Bok K, Gómez J. Identification of viral agents causing gastroenteritis among children in Buenos Aires, Argentina. J Clin Virol. 2002 Aug;25(2):197-203. Doi: 10.1016/S1386-6532(02)00010-0 [Link] [ Links ]
29 Lorrot M, Bon F, El Hajje MJ, Aho S, Wolfer M, Giraudon H, et al. Epidemiology and clinical features of gastroenteritis in hospitalised children: prospective survey during a 2-year period in a Parisian hospital, France. Eur J Clin Microbiol Infect Dis. 2011 Mar;30(3):361-8. Doi: 10.1007/s10096-010-1094-9 [Link] [ Links ]
30 He Y, Yang H. Typing of enteric adenoviruses in feces of infants with diarrhea. Zhonghua Shi Yan He Lin Chuang Bing Du Xue Za Zhi. 2000 Sep;14(3):278-80. [ Links ]
31 Saderi H, Roustai MH, Sabahi F, Sadeghizadeh M, Owlia P, De Jong JC. Incidence of enteric adenovirus gastroenteritis in Iranian children. J Clin Virol. 2002 Feb;24(1-2):1-5. Doi: 10.1016/S1386-6532(01)00206-2 [Link] [ Links ]
32 Oh DY, Gaedicke G, Schreier E. Viral agents of acute gastroenteritis in German children: prevalence molecular diversity. J Med Virol. 2003 Sep;71(1):82-93. Doi: 10.1002/jmv.10449 [Link] [ Links ]
33 Fodha I, Chouikha A, Peenze I, De Beer M, Dewar J, Geyer A, et al. Identification of viral agents causing diarrhea among children in the Eastern Center of Tunisia. J Med Virol. 2006 Sep;78(9):1198-203. Doi: 10.1002/jmv.20681 [Link] [ Links ]
34 Pereira Filho E, Assis RMS, Rocha M. Molecular characterization of human adenovirus associated with cases of infant gastroenteritis. In: 15º Encontro Nacional de Virologia; 2004 Sep 26-29; São Pedro, SP. [Brasília]: Sociedade Brasileira de Virologia ; 2004. 67 p. (Virus Reviews & Research; vol. 9; Suppl. 1). [ Links ]
35 Pereira Filho E, Faria NRC, Fialho AM, Assis RS, Almeida MMS, Rocha M, et al. Adenoviruses associated with acute gastroenteritis in hospitalized and community children up to 5 years old in Rio de Janeiro and Salvador, Brazil. J Med Microbiol. 2007 Mar;56(Pt 3):313-9. Doi: 10.1099/jmm.0.46685-0 [Link] [ Links ]
36 Huh JW, Kim WH, Moon SG, Lee JB, Lim YH. Viral etiology and incidence associated with acute gastroenteritis in a 5-year survey in Gyeonggi province, South Korea. J Clin Virol. 2009 Feb;44(2):152-6. Doi: 10.1016/j.jcv.2008.11.016 [Link] [ Links ]
37 Li L, Shimizu H, Doan LTP, Tung PG, Okitsu S, Nishio O, et al. Characterizations of adenovirus type 41 isolates from children with acute gastroenteritis in Japan, Vietnam, and Korea. J Clin Microbiol. 2004 Sep;42(9):4032-9. Doi: 10.1128/JCM.42.9.4032-4039.2004 [Link] [ Links ]
38 Li L, Phan TG, Nguyen TA, Kim KS, Seo JK, Shimizu H, et al. Molecular epidemiology of adenovirus infection among pediatric population with diarrhea in Asia. Microbiol Immunol. 2005 Feb;49(2):121-8. Doi: 10.1111/j.1348-0421.2005.tb03711.x [Link] [ Links ]
39 Logan C, O’Leary JJ, O'Sullivan N. Real-time reverse transcription-PCR for detection of rotavirus and adenovirus as causative agents of acute viral gastroenteritis in children. J Clin Microbiol. 2006 Sep;44(9):3189-95. Doi: 10.1128/JCM.00915-06 [Link] [ Links ]
40 Nguyen TA, Yagyu F, Okame M, Phan TG, Trinh QD, Yan H, et al. Diversity of viruses associated with acute gastroenteritis in children hospitalized with diarrhea in Ho Chi Minh City, Vietnam. J Med Virol. 2007 May;79(5):582-90. Doi: 10.1002/jmv.20857 [Link] [ Links ]
41 Grimwood K, Carzino R, Barnes GL, Bishop RF. Patients with enteric adenovirus gastroenteritis admitted to an Australian pediatric teaching hospital from 1981 to 1992. J Clin Microbiol. 1995 Jan;33(1):131-6. [Link] [ Links ]
42 De Jong JC, Kapsenberg JG, Muzerie CJ, Wermenbol AG, Kidd AH, Wadell G, et al. Candidate adenoviruses 40 and 41: fastidious adenoviruses from human infant stool. J Med Virol. 1983;11(3):215-31. Doi: 10.1002/jmv.1890110305 [Link] [ Links ]
43 Kamel AH, Ali MA, El-Nady HG, Rougemont A, Pothier P, Belliot G. Predominance and circulation of enteric viruses in the region of Greater Cairo, Egypt. J Clin Microbiol. 2009 Apr;47(4):1037-45. Doi: 10.1128/JCM.01381-08 [Link] [ Links ]
44 Silva PA, Stark K, Mockenhaupt FP, Reither K, Weitzel T, Ignatius R, et al. Molecular characterization of enteric viral agents from children in northern region of Ghana. J Med Virol. 2008 Oct;80(10):1790-8. Doi: 10.1002/jmv.21231 [Link] [ Links ]
45 Thörner PA, Ahrel-Andersson M, Hierholzer JC, Johansson ME. Characterization of two divergent adenovirus 31 strains. Arch Virol. 1993 Sep;133(3):397-405. Doi: 10.1007/BF01313778 [Link] [ Links ]
46 Magalhães GF, Nogueira PA, Grava AF, Penati M, Silva LHP, Orlandi PP. Rotavirus and adenovirus in Rondônia. Mem Inst Oswaldo Cruz. 2007 Aug;102(5):555-7. Doi: 10.1590/S0074-02762007005000067 [Link] [ Links ]
47 Özdemir S, Delialioğlu N, Emekdaş G. [Investigation of rotavirus, adenovirus and astrovirus frequencies in children with acute gastroenteritis and evaluation of epidemiological features]. Mikrobiyol Bul. 2010 Oct;44(4):571-8. [Link] [ Links ]
48 Ferreira LM, Costa IV. Pesquisa de adenovírus entéricos e astrovírus em espécimes fecais de crianças diarréicas provenientes de São Luís, Maranhão, 2004 [monografia]. Belém (PA): Universidade Federal do Pará, Faculdade de Ciências Farmacêuticas; 2004. 26f. [ Links ]
49 Cardoso DDP, Martins RMB, Kitajima EW, Barbosa AJ, Camarota SCT, Azevedo MSP. Rotavirus e adenovirus em crianças de 0-5 anos hospitalizadas com ou sem gastroenterite em Goiânia - GO, Brasil. Rev Inst Med Trop S Paulo. 2002 set-out;34(5):433-9. Doi: 10.1590/S0036-46651992000500010 [Link] [ Links ]
50 Basu G, Rossouw J, Sebunya TK, Gashe BA, De Beer M, Dewar JB, et al. Prevalence of rotavirus, adenovirus and astrovirus infection in young children with gastroenteritis in Gaborone, Botswana. East Afr Med J. 2003 Dec;80(12):652-5. Doi: 10.4314/eamj.v80i12.8783 [Link] [ Links ]
51 Uhnoo I, Wadell G, Svensson L, Johansson ME. Importance of enteric adenoviruses 40 and 41 in acute gastroenteritis in infants and young children. J Clin Microbiol. 1984 Sep;20(3):365-72. [Link] [ Links ]
52 Brandt CD, Kim HW, Rodriguez WJ, Arrobio JO, Jeffries BC, Stallings EP, et al. Adenoviruses and pediatric gastroenteritis. J Infect Dis. 1985 Mar;151(3):437-43. Doi: 10.1093/infdis/151.3.437 [Link] [ Links ]
53 Bates PR, Bailey AS, Wood DJ, Morris DJ, Couriel JM. Comparative epidemiology of rotavirus, subgenus F (types 40 and 41) adenovirus, and astrovirus gastroenteritis in children. J Med Virol. 1993 Mar;39(3):224-8. Doi: 10.1002/jmv.1890390309 [Link] [ Links ]
Se refiere al doi: 10.5123/S2176-62232017000400010, publicado originalmente en portugués. Traducido por: Lota Moncada
Cómo citar este artículo / How to cite this article: Müller ECA, Soares LS, Oliveira DS, Linhares AC, Sousa MS. Prevalência e diversidade molecular de adenovírus em crianças com gastroenterite aguda grave, em Belém, estado do Pará, antes e após a introdução da vacina contra rotavírus no Brasil. Rev Pan-Amaz Saude. 2017 oct-dic;8(4):1-11. Doi: http://dx.doi.org/10.5123/S2176-62232017000400010
Recibido: 05 de Septiembre de 2016; Aprobado: 10 de Diciembre de 2016











 texto em
texto em 


