INTRODUÇÃO
O uso de plantas para fins medicinais é adotado pela população para o tratamento de diversas enfermidades1, sendo conhecido por ser uma prática milenar construída a partir de sabedoria popular, cultura e costumes. Por acreditar que as plantas medicinais possuem origem natural e, por isso, seriam menos tóxicas que drogas de origem sintética, são comumente consumidas pela população nas formas de garrafadas (preparações constituídas da combinação de plantas medicinais e outros complementos), chás e outros2,3,4,5.
São inúmeras as plantas utilizadas com finalidade terapêutica; no entanto, a maioria das espécies não foi totalmente estudada, principalmente no que diz respeito aos seus compostos com efeitos citotóxicos, mutagênicos ou genotóxicos, os quais podem gerar danos à saúde humana6. Uma planta muito utilizada pela população como medicamento natural é a Synadenium grantii Hook. f., conhecida popularmente pelos nomes de janaúba, cancerosa, leitosinha, cola-nota, dentre outros, variando conforme a região em que se encontra7.
O gênero Synadenium pertence à família Euphorbiaceae e possui 19 espécies identificadas, incluindo a S. grantii que é uma planta de origem africana e americana. No Brasil, a espécie é encontrada principalmente na Região Amazônica e no estado do Mato Grosso, apresentando-se na forma de arbusto, podendo atingir até 5 m de altura8. É cultivada pela população para uso como ornamento e também como medicamento em diversos países. Foram isolados diversos metabólitos secundários, como ésteres de forbol, tripertenos, dipertenos, antocianinas, lecitinas e até algumas serino-proteases9. O látex dessa planta tem como característica uma alta toxidade, podendo causar lesões dérmicas e oftálmicas em pessoas e animais que entrarem em contato com a mesma5. O látex é empiricamente recomendado para tratar inflamações, gastrite, úlcera péptica, doenças neoplásicas e outras patologias. A administração ocorre em forma de garrafada, obtida pela diluição de 18 gotas do látex em 1 L de água pura e fresca, ingerida em pequenas doses três vezes ao dia9.
Para garantir a segurança dos fitoterápicos como medicamentos populares, podem ser utilizados biomarcadores que demonstrem o acometimento de danos durante o ciclo celular, devido à presença de substâncias nocivas. O teste de Allium cepa é muito utilizado para realizar esse monitoramento10,11, que consiste em usar a cebola comum (Allium cepa L.) para avaliar alterações cromossômicas durante o ciclo celular nas células meristemáticas e também a presença de micronúcleos, uma vez que as raízes ficam em contato direto com a substância testada, permitindo a avaliação de diferentes concentrações da mesma. É um teste eficaz, devido a sua elevada sensibilidade, rapidez, baixo custo, facilidade de manipulação e boa correlação com células de mamíferos12,13,14,15. Esse sistema permite também
avaliar o potencial citotóxico pelas alterações do índice mitótico e anomalias morfológicas nas células analisadas16.
Dessa forma, o presente estudo objetivou avaliar o potencial citotóxico e mutagênico/genotóxico do látex da planta Synadenium grantii, em diferentes concentrações, utilizando o teste de Allium cepa.
MATERIAIS E MÉTODOS
COLETA DA AMOSTRA
O látex da planta S. grantii foi obtido na chácara Santa Lurdes, situada na linha 126, no município de Presidente Médici, estado de Rondônia, Brasil, entre o paralelo 11°0'35.32" de latitude sul e o meridiano 61°46'52.24" de longitude oeste. A coleta ocorreu no mês de agosto de 2015 e foi realizada utilizando materiais devidamente esterilizados. O tronco do arbusto foi higienizado com álcool 70% e, em seguida, foram feitas incisões com bisturi, a fim de se obter o látex. Logo após, a amostra foi acondicionada em caixa isotérmica, com temperatura aproximada de 4 °C, e encaminhada para o Laboratório de Biologia Molecular do Centro Universitário Luterano de Ji-Paraná (CEULJI/ULBRA) no município de Ji-Paraná, Rondônia.
O material foi submetido aos processos de herborização e, posteriormente, identificado com o auxílio de literatura específica. O espécime S. grantii foi incorporado ao acervo do Herbário Antônio Dalla Martha do CEULJI/ULBRA sob o nº 253.
TESTE EM RAÍZES DE A. CEPA
Para a realização deste estudo, foram obtidas cebolas (A. cepa) de tamanho pequeno, não germinadas e de aspecto sadio, provenientes de uma fonte comercial na cidade de Presidente Médici, em Rondônia, e colocadas por 2 h em água potável para a retirada dos resíduos tóxicos16.
As diferentes concentrações foram preparadas, a partir da concentração de 0,8%, em diluições seriadas em razão de 2 com água destilada, obtendo-se assim, como concentrações testes, 0,8, 0,4, 0,2, 0,1, 0,05 e 0,025%. Como controle positivo, foi utilizado o sulfato de cobre na concentração de 0,0006 mg/L e, como controle negativo, a água destilada. Foram empregadas 10 unidades de A. cepa para cada concentração e controles positivo e negativo8. Posteriormente, os bulbos de cada unidade foram imersos nas diferentes concentrações do látex e nos controles positivo e negativo, em potes coletores estéreis, por 72 h à temperatura de 25 ºC. Após essa etapa, as raízes foram cortadas com o auxílio de bisturi, medidas com régua milimetrada e colocadas em tubo Eppendorf de 1,5 mL com solução de Carnoy 3:1 (álcool etílico: ácido acético glacial) para fixação do material. Após 24 h na solução, as raízes foram lavadas três vezes com 1 mL de água destilada estéril, hidrolisadas com HCl 1N por 10 min em banho-maria a 60 ºC e resfriadas em água corrente. Em seguida, as radículas foram novamente lavadas três vezes com água destilada estéril.
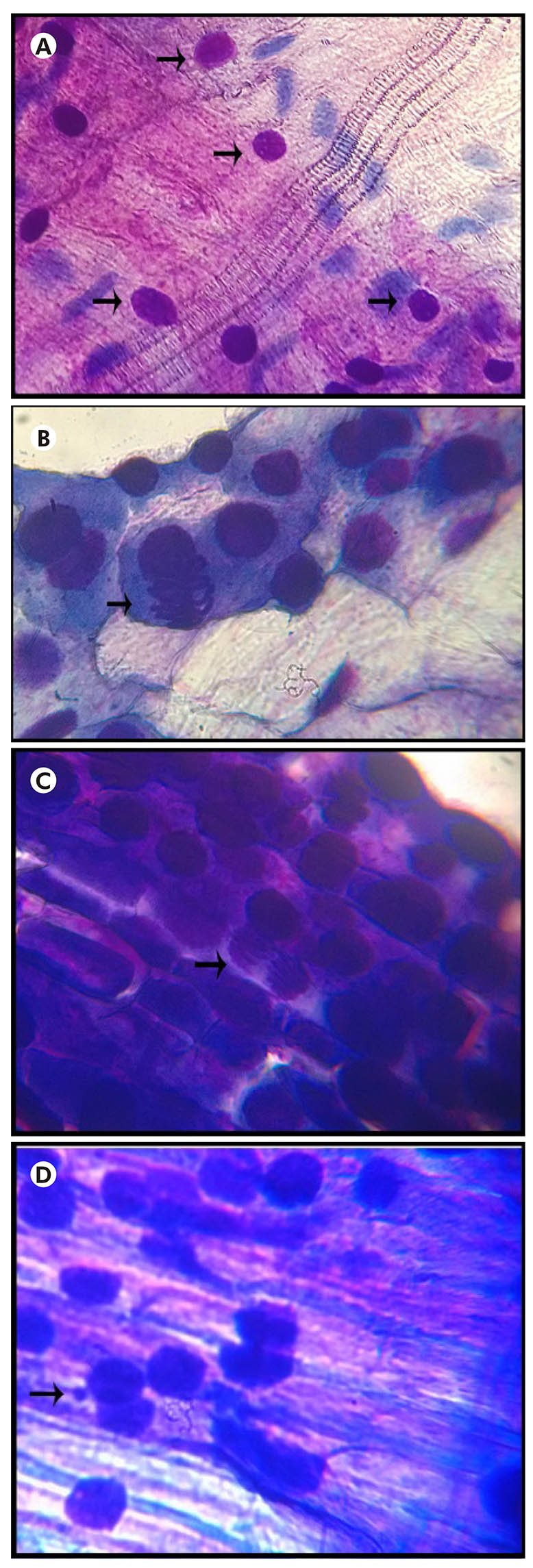
As lâminas foram confeccionadas em duplicata, pela técnica de esmagamento descrita por Guerra e Souza17, para visualização das células meristemáticas, e coradas com Kit Panótico Rápido (Laborclin, Pinhais, Paraná, Brasil), composto por triarilmetano a 0,1%, xantenos a 0,1% e tiazinas a 0,1%. As lâminas foram analisadas por microscopia óptica nos aumentos de 400 X e 1000 X com óleo de imersão. Foram contabilizadas 2.000 células para cada exemplar, totalizando 20.000 células por concentração, observando-se as diferentes fases da mitose para se obter o índice mitótico (IM), utilizando a seguinte fórmula: IM = (número de células em mitose/total de células) x 100, em cada grupo de tratamento18.
Os dados obtidos dos tamanhos das raízes e do índice mitótico foram tabulados em planilhas do programa Microsoft Excel; e as avaliações estatísticas foram realizadas no programa Graphpad Prism® v5.01 com análise de variância ANOVA, seguida do teste de Tukey com nível de significância de p < 0,05.
RESULTADOS
A tabela 1 demonstra o resultado da média do índice mitótico e o tamanho radicular dos meristemas de A. cepa quando submetidas às diferentes concentrações do látex da planta. Os resultados dos tamanhos das raízes mostraram que o grupo controle negativo com água destilada apresentou um valor de 1,98 cm, enquanto o grupo controle positivo com sulfato de cobre apresentou 0,34 cm. Os comprimentos das raízes variaram entre 1,46 cm e 2,33 cm nas concentrações de 0,8% e 0,025%, respectivamente, não obtendo diferença significativa quando comparados ao controle negativo. Porém, em relação ao índice mitótico, os valores variaram entre 14,89% e 38,75% para as concentrações de 0,8% e 0,025%, respectivamente; enquanto que, para os grupos controles positivo e negativo, os valores foram de 3,07% e 42,00%, respectivamente.
Tabela 1 - Análise da citotoxicidade de raízes de A. cepa expostas às diferentes concentrações do látex de S. grantti (médias ± desvio padrão
| Concentrações | Índice mitótico (%) | Tamanho das raízes (cm) |
|---|---|---|
| 0,8% | 14,89 ± 7,13* | 1,46 ± 0,69* |
| 0,4% | 19,04 ± 2,04* | 1,77 ± 0,50* |
| 0,2% | 28,17 ± 1,81* | 1,85 ± 0,60* |
| 0,1% | 28,13 ± 3,66* | 2,19 ± 0,95* |
| 0,05% | 28,64 ± 3,83* | 2,38 ± 0,64* |
| 0,025% | 38,75 ± 5,14* | 2,33 ± 0,81* |
| Controle negativo | 42,00 ± 3,85* | 1,98 ± 0,84* |
| Controle positivo | 03,07 ± 0,62* | 0,34 ± 0,25* |
* p < 0,0001 (ANOVA - teste de Tukey), em relação ao controle negativo.
Na tabela 2, estão apresentadas as médias do número total de células analisadas (16.000 células por tratamento) em intérfase e em diferentes fases do ciclo celular de A. cepa (prófase, metáfase, anáfase e telófase). Em relação às médias das diferentes etapas da fase mitótica, foi possível observar que as raízes expostas ao látex da planta e os controles positivo e negativo, apresentaram um aumento na fase de prófase significativamente maior do que as demais fases.
Tabela 2 - Média dos números de células em mitose, conforme as diferentes concentrações do látex de S. grantti sobre o sistema teste de Allium cepa
| Concentrações | Interfase | Fase mitótica | |||
|---|---|---|---|---|---|
| Prófase | Metáfase | Anáfase | Telófase | ||
| 0,8% | 851,10 | 148,83 | - | 0,07 | - |
| 0,4% | 809,60 | 190,33 | - | 0,07 | - |
| 0,2% | 718,29 | 281,71 | - | - | - |
| 0,1% | 718,70 | 280,88 | 0,21 | 0,21 | - |
| 0,05% | 713,51 | 285,95 | - | 0,54 | - |
| 0,025% | 612,60 | 387,30 | - | 0,10 | - |
| Controle negativo | 580,00 | 420,00 | - | - | - |
| Controle positivo | 969,29 | 030,71 | - | - | - |
Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
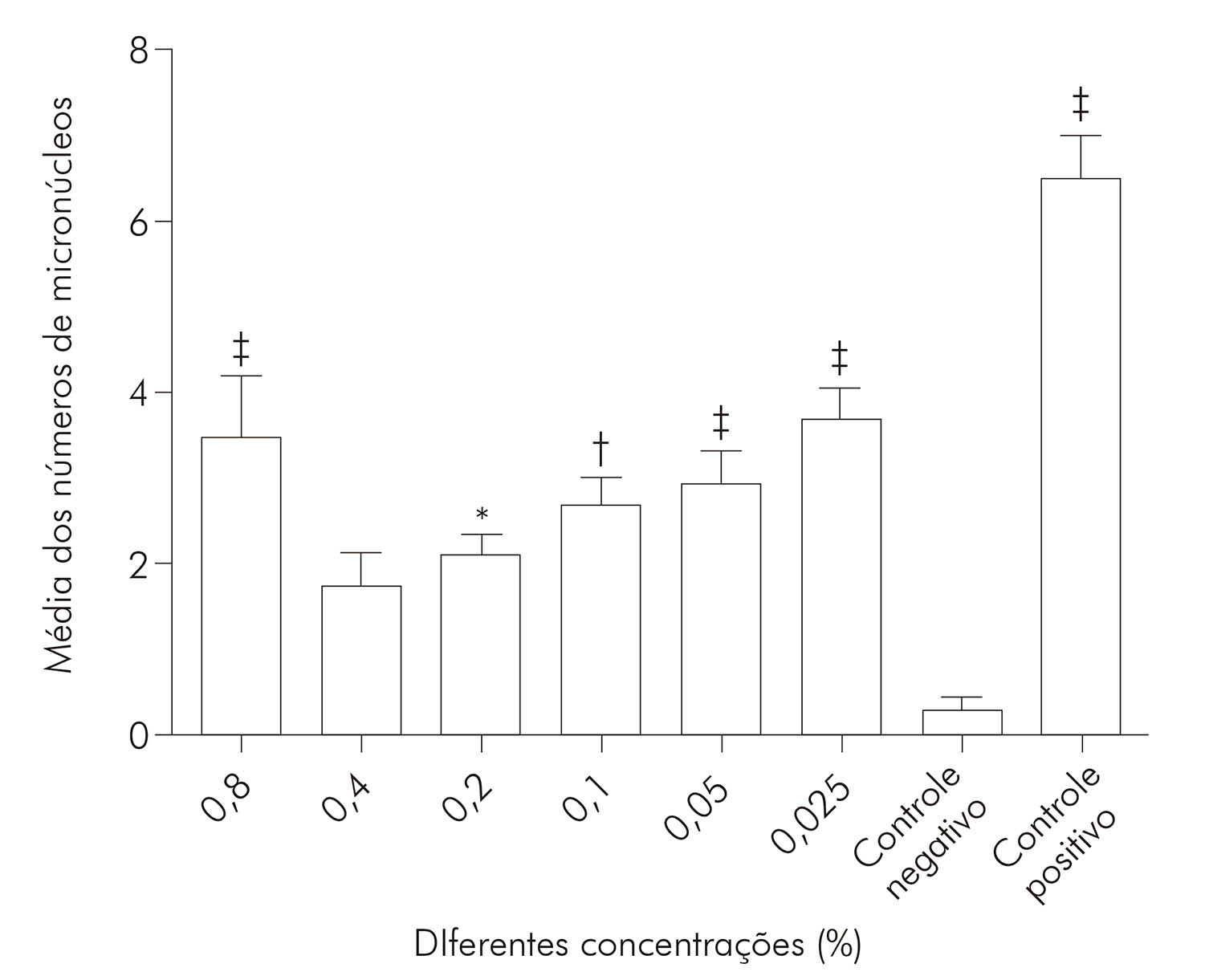
A avaliação da mutagenicidade, obtida pelas frequências de micronúcleos em raízes expostas às diferentes concentrações do látex de S. grantii, está apresentada na tabela 3 e na figura 1, onde foram apontadas as médias das frequências de micronúcleos para as diferentes concentrações. Os dados revelaram que houve diferença altamente significativa quando submetidas às concentrações de 0,8%, 0,1%, 0,05% e 0,025% do látex da planta, quando comparado ao controle negativo, enquanto a concentração de 0,4% não demonstrou diferença significativa. A figura 2 mostra as diferentes fases da divisão celular e micronúcleos encontrados nas células de A. cepa tratadas com a concentração de 0,1% do látex da planta.
Tabela 3 - Médias e desvios padrão da frequência de micronúcleos para as diferentes concentrações do látex de S. grantti sobre o sistema teste de Allium cepa
| Concentrações | Micronúcleos |
|---|---|
| 0,8% | 3,50 ± 2,00‡ |
| 0,4% | 1,75 ± 1,10‡ |
| 0,2% | 2,06 ± 0,78* |
| 0,1% | 2,67 ± 1,00† |
| 0,05% | 2,91 ± 1,23‡ |
| 0,025% | 3,67 ± 1,03‡ |
| Controle negativo | 0,28 ± 0,44‡ |
| Controle positivo | 6,50 ± 0,71‡ |
* p < 0,05 (ANOVA - teste de Tukey), em relação ao controle negativo;
† p < 0,001 (ANOVA - teste de Tukey), em relação ao controle negativo;
‡ p < 0,0001 (ANOVA - teste de Tukey), em relação ao controle negativo.
* p < 0,05 (ANOVA - teste de Tukey), em relação ao controle negativo; † p < 0,001 (ANOVA - teste de Tukey), em relação ao controle negativo; ‡ p < 0,0001 (ANOVA - teste de Tukey), em relação ao controle negativo.
Figura 1 - Total de micronúcleos formados (%) nas células analisadas em função das concentrações aplicadas sobre o sistema teste de Allium cepa
DISCUSSÃO
Os dados demonstrados na tabela 1 expressam a ocorrência de uma redução significativa do índice mitótico, conforme a diminuição da concentração do látex da S. grantii, apresentando diferença altamente significativa em relação ao controle negativo (p < 0,0001). Essa redução no índice mitótico, segundo Lucio Neto16, é resultado de ações químicas que podem inibir a síntese de DNA, reduzindo o processo de mitose. O índice mitótico é fundamental para a avaliação da toxicidade celular de muitas substâncias, as quais permitem que haja um aumento ou diminuição desse índice, devido à citotoxicidade presente em algum composto químico.
É possível observar que não houve diferença significativa no tamanho das raízes quando comparadas as diferentes concentrações com o controle negativo. No entanto, houve uma estabilidade do índice mitótico, visto que as células estacionaram na fase de prófase com severa depressão dos valores de metáfase, anáfase e telófase. O processo de divisão celular pode ser alterado conforme a produção de alguns compostos, devido aos efeitos alelopáticos, que não agem sobre a germinação, mas sobre a velocidade de germinação. Esse efeito pode inibir ou estimular o processo germinativo e de divisão celular, assim como interferir no processo germinativo de outras plantas19.
O resultado presente na tabela 2 assemelha-se ao encontrado no estudo realizado por Conceição20 sobre a divisão celular de células meristemáticas no sistema teste de Allium cepa frente às concentrações da erva mate, em que foi possível observar que as células apresentaram inibição significativa dos índices de metáfase, anáfase e telófase, exceto o de prófase. Os resultados do presente estudo demonstraram um efeito antiproliferativo citotóxico ao observar uma inibição da divisão celular, porém com algum efeito tóxico no fuso mitótico, devido ao tamanho das raízes não estar compatível com o índice mitótico. Efeitos altamente tóxicos promovem atraso do ciclo celular ou, ainda, morte celular, caso as lesões no DNA não sejam reparadas. O prolongamento da prófase pode ter sido resultado de toxicidade nas fibras do fuso mitótico21.
O presente estudo mostrou que a concentração de 0,4% foi a que apresentou menor frequência de micronúcleos, quando comparada às demais concentrações, e apresentou efeito citotóxico, o que pode levar posteriormente à formação de tecidos tumorais.
Não foi possível observar uma concentração segura e eficaz para a população que faz uso dessa planta. Os medicamentos devem ser aplicados dentro da zona terapêutica ideal, ou seja, na metade da sua
faixa terapêutica, que compreende a concentração mínima eficaz e a máxima resposta ao medicamento; portanto, qualquer concentração acima da faixa terapêutica pode ocasionar toxicidade22.
O látex da planta S. grantii possui em sua constituição ésteres de forbol e glicosídeos cianogênicos, que são compostos potencialmente tóxicos a um grande número de organismos vivos, demonstrando riscos na administração dessa planta. Os ésteres de forbol são substâncias tóxicas que induzem a formação de tumores. Os glicosídeos cianogênicos são substâncias presentes em vários alimentos, mas, quando ingeridas em grande quantidade, são capazes de provocar dispneia acentuada, taquicardia e até levar à morte5,23.
Há vários estudos relatando que as plantas cianogênicas mais importantes do Brasil pertencem à família Euphorbiaceae, por apresentarem, em sua composição, cianetos tóxicos24 capazes de causar lesões degenerativas no cérebro, perdas de células do tálamo e também bócio25. No bócio, os glicosídeos transformados em substâncias atóxicas no fígado atuam no impedimento da absorção do iodo pela tireoide, levando ao aumento de volume dessa glândula25. De acordo com Bagatini et al.26, estudos citogenéticos de espécies vegetais informam sobre as possíveis alterações cromossômicas, que podem ser decorrentes do próprio metabolismo ou devido à presença de agentes mutagênicos.
CONCLUSÃO
O presente estudo demonstrou o efeito antiproliferativo citotóxico em todas as concentrações analisadas e o efeito mutagênico nas concentrações de 0,8%, 0,2%, 0,1%, 0,05% e 0,025% do látex da planta S. grantii frente a células meristemáticas de A. cepa. Os efeitos do uso de S. grantii como medicamento podem contribuir para o desenvolvimento de patologias graves, representando um risco para seus usuários.











 texto em
texto em