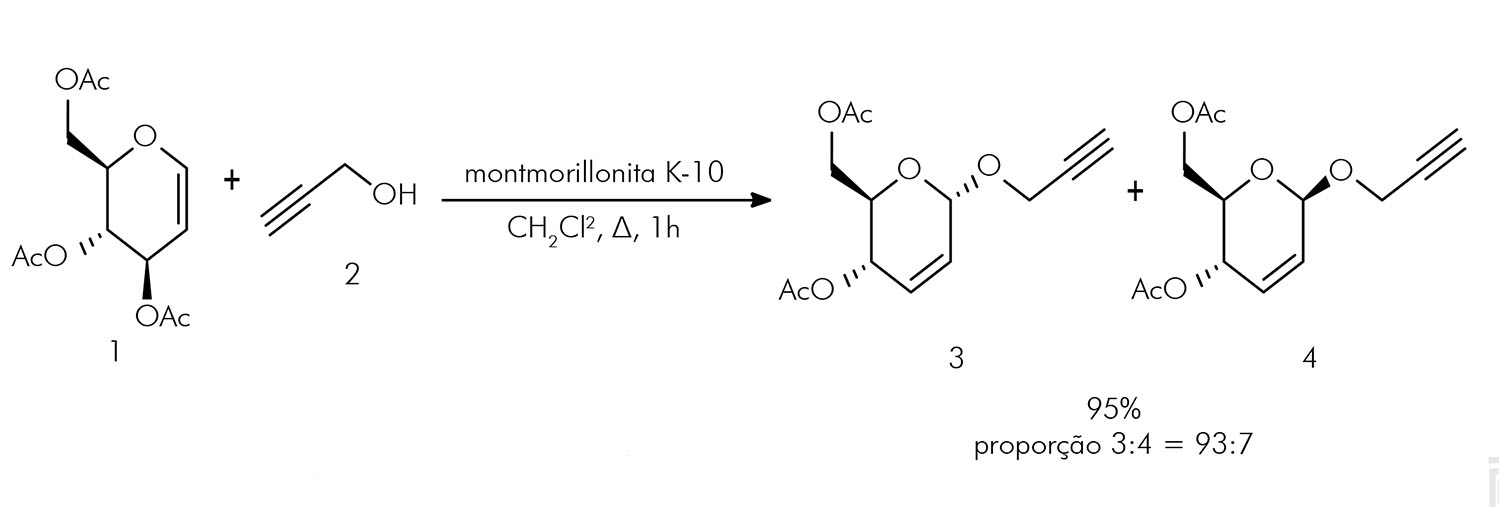
INTRODUÇÃO
O gênero Candida apresenta elevadas taxas de colonização e infecção1. Esses micro-organismos são leveduras cosmopolitas encontradas na microbiota normal do homem e de animais, estando presente em diversos sítios do corpo, como mucosas do trato gastrintestinal, boca, vagina e pele2; entretanto, tornam-se patogênicas em casos de alterações nos mecanismos de defesa do indivíduo1.
As infecções ocasionadas por Candida englobam casos de doenças superficiais e invasivas, sobretudo quando ocorre o acometimento de pacientes expostos a diversos fatores de riscos. Infecções de pele, mucosas, candidíase vaginal e candidemias são regularmente relatadas1. Em pacientes soropositivos, a candidíase orofaríngea é a infecção fúngica mais habitual3.
Durante a evolução da infecção por Candida, a levedura atua expressando diversos fatores de virulência, dentre os quais destacam-se a produção de enzimas extracelulares, a síntese de hemolisinas, a capacidade de adesão e a formação de biofilme4. Tais fatores são definidos geneticamente, entretanto são expressos pelos micro-organismos quando expostos a determinadas condições5. O interesse nesses fatores de virulência justifica-se pela necessidade de se estabelecerem possíveis tratamentos e formas de prevenir a infecção6.
A constante utilização de agentes antifúngicos tem despertado preocupações devido à seleção de cepas resistentes. Estudos têm relatado alta incidência de infecções ocasionadas por leveduras do gênero Candida resistentes aos fármacos de primeira e segunda escolha, como é o caso dos derivados azólicos, que estão entre os mais prescritos para o tratamento de candidíase7,8.
O tratamento de patógenos recorrentes é uma problemática em ascensão nos dias atuais e fundamenta-se em duas alternativas: a descoberta de novos fármacos antimicrobianos e/ou a associação de substâncias já existentes9. A associação de antimicrobianos é uma alternativa em infecções de etiologia polimicrobiana, onde a obtenção da cura pela monoterapia é dificultada10.
A investigação de novas moléculas, com potencial de serem ativas biologicamente, desponta como uma importante alternativa terapêutica, possibilitando explorar novos alvos terapêuticos e propor novas estratégias de agir sobre alvos terapêuticos já determinados11. Uma grande quantidade de moléculas ativas vem sendo obtida pela síntese orgânica12, como é o caso dos glicosídeos13,14,15.
Os glicosídeos são produtos obtidos por meio da reação de glicosilação, constituídos basicamente por duas unidades, a unidade sacarídica e a unidade ligada pelo carbono anomérico, denominada glicona (grupo sacarídico) ou aglicona (grupo não sacarídico).
Os objetivos deste estudo foram sintetizar e avaliar a ação antifúngica do prop-2-in-1-il 4,6-di-O- acetil-2,3-didesoxi-α-D-eritro-hex-2-enopiranosídeo contra espécies não albicans de Candida, assim como avaliar sua atividade antimicrobiana quando associado à anfotericina B ou ao cetoconazol.
MATERIAIS E MÉTODOS
PROCEDIMENTO GERAL: EQUIPAMENTOS E ANÁLISE DOS DADOS
As análises de ressonância magnética nuclear (RMN) foram realizadas em um espectrômetro VARIAN® modelo Unity Plus-300, utilizando como solvente o clorofórmio deuterado (CDCl3). Esse espectrômetro foi calibrado usando tetrametilsilano (0,00 ppm) como referência interna para os núcleos de 1H e 13C, e todas as constantes de acoplamento (J) foram descritas em hertz (Hz). O espectro de infravermelho foi registrado em um espectrofotômetro de infravermelho com transformada de Fourier no Spectrum 400 FT-IR/FT-NIR Spectrometer, modelo PerkinElmer, sendo a amostra preparada como pastilhas de KBr. A rotação específica foi determinada em um polarímetro digital da marca JASCO® P-2000 equipado com a luz de sódio em comprimento de onda 589 nm. A amostra foi preparada em concentração de 1 m/v % (em MeOH) em uma cubeta de 1 mL. O ponto de fusão foi realizado no Electrothermal série IA9100 Digital Melting Point. A chapa de agitação com aquecimento e a manta aquecedora eram da marca Fisatom, modelo 754A e 102E, respectivamente. O solvente foi removido, utilizando um evaporador rotativo da BÜCHI Rotavapor®, modelo R-114, conectado a uma bomba de vácuo modelo KNF Neuberger, e o solvente remanescente foi removido, utilizando uma bomba de alto vácuo da Edwards, modelo RV3. As estruturas dos compostos foram geradas por meio do software ChemBioUltra® v12.0.
PROCEDIMENTO DE SÍNTESE DO prop-2-in-1-il 4,6-di-O-acetil-2,3-didesoxi-α-D-eritro-hex-2-enopiranosídeo (GLICOSÍDEO 3)
O monitoramento das reações foi realizado por cromatografia em camada delgada, utilizando placas de sílica-gel contendo indicador fluorescente F254 da Merck. Para visualização, as placas foram colocadas em solução ácida (EtOH/H2SO4, 95:5) e solução de vanilina. A purificação, por meio da cromatografia líquida em coluna, foi realizada com o uso de sílica-gel 60 (Merck, 70-230 mesh), como fase estacionária, e sistemas hexano:acetato de etila, como fase móvel, numa coluna de vidro em diferentes proporções. Os solventes comerciais foram purificados de acordo com os protocolos descritos na literatura16. O hexano e o acetato de etila foram destilados em coluna de Vigreaux, o diclorometano, sob hidreto de cálcio, e o metanol, sob magnésio metálico e iodo sublimado. Os reagentes tri-O-acetil-D-glucal e o álcool 2-propin-1-ol da Sigma-Aldrich.
A síntese do composto prop-2-in-1-il 4,6-di-O-acetil-2,3-didesoxi-α-D-eritro-hex-2-enopiranosídeo foi realizada segundo o protocolo de Toshima et al.17, com algumas modificações. Desse modo, em um balão de fundo redondo, com capacidade de 50 mL, foram adicionados o tri-O-acetil-D-glucal (1; 0,27 g; 1 mmol), o álcool 2-propin-1-ol (2; 69,7 µL; 67,2 mg; 1,2 mmol) e o diclorometano seco (20 mL). Em seguida, o balão foi resfriado a 0 ºC e mantido sob agitação por 5 min. Após esse intervalo de tempo, foi adicionado montmorillonita K-10 (0,16 g; 60% M/M), e um sistema de refluxo foi acoplado ao balão. A mistura reacional foi mantida sob agitação e aquecimento (50 ± 5 ºC) por 1 h. Logo depois, o aquecimento foi interrompido, e o término da reação, verificado por cromatografia de camada delgada. Dando prosseguimento, a solução contida no balão foi filtrada e o solvente, removido sob pressão reduzida, utilizando evaporador rotativo. O produto bruto foi purificado em coluna cromatográfica, utilizando sílica-gel como fase estacionária e o sistema hexano:acetato de etila (início de 100:0 até 90:10) como fase móvel.
DETERMINAÇÃO DA CONCENTRAÇÃO INIBITÓRIA MÍNIMA
Foram utilizadas quatro cepas fúngicas: Candida tropicalis ATCC-13803, Candida parapsilosis ATCC-20019, Candida krusei LM-13 e Candida guilliermondii LM-703.
A determinação da concentração inibitória mínima (CIM) foi realizada pela técnica da microdiluição em caldo, utilizando como meio o caldo Sabouraud dextrose2,18,19. A concentração inicial do prop-2-in-1-il 4,6-di-O-acetil-2,3-didesoxi-α-D-eritro-hex-2- enopiranosídeo testada foi de 512 μg/mL e diluída seriadamente 1:2 até a concentração final de 0,5 μg/mL. As concentrações iniciais da anfotericina B e do cetoconazol foram de 128 μg/mL e diluídas seriadamente 1:2 até a concentração final de 0,0078 μg/mL. O inóculo foi adicionado em uma concentração final de aproximadamente 1-5 x 105 UFC/mL em cada cavidade. As soluções foram preparadas com o auxílio de DMSO (dimetilsulfóxido). Foram utilizados controles com DMSO nas mesmas concentrações usadas no teste.
Utilizou-se inóculo fúngico, contendo aproximadamente 1-5 x 106 UFC/mL, padronizado de acordo com a turbidez do tubo 0,5 da escala de McFarland. Todos os testes foram realizados em triplicata.
A incubação dos ensaios ocorreu em estufa a aproximadamente 35 °C, durante 48 h. Como CIM, considerou-se a menor concentração da substância testada, capaz de produzir inibição visual do crescimento das cepas de levedura utilizadas nos ensaios microbiólogos20; fato confirmado pela adição de 20 μL de TTC 1% (2,3,5 trifenil cloreto de tetrazólio) em cada cavidade2.
ASSOCIAÇÃO DAS DROGAS
Para a associação das substâncias, foram preparadas, separadamente, diferentes soluções nas concentrações de CIMx8, CIMx4, CIMx2, CIM, CIM/2, CIM/4 e CIM/8.
Realizou-se o estudo das associações pela técnica Checkerboard para a determinação do índice da concentração inibitória fracionária (ICIF), utilizando placas estéreis de microdiluição com 96 cavidades. Distribuíram-se as soluções na placa, de forma que todas as concentrações da substância A (glicosídeo), na horizontal, combinassem com todas as concentrações da substância B (anfotericina B ou cetoconazol) na vertical.
O experimento foi conduzido com inóculo 1-5 x 105 UFC/mL em cada cavidade. Para a realização das associações, utilizou-se a cepa fúngica C. tropicalis ATCC-13803.
Os ensaios foram incubados em estufa a 35 °C por 48 h, e, após esse período, determinada a CIM da associação.
Calculou-se o ICIF pela seguinte equação: ICIF = CIFA + CIFB, onde a concentração inibitória fracionáriaA (CIFA) foi calculada pela relação CIMA combinado/CIMA sozinho; enquanto que o CIFB = CIMB combinado/CIMB sozinho21. Sendo A o glicosídeo e B a anfotericina B ou o cetoconazol.
O ICIF foi classificado da seguinte forma: sinergismo (≤ 0,5), indiferença (> 0,5 < 4), antagonismo (≥ 4)22,23.
RESULTADOS
O prop-2-in-1-il 4,6-di-O-acetil-2,3-didesoxi-α-D- eritro-hex-2-enopiranosídeo (glicosídeo 3) foi obtido na forma de um sólido branco amorfo, com excelente rendimento (Figura 1).
Os resultados da análise espectroscópica dos espectros de RMN 1H, RMN 13C e infravermelho estão descritos na tabela 1.
Tabela 1 - Análise espectroscópica dos espectros de RMN 1H, RMN 13C e infravermelho do glicosídeo 3
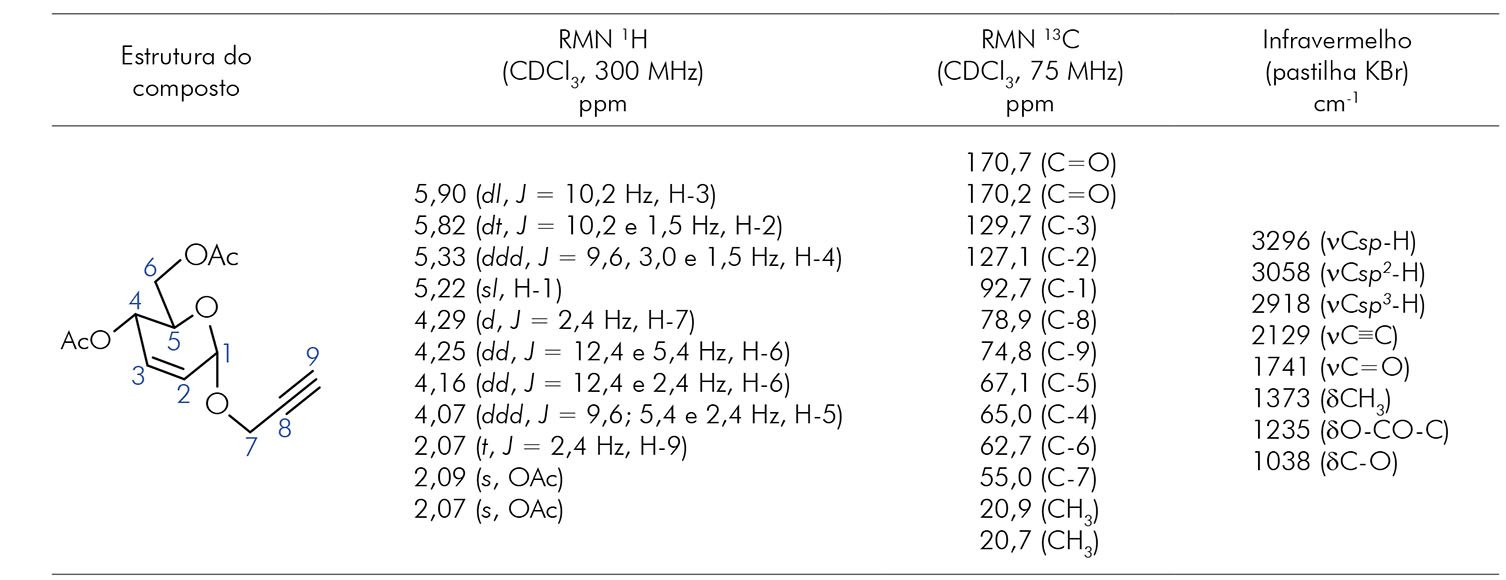
RMN: Ressonância magnética nuclear; ppm: Parte por milhão; dl: Dupleto largo; dt: Duplo tripleto; ddd: Duplo dupleto de dupleto; sl: Simpleto largo;
d: Dupleto; t: Tripleto; s: Simpleto; ν: Deformação axial; δ: Deformação angular.
O espectro de RMN 13C do glicosídeo 3 apresentou 13 sinais quimicamente diferentes (Tabela 1), valor esse semelhante à quantidade de carbonos presentes na estrutura do glicosídeo 3.
Na figura 2, observa-se a ampliação do espectro de RMN 1H (CDCl3, 300 MHz) da reação de glicosilação para determinar a proporção dos glicosídeos 3 e 4.
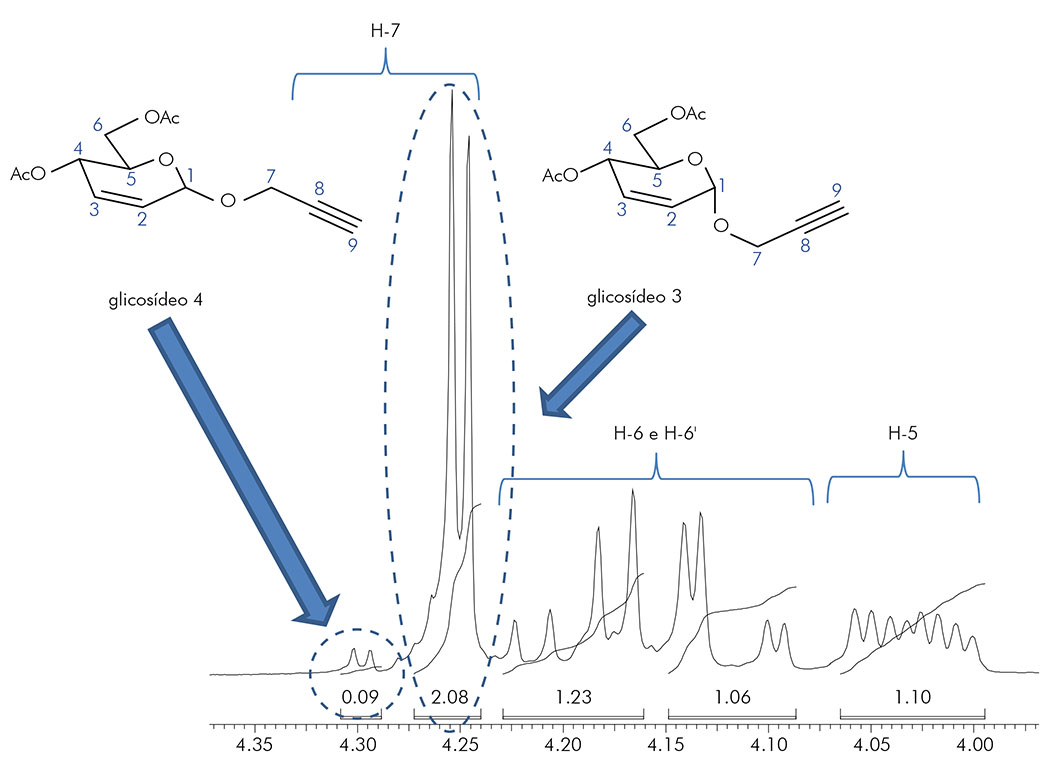
Figura 2 - Ampliação do espectro de RMN 1H (CDCl3, 300 MHz) da reação de glicosilação para determinar a proporção dos glicosídeos 3 e 4
A técnica espectroscópica NOESY corroborou a constatação do produto majoritário da reação de glicosilação (Figura 3).
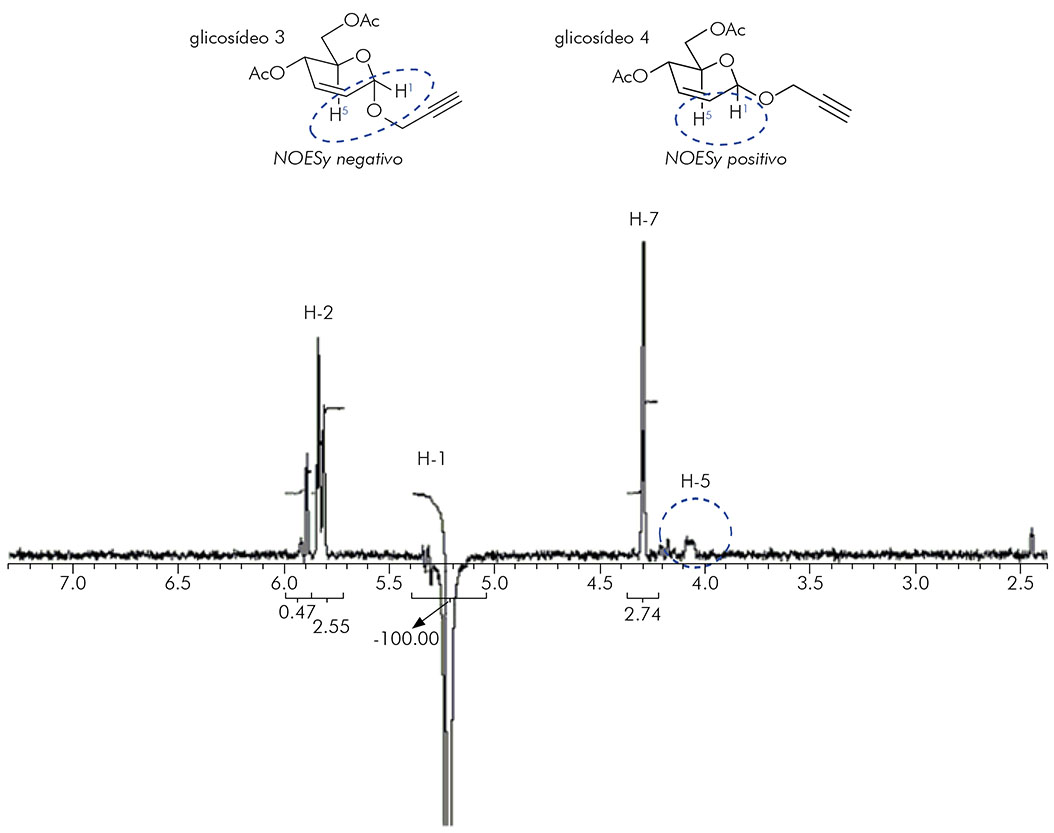
Figura 3 - Espectro de NOESY-1D (300 MHz, CDCl3) do glicosídeo 3 - irradiação no hidrogênio H-1 (5,22 ppm)
O glicosídeo 3 usado nos ensaios não apresentou atividade antifúngica em qualquer das cepas utilizadas nas concentrações testadas. Os valores das CIM da anfotericina B e do cetoconazol estão descritas na tabela 2.
Tabela 2 - Valores das CIM do glicosídeo 3, da anfotericina B e do cetoconazol frente às cepas não albicans
| Espécie fúngica | CIM glicosídeo 3 | CIM anfotericina B | CIM cetoconazol |
|---|---|---|---|
| C. krusei LM-13 | + | 2 µg/mL | 0,5 µg/mL |
| C. parapsilosis ATCC-20019 | + | 2 µg/mL | 0,5 µg/mL |
| C. tropicalis ATCC-13803 | + | 2 µg/mL | 0,5 µg/mL |
| C. guilliermondii LM-703 | + | 0,5 µg/mL | 0,125 µg/mL |
CIM: Concentração inibitória mínima; +: Crescimento fúngico em todas as concentrações testadas.
Para a realização das associações, foi considerada, como CIM do glicosídeo 3, a maior concentração testada. A associação entre o glicosídeo 3 e a anfotericina B apresentou resultado muito satisfatório e promissor; enquanto que, entre o glicosídeo 3 e o cetoconazol, o resultado não foi o esperado (Tabela 3).
Tabela 3 - Associação entre o glicosídeo 3 e a anfotericina B ou o cetoconazol contra C. tropicalis ATCC-13803
| CIF anfotericina B | 0,125 | CIF cetoconazol | 0,5 |
| CIF glicosídeo 3 | 0,125 | CIF glicosídeo 3 | 0,125 |
| ICIF | 0,25 | ICIF | 0,625 |
| Interação | Sinergismo | Interação | Indiferença |
CIF: Concentração inibitória fracionária; ICIF: Índice da concentração inibitória fracionária.
DISCUSSÃO
A análise dos dados espectroscópicos, provenientes dos espectros de RMN 1H e de NOESY, demonstrou que o glicosídeo, obtido como produto majoritário da reação de glicosilação, foi o composto 3. As informações detalhadas na tabela 1 corroboraram a estrutura do glicosídeo 3. Por fim, o ângulo de desvio óptico da solução metanólica do glicosídeo 3 foi positivo.
Após algumas mudanças no protocolo experimental descrito por Toshima et al.17, os glicosídeos 3 e 4 foram obtidos com 95% de rendimento e com uma diastereosseletividade de 95:5, que foi um pouco superior ao relatado por aqueles autores, tendo sido determinada pelo espectro de RMN 1H, utilizando a razão entre as integrais do sinal do hidrogênio metilênico (numerado como H-7) de ambos os compostos. O hidrogênio H-7 foi escolhido porque os demais sinais estavam sobrepostos (por exemplo, H-6, H-6' e H-5) (Figura 2).
Por meio da técnica espectroscópica NOESY, que leva em consideração as proximidades dos núcleos de 1H no espaço24, foi observado que o produto majoritário foi o glicosídeo 3, uma vez que a irradiação seletiva no hidrogênio H-1 (5,22 ppm) não afetou consideravelmente o hidrogênio H-5 (4,07 ppm), apenas os hidrogênios H-7 (4,29 ppm) e H-2 (5,82 ppm) (Figura 3).
Com relação ao espectro de infravermelho do glicosídeo 3, foram observadas várias bandas de absorção; no entanto, as bandas em número de ondas de 3296, 3058, 2918, 2129, 1741, 1373, 1235 e 1038 cm-1 foram atribuídas às ligações Csp-H (deformação axial, moderada), Csp2-H (deformação axial, fraca), Csp3-H (deformação axial assimétrica, fraca), C≡C (deformação axial, fraca), C=O (deformação axial, forte), CH3 (deformação angular, moderada), O-CO-C (deformação angular, moderada) e C-O (deformação angular, forte), respectivamente.
O ponto de fusão e o ângulo de desvio óptico da solução metanólica do glicosídeo 3 foram de 58 a 59 ºC e [α]+137,7, valores esses próximos ao descrito na literatura (59 ºC)25.
A terapia combinada de antifúngicos é considerada uma alternativa terapêutica importante para o tratamento de infecções, possibilitando benefícios como: redução da toxicidade, devido ao uso de menores concentrações de cada substância ativa; tratamento das infecções por múltiplos patógenos; e/ou prevenção ou retardo do desenvolvimento in vivo de subpopulações resistentes a antimicrobianos26,27,28. Nesse contexto, na combinação de fármacos, o sinergismo é a interação mais desejada27,29.
Estudos relatam que o efeito antimicrobiano dos fármacos tem sido potencializado tanto em micro-organismos sensíveis quanto em cepas resistentes a cada um dos fármacos, nos casos de associações sinérgicas10,30.
Para que se estabeleça a terapia combinada adequada entre antimicrobianos, é fundamental que se compreenda a interação existente na combinação dos fármacos. A metodologia do Checkerboard é uma das mais utilizadas para verificar o comportamento da associação in vitro no crescimento microbiano27.
Segundo Liu et al.31, existem limitações nas combinações de antifúngicos, como alto custo, efeitos indesejáveis e resultados contraditórios de ações sinérgicas ou antagônicas de algumas combinações de antifúngicos. Dessa forma, estudos com foco em avaliar combinações de antifúngicos com não antifúngicos vem sendo desenvolvidos.
A combinação de antifúngicos com agentes não antifúngicos, a exemplo da combinação com antibacterianos, sobretudo em infecções fúngicas profundas, apresenta-se como uma importante alternativa terapêutica. Outros agentes não antifúngicos, como os inibidores da calcineurina, inibidores da proteína 90 de choque térmico, reguladores da homeostase do cálcio e anti-inflamatórios não esteroidais, têm sido combinados com fluconazol, observando-se resultados sinérgicos. Outro fato importante é que combinações in vitro do ibuprofeno com o fluconazol contra estirpes resistentes ao fluconazol apresentam sinergia; porém essa mesma ação não é observada em estirpes sensíveis ao fluconazol31.
Foi observado sinergismo entre a associação de concentrações subinibitórias de estatinas com antifúngicos da classe dos azóis contra as espécies não albicans. A fluocitosina é um exemplo de antifúngico de pouca utilização clínica isoladamente, devido ao seu limitado espectro de ação e toxicidade considerável32,33. Entretanto, é comumente utilizada em combinação com a anfotericina B34. Estudos da associação entre a anfotericina B e a fluocitosina têm demonstrado sinergia contra cepas resistentes de Candida spp.35.
Os resultados da associação do glicosídeo com a anfotericina B foram diferentes da associação com o cetoconazol, possivelmente devido às diferenças entre os mecanismos de ação dos poliênicos e dos azóis.
CONCLUSÃO
O glicosídeo 3 obtido apresentou excelente rendimento e sua estrutura foi confirmada por diferentes técnicas espectroscópicas; no entanto, não apresentou atividade antifúngica ante as cepas não albicans de Candida quando utilizado isoladamente. Quando associado com a anfotericina B, a atividade foi sinérgica; com o cetaconazol, indiferente.