Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude vol.9 no.4 Ananindeua dez. 2018
http://dx.doi.org/10.5123/s2176-62232018000400003
ARTÍCULO ORIGINAL
Perfiles de infección del virus Mayaro y del virus Chikungunya en cepas de células de mamíferos y mosquitos
1Instituto Evandro Chagas/SVS/MS, Seção de Arbovirologia e Febres Hemorrágicas, Ananindeua, Pará, Brasil
OBJETIVO:
Trazar el perfil infeccioso del virus Mayaro (MAYV) y del virus Chikungunya (CHIKV) en cuatro diferentes cepas de células.
MATERIALES Y MÉTODOS:
Los aislados de esos virus se utilizaron para infectar cultivos de las siguientes cepas celulares - C6/36, VERO, BHK-21 y LLC-MK2 - frente a la multiplicidad de infección de 1 PFU/célula, las cuales fueron monitoreadas por hasta 96 h posinfección (hpi) por microscopia de contraste de fase para registrar el efecto citopático (ECP); y enseguida, se sometieron a ensayos de inmunofluorescencia indirecta (IFI) y reacción en cadena de la polimerasa de transcripción inversa cuantitativa (qRT-PCR) para detección de antígenos virales y determinar la carga de ARN, respectivamente.
RESULTADOS:
Para ambos virus, las células VERO y BHK-1 presentaron ECP de 24 hpi, las LLC-MK2 presentaron ECP a partir de 48 hpi y las C6/36 no presentaron ninguna ECP. En los ensayos de IFI, todas las células ya se tornaron positivas a 6 hpi, con excepción de las células LLC-MK2 y BHK-21 infectadas con CHIKV. Finalmente, los ensayos qRT-PCR mostraron que, en general, las células infectadas con MAYV presentaron aumento de la carga de ARN, aunque las células LLC-MK2 infectadas por el CHIKV hayan presentado la mayor carga de ARN.
CONCLUSIÓN:
Al evaluar el comportamiento de esos arbovirus en diferentes tipos de cultivos de células, incluyendo algunos no comúnmente utilizados en la rutina del diagnóstico de laboratorio, el presente estudio ofrece no solo una mejor comprensión de la cinética de replicación de MAYV y CHIKV, sino también oportunidades para la optimización de su diagnóstico en muestras biológicas.
Palavras-chave: Arbovirus; Alphavirus; Virus Mayaro; Virus Chikungunya; Linaje de la Célula
INTRODUCCIÓN
El virus Mayaro (MAYV) y el virus Chikungunya (CHIKV) son arbovirus pertenecientes a la familia Togaviridae, género Alphavirus. El MAYV fue aislado por primera vez en 1954, en muestras de trabajadores rurales en Trinidad y Tobagoy, posteriormente aislado en el área del río Guamá, en el estado de Pará, Brasil. El CHIKV fue aislado por primera vez en Tanzania, en 1952, durante un brote atribuido al virus del Dengue (DENV)1,2,3,4,5.
Se han registrado brotes y epidemias de fiebre de Mayaro en Brasil, Bolivia y Perú. En el norte de Brasil, hay informes de varios brotes en ciudades del estado de Pará, como Belterra (1978), Conceição do Araguaia (1981) y Benevides (1991) y en el estado de Amazonas, en Manaus (2007-2008)6. En el período de 2014 a 2016, se informaron 343 casos humanos sospechosos de fiebre de Mayaro y se distribuyeron en 11 estados brasileños, especialmente el estado de Goiás, que tuvo la frecuencia más alta7. Por otro lado, el primer caso autóctono de fiebre chikungunya ocurrió en las Américas en 2013, en la región del Caribe, llegó a Brasil en 2014 y causó decenas de miles de casos8,9. De 2014 a 2017, se notificaron 505.723 casos humanos sospechosos de fiebre chikungunya en Brasil9,10,11,12,13.
En humanos, la infección por MAYV es esporádica y afecta principalmente a personas de bosques tropicales, en donde el vector principal es el mosquito Haemagogus janthinomys. En relación con el CHIKV, se ha descrito un ciclo salvaje y periurbano de la enfermedad en África, transmitido por Aedes aegypti, y su propagación al Océano Índico, Asia y Europa se relacionó con la presencia del vector Aedes albopictus3,4,5,7,14.
La condición clínica del paciente afectado por la fiebre de Mayaro es de aparición repentina, caracterizada por fiebre que alcanza los 39 °C, dolor de cabeza, mialgia, erupción cutánea (principalmente en el pecho, espalda, brazos y piernas), dolor severo en las articulaciones de la muñeca, tobillos, dedos, rodillas y codos, así como la columna lumbar y sacra. Del mismo modo, la fiebre de Chikungunya se caracteriza por una poliartritis/artralgia simétrica en las muñecas, tobillos y codos, y puede retroceder después de 10 días de infección o progresar a cronicidad4,5,7,14,15,16,17.
El método más específico para el diagnóstico de infecciones por arbovirus es la reacción en cadena de la polimerasa de transcripción inversa (RT-PCR), pero el aislamiento del virus seguido de inmunofluorescencia (IF) se considera el método estándar de oro para detectar el agente infeccioso. Los intentos de aislar virus pueden llevarse a cabo mediante la inoculación en cultivos de células de ratones albinos suizos recién nacidos (2 a 3 días) y, eventualmente, también en mosquitos1,18.
Los cultivos de células de artrópodos se han utilizado cada vez más, ya que demuestran una sensibilidad al aislamiento de virus similar a la de los ratones lactantes. Entre las cepas celulares de artrópodos más utilizadas se encuentran las células C6/36 Aedes albopictus, las células AP-61 de Aedes pseudoscutellaris y las células TRA-284 Toxorhynchites amboinensis1,16,19. Los cultivos de células de vertebrados también se usan ampliamente e incluyen células VERO del riñón de mono verde africano (Chlorocebus aethiops), células BHK-21 del riñón de hámster bebé (Mesocricetus auratus) y células LLC-MK2 del riñón de mono rhesus (Macaca mulatta)16,20.
De muchos arbovirus se sabe poco o nada sobre sus características ecopidemiológicas y moleculares y su capacidad para infectar varias cepas celulares disponibles en la actualidad. Por lo tanto, este estudio tuvo como objetivo trazar el perfil de infección por MAYV y CHIKV en cuatro cepas celulares, analizando la susceptibilidad y permisividad de las células BHK-21 y LLC-MK2 a las infecciones por alfavirus en comparación con las células C6/36 y VERO, que se usan con mayor frecuencia en laboratorios específicos. Además, se realizaron estudios de cinética de replicación viral para acompañar la progresión de la infección viral en estas cepas celulares, evaluando el efecto citopático (ECP), la detección del antígeno viral y la progenie de la carga de ARN.
MATERIALES Y MÉTODOS
MUESTRAS DE VIRUS
Los aislados de virus brasileños utilizados en este estudio fueron suministrados por la colecta de arbovirus de la Sección de Arbovirología y Fiebre Hemorrágica (SAARB) del Instituto Evandro Chagas (IEC). La cepa MAYV (BeAr20290; pasaje 2; genotipo L; número de acceso genbank KY618127) fue aislada de un artrópodo hematófago (Haemagogus sp.) en 1960 y CHIKV (BeH803609; pasaje 2; genotipo asiático; número de acceso genbank KP164571) fue aislada a partir de lo sangre de un ser humano enfermo en 2014. Los estoques de CHIKV y MAYV utilizados fueron originarios de fluidos de cultivo de células y cerebro de ratones, respectivamente, mantenidos en freezer a -70 ºC.
CULTIVO DE CÉLULAS
Las células utilizadas en este estudio se cultivaron de acuerdo con las particularidades de cada cepa. Se cultivaron células C6/36 (ATCC, EE.UU.) A 28 °C en medio Leibovitz L-15 con L-glutamina (Gibco, EE.UU.) Suplementado con suero fetal bovino (SFB) al 5% (Gibco, EE.UU.), 3% de fosfato de triptosa (Himedia, India), 10 ml/L de aminoácidos no esenciales (Baktron Microbiology, Brasil) y solución antibiótica al 1% (10.000 U/ml de penicilina y 10.000 µg/ml de estreptomicina) (Gibco, EE.UU.)16,21. Se cultivaron células VERO (ATCC) a 37 °C y 5% de CO2 en medio 199 (Gibco, EE.UU.) suplido con 2,2 g/L de bicarbonato de sodio (Sigma, EE.UU.), 5% de SFB y 1% de solución antibiótica20,22. Las células BHK-21 (ATCC) se cultivaron a 37 °C y 5% de CO2 en MEM23 y las células LLC-MK2 (ATCC) se cultivaron a 37 °C y 5% de CO2 en DMEM24, ambos suplementados con 3.7 g/L y 2.2 g/L de bicarbonato de sodio, respectivamente, 5% de FBS y 1% de solución antibiótica.
PREPARACIÓN Y TITULACIÓN DE STOCKS DE VIRUS
Los stocks de virus se prepararon inoculando
200 μL de aislados de virus en células VERO cultivadas en matraces de cultivo de 25 cm2. La infección se realizó por el método de adsorción viral. Después de la infección, las células se visualizaron diariamente por microscopía óptica (LM) para observar la ECP. El sobrenadante del cultivo celular se obtuvo de cultivos de ECP, se fraccionó en alícuotas de 500 μl y se almacenó a -70 ºC.
Los títulos infecciosos de los stocks de virus se determinaron mediante el ensayo en placa25 usando diluciones en serie de 10 veces (101 a 107) de cada muestra preparada en medio 199; se inocularon 200 μL de cada dilución en placas de 6 pozos y, después de 1 h, se añadieron 3 ml de medio de cultivo semisólido (1,6% de carboximetilcelulosa en medio 199), suplido con 2% de SFB y 1% de solución antibiótica. Las placas se incubaron a 37 °C y 5% de CO2 durante 48 h y simultáneamente, se fijaron y tiñeron durante 3 h en una solución que contenía 1% de cristal violeta, 30% de etanol y 20% de formalina en solución salina tamponada con fosfato (PBS). Se contaron las placas y los títulos de virus se expresaron como unidades formadoras de placa (UFP)/ml.
INFECCIÓN EXPERIMENTAL DE LAS CEPAS CELULARES
Para estandarizar la dosis infecciosa, se utilizó la multiplicidad de infección (MOI) de 1 UFP/célula para todas las cepas celulares y se prepararon placas de 6 pozos contando las células de acuerdo con el título del virus obtenido en C6/36, VERO, BHK-21 células o LLC-MK2; y luego cada placa de pozo se infectó con MAYV o CHIKV mediante adsorción de 1 h para realizar los análisis cinéticos de replicación del virus a las 6, 12, 24, 48, 72 y 96 h pos infección (hpi). Se usó un control negativo para cada línea celular. Todas las infecciones se realizaron de acuerdo con el nivel tres de bioseguridad.
CONTRASTE DE FASE LM (PCLM)
Las células fueron observadas para ECP por pcLM. Las imágenes de contraste de fase se adquirieron en un microscopio Axiovert 25 usando lente objetiva 10x/0,25 CP-Achromat (Zeiss, Alemania). Los conjuntos de imágenes se procesaron con el software ImageJ 1.48 (NIH, EUA).
ENSAYO DE INMUNOFLUORESCENCIA INDIRECTA (IFI)
Las células fueron colectadas por raspado y sometidas a IF siguiendo un protocolo adaptado de Gubler et al.26. Se utilizaron, como anticuerpo primario, anticuerpos policlonales anti-alfavirus producidos en ratones y, como anticuerpos secundarios, anticuerpos anti-ratones conjugados con isotiocianato de fluoresceína (Cappel). Las imágenes IF se obtuvieron en un microscopio BX51 usando una cámara con lente objetiva UPlanFL N 20x/0.5 y filtros WB y U-25ND (Olympus, Japón). Los conjuntos de imágenes fueron procesados con el software ImageJ 1.48 (NIH, EE.UU.). Se utilizó una cantidad de clasificación de puntaje positivo basada en células establecida por inspección visual, para la expresión de los niveles de intensidad de fluorescencia de las imágenes de IF de la siguiente forma: (1+ = 1 a 25% de las células positivas, 2+ = aproximadamente 50% de las células positivas, 3+ = aproximadamente 75% de las células positivas y 4+ = aproximadamente 100% de las células positivas).
RT-PCR CUANTITATIVO (QRT-PCR)
Los sobrenadantes de los cultivos celulares se colectaron por aspiración y sometidos a qRT-PCR siguiendo los protocolos estandarizados por Celestino Júnior27 y Lanciotti et al.28. Los sobrenadantes de los cultivos de células infectadas fueron sometidos a la extracción de ARN usando Maxwell 16 Total RNA Purification kit en el instrumento Maxwell 16 (Promega, EUA). Para a ejecución de la técnica de qRT-PCR, se utilizó el kit qRT-PCR de una etapa SuperScript III Platinum con sondas TaqMan (Invitrogen, EUA) en el sistema de PCR en tiempo real ViiA 7 (Applied Biosystems, EUA). Los gráficos exponenciales generados por las amplificaciones se analizaron en el software Prism 6.0 (GraphPad, EUA).
RESULTADOS
PROGRESIÓN DE LA ECP Y TITULACIÓN DEL STOCK DE VIRUS
El título de CHIKV fue de 5.4 x 107 PFU/ml, mientras que el título de MAYV fue de 3.2 x 108 PFU/ml. En las células BHK-21 (Figura 1A) infectadas con CHIKV, la manifestación de la ECP ocurrió después de 24 hpi; a las 48 hpi, la presencia de la ECP fue más evidente; y, después de 72 hpi, la monocapa fue completamente destruida. Se observó el mismo patrón en MAYV en estas células, pero la ECP se detectó precozmente con solo 12 hpi. En las células C6/36 infectadas con virus (Figura 1B), no se observó ECP. Las células LLC-MK2 infectadas por virus (Figura 1C) mostraron la ECP relativamente más tarde, de 48 hpi en cultivos de MAYV y 72 hpi en células infectadas por CHIKV, que progresó con la destrucción de la monocapa a 96 hpi. Las células VERO infectadas por virus (Figura 1D) mostraron una manifestación de ECP de 24 hpi con un efecto más prominente en los cultivos de MAYV en este momento; y progresión rápida para ambos virus hacia la destrucción de la monocapa en los puntos de tiempo posteriores.
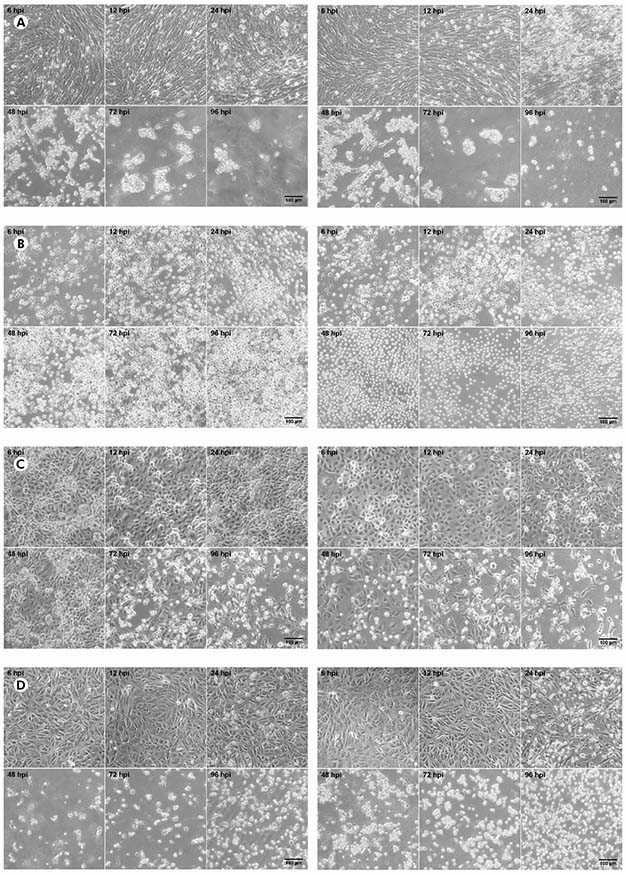
Las células BHK-21 (A), C6/36 (B), LLC-MK2 (C) y VERO (D) fueron infectadas con CHIKV (paneles a la izquierda) o MAYV (paneles a la derecha) bajo el MOI de 1 UFP/célula para los tiempos indicados después de la infección, cuando sus imágenes de luz transmitidas se registraron para medir la ECP por el LM, usando un anillo de contraste de fase. Las imágenes representan tres campos visuales seleccionados aleatoriamente para cada condición.
Figura 1 - Progresión de la ECP en células infectadas por alfavirus
En las células BHK-21, VERO y LLC-MK2 infectadas con MAYV y CHIKV, se observó la ECP de tipo lítico, causando el saqueo de las células muertas, bien como su refracción hasta la completa destrucción de la monocapa. No se observaron diferencias morfológicas entre las células infectadas con MAYV y CHIKV. Los controles negativos de cada línea de células se presentan en la figura 2.
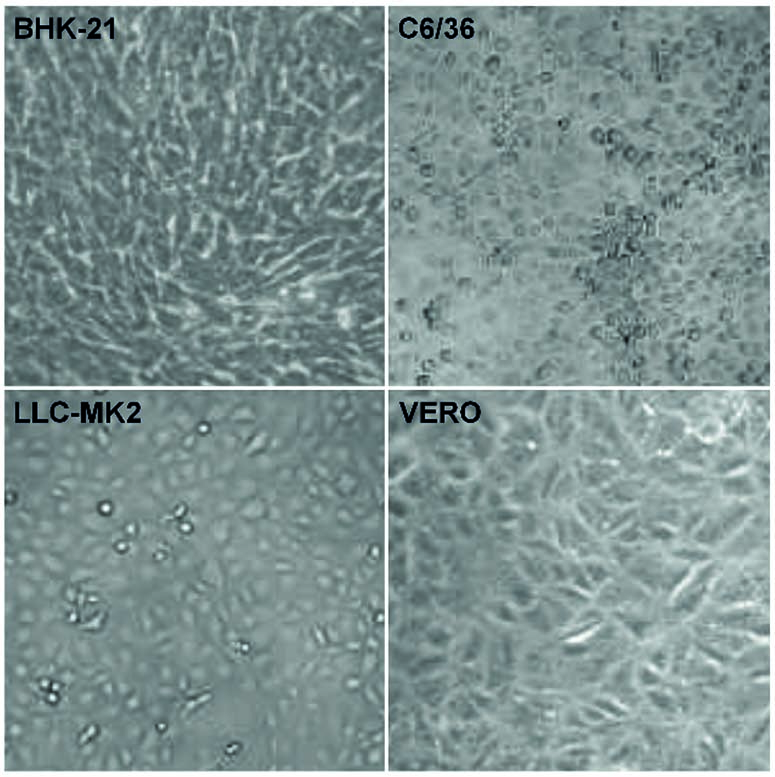
Las células BHK-21, C6/36, LLC-MK2 y VERO fueron cultivadas por 48 h, cuando sus imágenes de luz transmitidas se registraron para medir la ECP por el LM, usando un anillo de contraste de fase. Las imágenes representan tres campos visuales seleccionados aleatoriamente para cada condición.
Figura 2 - La ECP en células no infectadas
PROGRESIÓN DE LA DETECCIÓN DE ANTÍGENOS POR VIRUS
Con respecto al IF de las células BHK-21 infectadas con CHIKV (Figura 3A, paneles izquierdos), se observó una positividad de 1+ a las 12 hpi y 2+ a las 24 hpi; a 48 hpi, la fluorescencia progresó a una positividad de 3+; y, en momentos posteriores, la positividad se estabilizó en 3+. Por otro lado, las células BHK-21 infectadas con MAYV (Figura 3A, paneles a la derecha) ya mostraban la positividad de 1+ a 6 hpi; a las 12 y 24 hpi, hubo una positividad de 2+; a 48 hpi, la
fluorescencia progresó a 3+ de positividad; después de 72 hpi, hubo una positividad de 4+.
Las células C6/36 infectadas con CHIKV (Figura 3B, paneles a la izquierda) mostraron solo una célula positiva a las 6 hpi en el IFI, con progresión en las horas posteriores: a las 12 hpi con una positividad de 2+ y a las 24, 48, 72, y 96 hpi con una positividad de 3+. Las células C6/36 infectadas con MAYV (Figura 3B, paneles a la derecha) mostraron positividad de 1+ a las 6 hpi y 2+ a las 12 hpi, progresando directamente a 3+ a las 24 hpi; después de 48 hpi, hubo una positividad de 4+.
Con respecto a las células LLC-MK2 infectadas con CHIKV (Figura 3C, paneles a la izquierda), se observó positividad de 1+ a las 24 hpi, aumentando directamente a 3+ desde 48 hpi a 96 hpi. En contraste, las células LLC-MK2 infectadas con MAYV (Figura 3C, paneles a la derecha) ya habían mostrado positividad de 1+ a 6 hpi y 12 hpi; a las 24 hpi y 48 hpi, se observó positividad de 2+ y 3+, respectivamente; hubo positividad de 4+ a partir de 72 hpi.
Las células VERO infectadas con CHIKV (Figura 3D, paneles a la izquierda) o MAYV (Figura 3D, paneles a la derecha) ya habían mostrado positividades similares en el ensayo iIF, con 2+ a 6 hpi y 12 hpi, posteriormente creciendo a 3+ a 24 hpi. Ambos virus dieron como resultado la misma positividad de 4+ a las 48 hpi, estabilizándose a 4+ en las horas posteriores.
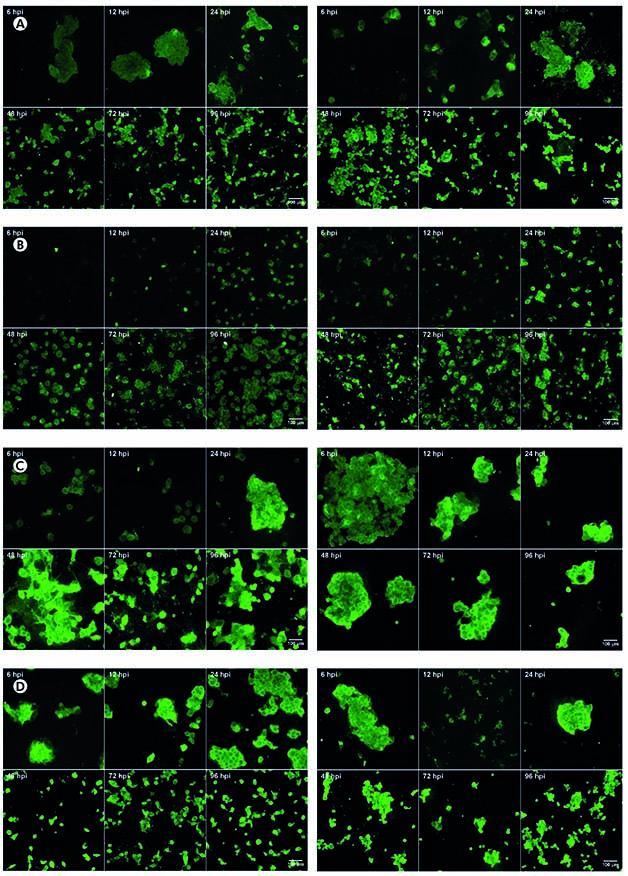
Las células BHK-21 (A), C6/36 (B), LLC-MK2 (C) y VERO (D) fueron infectadas con CHIKV (paneles a la izquierda) o MAYV (paneles a la derecha) bajo el MOI de 1 UFP/célula para os tempos indicados luego de la infección, cuando fueron fijados para medir la detección de antígenos por IF, usando anticuerpos primarios específicos y anticuerpos secundarios marcados con FITC. Las imágenes representan tres campos visuales seleccionados aleatoriamente para cada condición.
Figura 3 - Progresión de la detección de antígeno del virus en células infectadas por alfavirus
Todos los análisis de cultivo de células mostraron mayor intensidad de fluorescencia en las células infectadas por el MAYV.
Los controles negativos del IF de cada línea de células se presentan en la figura 4.

Las células BHK-21, C6/36, LLC-MK2 y VERO fueron cultivadas por 48 h, cuando fueron fijadas para medir la detección de antígeno por IF usando anticuerpos primarios antialfavirus y anticuerpos secundarios marcados con FITC. Las imágenes representan tres campos visuales seleccionados aleatoriamente para cada condición.
Figura 4 - La detección del antígeno del virus en células no infectadas
PROGRESIÓN DE LA CARGA DE ARN EN EL SOBRENADANTE
Según lo evaluado por qRT-PCR en el sobrenadante de cultivos celulares, en células BHK-21 infectadas con CHIKV (Figura 5A, barras negras), se detectó ARN viral a 6 hpi (3,60 x 103 copias/μL), con un aumento en este valor en los tiempos posteriores de 12 hpi (8,68 x 103 copias/μL), 24 hpi (2,60 x 104 copias/μL), 48 hpi (3,31 x 105 copias/μL) y 72 hpi (3.81 x 105 copias/μL). Eventualmente, hubo una caída en la carga viral en 96 hpi (2.84 x 105 copias/μL). Por otro lado, las células BHK-21 infectadas con MAYV (Figura 5A, barras grises) mostraron una carga viral creciente: 4.87 x 102 copias/μL a 6 hpi, 6.85 x 103 copias/μL a 12 hpi, 9.82 x 104 copias/μL a 24 hpi, 6.63 x 105 copias/μL a 48 hpi, 6.87 x 105 copias/μL a 72 hpi y 1,28 x 106 copias/μL a 96 hpi.
Las células C6/36 infectadas con CHIKV (Figura 5B, barras negras) presentaron cargas de ARN de 2,76 x 102 copias/μL a 6 hpi, 9,36 x 102 copias/μL a 12 hpi, 1,27 x 103 copias/μL a 24 hpi, 1,14 x 104 copias/μL a 48 hpi, 3,60 x 105 copias/μL a 72 hpi y 8,76 x 105 copias/μL a 96 hpi. Las células C6/36 infectadas por el MAYV (Figura 5B, barras grises) mostraron 3,36 x 102 copias/μL a 6 hpi, 1,08 x 103 copias/μL a 12 hpi,
2,25 x 103 copias/μL a 24 hpi, 2,14 x 104 copias/μL a 48 hpi, 4,42 x 105 copias/μL a 72 hpi e 6,86 x 105 copias/μL a 96 hpi.
Las células LLC-MK2 infectadas con CHIKV (Figura 5C, barras negras) mostraron un aumento en la carga de ARN a lo largo del tiempo: 2,62 x 102 copias/μL a 6 hpi, 6,45 x 105 copias/μL a 12 hpi, 4,54 x 106 copias/μL a 24 hpi, 8,89 x 106 copias/μL a 48 hpi, 9,16 x 106 copias/μL a 72 hpi y 1,26 x 107 copias/μL a 96 hpi. As células LLC-MK2 infectadas con MAYV (Figura 5C, barras grises) también mostraron una carga viral progresiva, exhibiendo 2,00 x 102 copias/μL a 6 hpi, 1,84 x 103 copias/μL a 12 hpi, 5,31 x 105 copias/μL a 24 hpi, 8,74 x 105 copias/μL a 48 hpi, 9,97 x 105 copias/μL a 72 hpi y 1,97 x 106 copias/μL a 96 hpi.
Las células VERO infectadas con CHIKV (Figura 5D, barras negras) presentaron cargas de ARN de 3,98 x 102 copias/μL, 7,00 x 103 copias/μL, 1,28 x 104 copias/μL, 3,98 x 104 copias/μL, 2,48 x 105 copias/μL y 2,55 x 105 copias/μL a 6 hpi, 12 hpi, 24 hpi, 48 hpi, 72 hpi y 96 hpi, respectivamente. Las células VERO infectadas con MAYV (Figura 5D, barras negras) presentaron las siguientes cargas de ARN: 1,82 x 102 copias/μL a 6 hpi, 9,03 x 102 copias/μL a 12 hpi, 2,24 x 104 copias/μL a 24 hpi, 6,91 x 104 copias/μL a 48 hpi, 3,48 x 105 copias/μL a 72 hpi y 4,88 x 105 copias/μL a 96 hpi.
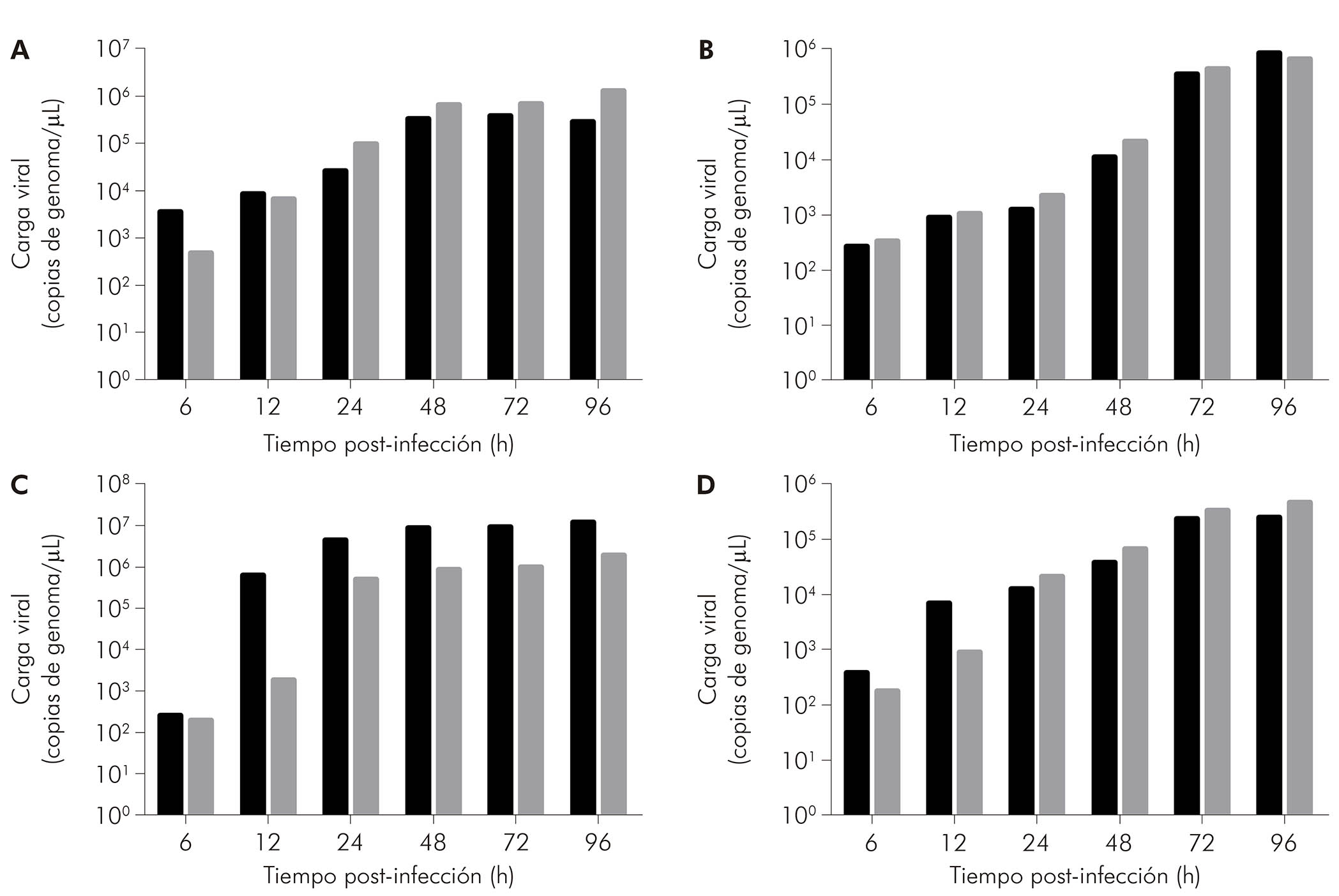
Las células BHK-21 (A), C6/36 (B), LLC-MK2 (C) y VERO (D) fueron infectadas con CHIKV (barras negras) o MAYV (barras grises) bajo el MOI de 1 UFP/célula para los tiempos indicados luego de la infección, cuando sus sobrenadantes fueron recolectados para medir la carga de ARN por RT-qPCR, usando conjuntos específicos de iniciador/sonda. Los datos se obtuvieron de tres experiencias y ploteados como promedio ± desvío estándar para cada condición.
Figura 5 - La progresión de la carga de ARN en el sobrenadante de células infectadas por alfavirus
DISCUSIÓN
Este estudio tuvo como objetivo comparar el perfil de dos infecciones por alfavirus de importancia en salud pública en la región amazónica brasileña: el MAYV, detectado por primera vez en Brasil en 195529, y el CHIKV detectado por primera vez en Brasil en 201430. Las principales cepas celulares usadas para el diagnóstico de laboratorio de esos arbovirus son C6/36 y VERO, que seguramente representan buenos sistemas de aislamiento de virus. Sin embargo, pocos estudios intentaron analizar la susceptibilidad de otras cepas celulares, como BHK-21 y LLC-MK2, en comparación con los mencionados anteriormente, además de analizar el inicio de la detección por intermedio de las pruebas IF y qRT-PCR.
Este estudio demuestra que, para ambos alfavirus, las células VERO y BHK-21 presentaron la ECP anterior, lo que ya era observado a 12 hpi en ambas células, cuando comparado a las células C6/36 y LLC-MK2. Las células C6/36 no presentaron ECP, como ya se esperaba, una vez que la mayoría de las infecciones por arbovirus no llevó a la muerte en esa cepa celular, y las células LLC-MK2 comenzaron a presentar ECP a partir de 48 hpi. Vale destacar que la ECP observada en todos los cultivos que mostraron ser del tipo lítico, con destrucción completa da monocapa y gran cantidad de células muertas arredondeadas.
Al comparar las infecciones por MAYV y CHIKV, se observó una ECP más pronunciada en cultivos de células infectadas con MAYV (VERO, BHK-21 y LLC-MK2), a partir de 12 hpi. En los cultivos de células infectadas con CHIKV, el aparecimiento de la ECP a las 24 hpi fue un poco más suave. Sin embargo, a partir de 48 hpi en general, los cultivos celulares infectadas por un u otro virus presentaron un patrón similar de ECP, excepto las células LLC-MK2, que todavía continuaban presentando una ECP un poco más avanzada cuando infectadas con MAYV.
Con respecto a los resultados de la detección de virus por IF para CHIKV, las células VERO mostraron la positividad más avanzada (a 6 hpi), seguidas por las células C6/36, lo que indica que para este virus, estos cultivos, ampliamente utilizados en la rutina de laboratorio, son mejores para el comienzo de la detección de virus por iIF. Cuando se analizaron los otros cultivos celulares, se observó que, para fines de diagnóstico, para obtener positividad en unos pocos días, el cultivo de células BHK-21 (positividad 2+ a 12 hpi) era mejor que el de las células LLC-MK2 (1 + positividad a las 12 hpi).
Por otra parte, en relación al MAYV, la prueba IF mostró una evolución de positividad hasta alcanzar 4+ en todas las cepas celulares estudiadas, mencionando que la mayoría de estos cultivos celulares tenían un patrón de positividad similar, alcanzando una positividad de 4+ ya 48 hpi. Por lo tanto, se puede sugerir que cualquiera de las cepas celulares estudiadas se puede utilizar con fin de diagnóstico, con el objetivo de la detección precoz del MAYV, y que las células LLC-MK2 y BHK-21 son buenas alternativas a la falta de células C6/36 o VERO en el laboratorio.
Con respecto a las cargas de ARN en los sobrenadantes de cultivos celulares, al comparar las células BHK-21 infectadas con MAYV o CHIKV, se obtuvieron valores más altos para MAYV. Este resultado corrobora los datos obtenidos por el IF, en el que el MAYV mostró una positividad de 4+ y el CHIKV, positividad de 3+ en los últimos momentos estudiados. En las células LLC-MK2, la carga de ARN fue mayor en el CHIKV que en el MAYV, esta fue la cepa celular que tuvo el título más alto entre todos los cultivos celulares analizados, señalando que las células que no se usan con frecuencia en la rutina de laboratorio muestran buenos resultados en la detección del virus. Los resultados de qRT-PCR para las células LLC-MK2, cuando se comparan con los resultados de IF, pueden parecer inconsistentes, se observa que el ensayo de qRT-PCR es más específico que el ensayo iIF, ya que el primero es cuantitativo y el este último es semicuantitativo y depende de la especificidad de los anticuerpos utilizados.
Con relación a las cargas de ARN del cultivo de células C6/36, el CHIKV alcanzó un valor más alto en el último momento analizado (96 hpi); sin embargo, en los otros momentos estudiados, el MAYV presentó valores más altos. Estos resultados corroboran los de la prueba de IF en relación con la mayor positividad para el MAYV a las 48 y 72 h, en comparación con el CHIKV en los mismos momentos. Por otro lado, las cargas de ARN obtenidas con el cultivo de células VERO fueron mayores para el MAYV durante la mayor parte del
estudio (24 a 96 hpi), aunque los resultados de la prueba IF indicaron similitud entre el MAYV y el CHIKV desde la detección inicial de virus a las 6 hpi hasta el último momento probado. Sin embargo, el CHIKV mostró valores más altos de carga de ARN por RT-qPCR en comparación con el MAYV.
Simon et al.31 relataron que el diagnóstico de CHIKV se realizó por RT-PCR y también destacaron el uso de células C6/36 y VERO para el aislamiento y estudio de ese virus. Dado el uso casi exclusivo de esas dos cepas celulares para el diagnóstico de arbovirus, se nota la relevancia de este estudio en el intento de comprender el comportamiento de los alfavirus en otras cepas celulares que no son comúnmente usadas en la rutina del laboratorio, como BHK-21 y principalmente LLC Células -MK2.
En el estudio de Way et al.32, se probaron 20 arbovirus - incluyendo nueve alfavirus - en ambos sistemas de aislamiento de virus (ratones y cultivo celular), y las células VERO y LLC-MK2 mostraron el mayor grado de infección en comparación con las células BHK-21. Esto corrobora el presente estudio, mostrando que los valores más altos de carga de ARN se obtuvieron en las células LLC-MK2.
Según Tesh33, la cepa celular más utilizada en la rutina de laboratorio para la propagación de arbovirus es C6/36, debido a su fácil mantenimiento y crecimiento a 28 °C. Figueiredo34, realizó la propagación de 23 arbovirus en células C6/36, con el MAYV siendo uno de los arbovirus estudiados. No se observó la ECP en estas células, y el IF para alfavirus mostró positividad después de dos o tres días de infección. Estos resultados corroboran el presente estudio, que mostró que no se observó la ECP para los alfavirus estudiados en células C6/36; sin embargo, en este estudio, la detección del antígeno del virus por IF fue posible después de 6 hpi, lo que probablemente puede explicarse por el menor MOI en las muestras del estudio de Figueiredo.
Debido a la buena adaptación del CHIKV a las células BHK-21, esa cepa celular está siendo usada actualmente para realizar estudios de pequeñas mutaciones en las glicoproteínas de la envoltura viral que facilitan la adaptación del virus al vector artrópodo35.
Lim y Chu36 realizaron una cinética de replicación del CHIKV en células VERO infectadas bajo el MOI de 10, con puntos de tiempo de 0, 12, 24, 36 y 48 hpi, y observaron la ECP de 36 hpi y una mayor intensificación a 48 hpi; en el mismo estudio, la cuantificación del ARN viral también se hizo mediante qRT-PCR, y la carga de ARN más alta se observó a las 24 hpi, con 5.0 x 108 UFP/ml. En el presente estudio, la cinética de replicación se realizó a las 6, 12, 24, 48, 72 y 96 hpi, con la aparición de ECP en células VERO infectadas con CHIKV a las 24 hpi, lo que corrobora el estudio mencionado36, dado que la ECP comienza a desarrollarse después de 24 hpi, sin embargo, a las 48 hpi está avanzada. Sin embargo, dado el MOI inicial diez veces menor, la carga de ARN en este estudio también fue menor que la del estudio Lim y Chu, alcanzando un pico de 96 hpi con 2.55 x 105 copias/μl para CHIKV en células VERO.
Lee y Chu37 pudieron replicar el CHIKV en células C6/36 para estudiar varias proteínas que interfieren con la replicación del virus en células de artrópodos, corroborando el presente estudio, demostrando que las células C6/36, aunque no presenten ECP, proporcionan buenos resultados en las pruebas IF y qRT-PCR.
Tomados en conjunto, estos hallazgos sugieren que las células VERO, BHK-21 y LLC-MK2 son las células elegidas para el monitoreo y titulación de la ECP y la formación de placas. Aunque las células C6/36 no demuestran ECP para los dos virus probados, presentan excelentes resultados con detección precoz, lo que justifica su amplio uso en el diagnóstico de laboratorio. Sin embargo, este trabajo también muestra que otras cepas celulares menos utilizadas en la rutina de diagnóstico, como BHK-21 y especialmente LLC-MK2, permiten excelentes cargas de ARN. Además, al comparar el MAYV con el CHIKV, generalmente se observó que el MAYV logró mayores cargas de ARN, así como un inicio temprano de detección de ECP e IF - probablemente porque la muestra del MAYV se aisló en 1960, sufriendo un número más de pasajes que la cepa de CHIKV aislada más recientemente.
Además, estudios como este son importantes para mostrar el mejor momento para recolectar células infectadas que servirán como fuentes de virus para técnicas como la secuenciación de nucleótidos, que requiere una gran cantidad de ARN viral; por ejemplo, con la cepa celular BHK-21, la mayor carga de ARN lograda para CHIKV fue de 72 hpi y, para MAYV, de 96 hpi. Esto indica que hay diferentes perfiles de replicación entre virus en diferentes cepas celulares.
Finalmente, se sabe que muchas células utilizadas en la rutina de laboratorio ya están estandarizadas para el diagnóstico de arbovirus, sin embargo, es necesario que se realicen nuevos estudios con otras cepas celulares para analizar su susceptibilidad y permisividad ante el creciente número de arbovirus de importancia médica para mejorar el diagnóstico virológico.
AGRADECIMIENTOS
Los autores agradecen al equipo del Laboratorio de Aislamiento Viral en Cultivo de Células y Laboratorio de Biología Molecular (SAARB/IEC), especialmente a Maissa Maia, Ercilia Gonçalves, Jamilla Pantoja, Maxwell Lima, Eliana Silva y Karla Melo, por la asistencia técnica al presente trabajo.
REFERENCIAS
1 Azevedo RSS, Martins LC, Rodrigues SG, Travassos da Rosa JFS, Vasconcelos PFC. Arboviroses. In: Farhat CK, Carvalho LHFR, Succi RCM, editores. Infectologia pediátrica. 3. ed. São Paulo: Atheneu; 2007. p. 534-51. [ Links ]
2 Causey OR, Maroja O, Azevedo MC. Epidemia pelo vírus "Mayaro" no estado do Pará. Rev Serv Esp Saude Publica. 1958;10(1):152-4. [ Links ]
3 Donalisio MR, Freitas ARR. Chikungunya no Brasil: um desafio emergente. Rev Bras Epidemiol. 2015 jan-mar;18(1):283-5. Doi: 10.1590/1980-5497201500010022 [Link] [ Links ]
4 Lopes N, Nozawa C, Linhares REC. Características gerais e epidemiologia dos arbovírus emergentes no Brasil. Rev Pan-Amaz Saude. 2014 set;5(3):55-64. Doi: 10.5123/S2176-62232014000300007 [Link] [ Links ]
5 Tauil PL. Condições para a transmissão da febre do vírus chikungunya. Epidemiol Serv Saude. 2014 out-dez;23(4):773-4. Doi: 10.5123/S1679-49742014000400020 [Link] [ Links ]
6 Mourão MPG, Bastos MS, Figueiredo RP, Gimaque JBL, Galusso EL, Kramer VM, et al. Mayaro fever in the city of Manaus, Brazil, 2007-2008. Vector Borne Zoonotic Dis. 2012 Jan;12(1):42-6. Doi: 10.1089/vbz.2011.0669 [Link] [ Links ]
7 Ministério da Saúde (BR). Situação epidemiológica - Dados [Internet]. Brasília (DF): Ministério da Saúde; 2015 nov 25 [atualizado 2016 nov 8; citado 2017 set 11]. Disponível em: Disponível em: http://portalms.saude.gov.br/saude-de-a-z/febre-do-mayaro/20950-situacao%20epidemiologica-dados . [ Links ]
8 Vasconcelos PFC, Azevedo RSS, Rodrigues SG, Martins LC, Chiang JO, Travassos da Rosa APA. Arboviroses. In: Leão RNQ, coordenador. Medicina tropical e infectologia na Amazônia. Belém: Samauma; 2013. Vol. 1; cap. 23; p. 481-503. [ Links ]
9 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Monitoramento dos casos de dengue, febre de Chikungunya e febre pelo vírus Zika até a Semana Epidemiológica 5, 2016. Bol Epidemiol. 2016;47(8):1-7. [Link] [ Links ]
10 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Monitoramento dos casos de dengue e febre de Chikungunya até a Semana Epidemiológica (SE) 53 de 2014. Bol Epidemiol. 2015;46(3):1-7. [Link] [ Links ]
11 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Monitoramento dos casos de dengue, febre de Chikungunya e febre pelo vírus Zika até a Semana Epidemiológica 52, 2015. Bol Epidemiol. 2016;47(3):1-10. [Link] [ Links ]
12 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Monitoramento dos casos de dengue, febre de Chikungunya e febre pelo vírus Zika até a Semana Epidemiológica 52, 2016. Bol Epidemiol. 2017;48(3):1-11. [Link] [ Links ]
13 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Monitoramento dos casos de dengue, febre de Chikungunya e febre pelo vírus Zika até a Semana Epidemiológica 52, 2017. Bol Epidemiol. 2018;49(2):1-13. [Link] [ Links ]
14 Travassos da Rosa APA, Travassos da Rosa JFS, Pinheiro FP, Vasconcelos PFC. Arboviroses. In: Leão RNQ, coordenador. Doenças infecciosas e parasitárias: enfoque amazônico. Belém: CEJUP; 1997. p. 207-25. [ Links ]
15 Pinheiro FP, Freitas RB; Travassos da Rosa JF, Gabbay YB, Mello WA, LeDuc JW. An outbreak of Mayaro virus disease in Belterra, Brazil: I. Clinical and virological findings. Am J Trop Med Hyg. 1981 May;30(3):674-81. Doi: 10.4269/ajtmh.1981.30.674 [Link] [ Links ]
16 Vasconcelos PFC, Travassos da Rosa APA, Pinheiro FP, Travassos da Rosa JFS. Arboviroses. In: Veronesi R, Focaccia R, editores. Tratado de infectologia. 4. ed. São Paulo: Atheneu; 2009. p. 339-51. [ Links ]
17 Vasconcelos PFC. Emergência do vírus Chikungunya: risco de introdução no Brasil. Rev Pan-Amaz Saude. 2014 set;5(3):9-10. Doi: 10.5123/S2176-62232014000300001 [Link] [ Links ]
18 Korsman SNJ, Zyl GV, Nutt L, Andersson MI, Preiser W. Virologia. Rio de Janeiro: Elsevier; 2014. p. 117-61. [ Links ]
19 Travassos da Rosa APA, Pinheiro FP, Travassos da Rosa ES, Rodrigues SG, Travassos da Rosa JFS, Vasconcelos PFC. Arboviroses. In: Tonelli E, Freire LMS, editores. Doenças infecciosas na infância e adolescência. 2. ed. Belo Horizonte: Medsi; 2000. p. 986-1015. [ Links ]
20 Travassos da Rosa APA, Pinheiro FP, Travassos da Rosa ES, Rodrigues SG, Travassos da Rosa JFS, Vasconcelos PFC. Arboviroses. In: Farhat CK, Carvalho ES, Carvalho LHFR, Succi RCM, editores. Infectologia pediátrica. 2. ed. São Paulo: Atheneu ; 1998. p. 358-67. [ Links ]
21 Barbosa ML, Rocco IM, Felippe JMMS, Cruz AS. Growth and maintenance of Aedes albopictus cell line, clone C6/36, in different media. Rev Inst Adolf Lutz. 1993;53(1-2):63-70. [ Links ]
22 Ammerman NC, Beier-Sexton M, Azad AF. Growth and maintenance of Vero cell lines. Curr Protoc Microbiol. 2008 Nov;11(1):A.4E.1-A.4E.7. Doi: 10.1002/9780471729259.mca04es11 [Link] [ Links ]
23 Macpherson I, Stoker M. Polyoma transformation of hamster cell clones - an investigation of genetic factors affecting cell competence. Virology. 1962 Feb;16(2):147-51. Doi: 10.1016/0042-6822(62)90290-8 [Link] [ Links ]
24 Hull RN, Cherry WR, Tritch OJ. Growth characteristics of monkey kidney cell strains LLC-MK1, LLC-MK2, and LLC-MK2(NCTC-3196) and their utility in virus research. J Exp Med. 1962 May;115(5):903-18. Doi: 10.1084/jem.115.5.903 [Link] [ Links ]
25 Dulbecco R, Vogt M. Some problems of animal virology as studied by the plaque technique. Cold Spring Harb Symp Quant Biol. 1953;18:273-9. Doi: 10.1101/SQB.1953.018.01.039 [Link] [ Links ]
26 Gubler DJ, Kuno G, Sather GE, Velez M, Oliver A. Mosquito cell cultures and specific monoclonal antibodies in surveillance for dengue viruses. Am J Trop Med Hyg. 1984 Jan;33(1):158-65. Doi: 10.4269/ajtmh.1984.33.158 [Link] [ Links ]
27 Celestino Jr AF. Desenvolvimento de técnica de RT-PCR em tempo real para detecção do vírus Mayaro (Togaviridae: Alphavirus) [dissertação]. Belém (PA): Universidade Federal do Pará, Instituto de Ciências Biológicas; 2013. 64 p. [Link] [ Links ]
28 Lanciotti RS, Calisher CH, Gubler DJ, Chang GJ, Vorndam AV. Rapid detection and typing of dengue viruses from clinical samples by using reverse transcriptase-polymerase chain reaction. J Clin Microbiol. 1992 Mar;30(3):545-51. [Link] [ Links ]
29 Causey OR, Maroja OM. Mayaro virus: a new human disease agent. III. Investigation of an epidemic of acute febrile illness on the river Guama in Pará, Brazil, and isolation of Mayaro virus as causative agent. Am J Trop Med Hyg. 1957 Nov;6(6):1017-23. Doi: 10.4269/ajtmh.1957.6.1017 [Link] [ Links ]
30 Nunes MRT, Faria NR, Vasconcelos JM, Golding N, Kraemer MUG, Oliveira LF, et al. Emergence and potential for spread of Chikungunya virus in Brazil. BMC Med. 2015 Apr;13:102. Doi: 10.1186/s12916-015-0348-x [Link] [ Links ]
31 Simon F, Javelle E, Oliver M, Leparc-Goffart I, Marimoutou C. Chikungunya virus infection. Curr Infect Dis Rep. 2011 Jun;13:218. Doi: 10.1007/s11908-011-0180-1 [Link] [ Links ]
32 Way HJ, Bowen ETW, Platt GS. Comparative studies of some African arboviruses in cell culture and in mice. J Gen Virol. 1976 Jan;30(1):123-30. Doi: 10.1099/0022-1317-30-1-123 [Link] [ Links ]
33 Tesh RB. A method for the isolation and identification of dengue viruses, using mosquito cell cultures. Am J Trop Med Hyg. 1979 Nov;28(6):1053-9. Doi: 10.4269/ajtmh.1979.28.1053 [Link] [ Links ]
34 Figueiredo LTM. Uso de células de Aedes albopictus C6/36 na propagação e classificação de arbovírus das famílias Togaviridae, Flaviviridae, Bunyaviridae e Rhabdoviridae. Rev Soc Bras Med Trop. 1990 jan-mar;23(1):13-8. Doi: 10.1590/S0037-86821990000100003 [Link] [ Links ]
35 Arias-Goeta C, Moutailler S, Mousson L, Zouache K, Thiberge JM, Caro V, et al. Chikungunya virus adaptation to a mosquito vector correlates with only few point mutations in the viral envelope glycoprotein. Infect Genet Evol. 2014 Jun;24:116-26. Doi: 10.1016/j.meegid.2014.03.015 [Link] [ Links ]
36 Lim PJ, Chu JJH. A polarized cell model for Chikungunya virus infection: entry and egress of virus occurs at the apical domain of polarized cells. PLoS Negl Trop Dis. 2014 Feb;8(2):e2661. Doi: 10.1371/journal.pntd.0002661 [Link] [ Links ]
37 Lee RCH, Chu JJH. Proteomics profiling of Chikungunya-infected Aedes albopictus C6/36 cells reveal important mosquito cell factors in virus replication. PLoS Negl Trop Dis. 2015 Mar;9(3):e0003544. Doi: 10.1371/journal.pntd.0003544 [Link] [ Links ]
AYUDA FINANCIERA Este trabajo fue financiado por donaciones del Ministerio de Salud, Brasil, Instituto Nacional de Ciencia y Tecnología de Fiebres Hemorrágicas Virales (concesión nº 573739/2008-0) y el Consejo Nacional de Desarrollo Científico y Tecnológico (concesión nº 457664/2013-4).
Se refiere al doi:10.5123/S2176-62232018000400003, publicado originalmente en inglês. Traducido por: Lota Moncada
Cómo citar este artículo / How to cite this article: Ribeiro ACS, Carvalho CAM, Casseb SMM, Rodrigues SG, Vasconcelos PFC, Carvalho VL, et al. Perfiles de infección del virus Mayaro y del virus Chikungunya en cepas de células de mamíferos y mosquitos. Rev Pan-Amaz Saude. 2018 oct-dic;9(4):1-11. Doi: http://dx.doi.org/10.5123/S2176-62232018000400003
Recibido: 11 de Septiembre de 2017; Aprobado: 03 de Agosto de 2018











 texto em
texto em 
 Curriculum ScienTI
Curriculum ScienTI

