Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Pan-Amazônica de Saúde
Print version ISSN 2176-6215On-line version ISSN 2176-6223
Rev Pan-Amaz Saude vol.10 Ananindeua 2019 Epub June 24, 2019
http://dx.doi.org/10.5123/s2176-6223201901607
ARTÍCULO ORIGINAL
Prevalencia de larvas migrans en suelos de parques públicos de la ciudad de Redenção, estado de Pará, Brasil
1 Faculdade de Ensino Superior da Amazônia Reunida, Redenção, Pará, Brasil
OBJETIVO:
Analizar la prevalencia de larva migrans visceral (LMV) y larva migrans cutánea (LMC) en suelos de parques públicos de la ciudad de Redenção, estado de Pará, Brasil.
MATERIALES Y MÉTODOS:
Fueron examinados los suelos de cinco parques de la ciudad, localizados del centro hasta la periferia. Se recogieron 60 g de suelo en cinco diferentes puntos de cada parque, totalizando 25 muestras. Para el procesamiento de ese material, se utilizaron técnicas de sedimentación espontánea y de centrífugo-fluctuación.
RESULTADOS:
Del total de muestras de los cinco parques, 80,0% fueron positivas para la presencia de formas parasitarias, 72,1% fueron identificadas como LMC y 27,9% como LMV. Además, se observó una predominancia de larvas filarioides de anquilostómidos (58,8%) en relación al restante de las larvas identificadas.
CONCLUSIÓN:
La prevalencia de esos parásitos en los parques públicos enfatiza la importancia de la adopción de medidas profilácticas, ya que los mismos pueden actuar como fuente de infección en el ambiente, comprometiendo la salud humana.
Palabras clave: Anquilostomiasis; Toxocaríasis; Parques Recreativos; Zoonosis
INTRODUCCIÓN
Hay más de 1500 millones de personas infectadas en todo el mundo por helmintos transmitidos por contacto con el suelo1. Estos parásitos son frecuentes en áreas tropicales y subtropicales, con las tasas más altas registradas en los continentes africano, asiático y latinoamericano, considerando que las condiciones climáticas y el saneamiento básico son más propicias para su desarrollo y transmisión2,3,4. Además, afectan principalmente a niños en edad preescolar y escolar que viven en estas regiones, que requieren tratamiento e intervenciones preventivas1,5.
Entre los helmintos infectantes, las especies Toxocara cati y Toxocara canis, de la familia Ascarididae, son responsables de los síndromes de larva migrans visceral (LMV) y larva migrans ocular (LMO); y anquilostomas, pertenecientes a la familia Ancylostomatidae, principalmente la especie Ancylostoma braziliense, debido al síndrome de la larva migrans cutánea (LMC)6,7. Los parásitos que causan estos síndromes se desarrollan solo en perros y gatos, que son sus anfitriones naturales definitivos y, cuando contaminan al ser humano, no pueden completar su ciclo evolutivo, vagando sin rumbo por las capas superficiales de la piel o a través de las vísceras, provocando un respuesta inflamatoria focal6,8.
Estas parasitosis se consideran enfermedades tropicales desatendidas por la Organización Mundial de la Salud (OMS)9,10. Se estima que 50 millones de personas están infectadas con anquilostomas y aproximadamente el 65% de estos casos ocurren en Brasil9. En un estudio realizado en el estado de Piauí11, el 14,1% de las 298 personas examinadas estaban infectadas con anquilostomas. Ferraz et al.12 identificaron el 3,45% de la población de Macapá, en el estado de Amapá, infectada con anquilostomas. También se sabe que la toxocaríasis y la estrongiloidíasis son endémicas en el país9,10.
El síndrome de LMC es una zoonosis provocada por las larvas filarioides de Ancylostoma braziliense, Ancylostoma caninum y, más raramente, Strongyloides stercoralis13,14. La transmisión de estos parásitos ocurre en la epidermis en el momento en que la piel entra en contacto con el suelo contaminado por las heces de animales que contienen larvas. Después de infectar al ser humano, hacen caminos sinuosos en la piel, desencadenando un proceso inflamatorio local. Debido a que permanecen confinadas a la epidermis y deja un rastro sinuoso detrás de ella, la patología se conoce comúnmente como "bicho geográfico". Los sitios del cuerpo con mayor afinidad para que las larvas penetren son pies, piernas, glúteos y manos8,15.
En comparación, las larvas que afectan las vísceras y los ojos causan los síndromes de LMV y LMO, respectivamente16. Estas infecciones son causadas por la ingestión de larvas de T. canis y, en menor medida, de T. cati en alimentos o suelos contaminados. La defecación de perros y gatos en áreas públicas es una de las formas que contribuye a la contaminación del medio ambiente17. Después de ingerir el huevo, las larvas eclosionan en el intestino y migran a varias vísceras, como el hígado, el cerebro, los pulmones y los ojos, lo que desencadena alteraciones locales17,18.
El contacto de la población con estos parásitos es constante, ya que el aumento en la tasa de poblaciones canina y felina que frecuentan el mismo ambiente que los humanos está creciendo19. Según el Instituto Brasileño de Geografía y Estadística (IBGE)20, en 2013, aproximadamente el 45% de la población brasileña tenía al menos un perro en su hogar y aproximadamente el 18% tenía al menos un gato en su hogar. En las zonas urbanas, los animales de compañía comparten espacios limitados (parques y plazas públicas) con otros animales callejeros o de compañía, un hecho que aumenta la posibilidad de transmisión y diseminación de los parásitos que causan LMC y LMV21.
Esas parasitosis acometen principalmente a los niños, por estar en mayor contacto con suelos arenosos contaminados onde cohabitan el ser humano, perros y gatos. Llevando en consideración que esos animales defecan no solamente en áreas públicas y cajas de arena de las guarderías, representan grave riesgo para la salud humana, principalmente de los niños1,22,23,24.
Debido a la importancia epidemiológica de esas enfermedades y como, en la ciudad de Redenção, estado de Pará, hay muchos animales domésticos y callejeros compartiendo espacios con niños y adultos, el presente estudio tuvo como objetivo identificar la prevalencia de LMC y LMV en suelos de parques públicos de ese municipio.
MATERIALES Y MÉTODOS
Estudio de tipo descriptivo con un enfoque cuantitativo25. La investigación se llevó a cabo en los parques públicos de Redenção, ubicada en la región sur del Estado, con una población estimada de 82.464 habitantes y un área de 3.823.809 km2, a 1.018 Km. de distancia de la capital Belém26. El clima es ecuatorial súperhúmedo, tipo Am de la clasificación Köppen-Geiger, en el límite de la transición a Aw, con una temperatura media anual de 25,35 °C, con un máximo de 32,01 °C y un mínimo de 22,71 °C26.
La evaluación del suelo en parques públicos se realizó entre febrero y junio de 2017. Las muestras se obtuvieron en cinco parques de la ciudad, ubicados en los siguientes sectores: Alto Paraná, Vila Paulista, Jardim Primavera, Santos Drumont y Centro (parques I a V, respectivamente). Estos parques se seleccionaron teniendo en cuenta aspectos como la ubicación (periferia y centro), una mayor frecuencia de visitas y la presencia de lugares recreativos sin una cerca o con una dañada.
Antes de la recolección, se eliminó el exceso de suciedad en la arena, para facilitar la visualización de las estructuras inspeccionadas. Las colectas se realizaron con una espátula metálica, introducida en el suelo en un ángulo de 45° hasta alcanzar una profundidad de aproximadamente 10 cm. Al final de cada procedimiento, la espátula se limpió con alcohol
a 70%, de modo que no hubo interferencia o alteración del resultado de la siguiente muestra. El tiempo entre la recolección y el análisis no superó las 24 h27.
Se recolectaron muestras de suelo de manera estandarizada en cinco puntos diferentes en cada parque, en los extremos superior (N = 2) e inferior (N = 2) y en el medio (N = 1), totalizando 25 muestras. Se eliminaron aproximadamente 60 g de la capa superior del suelo en cada punto de recolección. El material recolectado fue transportado al Laboratorio de Parasitología de la Facultad de Enseñanza Superior de la Amazonía Reunida, en una caja isotérmica para el transporte de muestras biológicas y dentro de recipientes de recolección debidamente identificados.
Los análisis de muestras se realizaron utilizando técnicas de sedimentación espontánea (Hoffman, Pons y Janer)28 y técnicas de flotación centrífuga (Faust et al.)29, adaptadas para la investigación en suelos arenosos30. Las muestras con huevos y larvas de anquilostomas, larvas de S. stercoralis y huevos de Toxocara spp.31 se consideraron positivas.
Los datos se tabularon con el software Microsoft Office Excel 2016. El análisis estadístico fue descriptivo, con distribuciones absolutas.
RESULTADOS
Del total de muestras de los cinco parques de Redenção, 80,0% (N = 4) fueron positivas para la presencia de huevos y larvas de anquilostomas, huevos de Toxocara spp. y larvas de S. stercoralis entre febrero y junio de 2017 (Tabla 1).
Se encontraron 36 formas parasitarias causadoras de LMC y LMV (Tabla 1); de ese total, 26 (72,1%) eran huevos y larvas de anquilostómidos y larvas de S. stercoralis, y los 10 restantes (27,9%), huevos de Toxocara spp. Se observó que los parques III y IV, localizados en la periferia de la ciudad, presentaron registros positivos para LMC de 52,7% (N = 19) en relación a los otros tres (19,4%; N = 7). Por otra parte, el hallazgo de Toxocara spp., en los cinco parques, no tuvo diferencia significativa. En el parque central (parque V) no se encontró ningún parásito (Tabla 1).
Tabla 1 - Total de parásitos causadores de larvas migrans encontrados en los parques del municipio de Redenção, estado de Pará, Brasil, febrero y junio de 2017
| Parques | Muestras | LMC | LMV | Total | |||
|---|---|---|---|---|---|---|---|
| N | % | N | % | N | % | ||
| I | 1 | 2 | 5,5 | 2 | 5,5 | 8 | 22,2 |
| 2 | 1 | 2,8 | - | - | |||
| 3 | 1 | 2,8 | 1 | 2,8 | |||
| 4 | - | - | 1 | 2,8 | |||
| 5 | - | - | - | - | |||
| II | 1 | - | - | - | - | 6 | 16,7 |
| 2 | - | - | 1 | 2,8 | |||
| 3 | 1 | 2,8 | - | - | |||
| 4 | - | - | 1 | 2,8 | |||
| 5 | 2 | 5,5 | 1 | 2,8 | |||
| III | 1 | 2 | 5,5 | - | - | 9 | 25,0 |
| 2 | 1 | 2,8 | - | - | |||
| 3 | 2 | 5,5 | 1 | 2,8 | |||
| 4 | 2 | 5,5 | 1 | 2,8 | |||
| 5 | - | - | - | - | |||
| IV | 1 | 5 | 13,9 | - | - | 13 | 36,1 |
| 2 | - | - | - | - | |||
| 3 | 3 | 8,4 | 1 | 2,8 | |||
| 4 | 4 | 11,1 | - | - | |||
| 5 | - | - | - | - | |||
| V | 1 | - | - | - | - | - | - |
| 2 | - | - | - | - | |||
| 3 | - | - | - | - | |||
| 4 | - | - | - | - | |||
| 5 | - | - | - | - | |||
| Total | 26 | 72,1 | 10 | 27,9 | 36 | 100,0 | |
LMC: larva migrans cutánea; LMV: larva migrans visceral; Señal convencional utilizada: - dato numérico igual a cero, no resultante de redondeo; N: número absoluto de los datos; %: porcentual de los datos.
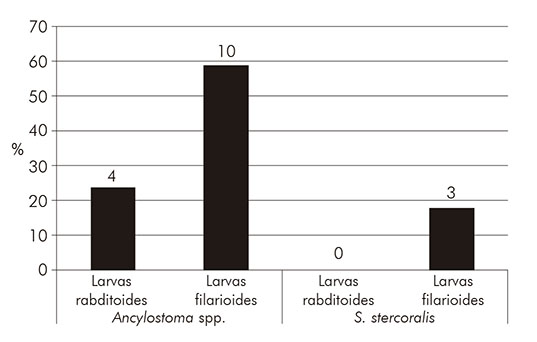
Se observó un porcentaje mayor de larvas de anquilostomas (53,8%; N = 14) en relación a los demás parásitos causadores de LMC (Figura 1). Además, se detectó una mayor predominancia de larvas filarioides de anquilostómidos (58,8%; N = 10) en relación a los rabditoides (23,5%; N = 4) (Figura 2).
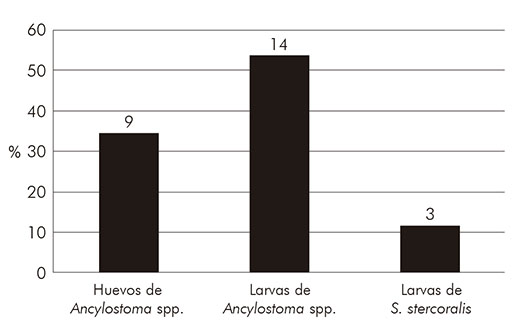
Figura 1 - Porcentaje de estructuras parasitarias causadoras de larva migrans cutánea encontradas en los parques del municipio de Redenção, estado de Pará, Brasil, febrero y junio de 2017
DISCUSIÓN
Los suelos de parques públicos son las principales rutas de transmisión de zoonosis, como LMC y LMV, causadas por anquilostómidos y Toxocara spp., respectivamente32. Esta realidad es un alerta para las autoridades y los profesionales de salud pública, ya que ha habido un aumento visible de las poblaciones de caninos y felinos entre los humanos en los últimos años, lo que aumenta las posibilidades de transmisión de diferentes zoonosis33,34,35.
Los datos obtenidos en este trabajo demostraron que esta contaminación también está presente en Redenção. Los parques III y IV, ubicados en las afueras de la ciudad, tenían un mayor porcentaje de parásitos causadores de LMC (52.7%) en comparación con los demás (19.4%). Sin embargo, en todas las muestras del Parque V, no se encontró ningún parásito, tal vez porque está completamente rodeado, no permitiendo el acceso de animales en este ambiente. Esto demuestra que, en las regiones periféricas de la ciudad, existe una mayor contaminación del suelo en relación al centro, probablemente porque la intervención pública está más dirigida a las regiones centrales, a través de la limpieza, el mantenimiento, la presencia de basureros y el acceso controlado por el uso de cercas24,36. En este contexto, las áreas periféricas ofrecen mejores condiciones para la aparición de estos helmintos37.
La disminución de los parásitos en las regiones centrales de la ciudad también es relatada por Marques et al.32 y Santarém et al.38. Esto puede deberse a que la densidad de población canina varía de una región a otra, especialmente los perros callejeros. Por otro lado, en estos ambientes públicos donde se permite el acceso de animales, puede ocurrir la transmisión de huevos y larvas al medio ambiente a través de las heces, lo que genera riesgos para la población39,40.
Por otra parte, el mayor predominio de LMC en los parques periféricos también puede estar relacionado con el contacto de los animales de la calle con estas regiones y porque estos parásitos son geo-helmintos36. Sin embargo, la literatura ha mostrado oscilaciones de este parámetro en varias regiones brasileñas32,41,42, lo que demuestra la necesidad de estudios regionales, teniendo en cuenta el tipo de suelo, el clima y la población de animales callejeros43.
En el presente trabajo, se encontró una alta tasa de huevos y larvas de anquilostomas y larvas de S. stercoralis (72.1%) en comparación con los huevos de Toxocara spp. (27,9%). Esta diferencia está relacionada con la necesidad de que los anquilostomas y S. stercoralis carezcan de suelo arenoso, sombreado y húmedo para la continuación de su ciclo, siendo este ambiente el hábitat de las larvas44. En contraste, los huevos de Toxocara spp. no tienen necesidad de suelo arenoso, ya que solo requieren humedad, temperatura favorable y oxigenación para su desarrollo8.
En el escenario nacional, Corrêa et al.45 encontraron un porcentaje similar en el suelo de las plazas en la ciudad de Manaus, estado de Amazonas, constatando que el 67,3% de las muestras fueron parasitadas por huevos de anquilostomas y el 4,8% por huevos de Toxocara spp. En tres municipios del estado de Rio de Janeiro43, también se encontró contaminación del suelo por anquilostomas (26,7%) más alta que la de Toxocara spp. (3,3%). Además, se puede observar que el escenario se repite en otras ciudades brasileñas, por ejemplo, en Santos, estado de São Paulo46, Pelotas, estado de Rio Grande do Sul47, Belo Horizonte, estado de Minas Gerais48, Campo Grande, estado de Mato Grosso do Sul49, y Curitiba, Estado de Paraná24.
Por otro lado, en el panorama mundial, la aparición de agentes transmisores de LMC y LMV oscila de acuerdo con el país. Por ejemplo, en Lisboa, Portugal50, 55,6% de las muestras de suelo estaban contaminadas con huevos de anquilostómidos; en Laguna, Filipinas51, 7,0% de las muestras fueron positivas para esos parásitos
y 77,7% para huevos de Toxocara spp.; en Bolívar, Venezuela52, 1,3% de las muestras de suelo contenía huevos de anquilostómidos y 25% huevos de Toxocara spp.; y en Lublin, Polonia53, 54,3% se presentaron positivas para anquilostomas y Toxocara spp.
Entre las estructuras parasitarias causadoras de LMC, las larvas de anquilostómidos (53,8%) obtuvieron una tasa mayor en esta investigación. Ese dato puede compararse al estudio de Brener et al.43, que encontraron 56,7% de larvas de anquilostómidos en suelos de plazas públicas y al de Rocha et al.46 que identificaron 82,5% de larvas de anquilostómidos en suelos de playas. Eso demuestra que los locales arenosos son propicios a la fecundación, desarrollo y supervivencia de las larvas, consecuentemente presentando una condición ideal de contaminación humana54.
Además, Chen y Mucci55 declararon que alrededor del 50% de los establecimientos públicos presentan riesgos para los niños porque tienen arena contaminada con larvas de anquilostómidos, lo que corrobora los datos de la presente investigación. Resultados similares y superiores, también se encontraron en los estados de Tocantins (100%)56 y Rio Grande do Sul (52%)57.
Las enfermedades causadas por estos nematodos son más frecuentes en ambientes tropicales y subtropicales, como en Brasil. Otro punto importante es que el tipo de suelo, la temperatura, el ambiente y la humedad son los principales factores que determinan el tiempo requerido para completar su ciclo1,2,9. Finalmente, las precarias condiciones de saneamiento básico, el bajo nivel socioeconómico y cultural y la poca información han favorecido la propagación de estas infecciones parasitarias58,59.
En cuanto a las fases evolutivas de las larvas, fue posible observar una mayor frecuencia del tipo filarioide de anquilostómidos (58,8%). El mayor número de larvas en esta etapa puede explicarse por el ciclo evolutivo parasitario en sí, ya que esta es la última muda larvaria realizada en el suelo antes de la infección de un nuevo huésped6. Estos datos son relevantes, ya que las larvas filarioides son las formas de transmisión y el contacto con el suelo contaminado permite la infección en el hombre y la aparición de la enfermedad6,60.
Vale la pena mencionar que se llevan a cabo varias investigaciones para identificar parásitos que causan LMC y LMV, y se pueden atribuir diferentes resultados a la diversidad de técnicas de laboratorio, procedimientos de recolección y condiciones climáticas, epidemiológicas, socioeconómicas y culturales de cada región58. Por lo tanto, es importante un consenso para estandarizar los métodos de laboratorio y la recolección de suelos, haciendo que los resultados sean más compatibles entre las diferentes regiones del país y el mundo61.
CONCLUSIÓN
Los síndromes LMC y LMV representan un problema de salud pública para la ciudad de Redenção, y existe una gran posibilidad de transmisión entre las poblaciones canina, felina y humana. Para mejorar ese parámetro sanitario, es necesario realizar programas educativos, para concienciar sobre la importancia de la erradicación de esos parásitos a través del tratamiento de los animales, medidas de restricción física de los parques y mejoría de las condiciones de saneamiento básico. Paralelamente, es importante la participación de los gestores en la definición de políticas públicas, para control de esas y de otras parasitosis.
REFERENCIAS
1 World Health Organization. Guideline: preventive chemotherapy to control soil-transmitted helminth infections in at-risk population groups [Internet]. Geneva: WHO; 2017 [cited 2018 May 7]. Available from: Available from: http://apps.who.int/iris/bitstream/10665/258983/1/9789241550116-eng.pdfua=1 . [ Links ]
2 Brooker S. Estimating the global distribution and disease burden of intestinal nematode infections: adding up the numbers - a review. Int J Parasitol. 2010 Aug;40(10):1137-44. Doi: 10.1016/j.ijpara.2010.04.004 [Link] [ Links ]
3 Prestes LF, Jeske S, Santos CV, Gallo MC, Villela MM. Contaminação do solo por geohelmintos em áreas públicas de recreação em municípios do sul do Rio Grande do Sul (RS), Brasil. Rev Patol Trop. 2015 abr-jun;44(2):155-62. Doi: 10.5216/rpt.v44i2.36645 [Link] [ Links ]
4 Motran CC, Silvane L, Chiapello LS, Theumer MG, Ambrosio LF, Volpini X, et al. Helminth infections: recognition and modulation of the immune response by innate immune cells. Front Immunol. 2018 Apr;9:664. Doi: 10.3389/fimmu.2018.00664 [Link] [ Links ]
5 World Health Organization. Helminth control in school-age children: a guide for managers of control programmes [Internet]. 2nd ed. Geneva: WHO ; 2011 [cited 2018 May 7]. Available from: Available from: http://apps.who.int/iris/bitstream/10665/44671/1/9789241548267_eng.pdf?ua=1 . [ Links ]
6 Ré AL, Bertoncin AC, Lopes FRF, Cabral JA. Importância da família Ancylostomidae como doença parasitária. Pensam Plur. 2011;5(1):21-9. [ Links ]
7 Carvalho EAA, Rocha RL. Toxocaríase: larva migrans visceral em crianças e adolescentes. J Pediatr (Rio J). 2011 mar-abr;87(2):100-10. Doi: 10.2223/JPED.2074 [Link] [ Links ]
8 Peruca LCB, Langoni H, Lucheis SB. Larva migrans visceral e cutânea como zoonoses: revisão de literatura. Vet Zootec. 2009 dez;16(4):601-16. [ Links ]
9 Hotez PJ, Bottazzi ME, Franco-Paredes C, Ault SK, Periago MR. The neglected tropical diseases of Latin America and the Caribbean: a review of disease burden and distribution and a roadmap for control and elimination. PLoS Negl Trop Dis. 2008 Sep;2(9):e300. Doi: 10.1371/journal.pntd.0000300. [Link] [ Links ]
10 Hotez PJ, Brindley PJ, Bethony JM, King CH, Pearce EJ, Jacobson J. Helminth infections: the great neglected tropical diseases. J Clin Invest. 2008 Apr;118(4):1311-21. Doi: 10.1172/JCI34261 [Link] [ Links ]
11 Reis ERC. Ancilostomíase e outras parasitoses intestinais na Região dos Carnaubais: estudo transversal no município de Nossa Senhora de Nazaré, Piauí [dissertação]. Teresina (PI): Fundação Oswaldo Cruz, Instituto Oswaldo Cruz; 2015. 92 p. [Link] [ Links ]
12 Ferraz RRN, Barnabé AS, Porcy C, D’Eça Jr A, Feitosa T, Figueiredo PM. Parasitoses intestinais e baixos índices de Gini em Macapá (AP) e Timon (MA), Brasil. Cad Saúde Colet. 2014 abr-jun;22(2):173-6. Doi: 10.1590/1414-462X201400020010 [Link] [ Links ]
13 González FCG, Galilea ONM, Pizarro CK. Larva migrans cutánea autóctona en Chile: a propósito de un caso. Rev Chil Pediatr. 2015 nov-dic;86(6):426-9. Doi: 10.1016/j.rchipe.2015.07.018 [Link] [ Links ]
14 Andrade EC, Leite ICG, Rodrigues VO, Cesca MG. Parasitoses intestinais: uma revisão sobre seus aspectos sociais, epidemiológicos, clínicos e terapêuticos. Rev APS. 2010 abr-jun;13(2):231-40. [Link] [ Links ]
15 Manikat R, Kannangara S. Cutaneous larva migrans. J Glob Infect Dis. 2017 Jul-Sep;9(3):125. Doi: 10.4103/jgid.jgid_171_16 [Link] [ Links ]
16 Zibaei M, Sadjjadi SM. Trend of toxocariasis in Iran: a review on human and animal dimensions. Iran J Vet Res. 2017;18(4):233-42. Doi: 10.22099/IJVR.2017.4591 [Link] [ Links ]
17 Tomoda Y, Futami S, Sumida K, Tanaka K. Neglected parasitic infection: toxocariasis. BMJ Case Rep. 2018 Mar;2018:bcr-2018-224492. Doi: 10.1136/bcr-2018-224492 [Link] [ Links ]
18 Von Sohsten AL, Silva AV. Toxocaríase humana: risco de infecção alimentar? Vet Zootec. 2015 dez;22(4):501-12. [ Links ]
19 Domingues LR, Cesar JA, Fassa AG, Domingues MR. Guarda responsável de animais de estimação na área urbana do município de Pelotas, RS, Brasil. Ciênc Saúde Coletiva. 2015 jan;20(1):185-92. Doi: 10.1590/1413-81232014201.19632013 [Link] [ Links ]
20 Instituto Brasileiro de Geografia e Estatística. Pesquisa nacional de saúde 2013: acesso e utilização dos serviços de saúde, acidentes e violências: Brasil, grandes regiões e unidades da federação. Rio de Janeiro: IBGE; 2015. 100 p. [Link] [ Links ]
21 Chomel BB, Ben B. Zoonoses in the bedroom. Emerg Infect Dis. 2011 Feb;17(2):167-72. Doi: 10.3201/eid1702.101070 [Link] [ Links ]
22 Sociedade Portuguesa de Pediatria. Toxocarose: protocolo de atuação. Acta Pediatr Port. 2008 jul-ago;39(4):171-5. [Link] [ Links ]
23 Vital TE, Barbosa MRA, Alves DSMM. Ocorrência de parasitos com potencial zoonótico em fezes de cães e gatos do Distrito Federal. Ensaios Cienc. 2012 out;16(1):9-23. Doi: 10.17921/1415-6938.2012v16n1p%25p [Link] [ Links ]
24 Sprenger LK, Green KT, Molento MB. Geohelminth contamination of public areas and epidemiological risk factors in Curitiba, Brazil. Rev Bras Parasitol Vet. 2014 Jan-Mar;23(1):69-73. Doi: 10.1590/S1984-29612014009 [Link] [ Links ]
25 Baruffi H. Metodologia científica: manual para elaboração de monografia. 4. ed. Dourados: Hbedit; 2004. [ Links ]
26 Instituto Brasileiro de Geografia e Estatística. Censo demográfico 2010: características da população e dos domicílios: resultados do universo. Rio de Janeiro: IBGE ; 2011. [ Links ]
27 Santarém VA, Sartor IF, Bergamo FMM. Contaminação, por ovos de Toxocara spp, de parques e praças públicas de Botucatu, São Paulo, Brasil. Rev Soc Bras Med Trop. 1998 nov-dez;31(6):529-32. Doi: 10.1590/S0037-86821998000600004 [Link] [ Links ]
28 Hoffman WA, Pons JA, Janer JL. The sedimentation-concentration method in Schistosomiasis mansoni. Puerto Rico J Public Health. 1934 Mar;9:283-91. [Link] [ Links ]
29 Faust EC, D’Antoni JS, Odom V, Miller MJ, Peres C, Sawitz W, et al. A critical study of clinical laboratory technics for the diagnosis of protozoan cysts and helminth eggs in feces. I. Preliminary communication. Am J Trop Med Hyg. 1938 Mar;18(2):169-83. Doi: 10.4269/ajtmh.1938.s1-18.169 [Link] [ Links ]
30 De Carli GA. Parasitologia clínica: seleção de métodos e técnicas de laboratório para o diagnóstico das parasitoses humanas. São Paulo: Atheneu; 2001. [ Links ]
31 Neves DP, Melo AL, Linardi PM, Vitor RWA. Parasitologia. Vol. 3. Rio de Janeiro: Guanabara Koogan; 2011. [ Links ]
32 Marques JP, Guimarães CR, Vilas Boas A, Carnaúba PU, Moraes J. Contamination of public parks and squares from Guarulhos (São Paulo State, Brazil) by Toxocara spp. and Ancylostoma spp. Rev Inst Med Trop S Paulo. 2012 Sep-Oct;54(5):267-71. Doi: 10.1590/S0036-46652012000500006 [Link] [ Links ]
33 Papini R, Campisi E, Faggi E, Pini G, Mancianti F. Prevalence of Toxocara canis eggs in dog faeces from public places of Florence, Italy. Helminthologia. 2012 Sep;49(3):154-8. Doi: 10.2478/s11687-012-0031-0 [Link] [ Links ]
34 Lallo MA, Spadacci-Morena DD, Coutinho SDA. Comportamento humano na criação de cães e a prevalência de parasitos intestinais com potencial zoonótico. Rev Acad Cienc Anim. 2016 jul;14:119-28. Doi: 10.7213/academica.14.2016.13 [Link] [ Links ]
35 Canatto BD, Silva EA, Bernardi F, Mendes MCNC, Paranhos NT, Dias RA. Caracterização demográfica das populações de cães e gatos supervisionados do município de São Paulo. Arq Bras Med Vet Zootec. 2012 dez;64(6):1515-23. Doi: 10.1590/S0102-09352012000600017 [Link] [ Links ]
36 Cassenote AJF, Pinto Neto JM, Lima-Catelani ARA, Ferreira AW. Contaminação do solo por ovos de geo-helmintos com potencial zoonótico na municipalidade de Fernandópolis, Estado de São Paulo, entre 2007 e 2008. Rev Soc Bras Med Trop. 2011 mai-jun;44(3):371-4. Doi: 10.1590/S0037-86822011005000026 [Link] [ Links ]
37 Dado D, Izquierdo F, Vera O, Montoya A, Mateo M, Fenoy S, et al. Detection of zoonotic intestinal parasites in public parks of Spain. Potential epidemiological role of microsporidia. Zoonoses Public Health. 2012 Feb;59(1):23-8. Doi: 10.1111/j.1863-2378.2011.01411.x [Link] [ Links ]
38 Santarém VA, Pereira VC, Alegre BCP. Contamination of public parks in Presidente Prudente (São Paulo, Brazil) by Toxocara spp. eggs. Rev Bras Parasitol Vet. 2012 Jul-Sep;21(3):323-5. Doi: 10.1590/S1984-29612012000300029 [Link] [ Links ]
39 Rubel D, Wisnivesky C. Magnitude and distribution of canine fecal contamination and helminth eggs in two areas of different urban structure, Greater Buenos Aires, Argentina. Vet Parasitol. 2005 Nov;133(4):339-47. Doi: 10.1016/j.vetpar.2005.06.002 [Link] [ Links ]
40 Sommerfelt IE, Cardillo N, López C, Ribicich M, Gallo C, Franco A. Prevalence of Toxocara cati and other parasites in cats' faeces collected from the open spaces of public institutions: Buenos Aires, Argentina. Vet Parasitol. 2006 Sep;140(3-4):296-301. Doi: 10.1016/j.vetpar.2006.03.022 [Link] [ Links ]
41 Oliveira ATG, Silva APPS, Farias CS, Alves MS, Silveira LJD, Farias JAC. Contaminação de ambientes arenosos por helmintos em praças públicas da cidade de Maceió-AL. Rev Semente. 2011;6(6):21-9. [Link] [ Links ]
42 Pedrassani D, Viera AM, Thiem EMB. Contaminação por Toxocara spp. e Ancylostoma spp. em áreas de lazer do município de Canoinhas, SC. Arch Vet Sci. 2008;13(2):110-7. Doi: 10.5380/avs.v13i2.12895 [Link] [ Links ]
44 Brener B, Mattos DPBG, Millar PR, Arashiro EKN, Duque-Ferreira V, Sudré AP. Estudo da contaminação de praças públicas de três municípios do estado do Rio de Janeiro, Brasil, por ovos e larvas de helmintos. Rev Pat Trop. 2008 jul-set;37(3):247-54. Doi: 10.5216/rpt.v37i3.5068 [Link] [ Links ]
43 Loukas A, Hotez PJ, Diemert D, Yazdanbakhsh M, McCarthy JS, Correa-Oliveira R, et al. Hookworm infection. Nat Rev Dis Primers. 2016 Dec;2:16088. Doi: 10.1038/nrdp.2016.88 [Link] [ Links ]
44 Corrêa CAS, Souza FS, Lisbôa RS. Ocorrência de parasitos zoonóticos em fezes de cães de praças públicas do centro da cidade de Manaus, AM. Pubvet. 2015 set;9(9):409-13. [Link] [ Links ]
45 Rocha S, Pinto RMF, Floriano AP, Teixeira LH, Bassili B, Martinez A, et al. Environmental analyses of the parasitic profile found in the sandy soil from the Santos municipality beaches, SP, Brazil. Rev Inst Med Trop S Paulo. 2011 Sep-Oct;53(5):277-81. Doi: 10.1590/S0036-46652011000500007 [Link] [ Links ]
46 Moura MQ, Jeske S, Vieira JN, Corrêa TG, Berne MEA, Villela MM. Frequency of geohelminths in public squares in Pelotas, RS, Brazil. Rev Bras Parasitol Vet. 2013 Jan-Mar;22(1):175-8. Doi: 10.1590/S1984-29612013000100034 [Link] [ Links ]
47 Ribeiro LM, Dracz RM, Mozzer LR, Lima WS. Soil contamination in public squares in Belo Horizonte, Minas Gerais, by canine parasites in different developmental stages. Rev Inst Med Trop S Paulo. 2013 Jul-Aug;55(4):229-31. Doi: 10.1590/S0036-46652013000400002 [Link] [ Links ]
48 Araújo FR, Crocci AJ, Rodrigues RGC, Avalhaes JS, Miyoshi MI, Salgado FP, et al. Contaminação de praças públicas de Campo Grande, Mato Grosso do Sul, Brasil, por ovos de Toxocara e Ancylostoma em fezes de cães. Rev Soc Bras Med Trop. 1999 set-out;32(5):581-3. Doi: 10.1590/S0037-86821999000500017 [Link] [ Links ]
49 Ferreira A, Alho AM, Otero D, Gomes L, Nijsse R, Overgaauw PAM, et al. Urban dog parks as sources of canine parasites: contamination rates and pet owner behaviours in Lisbon, Portugal. J Environ Public Health. 2017 Aug;2017:5984086. Doi: 10.1155/2017/5984086 [Link] [ Links ]
50 Paller VGV, Chavez ERC. Toxocara (Nematoda: Ascaridida) and other soil-transmitted helminth eggs contaminating soils in selected urban and rural areas in the Philippines. Sci World J. 2014 Oct;2014:386232. 51 Doi: 10.1155/2014/386232 [Link] [ Links ]
52 Devera R, Blanco Y, Hernández H, Simoes D. Toxocara spp. and other helminths in squares and parks of Ciudad Bolívar, Bolivar State (Venezuela). Enferm Infecc Microbiol Clin. 2008 Jan;26(1):23-6. Doi: 10.1157/13114391 [Link] [ Links ]
53 Studzińska MB, Demkowska-Kutrzepa M, Borecka A, Meisner M, Tomczuk K, Roczeń-Karczmarz M, et al. Variations in the rate of infestations of dogs with zoonotic nematodes and the contamination of soil in different environments. Int J Environ Res Public Health. 2017 Sep;14(9):E1003. Doi: 0.1016/S0140-6736(17)31930-X [Link] [ Links ]
54 Jourdan PM, Lamberton PHL, Fenwick A, Addiss DG. Soil-transmitted helminth infections. Lancet. 2018 Jan;391(10117):252-65. Doi: 10.1016/S0140-6736(17)31930-X [Link] [ Links ]
55 Chen AA, Mucci JLN. Frequência de contaminação por helmintos em área de recreação infantil de creches no município de Várzea Paulista, São Paulo, Brasil. Rev Patol Trop. 2012 abr-jun;41(2):195-202. Doi: 10.5216/rpt.v41i2.19329 [Link] [ Links ]
56 Miranda PHS, Bezerra WFL, Castro TMBQ, Gonçalves LS. Contaminação do solo de áreas de recreação infantil de creches públicas por Ancylostoma sp. e Toxocara sp. em Teresina-PI. Rev Interd. 2015 out-dez;8(4):93-8. [Link] [ Links ]
57 Mascarenhas JP, Silva DS. Presença de parasitos no solo das áreas de recreação em escolas de educação infantil. J Nurs Health. 2016;1(1):76-82. Doi: 10.15210/JONAH.V6I1.5732 [Link] [ Links ]
58 Souza GM, Barros JA, Vilela VLD. Análise de solos suscetíveis à contaminação parasitológica nas cidades de Arapongas e Apucarana - Paraná. Rev Terra Cult. 2016 jul-dez;32(63):21-9. [Link] [ Links ]
59 Mello CS, Mucci JLN, Cutolo SA. Contaminação parasitária de solo em praças públicas da zona leste de São Paulo, SP - Brasil e a associação com variáveis meteorológicas. Rev Patol Trop. 2011 jul-set;40(3):253-62. Doi: 10.5216/rpt.v40i3.15976 [Link] [ Links ]
60 Parija SC, Chidambaram M, Mandal J. Epidemiology and clinical features of soil-transmitted helminths. Trop Parasitol. 2017 Jul-Dec;7(2):81-5. Doi: 10.4103/tp.TP_27_17 [Link] [ Links ]
61 Bojanich MV, Alonso JM, Caraballo NA, Schöller MI, López MLA, García LM, et al. Assessment of the presence of Toxocara eggs in soils of an arid area in Central-Western Argentina. Rev Inst Med Trop S Paulo. 2015 Jan-Feb;57(1):73-6. Doi: 10.1590/S0036-46652015000100010 [Link] [ Links ]
Recibido: 14 de Diciembre de 2017; Aprobado: 17 de Septiembre de 2018











 text in
text in