INTRODUÇÃO
Existem mais de 1,5 bilhões de pessoas infectadas mundialmente por helmintos transmitidos pelo contato com o solo1. Essas parasitoses são frequentes em áreas tropicais e subtropicais, com os maiores índices registrados nos continentes africano, asiático e latino-americano, tendo em vista que as condições climáticas e de saneamento básico são mais propícias para o desenvolvimento e transmissão das mesmas2,3,4. Além disso, acometem principalmente crianças em idade pré-escolar e escolar que convivem nessas regiões, necessitando de tratamento e intervenções preventivas1,5.
Dentre os helmintos infectantes, as espécies Toxocara cati e Toxocara canis, da família Ascarididae, são responsáveis pelas síndromes larva migrans visceral (LMV) e larva migrans ocular (LMO); e os ancilostomídeos, pertencentes à família Ancylostomidae, principalmente a espécie Ancylostoma braziliense, pela síndrome larva migrans cutânea (LMC)6,7. Os parasitos causadores dessas síndromes desenvolvem-se somente nos cães e gatos, que são seus hospedeiros definitivos naturais e, ao contaminarem o ser humano, não conseguem completar seu ciclo evolutivo, vagando sem rumo sobre as camadas superficiais da pele ou pelas vísceras, desencadeando uma resposta inflamatória focal6,8.
Essas parasitoses são consideradas doenças tropicais negligenciadas pela Organização Mundial da Saúde (OMS)9,10. Estima-se que 50 milhões de pessoas estejam infectadas por ancilostomídeos e aproximadamente 65% desses casos ocorram no Brasil9. Em estudo realizado no estado do Piauí11, 14,1% de 298 pessoas examinadas estavam infectadas por ancilostomídeos. Ferraz et al.12 identificaram 3,45% da população de Macapá, no estado do Amapá, infectada por ancilostomídeos. Sabe-se também que a toxocaríase e a estrongiloidíase são endêmicas no país9,10.
A síndrome LMC é uma zoonose desencadeada pelas larvas filarioides dos Ancylostoma braziliense, Ancylostoma caninum e, mais raramente, do Strongyloides stercoralis13,14. A transmissão desses parasitos ocorre na epiderme no momento em que a pele entra em contato com o solo contaminado pelas fezes de animais contendo larvas. Após infectar o ser humano, as mesmas fazem trajetos sinuosos na pele, desencadeando um processo inflamatório local. Pelo fato de permanecerem confinadas a epiderme e deixarem atrás de si um rastro sinuoso, a patologia é comumente conhecida como "bicho geográfico". Os locais do corpo com maior afinidade para a penetração das larvas são pés, pernas, nádegas e mãos8,15.
Em contrapartida, as larvas que afetam vísceras e olhos causam as síndromes LMV e LMO, respectivamente16. Essas infecções são causadas pela ingestão de ovos larvados de T. canis e, em menor quantidade, de T. cati em alimentos ou solos contaminados. A defecação de cães e gatos, em áreas públicas, é uma das formas que contribui para a contaminação do ambiente17. Após a ingestão do ovo, as larvas eclodem no intestino e migram para diversas vísceras, como fígado, cérebro, pulmões e olhos, desencadeando alterações locais17,18.
O contato da população com esses parasitos é constante, pois o aumento na taxa das populações canina e felina que frequentam o mesmo ambiente dos humanos é crescente19. Segundo o Instituto Brasileiro de Geografia e Estatística (IBGE)20, em 2013, cerca de 45% da população braseira possuía pelo menos um cachorro em seu domicílio e aproximadamente 18% tinha pelo menos um gato em sua casa. Nas áreas urbanas, os animais de companhia dividem espaços limitados (parques e praças pública) com outros animais errantes ou de companhia, fato que aumenta a possibilidade de transmissão e disseminação dos parasitos causadores da LMC e LMV21.
Essas parasitoses acometem principalmente crianças, por estarem em maior contato com solos arenosos contaminados onde coabitam o ser humano, cães e gatos. Tendo em vista que esses animais defecam no solo de áreas públicas e caixas de areia das creches, os mesmos representam grave risco para a saúde humana, principalmente das crianças1,22,23,24.
Devido à importância epidemiológica dessas doenças e como, na cidade de Redenção, estado do Pará, há muitos animais domésticos e de rua compartilhando espaços com crianças e adultos, o presente estudo objetivou identificar a prevalência de LMC e LMV em solos de parques públicos desse município.
MATERIAIS E MÉTODOS
Trata-se de um estudo do tipo descritivo com abordagem quantitativa25. A pesquisa foi desenvolvida nos parques públicos de Redenção, situada na região sul do Estado, com população estimada em 82.464 habitantes e área de 3.823.809 km2, distante 1.018 km da capital Belém26. O clima é equatorial superúmido, tipo Am da classificação de Köppen-Geiger, no limite da transição para o Aw, com temperatura média anual de 25,35 oC, com máxima de 32,01 oC e mínima de 22,71 oC26.
A avaliação do solo nos parques públicos foi realizada entre fevereiro e junho de 2017. As amostras foram obtidas em cinco parques da cidade, localizados nos seguintes setores: Alto Paraná, Vila Paulista, Jardim Primavera, Santos Drumont e Centro (parques I a V, respectivamente). Esses parques foram selecionados levando-se em consideração aspectos como localização (periferia e centro), maior frequência de visitação e presença de locais de recreação sem cercado ou com o mesmo danificado.
Antes da realização das coletas, foram retirados os excessos de sujeiras sobre a areia, para facilitar a visualização das estruturas pesquisadas. As coletas foram realizadas com uma espátula de metal, introduzida no solo com um ângulo de 45° até atingir a profundidade de aproximadamente 10 cm. Ao fim de cada procedimento, foi feita a assepsia da espátula com álcool a 70%, para não haver qualquer interferência ou alteração do resultado da próxima amostra. O tempo entre a coleta e a análise não ultrapassou 24 h27.
As amostras de solos foram coletadas de forma padronizada em cinco diferentes pontos de cada parque, nas extremidades superior (N = 2) e inferior (N = 2) e no meio (N = 1), totalizando 25 amostras. Foram retiradas aproximadamente 60 g da camada superficial do solo em cada ponto de coleta. O material coletado foi transportado para o Laboratório de Parasitologia da Faculdade de Ensino Superior da Amazônia Reunida, em uma caixa isotérmica para transporte de amostras biológicas e dentro de potes coletores devidamente identificados.
As análises das amostras foram realizadas pelas técnicas de sedimentação espontânea (Hoffman, Pons e Janer)28 e centrífugo-flutuação (Faust et al.)29, adaptadas para a pesquisa em solos arenosos30. Foram consideradas positivas as amostras que apresentaram ovos e larvas de ancilostomídeos, larvas de S. stercoralis e ovos de Toxocara spp.31.
Os dados foram tabulados no software Microsoft Office Excel 2016. A análise estatística foi descritiva, utilizando distribuições absolutas.
RESULTADOS
Do total de amostras dos cinco parques de Redenção, 80,0% (N = 4) foram positivas para a presença de ovos e larvas de ancilostomídeos, ovos de Toxocara spp. e larvas de S. stercoralis entre fevereiro e junho de 2017 (Tabela 1).
Tabela 1 - Total de parasitos causadores de larvas migrans encontrados nos parques do município de Redenção, estado do Pará, Brasil, fevereiro e junho de 2017
| Parques | Amostras | LMC | LMV | Total | |||
|---|---|---|---|---|---|---|---|
| N | % | N | % | N | % | ||
| I | 1 | 2 | 5,5 | 2 | 5,5 | 8 | 22,2 |
| 2 | 1 | 2,8 | - | - | |||
| 3 | 1 | 2,8 | 1 | 2,8 | |||
| 4 | - | - | 1 | 2,8 | |||
| 5 | - | - | - | - | |||
| II | 1 | - | - | - | - | 6 | 16,7 |
| 2 | - | - | 1 | 2,8 | |||
| 3 | 1 | 2,8 | - | - | |||
| 4 | - | - | 1 | 2,8 | |||
| 5 | 2 | 5,5 | 1 | 2,8 | |||
| III | 1 | 2 | 5,5 | - | - | 9 | 25,0 |
| 2 | 1 | 2,8 | - | - | |||
| 3 | 2 | 5,5 | 1 | 2,8 | |||
| 4 | 2 | 5,5 | 1 | 2,8 | |||
| 5 | - | - | - | - | |||
| IV | 1 | 5 | 13,9 | - | - | 13 | 36,1 |
| 2 | - | - | - | - | |||
| 3 | 3 | 8,4 | 1 | 2,8 | |||
| 4 | 4 | 11,1 | - | - | |||
| 5 | - | - | - | - | |||
| V | 1 | - | - | - | - | - | - |
| 2 | - | - | - | - | |||
| 3 | - | - | - | - | |||
| 4 | - | - | - | - | |||
| 5 | - | - | - | - | |||
| Total | 26 | 72,1 | 10 | 27,9 | 36 | 100,0 | |
LMC: larva migrans cutânea; LMV: larva migrans visceral; Sinal convencional utilizado: - dado numérico igual a zero, não resultante de arredondamento; N: número absoluto dos dados; %: percentual dos dados.
Foram encontradas 36 formas parasitárias causadoras de LMC e LMV (Tabela 1); desse total, 26 (72,1%) eram ovos e larvas de ancilostomídeos e larvas de S. stercoralis, e os 10 restantes (27,9%), ovos de Toxocara spp. Observou-se que os parques III e IV, localizados na periferia da cidade, apresentaram positividade para LMC de 52,7% (N = 19) em relação aos outros três (19,4%; N = 7). Por sua vez, o encontro de Toxocara spp., nos cinco parques, não apresentou diferença significativa. No parque central (parque V) não foi encontrado qualquer parasito (Tabela 1).
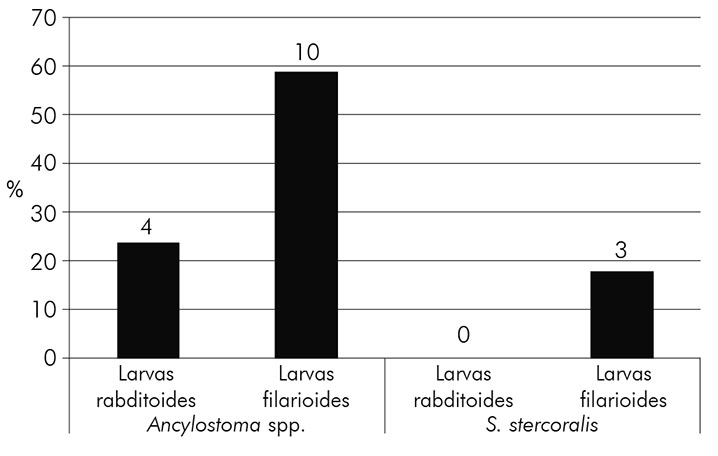
Observou-se uma porcentagem maior de larvas de ancilostomídeos (53,8%; N = 14) em relação aos demais parasitos causadores de LMC (Figura 1). Além disso, foi detectada uma maior predominância de larvas filarioides de ancilostomídeos (58,8%; N = 10) em relação às rabditoides (23,5%; N = 4) (Figura 2).
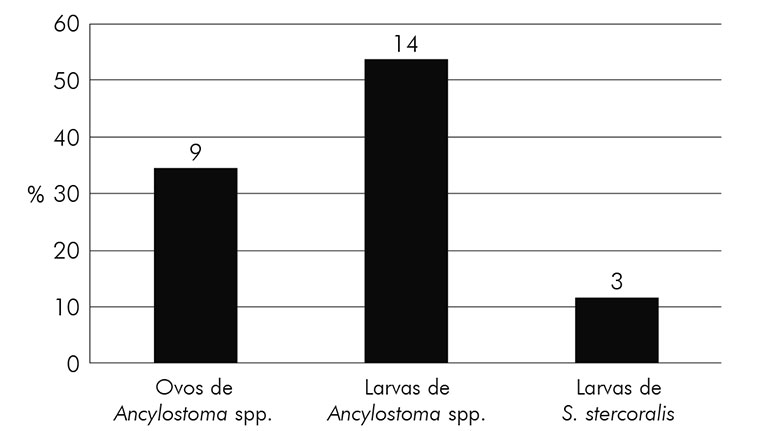
Figura 1 - Porcentagem de estruturas parasitárias causadoras de larva migrans cutânea encontradas nos parques do município de Redenção, estado do Pará, Brasil, fevereiro e junho de 2017
DISCUSSÃO
Os solos de parques públicos são as principais rotas de transmissão das zoonoses, como as LMC e LMV, causadas por ancilostomídeos e Toxocara spp., respectivamente32. Essa realidade é um alerta para as autoridades e profissionais de saúde pública, pois tem havido visível aumento das populações canina e felina entre os seres humanos nos últimos anos, aumentando assim as chances de transmissão de diferentes zoonoses33,34,35.
Os dados obtidos neste trabalho demonstraram que essa contaminação também está presente em Redenção. Os parques III e IV, localizados na periferia da cidade, apresentaram uma porcentagem maior de parasitos causadores de LMC (52,7%) em relação aos demais (19,4%). Mas, em todas as amostras do parque V, não foi encontrado qualquer parasito, talvez por estar completamente cercado, não permitindo o acesso de animais nesse ambiente. Isso demonstra que, nas regiões periféricas da cidade, há uma maior contaminação do solo em relação ao centro, provavelmente pela intervenção pública ser mais direcionada às regiões centrais, por meio de limpeza, manutenção, presença de lixeiras e aceso controlado pelo uso de cercas24,36. Nesse contexto, as áreas periféricas oferecem melhores condições para a ocorrência desses helmintos37.
A diminuição de parasitos, em regiões centrais da cidade, também é relatada por Marques et al.32 e Santarém et al.38. Isso pode ocorrer porque a densidade populacional canina varia de região para região, especialmente cães de rua. Por outro lado, nesses ambientes públicos onde é permitido o acesso de animais, pode ocorrer a transmissão de ovos e larvas para o ambiente pelas fezes e, assim, gerar riscos para a população39,40.
Por sua vez, a maior predominância de LMC, nos parques periféricos, também pode estar relacionada ao contato dos animais de rua com essas regiões e por esses parasitos serem geo-helmitos36. Porém, a literatura tem mostrado oscilações desse parâmetro em diversas regiões brasileiras32,41,42, demonstrando a necessidade de estudos regionais, levando em consideração o tipo de solo, o clima e a população de animais errantes43.
No presente trabalho, verificou-se uma elevada taxa de ovos e larvas de ancilostomídeos e larvas de S. stercoralis (72,1%) em comparação com ovos de Toxocara spp. (27,9%). Essa diferença está relacionada à necessidade dos ancilostomídeos e do S. stercoralis carecerem de solo arenoso, sombreado e úmido para a continuação do seu ciclo, sendo esse ambiente o habitat das larvas44. Em contrapartida, os ovos de Toxocara spp. não apresentam a obrigatoriedade de solo arenoso, necessitando apenas de umidade, temperatura favorável e oxigenação para o seu desenvolvimento8.
No cenário nacional, uma porcentagem semelhante foi encontrada por Corrêa et al.45 no solo de praças da cidade de Manaus, estado do Amazonas, constatando que 67,3% das amostras estavam parasitadas por ovos de ancilostomídeos e 4,8% por ovos de Toxocara spp. Em três municípios do estado do Rio de Janeiro43, também foi encontrada a contaminação de solo por ancilostomídeos superior (26,7%) a de Toxocara spp. (3,3%). Além disso, pode-se observar que o cenário se repete em outras cidades brasileiras, por exemplo, em Santos, estado de São Paulo46, Pelotas, estado do Rio Grande do Sul47, Belo Horizonte, estado de Minas Gerais48, Campo Grande, estado do Mato Grosso do Sul49, e Curitiba, estado do Paraná24.
Por outro lado, no panorama mundial, a ocorrência de agentes transmissores de LMC e LMV oscila de acordo com o país. Por exemplo, em Lisboa, Portugal50, 55,6% das amostras de solo estavam contaminadas com ovos de ancilostomídeos; em Laguna, Filipinas51, 7,0% das amostras apresentaram-se positivas para esses parasitos e 77,7% para ovos de Toxocara spp.; em Bolivar, Venezuela52, 1,3% das amostras de solo continham ovos de ancilostomídeos e 25% ovos de Toxocara spp.; e em Lublin, Polônia53, 54,3% apresentaram-se positivas para ancilostomídeos e Toxocara spp.
Dentre as estruturas parasitárias causadoras de LMC, as larvas de ancilostomídeos (53,8%) obtiveram uma taxa maior nesta pesquisa. Esse dado pode ser comparado ao estudo de Brener et al.43, que encontraram 56,7% de larvas de ancilostomídeos em solos de praças públicas e ao de Rocha et al.46 que identificaram 82,5% de larvas de ancilostomídeos em solos praianos. Isso demonstra que os locais arenosos são propícios ao embrionamento, desenvolvimento e sobrevivência das larvas, consequentemente apresentando uma condição ideal de contaminação humana54.
Além disso, Chen e Mucci55 afirmaram que cerca dos 50% dos estabelecimentos públicos apresentam riscos para as crianças por terem areia contaminada por larvas de ancilostomídeos, corroborando os dados da presente pesquisa. Resultados semelhantes e superiores também foram encontrados nos estados do Tocantins (100%)56 e Rio Grande do Sul (52%)57.
As doenças causadas por esses nematódeos são mais prevalentes em ambientes de clima tropical e subtropical, como no Brasil. Outro ponto de destaque é que tipo de solo, temperatura, ambiente e umidade são os principais fatores que determinam o tempo necessário para completarem seu ciclo1,2,9. Por fim, as condições precárias de saneamento básico, o baixo nível socioeconômico e cultural e a pouca informação vêm favorecendo a disseminação dessas infecções parasitárias58,59.
Em relação às fases evolutivas das larvas, foi possível observar uma frequência maior do tipo filarioide de ancilostomídeos (58,8%). A maior quantidade de larvas nesse estágio pode ser explicada pelo próprio ciclo evolutivo dos parasitos, uma vez que essa é a última muda larvária realizada no solo antes da infecção de um novo hospedeiro6. Esse dado torna-se relevante, pois larvas filarioides são as formas de transmissão, e o contato com o solo contaminado permite a infecção no homem e a instalação da doença6,60.
Vale ressaltar que diversas pesquisas são realizadas para a identificação de parasitos causadores de LMC e LMV, e diferentes resultados podem ser atribuídos à diversidade das técnicas laboratoriais, aos procedimentos de coleta e às condições climáticas, epidemiológicas, socioeconômicas e culturais de cada região58. Desse modo, é importante um consenso para padronizar os métodos laboratoriais e de coleta de solo, tornando os resultados mais compatíveis entre as diferentes regiões do país e do mundo61.
CONCLUSÃO
As síndromes LMC e LMV representam um problema de saúde pública para a cidade de Redenção, existindo uma grande possibilidade de transmissão entre as populações canina, felina e humana. Para melhorar esse parâmetro sanitário, é necessário realizar programas educacionais, para a conscientização sobre a importância da erradicação desses parasitos por meio de tratamento dos animais, medidas de restrição física dos parques e melhoria das condições de saneamento básico. Paralelo a isso, é importante a participação dos gestores na definição de políticas públicas, objetivando o controle dessas e de outras parasitoses.











 texto en
texto en