Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude vol.10 Ananindeua 2019 Epub 16-Set-2019
http://dx.doi.org/10.5123/s2176-6223201900041
ARTÍCULO ORIGINAL
Consumo de antimicrobianos y el impacto en la resistencia bacteriana en un hospital público del estado de Pará, Brasil, de 2012 a 2016
1 Universidade do Estado do Pará, Belém, Pará, Brasil
2 Universidade Federal do Pará, Faculdade de Medicina, Instituto de Ciências da Saúde, Belém, Pará, Brasil
3 Centro Universitário do Estado do Pará, Belém, Pará, Brasil
OBJETIVO:
Evaluar el perfil de consumo de antimicrobianos y su impacto en la resistencia bacteriana en un hospital universitario del estado de Pará, Región Norte de Brasil, entre 2012 y 2016.
MATERIALES Y MÉTODOS:
Fueron seleccionados 279 hemocultivos de pacientes adultos, de ambos sexos, internados en enfermerías y en el Centro de Terapia Intensiva (CTI), para posterior análisis de los resultados de cultivos de especímenes clínicos.
RESULTADOS:
Las infecciones primarias de corriente sanguínea representaron el 60,2% del total. Los bacilos Gram negativos (BGN) fueron los microorganismos más frecuentes (51,3%), de los cuales los fermentadores se mostraron resistentes a la ceftazidima (83,0%) y a la cefepima (76,1%). La resistencia del Staphylococcus aureus a la clindamicina y a la oxacilina alcanzó 57,4% y 48,9%, respectivamente. Hubo reducción, estadísticamente significativa, del consumo global de piperacilina + tazobactam y de vancomicina. En el CTI, se observó la reducción del consumo de ceftriaxona, oxacilina, piperacilina + tazobactam y vancomicina y el aumento del consumo de amikacina ye meropenem (todos estadísticamente significativos). Los BGN fermentadores y el S. aureus presentaron correlación positiva y no linear entre el aumento del porcentual de resistencia y el consumo de cefepima y oxacilina, respectivamente.
CONCLUSIÓN:
El consumo de antimicrobianos y el impacto en la resistencia bacteriana variaron durante el período analizado, destacándose la correlación positiva y no linear entre el aumento del consumo de cefepima y oxacilina y el recrudecimiento de las cepas de BGN fermentadores ye S. aureus resistentes, respectivamente.
Palabras clave: Utilización de Medicamentos; Farmacorresistencia Bacteriana Múltiple; Antiinfecciosos
INTRODUCCIÓN
Los antimicrobianos son sustancias de origen natural o sintético que actúan sobre los microorganismos al inhibir su crecimiento o causar su destrucción, y se usan de manera profiláctica y/o terapéutica, lo que constituye un avance farmacológico de suma importancia y amplio uso1.
El consumo de antimicrobianos se puede evaluar por varios métodos. La Organización Mundial de la Salud recomienda la clasificación Anatómica, Terapéutica y Química (ATC), que junto con la Dosis Diaria Definida (DDD), forman el sistema ATC/DDD, una medida internacional cuyo objetivo es determinar el consumo real en el ambiente hospitalario, además de establecer un perfil para el uso de fármacos y permitir comparaciones entre diferentes instituciones. La DDD es la dosis promedio de mantenimiento diaria de un medicamento en su indicación principal, en pacientes adultos, con 70 Kg., por vía de administración, expresada en cantidad de ingrediente activo2,3.
El uso indiscriminado de antimicrobianos contribuye al desarrollo de la resistencia bacteriana. Además, el abuso de estas drogas puede originar bacterias resistentes a múltiples fármacos, definidas como aquellas que no son susceptibles, como mínimo, a un agente en tres o más categorías de antimicrobianos4,5.
La búsqueda de mejores resultados, para tratar de controlar el consumo de estos medicamentos, se realiza a través de programas para racionalizar el uso de antimicrobianos, como Antimicrobial Stewardship, definido por las sociedades estadounidenses Infectious Diseases Society of America, Society for Healthcare Epidemiology of America y Sociedad de Enfermedades Infecciosas Pediátricas como intervenciones coordinadas destinadas a mejorar y cuantificar el uso apropiado de antimicrobianos mediante la elección del mejor régimen antibiótico. Entre los beneficios, destacamos la mejor evolución del paciente, la reducción de eventos adversos, la mejora de las tasas de susceptibilidad a los antimicrobianos elegidos y la optimización del uso de los recursos6.
Por lo tanto, para optimizar el control de las infecciones relacionadas a la asistencia a la salud (IRAS), el objetivo fue determinar el perfil de consumo de antimicrobianos y su impacto en la resistencia bacteriana en el Hospital Universitario João de Barros Barreto (HUJBB), en Belém, estado de Pará, Brasil, de 2012 a 2016.
MATERIALES Y MÉTODOS
Se respetaron los preceptos de la Declaración de Helsinki y el Código de Nuremberg, así como las normas de investigación involucrando a seres humanos previstas en la Resolución n° 466/12 del Consejo Nacional de Salud, después de la aprobación del proyecto por el Comité de Ética de Investigación del HUJBB, vía Plataforma Brasil, mediante el informe n° 1.852.513, de 6 de diciembre de 2016.
Se realizó un estudio de observación y transversal de enero a abril de 2017. Las informaciones pertinentes (género y rango de edad de los pacientes y topografía de la infección) se compilaron de las fichas que se refieren a las IRAs bacterianas, en un protocolo propio. Para realizar el análisis estadístico de naturaleza analítica, los datos encontrados se sometieron a las pruebas de Chi cuadrado de adherencia, independencia y partición y ANOVA, utilizando el software BioEstat® v5.3, adoptando un nivel de significancia de α = 0.05 o 5% para la toma de decisiones.
Se incluyó un total de 279 hemocultivos positivos que se refieren a las IRAs bacterianas (en total) en pacientes adultos en enfermerías (Medicina interna, Clínica quirúrgica, Neumología y Enfermedades Infecciosas y Parasitarias) y en el Centro de Terapia Intensiva (UTI) del local del estudio entre 2012 y 2016. Se excluyeron los registros de pacientes pediátricos, ya que la definición de DDD no se aplica a ellos, de pacientes con infecciones comunitarias y/o no bacterianas y cuyos datos eran incompletos y/o incomprensibles. Se incluyeron cocos Gram positivos y bacilos Gram negativos (BGN) fermentadores y no fermentadores.
Las bacterias se clasificaron según el perfil de sensibilidad a los antimicrobianos, en "sensibles" y "resistentes", por métodos de difusión en disco y gradiente de difusión y automatizados (Vitek®). Con respecto a la topografía de la infección, se consideraron los siguientes: infección primaria de la corriente sanguínea (IPCS), infección secundaria de la corriente sanguínea (ISCS), infección del tracto respiratorio (ITR), infección de piel y partes blandas (IPPM), infección abdominal (IABD) y endocarditis: los tres últimos se incluyeron en la variable "Otros", debido a su baja prevalencia.
Se eligieron los 20 antimicrobianos más utilizados para el tratamiento de infecciones causadas por los patógenos seleccionados, considerando solo sus presentaciones parenterales: amikacina, ampicilina, ampicilina + sulbactam, cefepima, ceftazidima, ceftriaxona, ciprofloxacina, clindamicina, colistina, ertapenem, imipenem, linezolid, meropenem, oxacilina, piperacilina + tazobactam, polimixina B, sulfametoxazol + trimetoprima, tigeciclina, vancomicina. Para medir el perfil de consumo, se calculó el DDD/100 camas/año utilizando la fórmula proporcionada por la Agencia Nacional de Vigilancia Sanitaria (ANVISA): DDD/100 camas/año = Ax100/BxP, donde: A = cantidad total de medicamento consumido en el período de tiempo considerado (en UI o g); B = DDD establecido para el medicamento; y P = número de días-paciente en el mismo período considerado. En los cálculos, los valores DDD establecidos para cada medicamento se usaron de acuerdo con el Índice ATC/DDD 20177.
Los valores que se refieren a la cantidad total de medicamentos consumidos se obtuvieron a través de los informes anuales de dispensación de medicamentos, producidos por la Farmacia del HUJBB. Para la comparación entre el consumo de antimicrobianos y su impacto en la resistencia bacteriana, los datos obtenidos se muestran en gráficos y la información se analiza para verificar si estas variables experimentaron cambios similares.
La División de Archivo Médico y Estadística proporcionó el número de pacientes/día en las salas. En relación con la CTI, las cifras de 2012 y 2013 fueron proporcionadas por el propio sector; en los años siguientes, por la Comisión de Control de Infección Hospitalaria. El número de pacientes/día se calcula utilizando la fórmula: Nº paciente/día = O x N x T, donde O = índice de ocupación de cama (número de camas ocupadas/número total de camas), N = número de camas disponibles y T = período (en días).
RESULTADOS
En el período del estudio, se realizaron 505 hemocultivos en el HUJBB. Después de la aplicación de los criterios de inclusión y exclusión, se evaluaron los datos de 279 hemocultivos.
Al analizar la topografía de las infecciones (Tabla 1), las IPCS fueron las más prevalentes (p < 0,0001), respondiendo por 168 casos (60,2%), seguidas por ISCS e ITR, con 17,2% cada.
Tabla 1 - Distribución de los aislados de hemocultivos realizados en el HUJBB, en el período de 2012 a 2016, según el género y el grupo de edad del paciente y la topografía de la infección
| Variables | Distribución de frecuencia | |
|---|---|---|
| N | % | |
| Género* | ||
| Femenino | 145 | 52,0 |
| Masculino | 134 | 48,0 |
| Grupo edad (años)† | ||
| < 40 | 75 | 26,9 |
| 40 a 59 | 81 | 29,0 |
| 60 a 79 | 87§ | 31,2 |
| ≥ 80 | 36 | 12,9 |
| Topografía‡ | ||
| Infección primaria de corriente sanguínea | 168§ | 60,2 |
| Infección secundaria de corriente sanguínea | 48 | 17,2 |
| Infección del tracto respiratorio | 48 | 17,2 |
| Otras | 15 | 5,4 |
| Total | 279 | 100,0 |
* p > 0,05 (p = 0,5522, prueba Chi cuadrado de adherencia); †p ≤ 0,05 (p < 0,001, prueba Chi cuadrado de adherencia); ‡p ≤ 0,05 (p < 0,0001, prueba Chi cuadrado de partición); § Estadísticamente significativo.
Los BGN fueron los más prevalentes (143; 51,3%) (p = 0,7149), con predominio de cepas fermentadoras (88; 31,6%), las más frecuentes Klebsiella spp. (18,3%) (Klebsiella pneumoniae y Klebsiella oxytoca) y Escherichia coli (6,8%). Con relación a los no fermentadores (55; 19,7%), los más frecuentes fueron Pseudomonas aeruginosa (6,8%) y Acinetobacter spp. (6,5%) (Tabla 2).
Tabla 2 - Distribución de los aislados de hemocultivos realizados en el HUJBB, en el período de 2012 a 2016, según la especie aislada
| Especies | Frecuencia | |
|---|---|---|
| N | % | |
| Cocos Gram positivos | ||
| Staphylococcus aureus | 47 | 16,8 |
| Staphylococcus spp. coagulase-negativa | 56* | 20,1 |
| Staphylococcus epidermidis | 23 | 8,2 |
| Enterococcus spp. | 10 | 3,6 |
| Bacilos Gram negativos | ||
| Enterobacter spp.† | 10 | 3,6 |
| Escherichia coli † | 19 | 6,8 |
| Klebsiella spp.† | 51 | 18,3 |
| Proteus mirabilis † | 2 | 0,7 |
| Serratia marcescens † | 6 | 2,1 |
| Acinetobacter spp.‡ | 18 | 6,5 |
| Complexo Burkholderia cepacia ‡ | 10 | 3,6 |
| Elizabethkingia meningoseptica ‡ | 1 | 0,4 |
| Pseudomonas aeruginosa ‡ | 19 | 6,8 |
| Stenotrophomonas maltophilia ‡ | 6 | 2,1 |
| Sphingomonas paucimobilis ‡ | 1 | 0,4 |
| Total | 279 | 100,0 |
p ≤ 0,05 (p < 0,0001, prueba Chi cuadrado de partición); * Estadísticamente significativa; † Fermentadores; ‡ No fermentadores.
Entre los cocos Gram positivos (136; 48,7%) (Tabla 2), predominaron los Staphylococcus spp. coagulasa-negativa (20,1%), siendo Staphylococcus hominis y Staphylococcus haemolyticus los más frecuentes.
En el análisis del consumo global del HUJBB en DDD/100 camas/año (Tabla 3), se notó una disminución del uso de los betalactámicos entre 2012 y 2016, fue estadísticamente significativa la reducción del consumo de piperacilina + tazobactam (p = 0,0492). También fue estadísticamente significativa la disminución del consumo del glicopéptido vancomicina (p = 0,0398).
Tabla 3 - DDD/100 camas/año global de los antimicrobianos pesquisados en el HUJBB de 2012 a 2016
| Medicamento | DDD/100 pacientes/año | p-valor | ||||
|---|---|---|---|---|---|---|
| 2012 | 2013 | 2014 | 2015 | 2016 | ||
| Amicacina | 1,07 | 1,76 | 1,63 | 0,64 | 1,83 | 0,3977 |
| Ampicilina | 0,16 | 0,13 | 0,06 | 0,05 | 0,01 | 0,7749 |
| Ampicilina + sulbactam | 0,14 | 0,04 | - | - | 0,13 | 0,6344 |
| Cefepima | 15,29 | 5,32 | 3,11 | 15,30 | 19,02 | 0,3977 |
| Ceftazidima | 2,78 | 3,68 | 2,51 | 2,52 | 2,05 | 0,7802 |
| Ceftriaxona | 12,78 | 10,71 | 13,14 | 12,88 | 13,29 | 0,8922 |
| Ciprofloxacino | 3,82 | 3,33 | 3,04 | 3,98 | 3,96 | 0,6979 |
| Clindamicina | 4,91 | 3,54 | 3,15 | 3,88 | 5,43 | 0,4459 |
| Colistina | 0,01 | - | - | - | 0,46 | 0,9838 |
| Ertapeném | 0,39 | 0,62 | 1,00 | 0,35 | 0,34 | 0,5677 |
| Gentamicina | 0,27 | 0,12 | 0,14 | 0,18 | 0,24 | 0,7828 |
| Imipeném | 4,14 | 5,14 | 6,22 | 4,99 | 3,79 | 0,4998 |
| Linezolida | 0,12 | 0,09 | 0,21 | 0,08 | 0,06 | 0,5678 |
| Meropeném | 0,50 | 1,02 | 0,78 | 0,68 | 0,54 | 0,8188 |
| Oxacilina | 20,68 | 13,87 | 18,40 | 15,66 | 13,83 | 0,6689 |
| Piperacilina + tazobactam | 7,03 | 5,99 | 3,96 | 3,48 | 3,31 | 0,0492* |
| Polimixina B | 0,28 | 0,19 | 0,40 | 0,45 | 0,35 | 0,8566 |
| Sulfametoxazol + trimetoprim | 3,03 | 4,32 | 3,98 | 4,72 | 4,31 | 0,7623 |
| Tigeciclina | 0,02 | - | 0,05 | 0,11 | 0,06 | 0,8988 |
| Vancomicina | 4,47 | 3,38 | 3,30 | 3,41 | 2,50 | 0,0398* |
* Estadísticamente significativo: p ≤ 0,05 (ANOVA - una elección). Señal convencional utilizada: - Dato numérico igual a cero, no resultante de redondeo.
En lo que dice al consumo en la UTI del HUJBB, en DDD/100 camas/año (Tabla 4), también hubo reducción estadísticamente significativa del consumo de piperacilina + tazobactam (p = 0,0185) y de vancomicina (p = 0,0395), bien como de ceftriaxona (p = 0,0324) y de oxacilina (p = 0,0063). Además, en la UTI, hubo un aumento de los consumos de amikacina (p = 0,0221) y meropenem (p = 0,0348).
Tabla 4 - DDD/100 camas/año de los antimicrobianos investigados en la UTI del HUJBB de 2012 a 2016
| Medicamento | DDD/100 pacientes/año | p-valor | ||||
|---|---|---|---|---|---|---|
| 2012 | 2013 | 2014 | 2015 | 2016 | ||
| Amicacina | 1,64 | 5,30 | 5,42 | 3,86 | 5,44 | 0,0221* |
| Ampicilina | 1,29 | - | - | - | - | 0,9987 |
| Ampicilina + sulbactam | - | 0,89 | - | - | 0,22 | 0,8997 |
| Cefepima | 35,52 | 9,19 | 5,92 | 18,72 | 28,37 | 0,4329 |
| Ceftazidima | 2,35 | 1,46 | 2,55 | 2,55 | 1,14 | 0,7876 |
| Ceftriaxona | 22,31 | 11,74 | 13,48 | 10,25 | 11,28 | 0,0324* |
| Ciprofloxacino | 13,52 | 12,23 | 7,67 | 13,52 | 8,82 | 0,5466 |
| Clindamicina | 6,42 | 2,99 | 4,13 | 1,89 | 6,49 | 0,9234 |
| Colistina | 0,16 | - | - | - | 8,82 | 0,0123* |
| Ertapeném | 2,37 | 1,14 | 1,91 | 1,73 | 0,37 | 0,3566 |
| Gentamicina | 1,74 | 1,35 | 0,43 | 2,49 | 2,76 | 0,7867 |
| Imipeném | 24,63 | 27,67 | 31,99 | 35,48 | 24,50 | 0,8897 |
| Linezolida | 1,04 | 0,84 | 2,49 | 0,09 | 0,28 | 0,8873 |
| Meropeném | 3,52 | 6,32 | 7,45 | 4,38 | 8,15 | 0,0348* |
| Oxacilina | 26,54 | 5,92 | 26,82 | 5,40 | 12,27 | 0,0063* |
| Piperacilina + tazobactam | 27,55 | 18,69 | 16,80 | 11,71 | 12,26 | 0,0185* |
| Polimixina B | 1,26 | 1,91 | 6,37 | 7,01 | 3,46 | 0,6578 |
| Sulfametoxazol + trimetoprim | 19,91 | 15,32 | 15,52 | 25,52 | 23,12 | 0,0784 |
| Tigeciclina | 0,40 | - | 0,72 | 1,51 | 0,41 | 0,8874 |
| Vancomicina | 32,90 | 24,44 | 27,02 | 28,05 | 22,51 | 0,0395* |
* Estadísticamente significativo: p ≤ 0,05 (ANOVA - una elección). Señal convencional utilizada: - Dato numérico igual a cero, no resultante de redondeo.
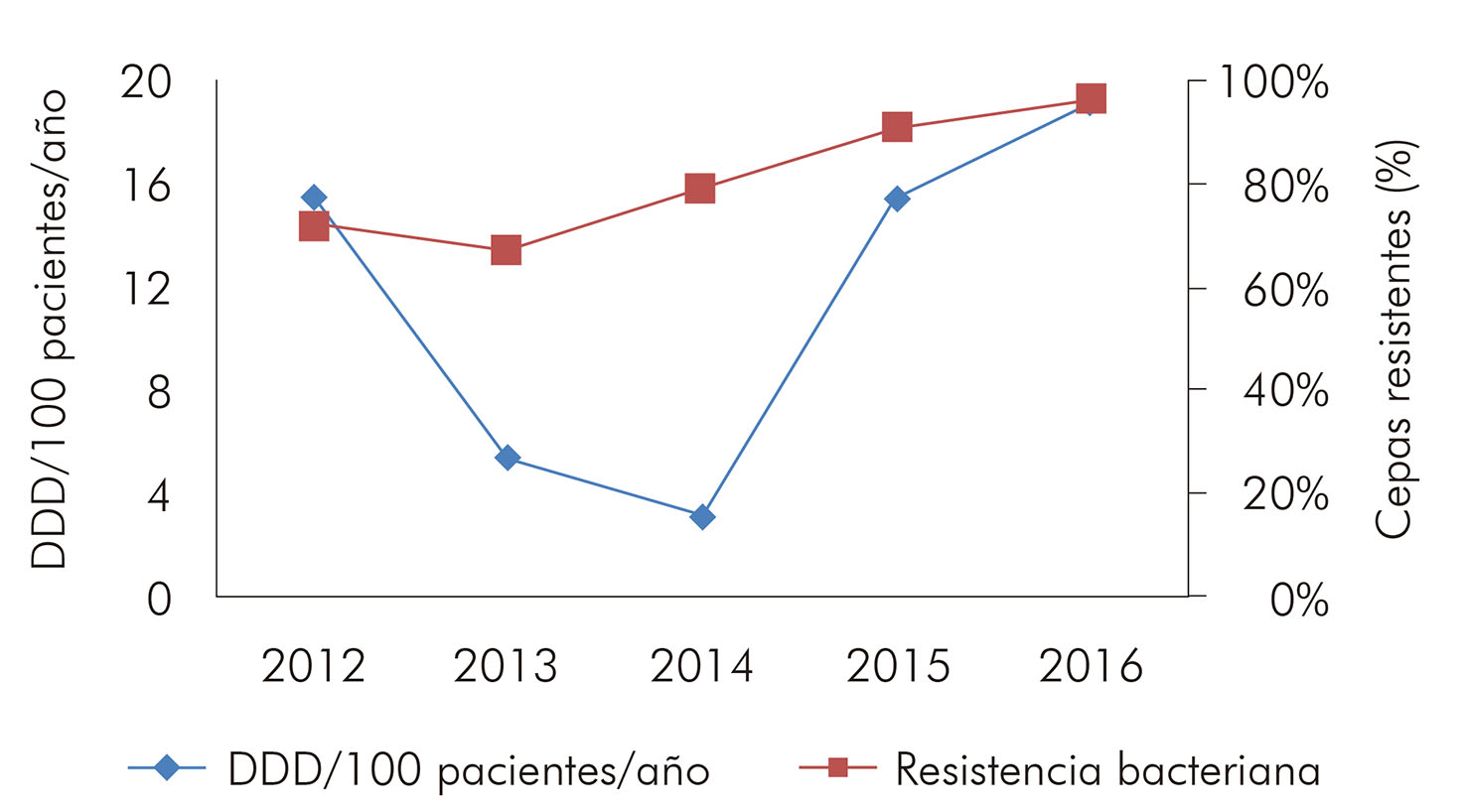
Las cepas de Staphylococcus aureus encontradas presentaron elevados índices de resistencia a la clindamicina (57,4%) y niveles decrecientes de resistencia a la oxacilina a lo largo del tiempo (Tabla 5). Al correlacionar el consumo de oxacilina al perfil de resistencia de esos microorganismos, se notó, entre 2012 y 2015, un estándar positivo y no linear (las alteraciones en el consumo conduciendo a alteraciones semejantes en el perfil de resistencia) (Figura 1).
Tabla 5 - Perfil de resistencia de los aislados de hemocultivos realizados en el HUJBB, de 2012 a 2016, positivos para S. aureus, conforme el año
| Medicamento | Staphylococcus aureus (N=47) | Total | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2012 (N=5) | 2013 (N=7) | 2014 (N=19) | 2015 (N=4) | 2016 (N=12) | ||||||||
| N | % | N | % | N | % | N | % | N | % | N | % | |
| Oxacilina | 3 | 60,0 | 3 | 42,9 | 12 | 63,2 | 1 | 25,0 | 4 | 33,3 | 23 | 48,9 |
| Clindamicina | 4 | 80,0 | 4 | 57,1 | 13 | 68,4 | 3 | 75,0 | 3 | 25,0 | 27 | 57,4 |
| Sulfametoxazol + trimetoprima | 1 | 20,0 | 4 | 57,1 | 3 | 15,8 | 1 | 25,0 | 5 | 41,7 | 14 | 29,8 |
| Vancomicina | - | - | - | - | - | - | - | - | - | - | - | - |
| Linezolida | - | - | - | - | - | - | - | - | - | - | - | - |
Señal convencional utilizada: - Dato numérico igual a cero, no resultante de redondeo.
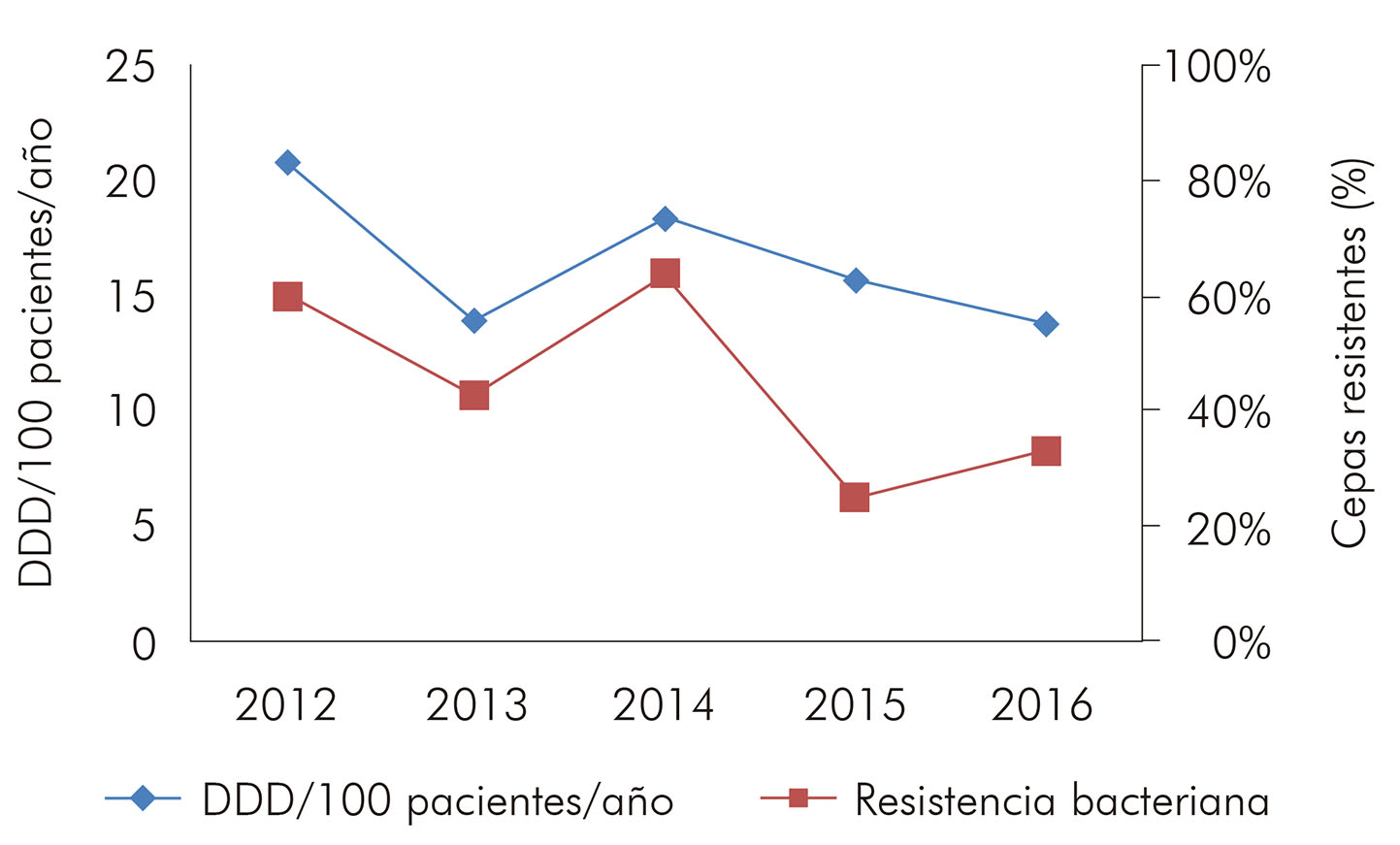
Figura 1 - Relación entre el consumo y la tasa de resistencia a la oxacilina en cepas de S. aureus aisladas en hemocultivos en el HUJBB, de 2012 a 2016
Los BGN fermentadores encontrados en el presente estudio presentaron elevados índices de resistencia a las cefalosporinas de tercera y cuarta generación (83,0% para ceftazidima y 76,1% para cefepima) (Tabla 6), habiendo predominado el perfil fenotípico de enterobacterias productoras de betalactamasas de espectro extendido (extended-spectrum beta-lactamases - ESBL). Al correlacionar el consumo de cefepima y el perfil de resistencia (Figura 2), también fue posible observar un estándar positivo y no linear entre 2012 y 2013 y entre 2014 y 2016. En el período del estudio, no hubo aislados con resistencia a los carbapenémicos.
Tabla 6 - Perfil de resistencia de los aislados de hemocultivos realizados en el HUJBB, de 2012 a 2016, positivos para bacilos Gram negativos fermentadores, conforme el año
| Medicamento | Bacilos Gram negativos fermentadores (N=88) | Total | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2012 (N=8) | 2013 (N=11) | 2014 (N=27) | 2015 (N=20) | 2016 (N=22) | ||||||||
| N | % | N | % | N | % | N | % | N | % | N | % | |
| Ciprofloxacino | 4 | 66,7* | 6 | 54,5 | 8 | 33,3* | 9 | 45,0 | 14 | 63,6 | 41 | 46,6 |
| Ceftazidima | 6 | 85,7* | 7 | 63,6 | 22 | 81,5 | 18 | 90,0 | 20 | 95,2* | 73 | 83,0 |
| Cefepima | 5 | 71,4* | 6 | 66,7* | 18 | 78,3 | 18 | 90,0 | 20 | 95,2* | 67 | 76,1 |
| Meropeném | - | - | - | - | - | - | - | - | - | - | - | - |
| Imipeném | - | - | - | - | - | - | - | - | - | - | - | - |
| Ertapeném | - | - | - | - | - | - | - | - | - | - | - | - |
| Piperacilina + tazobactam | - | - | 4 | 40,0* | 3 | 15,0* | 5 | 25,0 | 5 | 23,8* | 17 | 19,3 |
| Amicacina | 2 | 28,4* | 1 | 9,1 | 3 | 11,1 | 1 | 5,0 | - | - | 7 | 8,0 |
| Gentamicina | 2 | 50,0* | 5 | 45,5 | 14 | 51,9 | 13 | 65,0 | 9 | 47,4* | 43 | 48,9 |
| Sulfametoxazol + trimetoprima | 6 | 75,0 | 5 | 50,0* | 13 | 72,2* | NT | NT | 3 | 100,0* | 27 | 30,7 |
| Tigeciclina | - | - | - | - | - | - | 1 | 5,0 | 2 | 14,3* | 3 | 3,4 |
| Colistina | NT | NT | - | - | 4 | 22,2 | 3 | 15,0 | - | - | 7 | 8,0 |
* En los casos señalados, no todas las cepas fueron testadas para el antimicrobiano en tema. De esa forma, el porcentaje se calculó sobre el número de pruebas de sensibilidad realizados. NT: No testado. Señal convencional utilizada: - Dato numérico igual a cero, no resultante de redondeo.
DISCUSIÓN
Una de las principales preocupaciones mundiales con respecto al uso racional de medicamentos está relacionada con los antimicrobianos. El aumento de la resistencia bacteriana a diversos agentes conduce a una mayor atención en el tratamiento de infecciones y contribuye al aumento de los costos del sistema de salud. El monitoreo del consumo de antimicrobianos puede ayudar a las evaluaciones en varios niveles, como los hábitos de prescripción, la introducción de nuevos medicamentos y la variación en la flora bacteriana local8.
El uso de antimicrobianos varía considerablemente de un hospital a otro, en las diferentes salas, especialidades, etc. Por lo tanto, las características de consumo de un órgano deben estudiarse de manera amplia, con el objetivo de establecer las prioridades para la acción.
En este estudio, se analizaron las variaciones de consumo de 20 antimicrobianos utilizados en las salas y en la UTI de un hospital universitario en la Región Norte de Brasil durante cinco años.
La mayor prevalencia de IPCS no está de acuerdo con los resultados encontrados en un hospital de referencia en el norte del estado de Minas Gerais, en el que había una mayor frecuencia de infecciones del tracto urinario9. Las PCI se definen como infecciones con graves consecuencias sistémicas, bacteriemia o sepsis, sin foco primario identificable. El mayor número de IPCS puede estar relacionado con el uso de dispositivos intravasculares (catéteres venosos centrales y periféricos), que son muy comunes en pacientes que permanecen en el hospital durante mucho tiempo y son más susceptibles a las infecciones10.
Las IPCS representan una de las principales causas de morbilidad y mortalidad hospitalaria, y su gravedad es aún mayor en la UTI. Según datos de 2016 publicados por ANVISA, de las 16.949 notificaciones con la identificación de microorganismos que causan IPCS en UTI de adultos, en 2016, las más frecuentes fueron Staphylococcus spp. coagulasa negativa (18.9%), K. pneumoniae (18.2%) y S. aureus (14.1%)11. Aunque el pequeño número de IPCS en la UTI del HUJBB, en ese mismo año, fue causado por varias bacterias, al analizar el hospital en su conjunto, entre 2012 y 2016, los agentes más frecuentes fueron los mismos encontrados por el estudio publicado por la ANVISA.
El consumo de vancomicina disminuyó en aproximadamente un 44%, lo que también ocurrió en la UTI, en menor medida (31,5%). La vancomicina es uno de los principales recursos utilizados en el tratamiento de las infecciones por S. aureus resistentes a meticilina/oxacilina (MRSA/ORSA); por lo tanto, la resistencia a estos medicamentos genera una enorme preocupación. A pesar de la ausencia de cepas estafilocócicas resistentes a la vancomicina, el consumo de este medicamento ha disminuido. Esto puede explicarse por la acción del programa de racionalización antimicrobiana, que ejerce un mayor control sobre el uso de este medicamento, además del uso de medicamentos menos complejos y efectivos contra estas cepas, como sulfametoxazol + trimetoprima. La disminución en el consumo de vancomicina también puede explicarse por la reducción del 26,7% en la frecuencia de los aislados de MRSA en el período analizado.
La elevada resistencia de S. aureus a la clindamicina también se observó en un estudio realizado en un hospital terciario, entre 2012 y 2014, que encontró altos niveles de resistencia (46,7%)12.
Con relación a S. aureus y oxacilina, el presente estudio difiere de la literatura. La resistencia a la oxacilina no presentó un patrón fijo, en desacuerdo con la revisión de la literatura que verificó un crecimiento continuo en las instituciones hospitalarias de todo el mundo a lo largo del tiempo13. Además, los niveles de resistencia encontrados fueron más altos que los verificados por otros estudios, alrededor del 35%12,14.
Al correlacionar el consumo de oxacilina y la resistencia presentada por S. aureus, el patrón positivo y no lineal observado fue discordante en relación con un estudio realizado en un hospital de São Paulo, cuyos resultados no mostraron una correlación estadísticamente significativa entre estas dos variables. (p = 0,15)15. Como alternativa para el tratamiento de cepas estafilocócicas resistentes a la oxacilina, se pueden utilizar vancomicina y linezolid, ya que no se han encontrado cepas resistentes a estos antimicrobianos.
La reducción de aproximadamente 53% en el consumo de piperacilina + tazobactam difiere de un estudio realizado en un hospital de São Paulo, entre 1995 y 2006, que encontró un aumento estadísticamente significativo en el consumo de penicilina de amplio espectro en el grupo de ureidopenicilinas en cuestión15. Esto puede explicarse principalmente por la mayor susceptibilidad de las cepas de P. aeruginosa a la amikacina, con un nivel de resistencia general del 22,2% entre 2012 y 2016. El consumo de amikacina aumentó en aproximadamente un 71% en el período analizado. Este patrón también se observó en la UTI, con una reducción de aproximadamente 55,5% en el uso de piperacilina + tazobactam, asociado con los altos niveles de resistencia encontrados.
En la UTI, el consumo de ceftriaxona y oxacilina disminuyó en aproximadamente 49,5% y 53,8%, respectivamente. Esto se debe a la gran cantidad de Klebsiella spp. y cepas de estafilococos resistentes, en ese orden.
Aún en relación con la UTI, el uso de amikacina y meropenem aumentó en aproximadamente 231,7% y 131,5%, respectivamente. El mayor consumo de amikacina puede explicarse por la gran susceptibilidad de las cepas encontradas en la UTI, en las que prácticamente todos los fermentadores BGN y P. aeruginosa (además del 40% de los especímenes de Acinetobacter spp.) eran sensibles. Con respecto al meropenem, el aumento en el consumo puede explicarse por la gran susceptibilidad de los BGN fermentadores encontrados; otro hecho que puede explicar este aumento es la presencia de muchos especímenes Gram negativos fermentadores ESBL positivos, lo que haría inviable el uso de penicilinas y cefalosporinas, ya que la mayoría, con pocas excepciones para la cefepima, son ineficaces frente a los gérmenes ESBL positivos, tornando los carbapenémicos una de las principales estrategias de tratamiento.
En relación a los BGN fermentadores, los elevados índices de resistencia a las cefalosporinas encontrados no están de acuerdo a lo observado en otro hospital terciario, de 2012 a 201412, los que fueron inferiores cuando comparados con el presente estudio. La elevada utilización de cefepima, a partir de 2014, puede haber contribuido para los altos índices de resistencia entre 2014 y 2016, ya que hubo un aumento de más de 500% en el consumo de esa droga. Además, las bajas tasas de susceptibilidad pueden ser explicadas por la gran cantidad de cepas ESBL positivas. En ese sentido, la terapia empírica, en la sospecha de infecciones por BGN fermentadores, debe ser basada en el uso de carbapenémicos, ya que fueron identificados gérmenes resistentes a esa clase de antimicrobianos.
CONCLUSIÓN
Las IPCS fueron causadas, en su mayoría, por BGN, con destaque para los fermentadores, con patrón fenotípico de producción de ESBL. Los S. aureus fueron resistentes a la oxacilina en casi mitad de los aislados. Hubo una reducción significativa del consumo (global y en el CTI) de piperacilina + tazobactam y de vancomicina, bien como menor consumo de ceftriaxona y oxacilina, paralelo a las elevaciones del consumo de amikacina y meropenem. Al relacionar el consumo y el perfil de resistencia bacteriana, hubo correlación positiva y no linear entre el consumo de cefalosporinas de cuarta generación y el recrudecimiento de cepas de BGN fermentadores multirresistentes y entre oxacilina y S. aureus resistentes. Frente a lo expuesto, se observa que el uso racional de antimicrobianos en el ambiente hospitalario y el monitoreo de la dinámica de resistencia bacteriana son fundamentales para reducir la emergencia de microorganismos resistentes causadores de IRAS a los pacientes.
REFERENCIAS
1 Mota LM, Vilar FC, Dias LBA, Nunes TF, Moriguti JC. Uso racional de antimicrobianos. Medicina (Ribeirão Preto). 2010;43(2):164-72. [ Links ]
2 Onzi PS, Hoffman SP, Camargo AL. Avaliação do consumo de antimicrobianos injetáveis de um hospital privado no ano de 2009. R Bras Farm Hosp Serv Saude. 2011 mai/ago;2(2):20-5. [ Links ]
3 World Health Organization. Collaborating Centre for Drug Statistics Methodology. Guidelines for ATC classification and DDD assignment. 16th ed. Oslo: WHO; 2013. [ Links ]
4 Alós JI. Resistencia bacteriana a los antibióticos: una crisis global. Enferm Infecc Microbiol Clin. 2015 dic;33(10):692-9. [ Links ]
5 Magiorakos AP, Srinivasan A, Carey RB, Carmeli Y, Falagas ME, Giske CG, et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clin Microbiol Infect. 2012 Mar;18(3): 268-81. [ Links ]
6 Barlam TF, Cosgrove SE, Abbo LM, Macdougall C, Schuetz AN, Septimus EJ, et al. Implementing an antibiotic stewardship program: guidelines by the Infectious Diseases Society of America and the Society for Healthcare Epidemiology of America. Clin Infect Dis. 2016 May;62(10):e51-77. [ Links ]
7 World Health Organization. ATC/DDD index [Internet]. Oslo: WHO; 2017 [cited 2017 Sep 22]. Available from: Available from: http://www.whocc.no/atc_ddd_index/ . [ Links ]
8 Tavares NUL, Bertoldi AD, Muccillo-Baisch AL. Prescrição de antimicrobianos em unidades de saúde da família no Sul do Brasil. Cad Saude Publica. 2008 ago;24(8):1791-800. [ Links ]
9 Costa FM, Soares AP, Batista LB, Carneiro JA, Santos JAD. Infecção hospitalar: distribuição topográfica e microbiológica em um hospital público de ensino. J Health Sci Inst. 2014;32(3):265-70. [ Links ]
10 Agência Nacional de Vigilância Sanitária (BR). Critérios diagnósticos de infecções relacionadas à assistência à saúde. Brasília: Agência Nacional de Vigilância Sanitária; 2013. (Série segurança do paciente e qualidade em serviços de saúde; v. 2). [ Links ]
11 Agência Nacional de Vigilância Sanitária (BR). Boletim segurança do paciente e qualidade em serviços de saúde nº 16: avaliação dos indicadores nacionais das infecções relacionadas à assistência à saúde (IRAS) e resistência microbiana do ano de 2016. Brasília: Agência Nacional de Vigilância Sanitária; 2017. [ Links ]
12 Santana TR, Lima Jr AA, Lobo IMF, Araújo JG. Infecção de corrente sanguínea em um hospital terciário. Rev Soc Bras Clin Med. 2016 jan-mar;14(1):22-6. [ Links ]
13 Lima MFP, Borges MA, Parente RS, Victória Jr RC, Oliveira ME. Staphylococcus aureus e as infecções hospitalares - revisão de literatura. Rev Uninga Rev. 2015 jan-mar;21(1):32-9. [ Links ]
14 Dallacorte TS, Indras DM, Teixeira JJV, Peder LD, Silva CM. Prevalência e perfil de sensibilidade antimicrobiana de bactérias isoladas de hemoculturas realizadas em hospitais particulares. Rev Inst Adolfo Lutz. 2016;75:1702. [ Links ]
15 Hidalgo SR. Análise do perfil de consumo de antimicrobianos e correlação com resistência bacteriana de alguns agentes isolados em hemoculturas de um hospital de ensino de São Paulo [tese]. São Paulo (SP): Universidade Federal de São Paulo, Escola Paulista de Medicina; 2008. 103 p. [ Links ]
APOYO FINANCIERO Los autores no recibieron apoyo financiero, los costos necesarios para la realización de la investigación fueron provistos por financiación propia.
Cómo citar este artículo / How to cite this article: Furtado DMF, Silveira VS, Carneiro ICRS, Furtado DMF, Kilishek MP. Consumo de antimicrobianos y el impacto en la resistencia bacteriana en un hospital público del estado de Pará, Brasil, de 2012 a 2016. Rev Pan Amaz Saude. 2019;10:e201900041. Doi: http://dx.doi.org/10.5123/S2176-6223201900041
Recibido: 06 de Mayo de 2018; Aprobado: 19 de Septiembre de 2018











 texto em
texto em