INTRODUÇÃO
A interação entre um fungo, o micobionte, e uma alga ou cianobactéria, o fotobionte, resulta em uma relação simbiótica conhecida como fungo liquenizado ou líquen. O micobionte desempenha um papel importante na associação, pois confere proteção ao fotobionte, além de definir o nome científico e a morfologia do talo liquênico, classificado como crostoso (fixado firmemente no substrato), foliáceo (fixado parcialmente no substrato) ou fruticuloso (fixado pontualmente no substrato). O fotobionte influencia na morfologia e disponibiliza alimento para o fungo1.
Os liquens são usados na medicina popular desde a antiguidade (1700 a 1600 a.C.)2; porém, o primeiro estudo com substâncias liquênicas foi conduzido por Zopf3, em 1907, no qual descreveu cerca de 150 substâncias. Estudos sobre a ação biológica dessas substâncias passaram a ser realizados após a descoberta de que eram específicas dos liquens e do seu uso na medicina popular2,4.
Dentre as propriedades mais conhecidas está a ação antimicrobiana, que é estudada desde 19445, como a dos ácidos úsnico e norestíctico, que têm poder inibitório contra bactérias Gram-positivas, Gram-negativas, fungos e parasitas6,7,8.
Considerando-se que estudos sobre liquens de ocorrência na Região Amazônica podem contribuir para a descoberta de substâncias inibidoras do crescimento de fungos e bactérias de importância médica, e para aumentar o conhecimento sobre os mesmos, optou-se por avaliar espécies existentes no campus Belém da Universidade Federal do Pará (UFPA), pela disponibilidade de espécies liquênicas ainda não estudadas e por ser uma área de fácil acesso.
O campus da UFPA, localizado na cidade de Belém, estado do Pará, Brasil, apresenta uma área de 3.328.655,80 m2, onde pode ser encontrada uma variedade de fungos liquenizados, devido à grande disponibilidade de espécies vegetais cujos troncos são importantes substratos para o crescimento de diferentes espécies liquênicas, principalmente as de talo crostoso. Apesar de essas serem mais frequentes, foram selecionadas para o estudo espécies de talo foliáceo do gênero Leptogium e Parmotrema, por serem destacáveis do substrato, evitando a interferência do mesmo durante a extração de substâncias. Espécies de Leptogium e Parmotrema já foram referidas em várias localidades brasileiras, porém nenhum registro foi encontrado no Pará. Assim, este estudo objetivou avaliar a capacidade desses liquens de produzir compostos com atividade inibitória frente a bactérias e fungos causadores de infecções humanas.
MATERIAIS E MÉTODOS
MATERIAL LIQUÊNICO
Os fungos liquenizados Parmotrema sp. e Leptogium sp. foram coletados no campus Belém da UFPA, acondicionados em sacos de papel devidamente identificados e levados ao Laboratório de Botânica, do Instituto de Ciências Biológicas (ICB) da UFPA, para secagem e limpeza do material9. Parte desse material (10 g) foi utilizada para a identificação taxonômica e o restante (10 g) submetido à extração orgânica.
OBTENÇÃO DE EXTRATOS
Extratos orgânicos foram obtidos a partir das duas espécies de fungos liquenizados, por sistema de esgotamento a frio, seguindo a série eluotrópica clorofórmio e acetona. O talo liquênico seco (10 g) de cada espécie foi triturado em almofariz e extraído com 100 mL de clorofórmio, sendo mantido em repouso por 24 h a 6 ºC. Após esse período, o material foi filtrado e o resíduo extraído com o mesmo volume de acetona nas mesmas condições. Os extratos obtidos foram mantidos à temperatura ambiente (29 ± 3 ºC) até a total evaporação dos solventes.
MICRORGANISMOS TESTE
Para os testes de atividade antibacteriana, foram utilizados: cepas de referência obtidas da American Type Culture Colection (ATCC) - Staphylococcus aureus (ATCC 6538), Escherichia coli (ATCC 25922), Pseudomonas aeruginosa (ATCC 9027) e Klebsiella pneumoniae (ATCC 29665); cepas de referência do Departamento de Antibióticos da Universidade Federal de Pernambuco (UFPEDA) - Bacillus subtilis (UFPEDA 16) e Mycobacterium phlei (UFPEDA 71); e isolados clínicos de P. aeruginosa multirresistente e S. aureus resistente à Meticilina (MRSA). Para os testes antifúngicos, foram utilizados: isolados clínicos dos dermatófitos Trichophyton tonsurans, Trichophyton rubrum, Trichophyton mentagrophytes, Microsporum gypseum, Microsporum canis e Epidermophyton floccosum; e um isolado ambiental de M. gypseum. Como representantes de fungos leveduriformes, foram testados 10 isolados clínicos de Candida albicans e dois isolados ambientais de Cryptococcus: Cryptococcus neoformans e Cryptococcus gattii.
TESTE ANTIMICROBIANO DE DISCO DIFUSÃO EM ÁGAR
A atividade antimicrobiana dos extratos foi avaliada através do método de difusão em ágar10. Discos de papel com 6 mm de diâmetro foram impregnados com 20 µL de cada extrato liquênico solubilizado em Dimetilsulfóxido (DMSO), na concentração de 4 mg/mL, e depositados em placas de Petri contendo o meio Ágar Mueller-Hinton, previamente inoculado com bactérias, e Ágar Sabouraud, inoculado com fungos. Os inóculos com turvação compatível ao grau 0,5 da escala McFarland foram semeados na superfície do meio de cultura com o auxílio de um swab. Como controle negativo, foram utilizados discos impregnados com DMSO. Como controle positivo, foram utilizados os antibióticos Cefalotina e Amicacina para bactérias e Anfotericina B para fungos. Os experimentos foram incubados a 30 ºC e 36 ºC para fungos e bactérias, respectivamente. Os resultados foram obtidos pela medição dos halos de inibição em volta dos discos, após 24 h de crescimento para bactérias e leveduras e 72 h para dermatófitos.
CROMATOGRAFIA EM CAMADA DELGADA (CCD)
Os extratos liquênicos foram solubilizados em acetona, na concentração de 4 mg/mL, e aplicados em placas de sílica Gel 60 F254+366 (Merck, Darmstadt, Alemanha), no volume de 10 µL. As placas foram submetidas à eluição, utilizando-se como eluente o sistema de solvente A (tolueno/acetona/ácido acético 180:45:5 v/v/v) com adaptações11. As bandas obtidas foram visualizadas sob luz ultravioleta, nos comprimentos de onda 254 nm e 366 nm, por meio de um leitor de cromatoplacas (CAMAG TLC Visualizer, CAMAG, Muttenz, Suíça), e comparadas usando valores de Rf (fator de retenção de cada substância na placa cromatográfica, o qual é calculado pela razão entre a distância percorrida pela banda e a distância percorrida pelo sistema de solventes, multiplicado por 100) e coloração com os padrões dos ácidos girofórico, divaricático, roccélico, leprolomina e isovicanicina aplicados como referência.
BIOAUTOGRAFIA POR IMERSÃO OU SOBREPOSIÇÃO DO ÁGAR
Os extratos liquênicos foram submetidos a ensaios bioautográficos12 para detecção dos compostos ativos dos extratos cromatografados. Os extratos com maior ação antimicrobiana nos testes de disco difusão em ágar foram aplicados em placas de sílica gel nas mesmas condições da CCD, as quais foram depositadas em placas de Petri e, sobre elas, o meio de cultura ágar Mueller-Hinton inoculado com o microrganismo mais sensível nos testes de difusão em ágar.
RESULTADOS
Os extratos das duas espécies de fungos liquenizados avaliadas neste estudo inibiram o crescimento da maioria das bactérias testadas, sendo os de Parmotrema sp. os mais eficazes, principalmente o extrato clorofórmico, que inibiu o crescimento de 62,5% das bactérias analisadas com halos de inibição que variaram de 8 a 12 mm, enquanto o extrato acetônico foi ativo frente a 37,5% das mesmas. Embora o extrato clorofórmico de Leptogium sp. também tenha inibido o mesmo percentual de bactérias (62,5%), os halos de inibição não ultrapassaram o diâmetro de 8 mm (Tabela 1).
Tabela 1 - Atividade antimicrobiana de extratos obtidos a partir de fungos liquenizados presentes no campus Belém da Universidade Federal do Pará
| Microrganismos | Diâmetro dos halos de inibição (mm) | ||||||
|---|---|---|---|---|---|---|---|
| Leptogium sp. | Parmotrema sp. | DMSO | CFL | ||||
| ECl | EAc | ECl | EAc | ||||
| Bactérias | |||||||
| Staphylococcus aureus (ATCC 6538) | 8 | - | - | - | - | 11 | |
| Staphylococcus aureus (MRSA) | - | - | 8 | 11 | - | 30 | |
| Bacillus subtilis (UFPEDA 16) | - | - | 12 | - | - | 41 | |
| Escherichia coli (ATCC 25922) | 8 | 8 | 11 | - | - | 41 | |
| Pseudomonas aeruginosa (ATCC 9027) | 8 | 14 | - | - | - | 15 | |
| Pseudomonas aeruginosa (multirresistente) | - | - | - | - | - | 12 | |
| Klebsiella pneumoniae (ATCC 29665) | 8 | - | 12 | 11 | - | 41 | |
| Mycobacterium phlei (UFPEDA 71) | 8 | 8 | 11 | 10 | - | 30* | |
| Fungos | AFB | ||||||
| Trichophyton tonsurans | - | - | 12 | 15 | - | 14 | |
| Trichophyton rubrum | - | - | - | - | - | 18 | |
| Trichophyton mentagrophytes | - | - | 8 | 8 | - | 14 | |
| Microsporum gypseum (clínico) | 10 | - | 15 | 9 | - | 9 | |
| Microsporum gypseum (ambiental) | 10 | - | 10 | 10 | - | 10 | |
| Microsporum canis | - | - | 9 | - | - | 15 | |
| Epidermophyton floccosum | - | - | - | 21 | - | 40 | |
ECl: Extrato clorofórmico; EAc: Extrato acetônico; DMSO: Dimetilsulfóxido; CFL: Cefalotina; * Amicacina; AFB: Anfotericina B. Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
Entre as bactérias testadas, as cepas de E. coli, K. pneumoniae e M. phlei apresentaram maior sensibilidade, uma vez que foram inibidas pelas duas espécies de liquens, com destaque para M. phlei, que foi sensível a 100% dos extratos liquênicos avaliados. Por outro lado, o isolado clínico multirresistente de P. aeruginosa apresentou resistência a todos os extratos testados, confirmando a dificuldade de se controlar o crescimento dessa cepa bacteriana. Em contrapartida, a cepa ATCC de P. aeruginosa apresentou sensibilidade ao extrato acetônico de Leptogium sp. semelhante à apresentada ao antibiótico utilizado como referência (Tabela 1).
Em relação à atividade antifúngica, os extratos de Parmotrema sp. também foram mais promissores, pois inibiram 85,7% dos dermatófitos testados; os mais sensíveis foram T. tonsurans e M. gypseum de origem clínica, apresentando halos de inibição de até 15 mm de diâmetro para o extrato clorofórmico, e E. floccosum, com halos de até 21 mm para o extrato acetônico (Tabela 1).
Por outro lado, os extratos de Leptogium sp. inibiram apenas as cepas de M. gypseum de origem clínica e ambiental, com halos de 10 mm de diâmetro. Vale ressaltar que alguns extratos apresentaram ação superior a do antifúngico comercial utilizado como referência, como o extrato acetônico de Parmotrema sp. frente ao T. tonsurans, e o extrato clorfórmico da mesma espécie de líquen frente ao M. gypseum de origem clínica. Os testes realizados com leveduras demonstraram 100% de resistência desse grupo aos extratos de ambas as espécies de liquens.
A análise química por CCD revelou a presença de apenas uma banda em ambos os extratos de Leptogium sp., com Rf 89. Em relação ao Parmotrema sp., foram observadas sete bandas para o extrato clorofórmico, com valores de Rf 88, 66, 53, 48, 45, 40 e 29, e seis no extrato acetônico, com valores de Rf 88, 68, 53, 40, 33 e 27 (Figura 1). Notou-se que as bandas com Rf 88, 53 e 40 estão presentes em ambos os extratos de Parmotrema sp., pois além de apresentarem o mesmo valor de Rf, possuem também a mesma reação de coloração. O mesmo ocorreu com a banda de Rf 33 no extrato acetônico dessa espécie que correspondeu ao mesmo Rf e reação de coloração do ácido girofórico, sugerindo a produção dessa substância por Parmotrema sp. (Tabela 2).
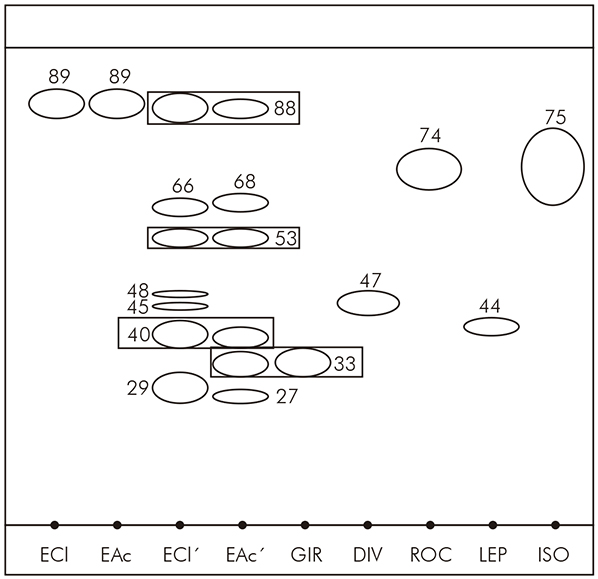
ECl: Extrato clorofórmico de Leptogium sp.; EAc: Extrato acetônico de Leptogium sp.; ECl’: Extrato clorofórmico de Parmotrema sp.; EAc’: Extrato acetônico de Parmotrema sp.; GIR: Ácidos girofórico; DIV: Divaricático; ROC: Roccélico; LEP: Leprolomina; ISO: Isovicanicina.
Figura 1 - CCD desenvolvida no sistema de solventes (tolueno/acetona/ácido acético 180:45:4 v/v/v)
Tabela 2 - Valores de Rf e coloração das bandas visualizadas por CCD, a 254 nm e 366 nm, nos extratos de Leptogium sp. e Parmotrema sp. e no ponto correspondente ao ácido girofórico
| Rf | Leptogium sp. | Parmotrema sp. | Ácido girofórico 254/366 | ||
|---|---|---|---|---|---|
| Extrato clorofórmico 254/366 | Extrato acetônico 254/366 | Extrato clorofórmico 254/366 | Extrato acetônico 254/366 | ||
| 89 | Cinza-claro/Vermelho | Cinza-claro/Vermelho | - | - | - |
| 88 | - | - | Cinza/Vermelho-escuro | Cinza/Vermelho-escuro | - |
| 68 | - | - | - | Cinza-claro/NV | - |
| 66 | - | - | Cinza/NV | - | - |
| 53 | - | - | Cinza/NV | Cinza/NV | - |
| 48 | - | - | Cinza/Amarelo-claro | - | - |
| 45 | - | - | Cinza/Amarelo-claro | - | - |
| 40 | - | - | Cinza/Marrom | Cinza/Marrom | - |
| 33 | - | - | - | Cinza-escuro/Azul-claro | Cinza-escuro/Azul-claro |
| 29 | - | - | Cinza-claro/Marrom-claro | - | - |
| 27 | - | - | - | Cinza/NV | - |
Rf: Fator de retenção; -: Ausente; NV: Não visualizado.
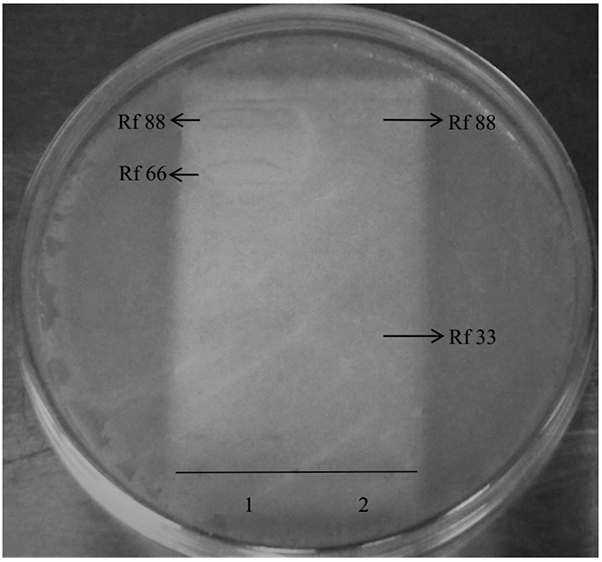
O ensaio bioautográfico foi realizado com os extratos de Parmotrema sp., por exibirem maior efeito inibitório contra os microrganismos testados, sendo M. phlei a espécie bacteriana selecionada por se mostrar a mais sensível nos testes de disco difusão em ágar. A bioautografia demonstrou que as bandas com Rf 88 e 66, presentes no extrato clorofórmico, são as responsáveis pela ação antibacteriana desse extrato, agindo sinergicamente no controle do crescimento de M. phlei, visto que houve formação de halo de inibição abrangendo essas duas bandas cromatográficas (Figura 2).
DISCUSSÃO
Estudos sobre a atividade antimicrobiana de substâncias liquênicas normalmente relatam a maior sensibilidade de bactérias Gram-positivas a extratos de diferentes espécies de fungos liquenizados13,14,15,16,17. Concomitante a isso, alguns autores reportaram a ineficácia dessas substâncias contra cepas de bactérias Gram-negativas18,19. Entretanto, neste trabalho, as cepas Gram-positivas padrão de S. aureus e B. subtilis foram inibidas por apenas 25% dos extratos avaliados, enquanto as Gram-negativas E. coli e K. pneumoniae foram sensíveis a 75% dos extratos e P. aeruginosa (ATCC 9027) a 50% desses extratos, demonstrando maior sensibilidade de bactérias Gram-negativas aos extratos liquênicos aqui avaliados. Esses dados estão de acordo com os de Mie et al.20, que também encontraram maior sensibilidade de bactérias Gram-negativas a extratos de Parmotrema praesorediosum. Essas diferenças podem ocorrer devido a vários fatores, entre eles: os solventes empregados na extração, a espécie liquênica estudada, fatores extrínsecos e intrínsecos que interferem no metabolismo liquênico, como idade do talo, fatores genéticos, umidade, luminosidade e os tipos de metabólitos secundários produzidos16,21.
Independente disso, merece destaque a ação dos extratos de Parmotrema sp. frente à S. aureus (MRSA), uma bactéria multirresistente presente em uma variedade de processos infecciosos nosocomiais de difícil controle, tornando importante a sensibilidade dessa bactéria aos extratos de Parmotrema sp. utilizados neste estudo. Amostras clínicas de S. aureus multirresistentes já foram citadas em outros trabalhos como sensíveis a extratos de Parmotrema coletados em outras localidades22,23.
Outro dado a ser destacado é a sensibilidade da cepa ATCC de P. aeruginosa ao extrato acetônico de Leptogium sp. semelhante à ação do antibiótico utilizado como referência, pois se trata de uma bactéria oportunista, considerada um dos maiores problemas na clínica médica pela sua grande capacidade de adquirir resistência aos antibióticos comercializados. Dessa forma, apesar da baixa ação dos extratos de Leptogium sp., é importante investir na identificação da substância capaz de inibir a cepa ATCC de P. aeruginosa.
A sensibilidade de M. phlei a 100% dos extratos testados neste trabalho também é de grande importância, visto que é uma bactéria álcool-ácido resistente pertencente a um gênero de grande interesse médico, que abrange agentes etiológicos de enfermidades como a hanseníase e a tuberculose, as quais vêm sendo frequentemente relacionadas a casos de resistência a antibióticos24.
Considerando-se que é vital a busca por novas drogas que sejam efetivas contra patógenos multirresistentes, os liquens podem servir de modelo para o desenvolvimento de novas terapias contra os atuais casos de doenças causadas por essas bactérias.
No que se refere à atividade antifúngica, alguns estudos relataram a sensibilidade de T. tonsurans, M. gypseum e E. floccosum a extratos liquênicos de diferentes espécies6,25, assim como a que foi demonstrada no presente estudo. Em contrapartida, nenhuma levedura mostrou-se sensível aos extratos analisados. Tal resistência é um fato conhecido, visto que alguns trabalhos demonstraram a resistência de leveduras a extratos de várias espécies de liquens6,26. Kambar et al.27, por exemplo, constataram resistência de C. albicans a extratos metanólicos de duas espécies liquênicas até a concentração de 20 mg/mL, resultados também encontrados nesta pesquisa, confirmando a resistência de fungos leveduriformes aos extratos liquênicos.
Os extratos de Parmotrema sp. apresentaram maior capacidade inibitória nos testes em disco e maior número de bandas nos testes cromatográficos, sendo o extrato clorofórmico o mais ativo e o que apresentou o maior número de bandas em relação ao extrato acetônico da mesma espécie e em detrimento dos extratos de Leptogium sp. A bioautografia demonstrou que a banda 66, presente no extrato clorofórmico de Parmotrema sp., confere maior potencial antimicrobiano a esse extrato, uma vez que age sinergicamente com a banda 88 na inibição do crescimento microbiano. Esses testes também permitiram identificar o ácido girofórico no extrato acetônico de Parmotrema sp. Várias substâncias já foram citadas para o gênero, como é o caso de atranorina, norlobaridona e ácido úsnico23,28; porém, esta é a primeira referência do ácido girofórico para espécies do gênero Parmotrema, o qual não apresentou ação antimicrobiana, como observado na bioautografia. Apesar dos relatos sobre a ação antimicrobiana do ácido girofórico18,29, é provável que sua concentração, no extrato acetônico da amostra de Parmotrema sp. aqui avaliada, esteja abaixo do mínimo necessário para produzir inibição microbiana.
Os dados bioautográficos justificaram o maior potencial inibitório do extrato clorofórmico de Parmotrema sp. ao mostrarem a ação sinérgica das substâncias com Rf 88 e 66. Embora a banda 88 também esteja presente no extrato acetônico conferindo ação antimicrobiana ao mesmo, é evidente a sua menor concentração nesse extrato, como observado pelo tamanho da banda cromatográfica correspondente (Figura 1). Esse fato, associado à ausência da banda 66, justificam o menor potencial inibitório do extrato acetônico de Parmotrema sp. O extrato clorofórmico desse líquen, portanto, apresentou maior potencial inibitório por conter uma associação de duas substâncias que agem sinergicamente inibindo o crescimento microbiano.
Estes dados mostram que o campus Belém da UFPA tem espécies liquênicas com potencial antimicrobiano e que pode tornar-se uma fonte de substâncias antibióticas para a população frequentemente afetada por infecções fúngicas e bacterianas.
CONCLUSÃO
Os resultados mostraram o potencial antimicrobiano de liquens presentes no campus Belém da UFPA, uma vez que produziram substâncias capazes de inibir o crescimento de bactérias e fungos causadores de infecções humanas, destacando-se os extratos de Parmotrema sp., que apresentaram maior potencial inibitório tanto nos testes antibacterianos como nos antifúngicos.
Os dados obtidos servem de base para estudos futuros sobre a identificação dos princípios ativos detectados, bem como para subsidiar estudos sobre a toxicidade dessas substâncias, os quais são necessários para viabilizar o uso clínico de substâncias liquênicas.











 texto em
texto em