INTRODUÇÃO
A hanseníase é uma doença infecciosa, causada pelo Mycobacterium leprae, que atinge populações pobres de países com clima tropical e subtropical, produzindo importante impacto na morbidade e na qualidade de vida dessas populações, representando um problema de saúde pública1,2,3. Atualmente, há uma tendência de redução da detecção de casos novos e da prevalência da doença em quase todas as regiões de notificação da Organização Mundial da Saúde (OMS), o que se deve à introdução do tratamento poliquimioterápico2. Em 2015, foram notificados 210.758 novos casos de hanseníase no mundo. A despeito dessa redução, a carga global da doença concentra-se atualmente em 14 países, onde ocorrem 95% das notificações, destacando-se Índia (60,38%), Brasil (16,17%) e Indonésia (8,15%)4.
No Brasil, dentre todas as unidades da federação, o estado do Pará registrou a quinta maior taxa de detecção de casos novos de hanseníase, em 2016, com taxa de detecção geral de 30 casos/100.000 habitantes e 7% dos doentes portadores de incapacidade física classificada em grau II5.
O grau de imunidade específica do indivíduo infectado determina a manifestação das formas clínicas da hanseníase. Assim, a forma indeterminada constitui a expressão inicial da doença, podendo evoluir para a cura sem tratamento ou ainda, frente a uma resposta imunológica competente, evoluir para a forma clínica tuberculoide e, naqueles com imunidade menos eficaz, evoluir para as formas de hanseníase virchowiana ou dimorfa6,7.
O diagnóstico da hanseníase é essencialmente clínico e epidemiológico, com base na anamnese e no exame dermatoneurológico. Visando à descentralização do plano de tratamento poliquimioterápico e ao acompanhamento dos casos pela Atenção Primária à Saúde (APS), a OMS recomendou, a partir do ano 2000, para países onde a doença é endêmica, a classificação operacional baseada no número de lesões. Sendo assim, classificou, em paucibacilar, a hanseníase em indivíduos portadores de uma a cinco leões e, em multibacilar, quando presentes mais de cinco lesões8. Os exames laboratoriais podem e devem ser realizados, quando disponíveis, principalmente nos centros de referência7.
Ainda que passível de atingir pessoas em qualquer classe social, a propagação do agente etiológico da hanseníase é facilitada pelas condições socioeconômicas e ambientais desfavoráveis, que se relacionam à distribuição espacial da doença em zonas de pobreza e subdesenvolvimento dos diversos países onde é endêmica9,10,11,12.
Como parte das políticas públicas da área da saúde, a Estratégia Saúde da Família (ESF), concebida para ser operacionalizada no nível municipal, é proposta para dar suporte e ampliar os serviços oferecidos pelas Unidades Básicas de Saúde (UBS). A ESF tem ainda a finalidade de ser a porta de entrada para os serviços de saúde, facilitando o acesso ao Sistema Único de Saúde (SUS)13.
Por ser uma estratégia de reorganização do modelo assistencial, operacionalizada mediante a implantação de equipes multiprofissionais, a ESF deve contemplar, em um território delimitado, o desenvolvimento de ações de promoção da saúde, de prevenção de doenças e de agravos, de recuperação e de reabilitação de pessoas em uma área adstrita, ou seja, aquela composta por cerca de 4.200 pessoas em média12.
Na cidade de Belém, capital do estado do Pará, considerada a metrópole da Amazônia, a incidência da hanseníase tem se mantido elevada nos últimos oito anos, com taxa média de detecção de 26 casos/100.000 habitantes4. Além das questões ambientais associadas, é preciso compreender o impacto dos serviços de saúde na redução de indicadores que medem o risco de transmissão. Contudo, uma avaliação espaço-temporal da doença, correlacionada à cobertura dos serviços, não está disponível para orientar melhorias no nível de assistência básica e prevenção.
Dessa forma, realizou-se uma análise espaço-temporal da evolução da hanseníase em Belém, entre 2006 e 2015. Os atributos "cobertura dos serviços ESF e UBS", bem como seus efeitos no perfil clínico-epidemiológico da doença, no período mencionado, foram correlacionados e discutidos neste artigo.
MATERIAIS E MÉTODOS
Trata-se de um estudo do tipo ecológico, para investigar associações de risco entre cobertura de serviços de saúde e os aspectos clínico-epidemiológicos e espaço-temporais da hanseníase em Belém, de 2006 a 2015.
A área do estudo, o município de Belém (Latitude: 1°27'18" Sul; Longitude: 48°30'9" Oeste), possuía, em 2016, uma população estimada de 1.452.275 habitantes14.
As fontes dos dados epidemiológicos e de cobertura populacional da ESF foram o Sistema de Informação de Agravos de Notificação (Sinan) e o Departamento de Atenção Básica da Secretaria de Atenção à Saúde do Ministério da Saúde (MS)15,16.
Os bancos de dados do Sinan, recebidos da Secretaria de Estado da Saúde do Pará (SESPA), não continham nomes de pessoas, dispensando-se, nesse caso, a submissão do protocolo de pesquisa a um comitê de ética na Plataforma Brasil.
Foram incluídos registros de todos os casos notificados como de hanseníase e residentes em Belém; e excluídos aqueles cujo diagnóstico da doença não foi confirmado.
A descrição do perfil sociodemográfico foi construída a partir da análise das variáveis gênero, faixa etária, local de residência, raça/cor da pele, escolaridade e ocupação. Os aspectos clínico-epidemiológicos concentraram-se na análise das variáveis: ano do diagnóstico, formas clínicas, classificação operacional, presença de incapacidade física grau I e II e número de contatos intradomiciliares.
As taxas de detecção geral, em menores de 15 anos de idade, e de prevalência foram calculadas por meio de técnicas padronizadas e referenciadas pelo MS, expressas na forma de indicadores de monitoramento do progresso da eliminação da hanseníase enquanto problema de saúde pública17. A cobertura de UBS teve como referência, para grandes centros urbanos, uma UBS para cada 30.000 habitantes18. Para avaliar a cobertura da ESF, foram utilizados os parâmetros: a) sem cobertura e/ou cobertura incipiente (< 30,0%); b) cobertura intermediária 1 e 2 (30,0% a 69,9%); ou c) cobertura (≥ 70,0%) e duração menor que quatro anos, respectivamente; e d) cobertura consolidada (≥ 70,0%), com duração maior que quatro anos19.
Os parâmetros para a classificação de endemicidade da doença foram aqueles recomendados pelo MS e expressos nos indicadores de monitoramento e progresso da eliminação da hanseníase, especificados, de acordo com o nível de endemicidade, em baixa, média, alta, muito alta e hiperendêmico17.
Buscando minimizar possíveis variações sazonais e temporais da ocorrência de casos, das populações e das coberturas de UBS e ESF, os dados foram agrupados em intervalo bienal, considerando o período de estudo entre os anos de 2006 a 2015. Para calcular a variação anual de decaimento das taxas de detecção geral, de menores de 15 anos de idade e da prevalência, procedeu-se a aglutinação em dois quinquênios. A partir da suposição de uma variação linear e decaimento, a variação foi determinada pela expressão: [(T2/T1)1/y2-y1 - 1] x 100, onde T2 = taxa de detecção de hanseníase no período final de série, T1 = taxa de detecção de hanseníase no período inicial da série, Y2 = ano no final da série e Y1 = ano no início da série.
[Como unidades de análise de agregação dos dados espaciais, foram considerados os bairros e as ilhas de Outeiro, Mosqueiro, Cotijuba e Combu, que integram o teritório de Belém. A Companhia de Desenvolvimento e Administração da Área Metropolitana de Belém (CODEM) disponibilizou os dados cartográficos dos bairros. Para a ilha de Outeiro, os polígonos das áreas urbana e rural foram unificados, e tomou-se por base a população disponibilizada pelo Instituto Brasileiro de Geografia e Estatística (IBGE), sem especificação da área de residência (urbana e rural). Para as ilhas de Combu e Cotijuba, foram criados arquivos vetoriais em formato shapefile (*.shp).
O georreferenciamento das unidades de saúde classificadas como ESF e UBS foi realizado por meio do aplicativo Google Maps, e as respectivas coordenadas geográficas obtidas foram incorporadas ao banco de dados do software de geoprocessamento QGis v2.18.
Foram aplicados a estatística descritiva e o teste qui-quadrado de aderência para a análise da distribuição de frequências. As variáveis gênero, idade, escolaridade, número de contatos domiciliares, número de lesões e classificação operacional foram recodificadas em variáveis binárias, para a investigação de possíveis associações estatísticas com algum grau de incapacidade física no momento do diagnóstico.
A força de associação das variáveis foi estimada pelo cálculo da razão de chances (odds ratio - OR) com a estimativa do intervalo de confiança (IC) de 95%. Uma análise multivariada de regressão logística binomial foi aplicada para identificar o efeito conjunto das variáveis estudadas com o nível de significância estatística de 5% (p < 0,05). Os softwares BioEstat v5.0 e o SPSS v22.0 foram usados nas análises estatísticas20,21.
As análises espacias foram realizadas no programa QGis v2.18. Foi produzido o mapa temático da taxa média de detecção e da média de cobertura das UBS e ESF. O estimador de densidade de kernel identificou áreas com concentração das taxas médias de detecção da hanseníase, onde desenhou uma vizinhança circular ao redor de cada ponto da amostra, correspondente ao seu raio de influência de 500 m. Em seguida, aplicou-se uma função matemática de 1 na posição do ponto a 0 em sua respectiva fronteira de vizinhança. O valor para a célula foi a soma dos valores kernel sobrepostos e divididos pela área de cada raio da pesquisa22.
O índice de Moran local foi aplicado na análise espacial dos casos novos de hanseníase, com identificação, em mapa (LISA map), das áreas prioritárias (clusters). Cada evento mapeado teve um valor de dependência espacial, a partir da exploração do grau de dependência espacial, de uma estimativa de segunda ordem, ou seja, a partir da análise da covariância espacial entre os agrupamentos dos bairros22,23.
RESULTADOS
Foram notificados 3.921 casos novos de hanseníase de 2006 a 2015, em Belém. A maioria residia na zona urbana (92,76%; 3.637/3.921), tinha de 20 a 59 anos de idade (67,66%; 2.653/3.921), declarava-se mestiço ou pardo (64,93%; 2.546/3.921) e pertencia ao gênero masculino (58,07%; 2.277/3.921), todos com p < 0,0001, na comparação entre as categorias das covariáveis estudadas. Foi registrada alta frequência de indivíduos com baixo nível educacional, com escolaridade igual ou inferior a quatro anos de estudo (43,82%; 1.718/3.921) (p < 0,0001).
As ocupações mais frequentes foram pedreiro (2,91%; 114/3.921), representante comercial autônomo (2,40%; 94/3.921) e empregado em serviços gerais (2,35%; 92/3.921). Entre as mulheres, uma pequena proporção dedicava-se apenas a tarefas domésticas (10,89%; 427/3.921). O conhecimento dos casos foi mais frequente por meio do encaminhamento ao médico (64,68%; 2.536/3.921) e por demanda espontânea à UBS (30,81%; 1.208/3.921). A hanseníase de forma multibacilar foi a mais prevalente (62,69%; 2.458/3.921). As formas clínicas mais frequentes foram a dimorfa (39,56%; 1.551/3.921), a tuberculoide (26,17%; 1.026/3.921) e a virchowiana (21,42%; 840/3.921).
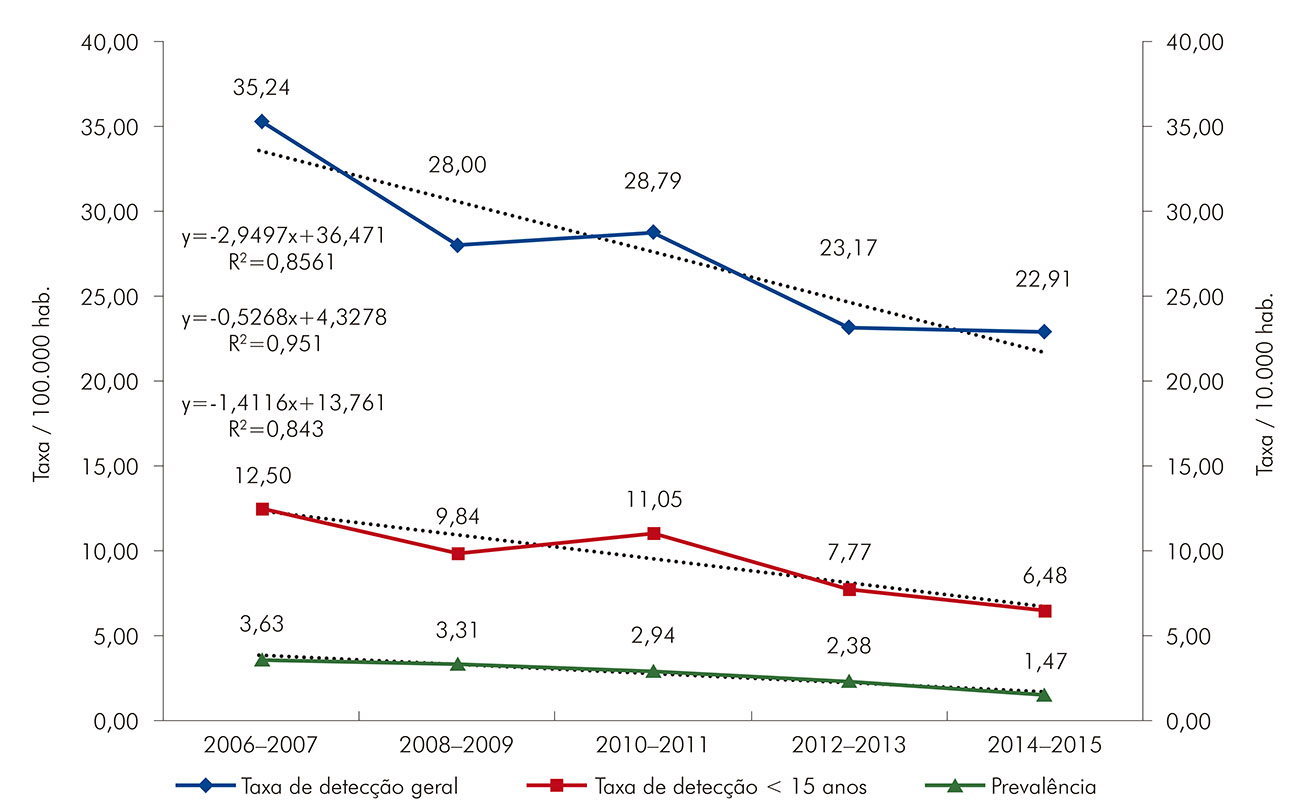
As taxas de detecção e de prevalência da hanseníase apresentaram-se de forma decrescente no período do estudo (Figura 1). A redução mais acentuada ocorreu na taxa de prevalência (4,81%), seguida pelas taxas de detecção em menores de 15 anos de idade (3,19%) e de detecção geral (2,50%). Houve decréscimo na taxa de detecção da doença à medida que aumentou a cobertura da UBS. A cobertura da ESF oscilou em torno de 20% de cobertura populacional ao longo da série estudada (Figura 2).
Fonte: Sinan/MS, 2016.
Figura 1 - Taxas de detecção e de prevalência da hanseníase em Belém, estado do Pará, Brasil, de 2006 a 2015

Fonte: Sinan/MS, 2016.
Figura 2 - Taxa de detecção geral da hanseníase e cobertura de serviços básicos de saúde em Belém, estado do Pará, Brasil, de 2006 a 2015
Dos 3.921 casos notificados, 3.373 (86,02%) foram avaliados quanto à presença de algum grau de incapacidade física no momento do diagnóstico, tendo apresentado associação significante, após ajustamento da OR, para as variáveis: idade, escolaridade, contatos, lesões e classificação operacional (Tabela 1).
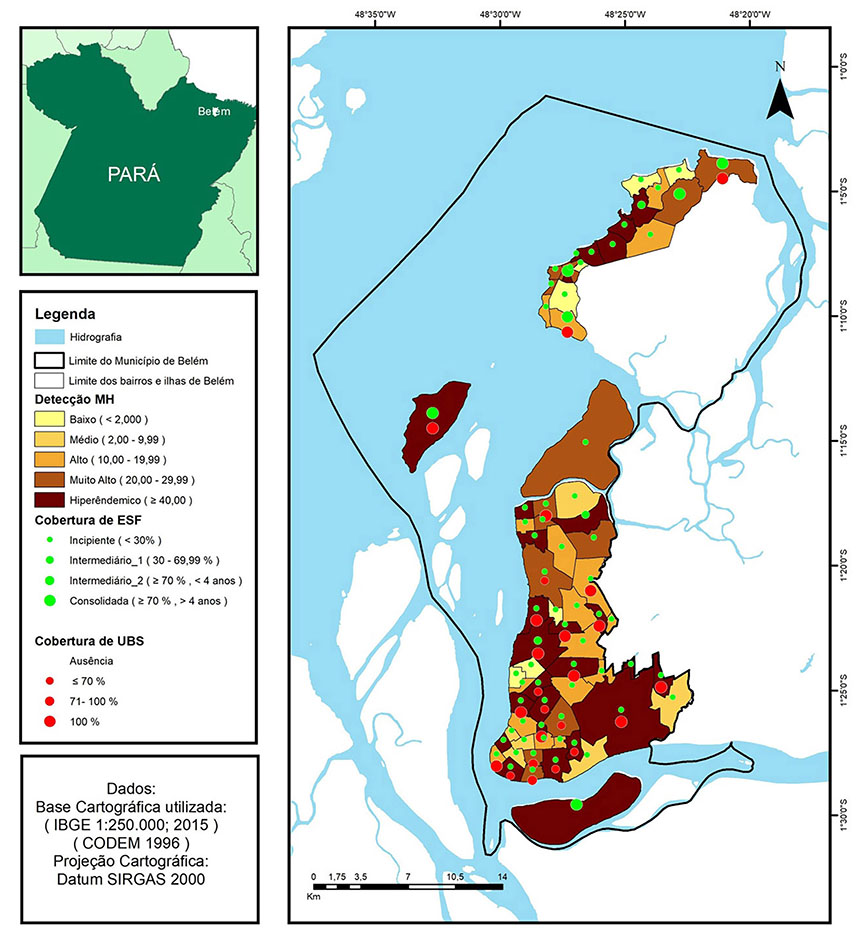
A espacialização da taxa média de detecção da hanseníase, nos bairros e ilhas de Belém, revelou um mosaico de magnitude para expressar a endemicidade da doença (Figura 3). A hiperendemicidade correspondeu a 37% do total das unidades de análise, tendo se concentrado nas ilhas Combu, Cotijuba e Mosqueiro. Na ilha de Mosqueiro, as áreas hiperendêmicas concentraram-se nos bairros de Murubira, Carananduba, São Francisco, Ariramba, Porto Arthur e Aeroporto. Na área do continente, a hiperendemicidade esteve presente nos bairros de Águas Negras, Cruzeiro, Paracuri, Pratinha, Bengui, Val-de-Cães, Marambaia, Fátima, Pedreira, Sacramenta, Telégrafo, Jurunas, Campina, Guamá, Terra Firme, Curió-Utinga, Águas Lindas, Guanabara e Cabanagem.
A distribuição das unidades de ESF, por bairros e ilhas, e a permanência, como unidade que desenvolvia APS, em um período igual ou superior a quatro anos de funcionalidade, só atingiu cobertura consolidada nas ilhas de Combu, Cotijuba e Mosqueiro, sendo, nessa última, observada apenas nos bairros Aeroporto, Baia do Sol, Maracajá e Sucurijuquara. A maioria das áreas apresentou cobertura incipiente, seguida por cobertura entre 30 a 70% com atuação inferior a quatro anos consecutivos, caracterizadas como cobertura intermediária 1 e 2 (Figura 3).
A cobertura de UBS para cada 30.000 habitantes nas unidades de análise variou, entre ≤ 70% e 100%, de forma bastante heterogênea, sem distribuição geográfica adequada para gerar cobertura suficiente, onde existia um maior adensamento populacional (Figura 3).
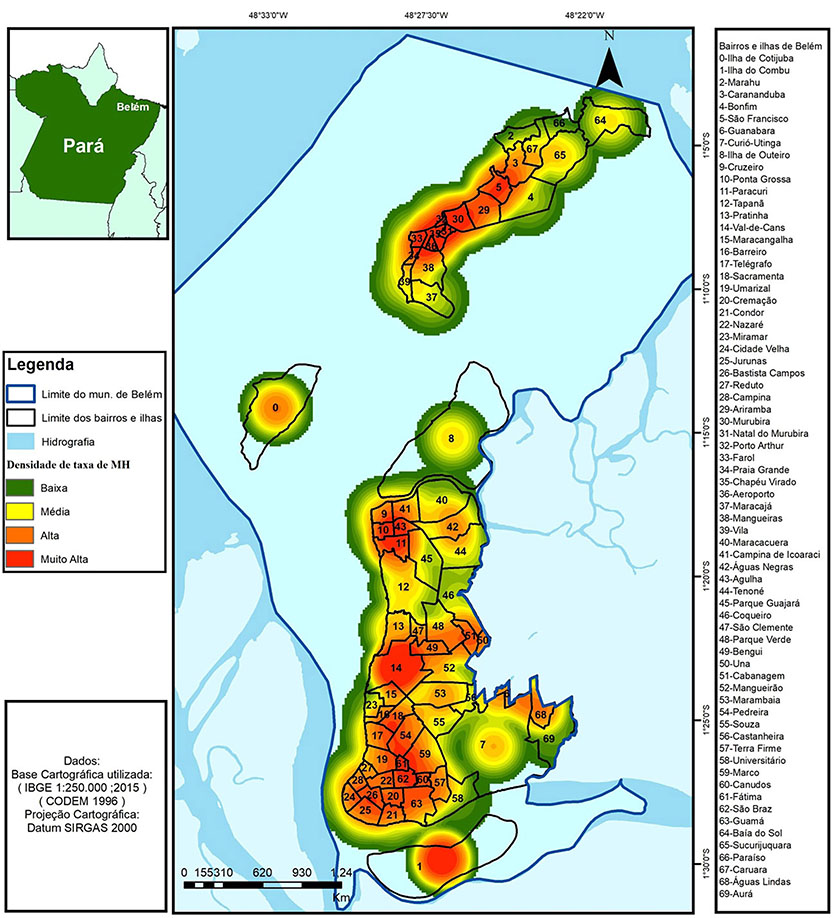
A densidade das taxas médias de detecção da hanseníase apresentou-se muito alta na ilha de Mosqueiro, envolvendo os bairros de Carananduba, São Francisco, Murubira, Chapéu Virado, Porto Arthur, Aeroporto, Farol, parte norte de Mangueiras e Praia Grande. No continente, a densidade foi muito alta nos bairros da Agulha, Ponta Grossa, Paracuri, parte sul do Cruzeiro e Campina de Icoaraci; e também nos bairros de Val-de-Cães, parte leste do Bengui, área sul da Sacramenta, sudoeste da Pedreira, área nordeste de São Braz, sudoeste do Marco e em todo o bairro de Fátima. A ilha do Combu também apresentou densidade muito alta (Figura 4).
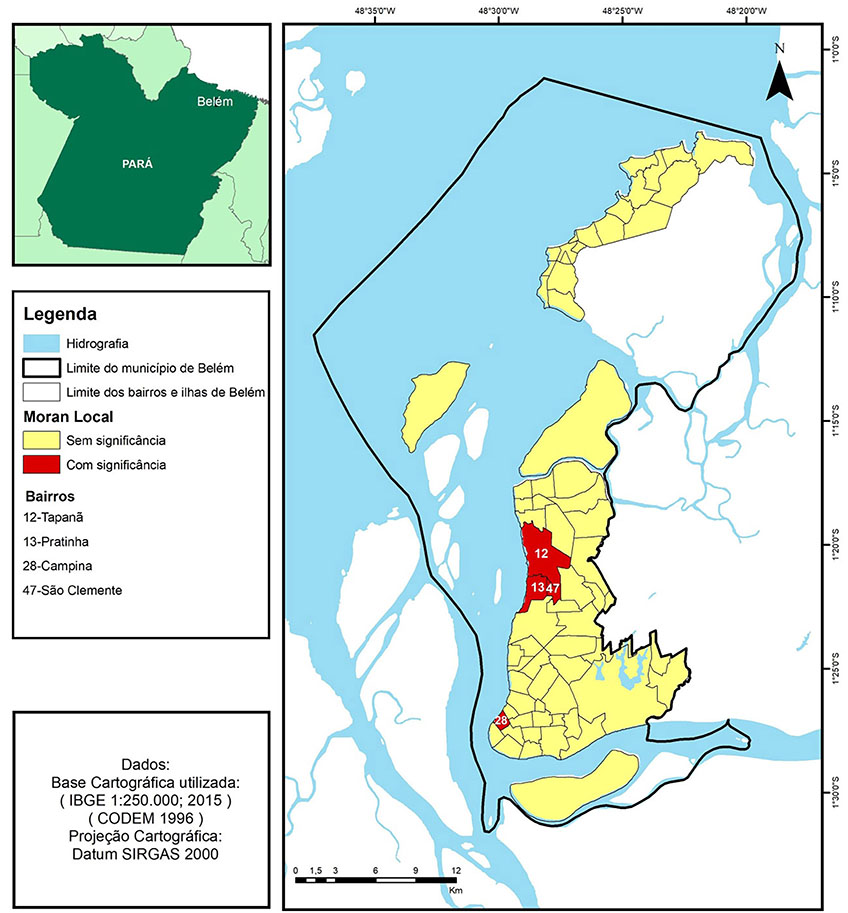
A autocorrelação espacial local (Moran LISA), para as taxas médias de detecção de hanseníase, apresentou significância para os bairros Tapanã, Pratinha, São Clemente e Campina (Figura 5).
Tabela 1 - Associação de variáveis e incapacidade física no momento do diagnóstico de hanseníase, em Belém, estado do Pará, Brasil, de 2006 a 2015
| Variáveis | Incapacidade física | p* | OR bruta (CI 95%) | p† | OR ajustada‡ (CI 95%) | |
|---|---|---|---|---|---|---|
| I ou II | Nenhuma | |||||
| Sexo | ||||||
| Masculino Feminino | 568 290 | 1.400 1.120 | <0,0001 | 1,567 (1,333-1,842) | <0,5689 | 0,949 (0,793-1,136) |
| Idade | ||||||
| ≥ 15 anos < 15 anos | 812 46 | 2.272 248 | <0,0001 | 1,927 (1,393-2,666) | <0,0071 | 1,603 (1,137-2,261) |
| Escolaridade | ||||||
| ≤ 9 anos > 9 anos | 550 295 | 1.298 1162 | <0,0001 | 1,669 (1,419-1,963) | <0,0001 | 0,677 (0,569-0,805) |
| Contatos | ||||||
| ≥ 5 < 5 | 289 541 | 833 1.616 | <0,7037 | 1,036 (0,878-1,223) | <0,8212 | 0,9799 (0,822-1,168) |
| Lesões | ||||||
| > 5 ≤ 5 | 544 305 | 923 1.590 | <0,0001 | 3,072 (2,613-3,613) | <0,0001 | 1,702 (1,384-2,092) |
| Classificação operacional | ||||||
| Multibacilar Paucibacilar | 716 142 | 1.377 1.143 | <0,0001 | 4,185 (3,439-5,094) | <0,0001 | 2,765 (2,146-3,562) |
Fonte: Sinan/MS, 2017; BioEstat, 2007; SPSS, 2016.
* p-valor OR bruta; † p-valor OR ajustada; ‡ Análise multivariada por regressão logística.
Fonte: Sinan/MS, 2017; IBGE, 2015; CODEM, 1996; QGis v2.18.
Figura 3 - Taxa média de detecção de hanseníase e cobertura média da ESF e UBS, por bairros e ilhas, em Belém, estado do Pará, Brasil, de 2006 a 2015
Fonte: Sinan, 2017; IBGE, 2015; CODEM, 1996; QGis v2.18.
Figura 4 - Densidade da taxa média de detecção da hanseníase, por bairros e ilhas, em Belém, estado do Pará, Brasil, de 2006 a 2015
DISCUSSÃO
A célere ocupação dos espaços urbanos costuma gerar desigualdades sociais e econômicas, favorecidas pela alta densidade demográfica e a consequente precariedade das condições de vida da população estabelecida em áreas sem estrutura de saneamento básico24,25,26. A análise sociodemográfica deste estudo revelou que 92,76% dos casos notificados de 2006 a 2015 eram de residentes de área urbana.
A urbanização em Belém avançou de 78% para 99% na década de 1991 a 2000 e estabilizou na década de 2000 a 2010, mantendo-se inalterada (99%)26. Esse fenômeno favorece a multiplicidade e a interação de diversos fatores determinantes para a endemicidade da hanseníase na cidade27,28,29,30,31.
O perfil dos doentes foi similar ao observado em outros locais do Brasil, onde geralmente é formado por homens adultos (20 a 59 anos), em idade produtiva, com baixa escolaridade e residentes de bairros pobres da área urbana com altos índices de pobreza24,29,32,33,34,35; exceto pela cor da pele, onde a maioria (64,93%) era parda. Dados do Censo do IBGE 2010 apontaram que, na população brasileira, 43,1% se autodeclararam pardos, com o maior percentual desse contingente residente na Região Norte (66,9%). Nas demais Regiões, esses percentuais ficaram entre 35% e 50%, exceto na Região Sul, que registrou 16,5% de pessoas pardas14.
Para a medida do status socioeconômico, considerou-se importante a variável ocupação. A maioria dos doentes declarou ocupações que exigem baixo nível de escolaridade ou nenhuma escolaridade, incluindo "donas de casa", "pedreiros", "empregados domésticos" e "empregados atuando em serviços gerais". Quanto menor o nível de escolaridade, maiores as dificuldades para a compreensão do processo saúde-doença e das formas de prevenção da hanseníase36,37.
A magnitude da endemia se expressa pela apresentação clínica da doença38,39. Os casos incidentes no período de estudo apresentaram-se, em sua maioria, como hanseníase dimorfa, seguida pelas formas tuberculoide e virchowiana. Além disso, houve alta frequência de casos multibacilares, achado compatível com situação de hiperendemia24,32,40,41. No momento do diagnóstico, a maioria apresentou algum grau de incapacidade física, deixando evidente o diagnóstico tardio, possivelmente devido às baixas coberturas populacionais de ESF e às deficiências operacionais no tocante à busca ativa de casos42. Esse cenário epidemiológico proporciona maiores chances para o aumento da incidência da doença.
A permanência de taxa de detecção, em menores de 15 anos, em nível muito alto de endemicidade (Figura 1) permite avaliar que a morbidade tem força, e que a doença atinge crianças e jovens em uma transmissão recente da endemia, devido à exposição precoce ao M. leprae. A alta endemicidade demonstra persistência na transmissão do bacilo e retrata as dificuldades dos programas de saúde em controlar a doença43,44,45.
A despeito da importância do achado do decaimento anual das taxas de detecção geral da hanseníase (2,55%), em menores de 15 anos (3,19%) e na prevalência da doença (4,81%), esses decaimentos precisariam ser maiores, na ordem de -26,23%, -29,16% e -12,67%, respectivamente, visando alcançar baixos índices de endemicidade para o controle efetivo da doença16,40.
Os indicadores analisados demonstram que há transmissão ativa da hanseníase em Belém, confirmando a gravidade do problema no espaço urbano36,46,47,48. A prevalência com declínio muito lento entre os biênios e a manutenção de índice acima de um caso para cada 10.000 habitantes não assegura falar em eliminação da doença2.
A redução da taxa de detecção observada foi proporcional ao aumento da cobertura de UBS, embora a ESF, com cobertura incipiente em todo o período estudado, seja a porta de entrada do sistema de saúde. Essa incipiência de cobertura dificulta a organização da assistência aos pacientes com hanseníase, desfavorecendo seu acesso aos serviços de promoção, prevenção e tratamento na capital paranese40.
Para a solução do problema, seriam necessários esforços visando à expansão da cobertura da ESF, que no período de estudo não chegou a 30% (Figura 2). O que garantiria disponibilidade adequada de serviços de APS seria a manutenção de uma cobertura da ESF acima de 70% em período igual ou superior a quatro anos19,28,49,50.
O grau de incapacidade física consequente da hanseníase foi maior em paciente com baixa ou nenhuma escolaridade, como observado em pesquisas anteriores27,44,48,51. Esse achado auxilia na orientação das equipes de saúde quanto à vulnerabilidade social nos territórios em que habitam.
As chances para o desenvolvimento de algum grau de incapacidade física em maiores de 15 anos variaram conforme a apresentação clínica da doença, porém com chance 1,53 vezes maior quando comparado com os menores de 15 anos de idade51. Merecem destaque as variáveis "contatos" e "classificação operacional", considerando que ter cinco ou mais contatos e ser paciente de hanseníase multibacilar estiveram associados às chances 2,6 e 4,1 vezes maiores, respectivamente, em apresentar ou desenvolver algum grau de incapacidade física.
Famílias extensas e monoparentais, assim como numerosos contatos intradomiciliares, apresentam um maior risco de infecção por hanseníase. Alguns estudos apontaram para um risco de cinco a oito vezes maior48,52,53,54,55. Para os casos multibacilares, a presença de incapacidade física é comumente alta, consequência de lesão neural no decurso da doença e do diagnóstico tardio, sendo esse um facilitador da manutenção de casos ativos da doença e um marcador para o reconhecimento da transmissão contínua da infecção na comunidade49,56.
O grau de incapacidade física, quando presente entre os pacientes no momento do diagnóstico, é um importante indicador para avaliar a prevalência oculta e a qualidade dos serviços para o controle da hanseníase, além de reforçar a premissa de diagnóstico tardio. A maior proporcionalidade do diagnóstico realizado de forma passiva confirmou a detecção tardia da doença para a maioria dos casos notificados no período, o que tem sido relativamente comum em outras áreas de estudo da endemia27,49,57,58.
A distribuição geográfica das taxas de detecção coincide com as áreas de maior vulnerabilidade social e incipiente cobertura dos serviços de ESF. Dessa maneira, a identificação das áreas hiperendêmicas e de muito alta endemicidade (Figura 3) pode auxiliar em um planejamento estratégico que envolva, coordenadamente, capacitação das equipes, ações de vigilância da saúde, com priorização para a busca ativa, diagnóstico, tratamento e acompanhamento de casos, conforme a lógica do novo modelo assistencial10,34,47,59,60.
Os maiores riscos para o adoecimento por hanseníase estariam ancorados na situação socioeconômica da população e nos processo migratórios. Nesse contexto, a organização do SUS é de fundamental importância, por atuar no comportamento epidemiológico da doença. Entretanto, a despeito do número de UBS, sua distribuição é considerada inadequada, pois não atende aos critérios básicos de cobertura dos serviços32,59.
A alta densidade das taxas médias de detecção na ilha de Mosqueiro, um balneário da Região Metropolitana de Belém, ocupou quase a metade do total das unidades de análise (Figura 4), sendo essa uma área com alto risco para o surgimento de novos casos. Apesar de ser uma área com frequente visitação, principalmente no período das férias escolares (janeiro, julho e dezembro), sua estrutura de saneamento é precária. As residências dos nativos concentram-se na periferia da área urbana, onde as condições sociais e econômicas são ainda mais precárias, facilitando a transmissão da doença7,16,27,29.
Na região continental de Belém, as maiores densidades das taxas médias de detecção ocupam, de forma heterogênea, 22,54% do total das unidades de análise, formando um padrão no espaço com três aglomerados distintos, o que reflete muito alta endemicidade e facilidade de propagação da doença43,51,57,61,62.
A autocorrelação espacial local, para as taxas médias de detecção da hanseníase, destacou um aglomerado ou cluster envolvendo três bairros, que são cortados por três importantes rodovias. A área é de grande mobilidade populacional, com intenso processo de expansão urbana. As áreas apresentam, além de conjuntos e condomínios habitacionais, diversas ocupações irregulares feitas por famílias de baixa renda. Essas ocupações irregulares estabeleceram-se em locais de grandes carências, como déficit em número de escolas, saneamento básico e unidades de saúde14,61,63,64,65.
Apenas um bairro isolado, Campina, teve autocorrelação espacial significante para as taxas médias de detecção da hanseníase, tendo sido classificado como uma dispersão ou outlier, mas com risco aumentado para a transmissão da doença. Nesse bairro está situada a área portuária e a concentração da área comercial do Município, situações que favorecem o intenso fluxo de pessoas26,66,67,68,69,70.
CONCLUSÃO
Os resultados apresentados neste estudo apontam para uma alta proporção de portadores de hanseníase multibacilar, do sexo masculino e em idade adulta e alertam ainda para o diagnóstico tardio, o que poderia ser evitado com a priorização da estratégia de busca ativa dos doentes.
As tendências de redução, nas taxas de detecção geral e em menores de 15 anos e de prevalência da hanseníase, foram mais expressivas para a taxa da prevalência, seguida pela taxa de detecção em menores de 15 anos e taxa de detecção geral.
Observou-se uma frequência elevada de incapacidade física no momento do diagnóstico, indicando um atraso no diagnóstico da doença, o que poderia apontar para uma alta prevalência oculta, além do impacto da baixa cobertura dos serviços de atenção à saúde para o controle da hanseníase, pois os doentes com algum grau de incapacidade física, no momento do diagnóstico, tiveram o seguinte perfil: idade maior ou igual a 15 anos, escolaridade menor ou igual a nove anos de estudo, mais de cinco contatos intradomiciliares, mais de cinco lesões e forma clínica operacional de hanseníase multibacilar.
A distribuição espacial da doença revelou que os bairros hiperendêmicos e de alta endemicidade possuem a menor cobertura de serviços de saúde e maior risco de manutenção da transmissão.
A descentralização do controle da doença para a ESF ainda é restrita, sinalizada pela incipiência de cobertura. A identificação de um agrupamento de bairros (cluster) hiperendêmicos, bem delimitado, auxilia no planejamento de ações prioritárias de controle.
Para avançar no controle da hanseníase em Belém, é necessário aumentar a cobertura de serviços na atenção básica. As áreas hiperendêmicas, prioritárias às ações de prevenção e controle, não podem prescindir do aumento da cobertura dos serviços de ESF de < 30% (atual) para > 70% por quatro anos consecutivos. Do mesmo modo, faz-se necessário melhorar a distribuição geográfica das UBS, de modo a facilitar o acesso da população ao diagnóstico precoce e dos doentes ao tratamento.
A despeito das limitações inerentes aos estudos que se apoiam em dados secundários, os achados provenientes desta pesquisa permitiram caracterizar a hanseníase como um relevante problema de saúde pública no município de Belém.











 text in
text in