Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude vol.10 Ananindeua 2019 Epub 12-Nov-2019
http://dx.doi.org/10.5123/s2176-6223201900069
ARTÍCULO ORIGINAL
Lepra en metrópolis de la Amazonía brasileña: cobertura de atención básica a la salud y su relación con el perfil clínico y la distribución espacio-temporal de la enfermedad en Belém, estado de Pará, Brasil, de 2006 a 2015
1 Universidade Federal do Pará, Belém, Pará, Brasil
2 Universidade do Estado do Pará, Belém, Pará, Brasil
3 Instituto Nacional de Pesquisas Espaciais, Belém, Pará, Brasil
4 Instituto Evandro Chagas, Ananindeua, Pará, Brasil
OBJETIVO:
Analizar la distribución espacio-temporal de la lepra y la cobertura de los servicios de atención básica en el municipio de Belém, estado de Pará, Brasil, de 2006 a 2015.
MATERIALES Y MÉTODOS:
Estudio ecológico, con análisis de datos de los Sistemas de Información de Agravamientos de Notificación y de Atención Básica del Ministerio de Salud. Se incluyeron 3.921 registros de casos nuevos. Se investigaron datos clínico-epidemiológicos, incluyendo la distribución espacial de la tasa de detección de la enfermedad. Los datos fueron tabulados en Microsoft Excel®, las pruebas estadísticas elaboradas en BioEstat y en SPSS, y los mapas generados en Qgis.
RESULTADOS:
Los enfermos de lepra eran, en general, del género masculino (58,07%), de 20 a 59 años de edad (67,66%) y con formación escolar inferior a cuatro años de estudio (43,82%). La mayoría era portador de lepra multibacilar (62,69%), con predominio de la forma clínica dimorfa (borderline) (39,56%). La tendencia de la detección general fue regresiva frente al aumento de la cobertura de Unidades Básicas de Salud (UBS). La asociación con algún grado de incapacidad física fue significante para edad, escolaridad, contactos, lesiones y clasificación operacional (p < 0,0001). Áreas hiperendémicas correspondieron a 37% de las unidades de análisis. El análisis de la autocorrelación espacial local identificó aglomerados en cuatro barrios de la ciudad.
CONCLUSIÓN:
Los hallazgos indicaron áreas hiperendémicas prioritarias para las acciones de prevención y control, bien como la necesidad de aumento de la cobertura de los servicios de la Estrategia Salud de la Familia y una mejor distribución geográfica de las UBS, de modo a facilitar el acceso a las medidas de prevención y control de la enfermedad.
Palabras clave: Lepra; Epidemiología Descriptiva; Análisis Espacial; Indicadores Básicos de Salud; Estrategia Salud de la Familia
INTRODUCCIÓN
La lepra es una enfermedad infecciosa, causada por Mycobacterium leprae, que afecta a poblaciones pobres en países de clima tropical y subtropical, produciendo un impacto importante en la morbilidad y en la calidad de vida de estas poblaciones y representando un problema de salud pública1,2,3. Actualmente, existe una tendencia a reducir la detección de nuevos casos y la prevalencia de enfermedad en casi todas las regiones de notificación de la Organización Mundial de la Salud (OMS), lo que se debe a la introducción del tratamiento poliquimioterápico2. En 2015, se notificaron 210.758 nuevos casos de lepra en el mundo. A pesar de esta reducción, la carga mundial de la enfermedad se concentra actualmente en 14 países, donde se produce el 95% de las notificaciones, especialmente en India (60,38%), Brasil (16,17%) e Indonesia (8,15%)4.
En Brasil, entre todas las unidades de la federación, el estado de Pará registró la quinta tasa más alta de detección de nuevos casos de lepra, en 2016, con una tasa general de detección de 30 casos/100.000 habitantes y 7% de pacientes con incapacidad física clasificada en grado II5.
El grado de inmunidad específica del individuo infectado determina la manifestación de las formas clínicas de la lepra. Así, la forma indeterminada constituye la expresión inicial de la enfermedad, pudiendo evolucionar hacia una cura sin tratamiento o, ante una respuesta inmune competente, evolucionar a la forma clínica tuberculoide y, en aquellos con inmunidad menos efectiva, evolucionar a las formas de lepra Virchowiana o dimorfa6,7.
El diagnóstico de lepra es fundamentalmente clínico y epidemiológico, basado en la anamnesis y en el examen dermatoneurológico. Con el objetivo de descentralizar el plan de tratamiento de la poliquimioterapia y el seguimiento de los casos por parte de la Atención Primaria de Salud (APS), la OMS recomendó, a partir del año 2000, para los países donde la enfermedad es endémica, la clasificación operativa basada en el número de lesiones. Así, clasificó a la lepra, en individuos con una a cinco lesiones, como paucibacilares y, en multibacilares, cuando había más de cinco lesiones8. Las pruebas de laboratorio pueden y deben realizarse, cuando estén disponibles, principalmente en los centros de referencia7.
Aunque susceptible de llegar a personas de cualquier clase social, la propagación del agente etiológico de la lepra se ve facilitada por las condiciones socioeconómicas y ambientales desfavorables, que se relacionan con la distribución espacial de la enfermedad en áreas de pobreza y subdesarrollo en los diferentes países donde es endémica9,10,11,12.
Como parte de las políticas de salud pública, la Estrategia Salud de la Familia (ESF), diseñada para ser operativa a nivel municipal, se propone para apoyar y ampliar los servicios que ofrecen las Unidades Básicas de Salud (UBS). La ESF también pretende ser la puerta de entrada a los servicios de salud, facilitando el acceso al Sistema Único de Salud (SUS)13.
Por tratarse de una estrategia de reorganización del modelo asistencial, operativa a través de la implementación de equipos multiprofesionales, la ESF debe contemplar, en un territorio definido, el desarrollo de acciones de promoción de la salud, prevención de enfermedades y lesiones, recuperación y rehabilitación de personas en una zona restringida, es decir, la compuesta por unas 4.200 personas en promedio12.
En la ciudad de Belém, capital del estado de Pará, considerada la metrópolis de la Amazonía, la incidencia de lepra se ha mantenido alta durante los últimos ocho años, con una tasa de detección promedio de 26 casos/100.000 habitantes4. Además de los problemas ambientales asociados, es necesario comprender el impacto de los servicios de salud en la reducción de indicadores que miden el riesgo de transmisión. Sin embargo, no se dispone de una evaluación espacio-temporal de la enfermedad, correlacionada con la cobertura de los servicios, para orientar mejoras en el nivel de atención básica y prevención.
Así, se realizó un análisis espacio-temporal de la evolución de la lepra en Belém, entre 2006 y 2015. Los atributos "cobertura de los servicios ESF y UBS", bien como sus efectos en el perfil clínico-epidemiológico de la enfermedad, en el período mencionado, fueron correlacionados y discutidos en este artículo.
MATERIALES Y MÉTODOS
Se trata de un estudio de tipo ecológico, para investigar asociaciones de riesgo entre cobertura de servicios de salud y los aspectos clínico-epidemiológicos y espacio-temporales de la lepra en Belém, de 2006 a 2015.
El área del estudio, el municipio de Belém (Latitud: 1°27'18" Sur; Longitud: 48°30'9" Oeste), tenía en 2016, una población estimada de 1.452.275 habitantes14.
Las fuentes de los datos epidemiológicos y de cobertura poblacional de la ESF fueron el Sistema de Información de Agravamientos de Notificación (Sinan) y el Departamento de Atención Básica de la Secretaría de Atención a la Salud del Ministerio de Salud (MS)15,16.
Los bancos de datos del Sinan, recibidos de la Secretaría de Estado de Salud de Pará (SESPA), no contenían nombres de personas, dispensando, en ese caso, someter el protocolo de investigación a un comité de ética en la Plataforma Brasil.
Se incluyeron registros de todos los casos notificados como de lepra y residentes en Belém; y excluidos aquellos cuyo diagnóstico de la enfermedad no fue confirmado.
La descripción del perfil sociodemográfico se construyó a partir del análisis de las variables género, grupo de edad, local de residencia, raza/color de piel, escolaridad y ocupación. Los aspectos clínico-epidemiológicos se concentraron en el análisis de las variables: año del diagnóstico, formas clínicas, clasificación operacional, presencia de incapacidad física grados I y II y número de contactos en los hogares.
Las tasas de detección general, en menores de 15 años de edad, y de prevalencia se calcularon a través de técnicas estandarizadas y referenciadas por el MS, expresadas en forma de indicadores de monitoreo del progreso de la eliminación de la lepra como problema de salud pública17. La cobertura de UBS tuvo como referencia, para grandes centros urbanos, una UBS para cada 30.000 habitantes18. Para evaluar la cobertura de la ESF, se utilizaron los parámetros: a) sin cobertura y/o cobertura incipiente (< 30,0%); b) cobertura intermedia 1 y 2 (30,0% a 69,9%); o c) cobertura (≥ 70,0%) y duración menor a cuatro años, respectivamente; y d) cobertura consolidada (≥ 70,0%), con duración mayor que cuatro años19.
Los parámetros para la clasificación de epidemicidad de la enfermedad fueron los recomendados por el MS y expresados en los indicadores de monitoreo y progreso de la eliminación de la lepra, especificados, de acuerdo al nivel de epidemicidad, en baja, media, alta, muy alta e hiperendémico17.
Buscando minimizar las posibles variaciones estacionales y temporales de la aparición de casos, de las poblaciones y las coberturas de UBS y ESF, los datos fueron agrupados en intervalo bienal, considerando el período de estudio entre los años de 2006 a 2015. Para calcular la variación anual de disminución de las tasas de detección general, de menores de 15 años de edad y de la prevalencia, se procedió a la aglutinación en dos quinquenios. A partir de la suposición de una variación linear y decaimiento, la variación se determinó por la expresión: [(T2/T1)1/y2-y1 - 1] x 100, en la cual, T2 = tasa de detección de lepra en el período final de serie, T1 = tasa de detección de lepra en el período inicial de la serie, Y2 = año a final de la serie e Y1 = año al inicio de la serie.
Como unidades de análisis de agregación de los datos espaciales, fueron considerados los barrios y las islas de Outeiro, Mosqueiro, Cotijuba y Combu, que integran el territorio de Belém. La Compañía de Desarrollo y Administración del Área Metropolitana de Belém (CODEM) puso a disposición los datos cartográficos de los barrios. Para la isla de Outeiro, los polígonos de las áreas urbana y rural fueron unificados, y se tomó por base la población puesta a disposición por el Instituto Brasileño de Geografía y Estadística (IBGE), sin especificación del área de residencia (urbana y rural). Para las islas de Combu y Cotijuba, se crearon archivos vectoriales en formato shapefile (*.shp).
La georreferenciación de las unidades de salud clasificadas como ESF y UBS se realizó con el aplicativo Google Maps, y las respectivas coordenadas geográficas obtenidas se incorporaron al banco de datos del software de geoprocesamiento QGis v2.18.
Se aplicaron la estadística descriptiva y la prueba Chi cuadrado de adherencia para el análisis de la distribución de frecuencias. Las variables género, edad, escolaridad, número de contactos domiciliares, número de lesiones y clasificación operacional se recodificaron en variables binarias para la investigación de posibles asociaciones estadísticas, con algún grado de incapacidad física al momento del diagnóstico.
La fuerza de asociación de las variables se estimó por el cálculo de la odds ratio (OR) con la estimativa del intervalo de confianza (IC) de 95%. Se aplicó un análisis multivariado de regresión logística binomial para identificar el efecto conjunto de las variables estudiadas con el nivel de significancia estadística de 5% (p < 0,05). Los softwares BioEstat v5.0 y SPSS v22.0 se utilizaron en los análisis estadísticos20,21.
Los análisis espaciales se realizaron utilizando el programa QGis v2.18. Se elaboró un mapa temático de la tasa de detección promedio y la cobertura promedio de la UBS y la ESF. El estimador de densidad kernel identificó áreas con concentración de las tasas promedio de detección de lepra, donde trazó una vecindad circular alrededor de cada punto de la muestra, correspondiente a su radio de influencia de 500 m. Luego, se aplicó una función matemática de 1 en la posición del punto a 0 en su respectivo límite de vecindad. El valor de la célula fue la suma de los valores kernel superpuestos y divididos por el área de cada radio de investigación22.
Se aplicó el índice de Moran local al análisis espacial de nuevos casos de lepra, con identificación, en un mapa (LISA map), de las áreas prioritarias (clusters). Cada evento mapeado tuvo un valor de dependencia espacial, a partir de la exploración del grado de dependencia espacial, de una estimación de segundo orden, es decir, del análisis de la covarianza espacial entre los conglomerados de vecindad22,23.
RESULTADOS
Se notificaron 3.921 casos nuevos de lepra de 2006 a 2015, en Belém. La mayoría vivía en la zona urbana (92,76%; 3.637/3.921), tenía de 20 a 59 años de edad (67,66%; 2.653/3.921), se declaraba mestizo o pardo (64,93%; 2.546/3.921) y era de género masculino (58,07%; 2.277/3.921), todos con p < 0,0001, en la comparación entre las categorías de las covariables estudiadas. Se registró una frecuencia alta de individuos con bajo nivel educacional, con escolaridad igual o inferior a cuatro años de estudio (43,82%; 1.718/3.921) (p < 0,0001).
Las ocupaciones más frecuentes fueron albañil (2,91%; 114/3.921), representante comercial autónomo (2,40%; 94/3.921) y empleado en servicios generales (2,35%; 92/3.921). Entre las mujeres, una pequeña proporción se dedicaba solo a tareas domésticas (10,89%; 427/3.921). El conocimiento de los casos fue más frecuente a través de la derivación al médico (64,68%; 2.536/3.921) y por demanda espontánea a la UBS (30,81%; 1.208/3.921). La lepra de forma multibacilar fue la más prevalente (62,69%; 2.458/3.921). Las formas clínicas más frecuentes fueron la dimorfa (39,56%; 1.551/3.921), la tuberculoide (26,17%; 1.026/3.921) y la virchowiana (21,42%; 840/3.921).
Las tasas de detección y de prevalencia de la lepra se presentaron de forma decreciente en el período del estudio (Figura 1). La reducción más acentuada fue en la tasa de prevalencia (4,81%), seguida por las tasas de detección en menores de 15 años de edad (3,19%) y de detección general (2,50%). Hubo disminución en la tasa de detección de la enfermedad a medida que aumentó la cobertura de la UBS. La cobertura de la ESF osciló alrededor de 20% de cobertura poblacional a lo largo de la serie estudiada (Figura 2).
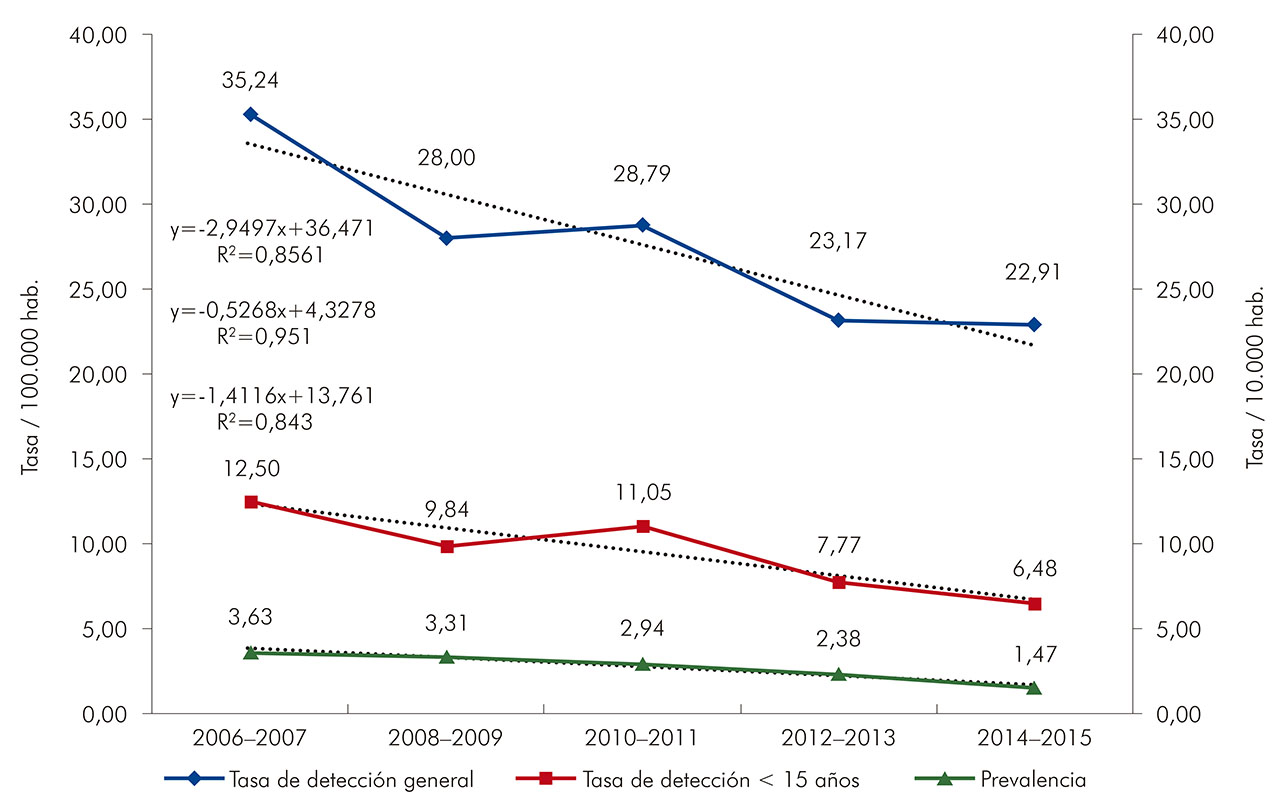
Fuente: Sinan/MS, 2016.
Figura 1 - Tasas de detección y de prevalencia de la lepra en Belém, estado de Pará, Brasil, de 2006 a 2015
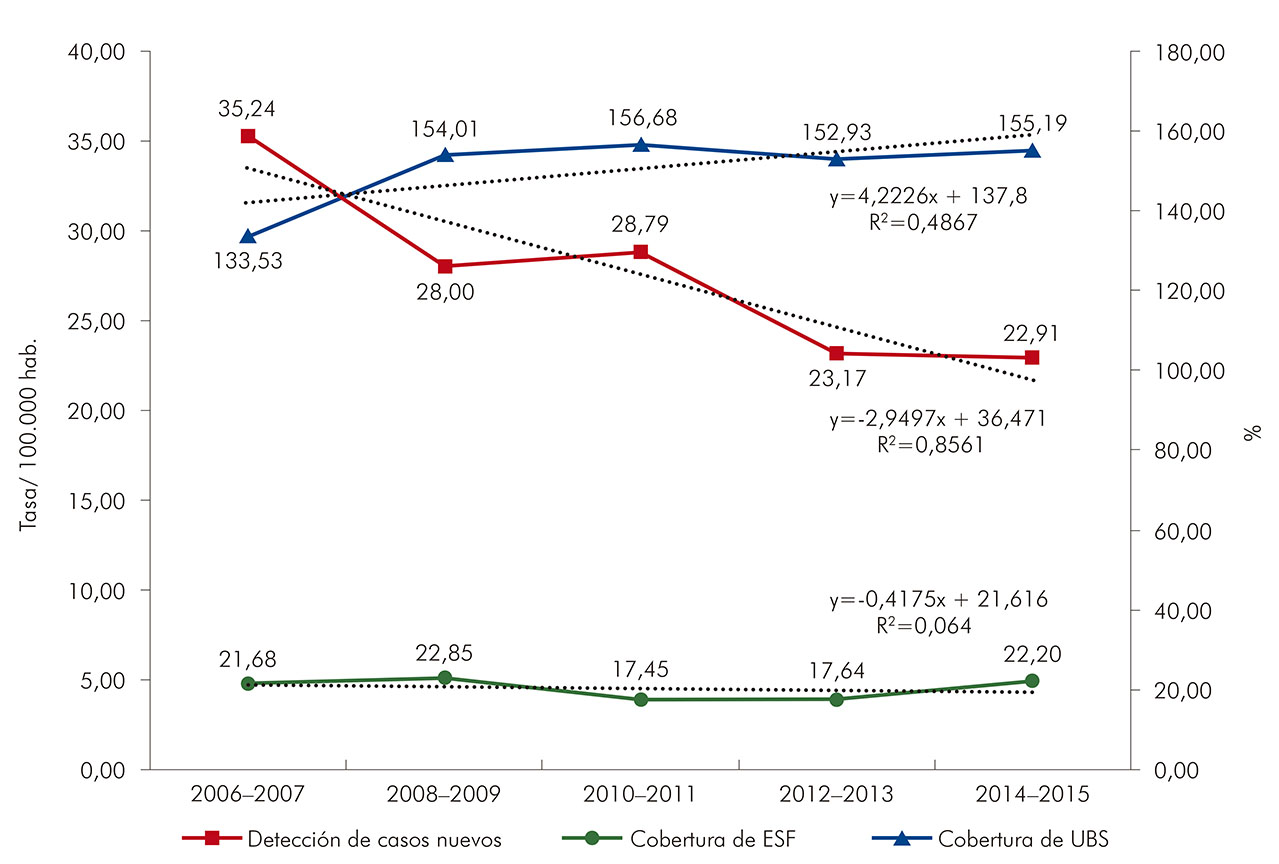
Fuente: Sinan/MS, 2016.
Figura 2 - Tasa de detección general de la lepra y cobertura de servicios básicos de salud en Belém, estado de Pará, Brasil, de 2006 a 2015
De los 3.921 casos notificados, 3.373 (86,02%) se evaluaron con relación a la presencia de algún grado de incapacidad física al momento del diagnóstico, habiendo presentado asociación significante, luego de ajuste de la OR, para las variables: edad, escolaridad, contactos, lesiones y clasificación operacional (Tabla 1).
Tabla 1 - Asociación de variables e incapacidad física al momento del diagnóstico de lepra, en Belém, estado de Pará, Brasil, de 2006 a 2015
| Variables | Incapacidad física | p* | OR bruta (CI 95%) | p† | OR ajustada‡ (CI 95%) | |
|---|---|---|---|---|---|---|
| I ou II | Ninguna | |||||
| Sexo | ||||||
| Masculino Femenino | 568 290 | 1.400 1.120 | <0,0001 | 1,567 (1,333-1,842) | <0,5689 | 0,949 (0,793-1,136) |
| Edad | ||||||
| ≥ 15 años < 15 años | 812 46 | 2.272 248 | <0,0001 | 1,927 (1,393-2,666) | <0,0071 | 1,603 (1,137-2,261) |
| Escolaridad | ||||||
| ≤ 9 años > 9 años | 550 295 | 1.298 1162 | <0,0001 | 1,669 (1,419-1,963) | <0,0001 | 0,677 (0,569-0,805) |
| Contactos | ||||||
| ≥ 5 < 5 | 289 541 | 833 1.616 | <0,7037 | 1,036 (0,878-1,223) | <0,8212 | 0,9799 (0,822-1,168) |
| Lesiones | ||||||
| > 5 ≤ 5 | 544 305 | 923 1.590 | <0,0001 | 3,072 (2,613-3,613) | <0,0001 | 1,702 (1,384-2,092) |
| Clasificación operacional | ||||||
| Multibacilar Paucibacilar | 716 142 | 1.377 1.143 | <0,0001 | 4,185 (3,439-5,094) | <0,0001 | 2,765 (2,146-3,562) |
Fuente: Sinan/MS, 2017; BioEstat, 2007; SPSS, 2016.
* p-valor OR bruta; † p-valor OR ajustada; ‡ Análisis multivariada por regresión logística.
La especialización de la tasa promedio de detección de la lepra, en los barrios e islas de Belém, reveló un mosaico de magnitud para expresar la epidemicidad de la enfermedad (Figura 3). La hiperendemicidad correspondió a 37% del total de las unidades de análisis, concentrándose en las islas Combu, Cotijuba y Mosqueiro. En la isla de Mosqueiro, las áreas hiperendémicas se concentraron en los barrios de Murubira, Carananduba, São Francisco, Ariramba, Porto Arthur y Aeroporto. En el área del continente, la hiperendemicidad estuvo presente en los barrios de Águas Negras, Cruzeiro, Paracuri, Pratinha, Bengui, Val-de-Cães, Marambaia, Fátima, Pedreira, Sacramenta, Telégrafo, Jurunas, Campina, Guamá, Terra Firme, Curió-Utinga, Águas Lindas, Guanabara y Cabanagem.
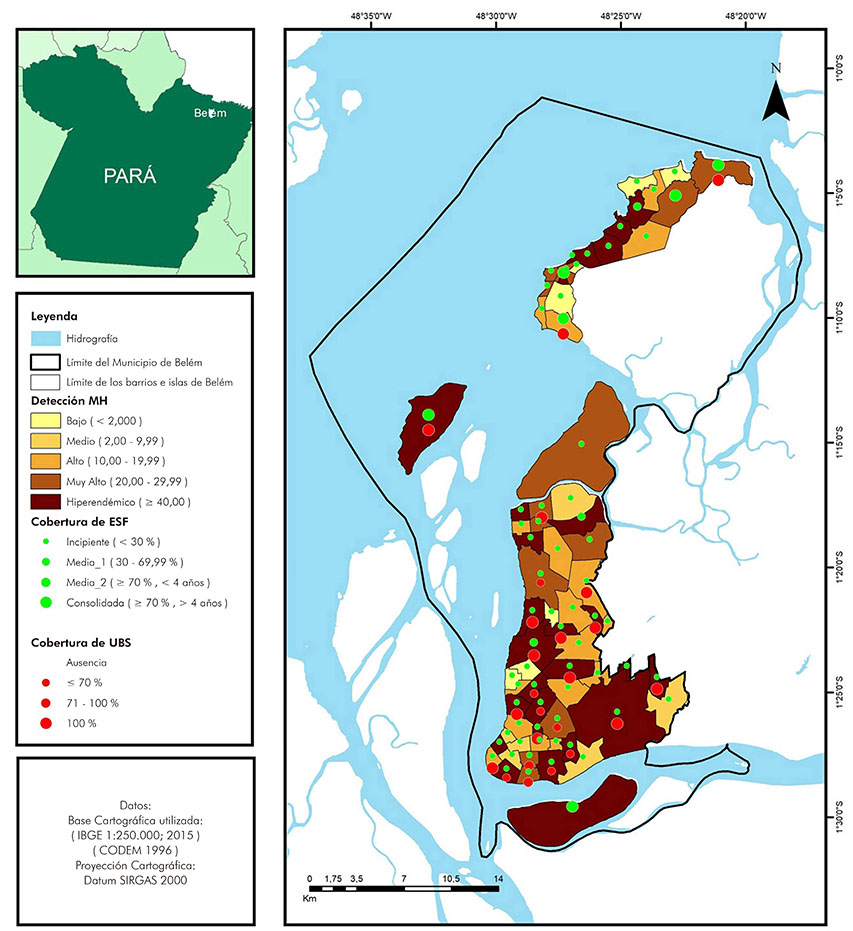
Fuente: Sinan/MS, 2017; IBGE, 2015; CODEM, 1996; QGis v2.18.
Figura 3 - Tasa promedio de detección de la lepra y cobertura promedio de la ESF y UBS, por barrios e islas, en Belém, estado de Pará, Brasil, de 2006 a 2015
La distribución de las unidades de ESF, por barrios e islas, y la permanencia, como unidad que desarrollaba APS, en un período igual o superior a cuatro años de funcionalidad, solamente alcanzó cobertura consolidada en las islas de Combu, Cotijuba y Mosqueiro, en esa última, observada apenas en los barrios Aeroporto, Baia do Sol, Maracajá y Sucurijuquara. La mayoría de las áreas presentó cobertura incipiente, seguida por cobertura entre 30 a 70% con actuación inferior a cuatro años consecutivos, caracterizadas como cobertura intermedia 1 y 2 (Figura 3).
La cobertura de UBS para cada 30.000 habitantes en las unidades de análisis varió, entre ≤ 70% y 100%, de forma bastante heterogénea, sin distribución geográfica adecuada para generar cobertura suficiente, en donde existía mayor densidad poblacional (Figura 3).
La densidad de las tasas medias de detección de la lepra se presentó muy alta en la isla de Mosqueiro, abarcando los barrios de Carananduba, São Francisco, Murubira, Chapéu Virado, Porto Arthur, Aeroporto, Farol, parte norte de Mangueiras y Praia Grande. En el continente, la densidad fue muy alta en los barrios de Agulha, Ponta Grossa, Paracuri, parte sur de Cruzeiro y Campina de Icoaraci; y también en los barrios de Val-de-Cães, parte este de Bengui, área sur de la Sacramenta, sudoeste de Pedreira, área nordeste de São Braz, sudoeste del Marco y en todo el barrio de Fátima. La isla de Combu también presentó densidad muy alta (Figura 4).
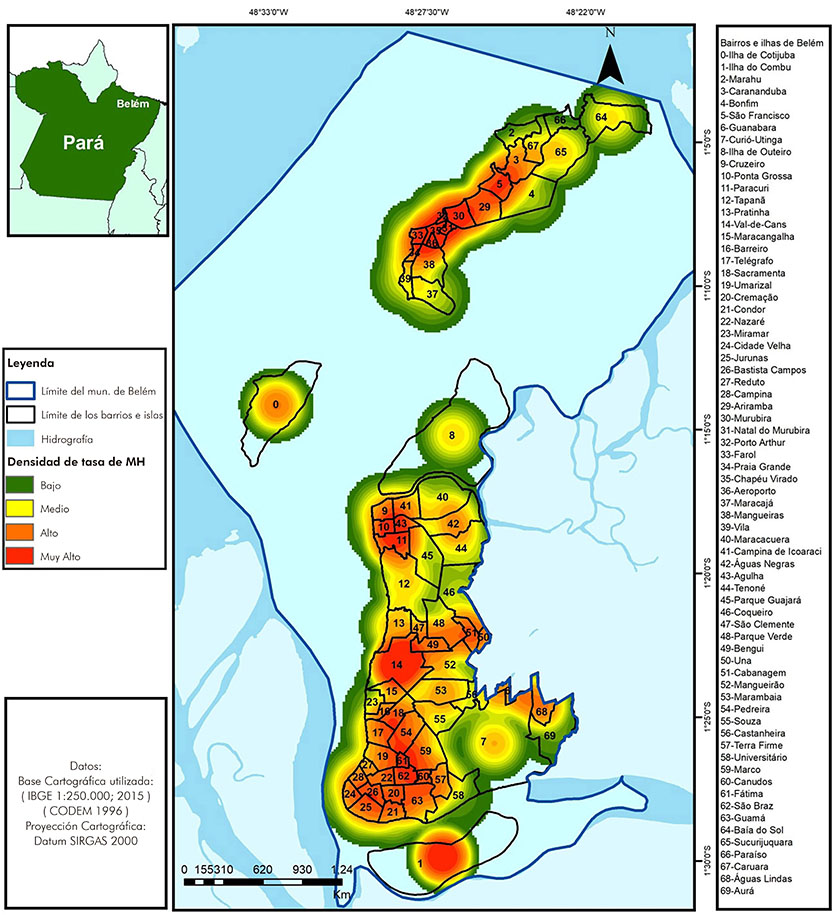
Fuente: Sinan, 2017; IBGE, 2015; CODEM, 1996; QGis v2.18.
Figura 4 - Densidad de la tasa promedio de detección de la lepra, por barrios e islas, en Belém, estado de Pará, Brasil, de 2006 a 2015
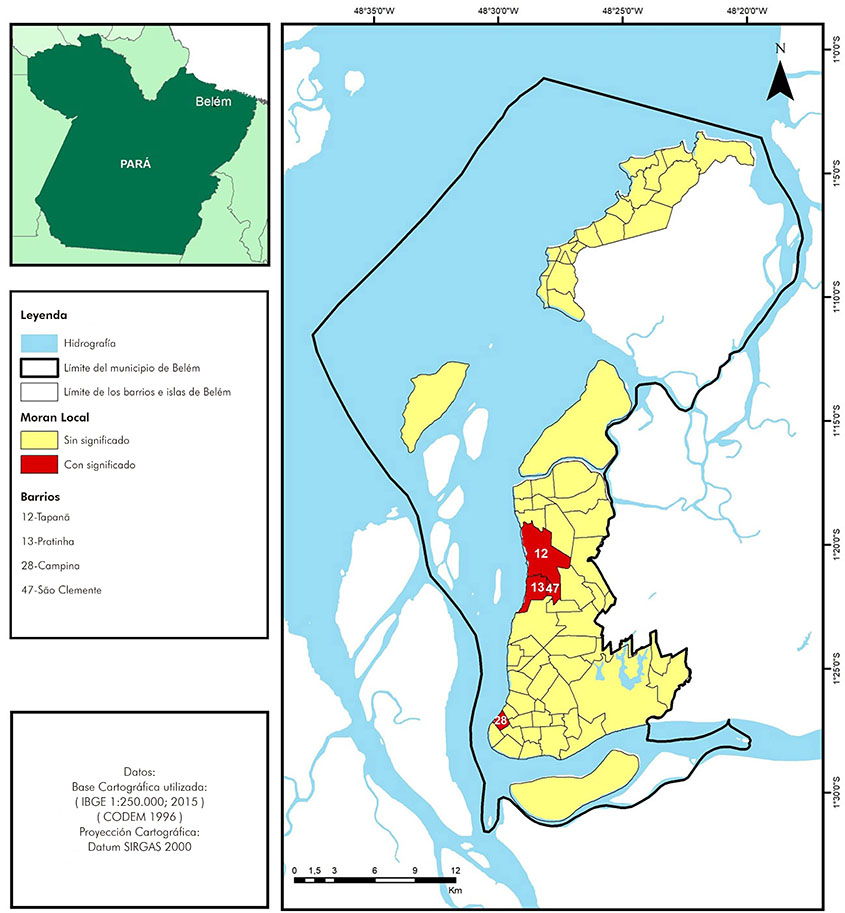
La autocorrelación espacial local (Moran LISA), para las tasas medias de detección de lepra, presentó significancia para los barrios Tapanã, Pratinha, São Clemente y Campina (Figura 5).
DISCUSIÓN
La rápida ocupación de los espacios urbanos suele generar desigualdades sociales y económicas, favorecidas por la alta densidad demográfica y la consecuente precariedad de las condiciones de vida de la población establecida en áreas sin estructura de saneamiento básico24,25,26. El análisis sociodemográfico de este estudio reveló que 92,76% de los casos notificados de 2006 a 2015 era de residentes en área urbana.
La urbanización en Belém avanzó del 78% al 99% en la década de 1991 a 2000 y se estabilizó en la década de 2000 a 2010, permaneciendo sin cambios (99%)26. Este fenómeno favorece la multiplicidad e interacción de varios factores determinantes de la epidemicidad de la lepra en la ciudad 27,28,29,30,31.
El perfil de los pacientes fue similar al observado en otros lugares de Brasil, donde generalmente está formado por hombres adultos (20 a 59 años), en edad productiva, con baja escolaridad y residentes de barrios pobres del área urbana con altas índices de pobreza24,29,32,33,34,35; excepto por el color de la piel, donde la mayoría (64,93%) era parda. Los datos del Censo del IBGE 2010 señalaron que, en la población brasileña, el 43,1% se declaró pardo, con el mayor porcentaje de este contingente residiendo en la Región Norte (66,9%). En el resto de las Regiones, estos porcentajes se situaron entre 35% y 50%, excepto en la Región Sur, que registró un 16,5% de personas pardas14.
Para la medición del estatus socioeconómico se consideró importante la variable ocupación. La mayoría de los pacientes informaron ocupaciones que requieren poca o ninguna educación, incluidas "amas de casa", "albañiles", "empleados domésticos" y "empleados que trabajan en servicios generales". Cuanto menor es el nivel educativo, mayores son las dificultades para comprender el proceso salud-enfermedad y las formas de prevenir la lepra36,37.
La magnitud de la enfermedad endémica se expresa por la presentación clínica de la enfermedad38,39. La mayoría de los casos incidentes durante el período de estudio, se presentaron como lepra dimórfica, seguida de las formas tuberculoide y virchowiana. Además, hubo una frecuencia alta de casos multibacilares, hallazgo compatible con una situación de hiperendemia24,32,40,41. Al momento del diagnóstico, la mayoría presentaba algún grado de incapacidad física, evidenciando el diagnóstico tardío, posiblemente por la baja cobertura poblacional de la ESF y las deficiencias operativas en cuanto a la búsqueda activa de casos42. Este escenario epidemiológico ofrece mayores posibilidades de aumentar la incidencia de la enfermedad.
La permanencia de la tasa de detección, en menores de 15 años, en un nivel muy alto de epidemicidad (Figura 1) permite evaluar que la morbilidad es fuerte, y que la enfermedad afecta a niños y jóvenes en una transmisión reciente de la endemia, debido a la exposición temprana al M. leprae. La alta epidemicidad muestra persistencia en la transmisión del bacilo y retrata las dificultades de los programas de salud para controlar la enfermedad43,44,45.
A pesar de la importancia del hallazgo de una disminución anual en las tasas de detección general de la lepra (2,55%), en niños menores de 15 años (3,19%) y en la prevalencia de la enfermedad (4,81%), estas reducciones deberían ser superiores, del orden de -26,23%, -29,16% y -12,67%, respectivamente, con el objetivo de alcanzar bajos índices de epidemicidad para el control efectivo de la enfermedad16,40.
Los indicadores analizados demuestran que existe una transmisión activa de la lepra en Belém, lo que confirma la gravedad del problema en el espacio urbano36,46,47,48. La prevalencia con un descenso muy lento entre los bienios y el mantenimiento de un índice superior a un caso por cada 10.000 habitantes no garantiza hablar de eliminación de la enfermedad2.
La reducción de la tasa de detección observada fue proporcional al aumento de la cobertura del UBS, aunque la ESF, con cobertura incipiente a lo largo del período de estudio, es la puerta de entrada al sistema de salud. Esta incipiente cobertura dificulta la organización de la asistencia a los pacientes con lepra, perjudicando su acceso a los servicios de promoción, prevención y tratamiento en la capital paraense40.
Para la solución del problema, serían necesarios esfuerzos con el objetivo de dar expansión a la cobertura de la ESF, que en el período de estudio no llegó a 30% (Figura 2). Lo que garantizaría la disponibilidad adecuada de servicios de APS sería el mantenimiento de una cobertura de la ESF superior a 70% en período igual o superior a cuatro años19,28,49,50.
El grado de incapacidad física consecuente con la lepra fue mayor en pacientes con baja o ninguna escolaridad, como lo observado en investigaciones anteriores27,44,48,51. Este hallazgo auxilia en la orientación de los equipos de salud con relación a la vulnerabilidad social en los territorios en los que habitan.
Las probabilidades del desarrollo de algún grado de incapacidad física en personas mayores de 15 años variaron según la presentación clínica de la enfermedad, pero con una probabilidad 1,53 veces mayor en comparación con los menores de 15 años51. Cabe destacar las variables "contactos" y "clasificación operativa", considerando que tener cinco o más contactos y ser un paciente con lepra multibacilar se asociaron con 2,6 y 4,1 veces más probabilidades, respectivamente, de presentar o desarrollar algún grado de incapacidad física.
Las familias numerosas y monoparentales, así como los numerosos contactos domésticos, corren un mayor riesgo de infección por lepra. Algunos estudios han señalado un riesgo de cinco a ocho veces mayor48,52,53,54,55. Para los casos multibacilares, la presencia de incapacidad física suele ser alta, consecuencia de lesión neural durante el curso de la enfermedad y diagnóstico tardío, lo que es un facilitador del mantenimiento de los casos activos de la enfermedad y un marcador para el reconocimiento de la transmisión continua de la infección en la comunidad49,56.
El grado de incapacidad física, cuando está presente entre los pacientes al momento del diagnóstico, es un indicador importante para evaluar la prevalencia oculta y la calidad de los servicios para el control de la lepra, además de reforzar la premisa del diagnóstico tardío. La mayor proporcionalidad del diagnóstico realizado de forma pasiva confirmó la detección tardía de la enfermedad en la mayoría de los casos notificados en el período, lo que ha sido relativamente común en otras áreas de estudio de la endemia27,49,57,58.
La distribución geográfica de las tasas de detección coincide con las áreas de mayor vulnerabilidad social y cobertura incipiente de los servicios de ESF. De esta forma, la identificación de áreas hiperendémicas y de muy alta epidemicidad (Figura 3) puede ayudar en la planificación estratégica que involucre, de manera coordinada, la formación de equipos, acciones de vigilancia en salud, priorizando la búsqueda activa, diagnóstico, tratamiento y seguimiento. de casos, según la lógica del nuevo modelo asistencial10,34,47,59,60.
Los mayores riesgos de enfermar de lepra estarían anclados en la situación socioeconómica de la población y en los procesos migratorios. En este contexto, la organización del SUS es de fundamental importancia, ya que actúa sobre el comportamiento epidemiológico de la enfermedad. Sin embargo, a pesar del número de UBS, su distribución se considera inadecuada, ya que no cumple los criterios básicos de cobertura de los servicios32,59.
La alta densidad de tasas promedio de detección en la isla de Mosqueiro, un balneario de la Región Metropolitana de Belém, ocupó casi la mitad del total de unidades de análisis (Figura 4), que es un área con alto riesgo para la aparición de nuevos casos. A pesar de ser una zona con frecuentes visitas, principalmente durante las vacaciones escolares (enero, julio y diciembre), su estructura sanitaria es precaria. Las residencias de los nativos se concentran en la periferia del área urbana, donde las condiciones sociales y económicas son aún más precarias, facilitando la transmisión de enfermedades7,16,27,29.
En la región continental de Belém, las densidades más altas de las tasas promedio de detección ocupan, de manera heterogénea, el 22,54% del total de unidades de análisis, formando un estándar en el espacio con tres aglomerados distintos, lo que refleja una muy alta epidemicidad y facilidad de propagación de la enfermedad43,51,57,61,62.
La autocorrelación espacial local, para las tasas promedio de detección de lepra, destacó un aglomerado o cluster, que involucra tres barrios, que están cortados por tres carreteras importantes. La zona es de gran movilidad poblacional, con un intenso proceso de expansión urbana. Además de los complejos habitacionales y condominios, las áreas tienen varias ocupaciones irregulares realizadas por familias de bajos ingresos. Estas ocupaciones irregulares se establecieron en lugares de grandes carencias, como déficit en el número de escuelas, saneamiento básico y unidades de salud14,61,63,64,65.
Solo un barrio aislado, Campina, tuvo una autocorrelación espacial significativa para las tasas promedio de detección de lepra, habiendo sido clasificado como dispersión o atípico, pero con riesgo aumentado para transmisión de la enfermedad. En este barrio se ubica el área portuaria y la concentración del área comercial de la ciudad, situaciones que favorecen el intenso flujo de personas26,66,67,68,69,70.
CONCLUSIÓN
Los resultados presentados en este estudio apuntan a una alta proporción de pacientes con lepra multibacilar, tanto del sexo masculino como en edad adulta, y advierten también de un diagnóstico tardío, que podría evitarse priorizando la estrategia de búsqueda activa de pacientes.
Las tendencias de reducción, en las tasas de detección general y en menores de 15 años y en la prevalencia de lepra, fueron más expresivas para la tasa de prevalencia, seguida por la tasa de detección en menores de 15 años y la tasa de detección general.
Hubo una alta frecuencia de incapacidad física al momento del diagnóstico, lo que indica un retraso en el diagnóstico de la enfermedad, lo que podría apuntar a una alta prevalencia oculta, además del impacto de la baja cobertura de los servicios de salud para el control de la lepra, porque los pacientes con algún grado de incapacidad física, al momento del diagnóstico, tenían el siguiente perfil: edad mayor o igual a 15 años, escolaridad menor o igual a nueve años de estudio, más de cinco contactos domiciliarios, más de cinco lesiones y forma clínica operativa de lepra multibacilar.
La distribución espacial de la enfermedad reveló que los barrios hiperendémicos y de alta epidemicidad tienen la menor cobertura de servicios de salud y mayor riesgo de mantenimiento de la transmisión.
La descentralización del control de la enfermedad para la ESF es todavía, restricta, señalizada por lo incipiente de la cobertura. La identificación de un aglomerado de barrios (cluster) hiperendémicos, bien delimitado, auxilia en la planificación de acciones prioritarias de control.
Para avanzar en el control de la lepra en Belém, es preciso aumentar la cobertura de servicios en la atención básica. Las áreas hiperendémicas, prioritarias en las acciones de prevención y control, no pueden prescindir del aumento de la cobertura de los servicios de ESF de < 30% (actual) para > 70% por cuatro años consecutivos. De la misma forma, es necesario mejorar la distribución geográfica de las UBS, de modo a facilitar el acceso de la población al diagnóstico precoz y de los enfermos al tratamiento.
A pesar de las limitaciones inherentes a los estudios que se apoyan en datos secundarios, los hallazgos provenientes de esta investigación permitieron caracterizar la lepra como un relevante problema de salud pública en el municipio de Belém.
REFERENCIAS
1 Morel CM. Inovação em saúde e doenças negligenciadas. Cad Saude Publica. 2006 ago;22(8):1522-3. Doi: 10.1590/S0102-311X2006000800001 [Link] [ Links ]
2 World Health Organization. Global plan to combat neglected tropical diseases 2008-2015. Geneva: WHO; 2007. [Link] [ Links ]
3 Organização Mundial da Saúde. Avanços para superar o impacto global de doenças tropicais negligenciadas: primeiro relatório da OMS sobre doenças tropicais negligenciadas. Brasília: OMS; 2012. [Link] [ Links ]
4 World Health Organization. Global leprosy update, 2015: time for action, accountability and inclusion. Wkly Epidemiol Rec. 2016 Sep;91(35): 405-20. [Link] [ Links ]
5 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Sistema de Agravos Notificáveis. Registro ativo: número e percentual, casos novos de hanseníase: número, taxa e percentual, faixa etária, classificação operacional, sexo, grau de incapacidade, contatos examinados, por estados e regiões, Brasil, 2017 [Internet]. Brasília: Ministério da Saúde; 2017 [citado 2017 jun 6]. Disponível em: http://portalms.saude.gov.br/saude-de-a-z/hanseniase/situacao-epidemiologica. [ Links ]
6 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Coordenação-Geral de Desenvolvimento da Epidemiologia em Serviços. Guia de vigilância em saúde. Volume único [Internet]. 2. ed. Brasília: Ministério da Saúde ; 2017 [citado 2017 dez 12]. Disponível em: Disponível em: http://portalarquivos.saude.gov.br/images/pdf/2017/outubro/06/Volume-Unico-2017.pdf . [ Links ]
7 Pires CAA. Reações hansênicas em pacientes coinfectados com HIV/hanseníase: clínica e imunopatologia [tese]. Belém (PA): Universidade Federal do Pará, Núcleo de Medicina Tropical; 2013. 138 p. [Link] [ Links ]
8 Marques DM. Classificação operacional da hanseníase baseada no número de lesões cutâneas (OMS) x classificação clínico-baciloscópica - validação para alocação do paciente na poliquimioterapia [dissertação]. Recife (PE): Universidade Federal de Pernambuco, Centro de Ciências da Saúde; 2006. 86 p. [Link] [ Links ]
9 Silva DRX, Ignotti E, Souza-Santos R, Hacon SS. Hanseníase, condições sociais e desmatamento na Amazônia brasileira. Rev Panam Salud Publica. 2010 abr;27(4):268-75. Doi: 10.1590/S1020-49892010000400005 [Link] [ Links ]
10 Ferreira IN, Evangelista MSN, Alvarez RRA. Distribuição espacial da hanseníase na população escolar em Paracatu - Minas Gerais, realizada por meio da busca ativa (2004 a 2006). Rev Bras Epidemiol. 2007 dez;10(4):555-67. Doi: 10.1590/S1415-790X2007000400014 [Link] [ Links ]
11 Pinheiro MMO. Hanseníase em registro ativo no município de Passos, MG - Brasil 2006 [dissertação]. Franca (SP): Universidade de Franca; 2007. 60 p. [Link] [ Links ]
12 Garcia DR, Ignotti E, Cortela DCB, Xavier DR, Barelli CSGAP. Análise espacial dos casos de hanseníase, com enfoque à área de risco, em uma unidade básica de saúde no município de Cáceres (MT). Cad Saude Colet. 2013 abr-jun;21(2):168-72. Doi: 10.1590/S1414-462X2013000200011 [Link] [ Links ]
13 Ministério da Saúde (BR). Secretaria de Atenção à Saúde. Departamento de Atenção Básica. Política nacional de atenção básica [Internet]. Brasília: Ministério da Saúde ; 2012 [citado 2016 jun 12]. Disponível em: Disponível em: http://189.28.128.100/dab/docs/publicacoes/geral/pnab.pdf . [ Links ]
14 Instituto Brasileiro de Geografia e Estatística. Cidades e estados [Internet]. Rio de Janeiro: IBGE; 2017. [citado 2017 nov 16]. Disponível em: Disponível em: https://www.ibge.gov.br/geociencias-novoportal/organizacao-do-territorio/estrutura-territorial/15761-areas-dos-municipios. html?t=destaque&c=1501402 . [ Links ]
15 Secretaria de Estado de Saúde Pública (PA). Diretoria de Vigilância em Saúde. Departamento de Epidemiologia. Sistema de Agravos de Notificação. Belém: SESPA; 2017. [ Links ]
16 Ministério da Saúde (BR). Portal da Saúde - SUS. Histórico de cobertura de saúde da família [Internet]. Brasília: Ministério da Saúde ; 2016 [citado 2016 jun 24]. Disponível em: Disponível em: http://dab.saude.gov.br/portaldab/histórico_cobertura_ sf_php . [ Links ]
17 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Diretrizes para vigilância, atenção e eliminação da hanseníase como problema de saúde pública: manual técnico-operacional [Internet]. Brasília: Ministério da Saúde ; 2016 [citado 2017 jun 12]. Disponível em: Disponível em: http://portal.saude.pe.gov.br/sites/portal.saude.pe.gov.br/files/diretrizes_para_._eliminacao_hanseniase_-_manual_-_3fev16_isbn_nucom_final_2.pdf . [ Links ]
18 Ministério da Saúde (BR). Secretaria de Atenção à Saúde. Departamento de Atenção Básica. Política Nacional de Atenção Básica - PNAB [Internet]. Brasília: Ministério da Saúde ; 2012 [citado 2017 jun 12]. Disponível em: Disponível em: http://189.28.128.100/dab/docs/publicacoes/geral/pnab.pdf . [ Links ]
19 Aquino R, Oliveira NF, Barreto ML. Impact of the family health program on infant mortality in Brazilian municipalities. Am J Public Health. 2009 Jan;99(1):87-93. Doi: 10.2105/AJPH.2007.127480 [Link] [ Links ]
20 Ayres M, Ayres Jr M, Ayres DL, Santos AS. BioEstat 5.0: aplicações estatísticas nas áreas das ciências biológicas e médicas. Belém: Sociedade Mamirauá; 2007. 364 p. [ Links ]
21 International Business Machines. Statistical package for the social sciences (SPSS). Version 22.0. [ Links ]
22 Silverman BW. Density estimation for statistics and data analysis. New York: Chapman and Hall; 1986. [ Links ]
23 Anselin L. Local Indicators of Spatial Association - LISA. Geogr Anal. 1995 Apr;27(2):93-115. Doi: 10.1111/j.1538-4632.1995.tb00338.x [Link] [ Links ]
24 Ribeiro Junior AF, Vieira MA, Caldeira AP. Perfil epidemiológico da hanseníase em uma cidade endêmica no norte de Minas Gerais. Rev Bras Clin Med. 2012 jul-ago;10(4):272-7. [Link] [ Links ]
25 Freitas LR, Duarte EC, Garcia LP. Leprosy in Brazil and its association with characteristics of municipalities: ecological study, 2009-2011. Trop Med Int Health. 2014 Oct;19(10):1216-25. Doi: 10.1111/tmi.12362 [Link] [ Links ]
26 Oliveira FFL, Macedo LC. Perfil epidemiológico dos portadores de hanseníase em um município da região centro-oeste do Paraná. SaBios: Rev Saude Biol. 2012 jan-abr;7(1):45-51. [ Links ]
27 Imbiriba ENB, Silva Neto AL, Souza WV, Pedrosa V, Cunha MG, Garnelo L. Desigualdade social, crescimento urbano e hanseníase em Manaus: abordagem espacial. Rev Saude Publica. 2009 ago; 43(4):656-65. Doi: 10.1590/S0034-89102009005000046 [Link] [ Links ]
28 Universidade Federal do Pará. Núcleo de Altos Estudos Amazônicos. Observatório das Metrópoles. Análise populacional da Região Metropolitana de Belém e do Estado do Pará, 2000-2010 [Internet]. Belém: Universidade Federal do Pará; 2011 [citado 2017 dez 7]. Disponível em: Disponível em: http://www.observatoriodasmetropoles.net/download/Censo2010_RMB_2011.pdf . [ Links ]
29 Arantes CK, Garcia MLR, Filipe MS, Nardi SMT, Paschoal VDA. Avaliação dos serviços de saúde em relação ao diagnóstico precoce da hanseníase. Epidemiol Serv Saude. 2010 jun;19(2):155-64. Doi: 10.5123/S1679-49742010000200008 [Link] [ Links ]
30 Batista ES, Campos RX, Queiroz RCG, Siqueira SL, Pereira SM, Pacheco TJ, et al. Perfil sócio-demográfico e clínico-epidemiológico dos pacientes diagnosticados com hanseníase em Campos dos Goytacazes, RJ. Rev Bras Clin Med. 2011 mar-abr;9(2):101-6. [Link] [ Links ]
31 Tavares APN, Marques RC, Lana FCF. Ocupação do espaço e sua relação com a progressão da hanseníase no Nordeste de Minas Gerais - século XIX. Saude Soc. 2015;24(2):691-702. Doi: 10.1590/S0104-12902015000200023 [Link] [ Links ]
32 Oliveira, MHP. Os efeitos da hanseníase em homens e mulheres: um estudo de gênero [tese livre docência]. São Paulo (SP): Universidade de São Paulo, Escola de Enfermagem de Ribeirão Preto; 1995. 189 p. [ Links ]
33 Romão ER, Mazzoni AM. Perfil epidemiológico da hanseníase no município de Guarulhos, SP. R Epidemiol Control Infec. 2013 jan;3(1):22-7. Doi: 10.17058/reci.v3i1.3344 [Link] [ Links ]
34 Pinto Neto JM, Villa TCS. Características epidemiológicas dos comunicantes de hanseníase que desenvolveram a doença, notificados no Centro de Saúde de Fernandópolis (1993 a 1997). Hansen Int. 1999;24(2):129-36. [Link] [ Links ]
35 Vieira GD, Aragosa I, Carvalho RMB, Sousa CM. Hanseníase em Rondônia: incidência e características dos casos notificados, 2001 a 2012. Epidemiol Serv Saude. 2014 jun;23(2):269-75. Doi: 10.5123/S1679-49742014000200008 [Link] [ Links ]
36 Amaral EP, Lana FCF. Análise espacial da hanseníase na microrregião de Almenara, MG, Brasil. Rev Bras Enferm. 2008 nov;61(Esp):701-7. Doi: 10.1590/S0034-71672008000700008 [Link] [ Links ]
37 Corrêa RGCF, Aquino DMC, Caldas AJM, Amaral DKCR, França FS, Mesquita ERRBPL. Epidemiological, clinical, and operational aspects of leprosy patients assisted at a referral service in the state of Maranhão, Brazil. Rev Soc Bras Med Trop. 2012 Jan-Feb;45(1):89-94. Doi: 10.1590/S0037-86822012000100017 [Link] [ Links ]
38 Rosa SPS, Medeiros VM, Andrade SRSR, Medeiros OQ, Medeiros AC. Incidência de hanseníase na Paraíba entre os anos de 2010 a 2014. Rev Bra Edu Saude. 2016 out-dez;6(4):22-6. Doi: 10.18378/rebes.v6i4.4615 [Link] [ Links ]
39 Talhari C, Talhari S, Penna GO. Clinical aspects of leprosy. Clin Dermatol. 2015 Jan-Feb;33(1):26-37. Doi: 10.1016/j.clindermatol.2014.07.002 [Link] [ Links ]
40 Lana FCF, Carvalho APM, Davi RFL. Perfil epidemiológico da hanseníase na microrregião de Araçuaí e sua relação com ações de controle. Esc Anna Nery. 2011 jan-mar;15(1):62-7. Doi: 10.1590/S1414-81452011000100009 [Link] [ Links ]
41 Pereira DL, Brito LM, Nascimento AH, Ribeiro EL, Lemos KRM, Alves JN, et al. Estudo da prevalência das formas clínicas da hanseníase na cidade de Anápolis-GO. Ens Cienc. 2012;16(1):55-67. Doi: 10.17921/1415-6938.2012v16n1p%25p [Link] [ Links ]
42 Nickel DA, Schneider IJC, Traebert J. Carga das doenças infecciosas relacionadas à pobreza no Brasil. In: Ministério da Saúde (BR), Secretaria de Vigilância em Saúde, Departamento de Análise de Situação em Saúde. Saúde Brasil 2013: uma análise da situação de saúde e das doenças transmissíveis relacionadas à pobreza [Internet]. 10. ed. Brasília: Ministério da Saúde ; 2014 [citado 2018 jan 15]. p. 227-54. Disponível em: Disponível em: http://bvsms.saude.gov.br/bvs/publicacoes/saude_brasil_2013_analise_situacao_ saude.pdf . [ Links ]
43 Souza EA. Hanseníase, risco e vulnerabilidade: perspectiva espaço-temporal e operacional de controle no Estado da Bahia, Brasil [tese]. Fortaleza (CE): Universidade Federal do Ceará; 2017. 321 p. .[Link] [ Links ]
44 Barbosa DRM, Almeida MG, Santos AG. Características epidemiológicas e espaciais da hanseníase no Estado do Maranhão, Brasil, 2001-2012. Medicina (Ribeirão Preto). 2014;47(4):347-56. Doi: 10.11606/issn.2176-7262.v47i4p347-356 [Link] [ Links ]
45 Lockwood DN, Shetty V, Penna GO. Hazards of setting targets to eliminate disease: lessons from the leprosy elimination campaign. BMJ. 2014 Feb;348:g1136. Doi: 10.1136/bmj.g1136 [Link] [ Links ]
46 Simões MJS, Delello D. Estudo do comportamento social dos pacientes de hanseníase do município de São Carlos - SP. Rev Espaço Saude. 2005 dez;7(1):10-5. [ Links ]
47 Queirós MI. Perfil sociodemográfico, clínico-epidemiológico e padrões de atendimento da hanseníase em hospital universitário de Fortaleza - Ceará, 2007-2011 [dissertação]. Fortaleza (CE): Universidade Federal do Ceará; 2014. 107 p. [Link] [ Links ]
48 Lopes VAS, Rangel EM. Hanseníase e vulnerabilidade social: uma análise do perfil socioeconômico de usuários em tratamento irregular. Saude Debate. 2014 out-dez;38(103):817-29. Doi: 10.5935/0103-1104.20140074 [Link] [ Links ]
49 Pires CAA, Malcher CMSR, Abreu Jr JMC, Albuquerque TG, Corrêa IRS, Daxbacher ELR. Hanseníase em menores de 15 anos: a importância do exame de contato. Rev Paul Pediatr. 2012 jun;30(2):292-5. Doi: 10.1590/S0103-05822012000200022 [Link] [ Links ]
50 Melão S, Blanco LFO, Mounzer N, Veronezi CCD, Simões PWTA. Perfil epidemiológico dos pacientes com hanseníase no extremo sul de Santa Catarina, no período de 2001 a 2007. Rev Soc Bras Med Trop. 2011 jan-fev;44(1):79-84. Doi: 10.1590/S0037-86822011000100018 [Link] [ Links ]
51 Monteiro LD, Alencar CHM, Barbosa JC, Braga KP, Castro MD, Heukelbach J. Incapacidades físicas em pessoas acometidas pela hanseníase no período pós-alta da poliquimioterapia em um município no Norte do Brasil. Cad Saude Publica. 2013;29(5):909-20. Doi: 10.1590/S0102-311X2013000500009 [Link] [ Links ]
52 Femina LL, Nardi SMT, Donda P, Lozano AW, Lazaro C, Paschoal VDA. Perfil epidemiológico da hanseníase em município do interior paulista. Arq Cienc Saude. 2016 out-dez;23(4):15-20. Doi: 10.17696/2318-3691.23.4.2016.235 [Link] [ Links ]
53 Ministério da Saúde (BR), Secretaria de Vigilância em Saúde, Coordenação-Geral de Desenvolvimento da Epidemiologia em Serviços. Guia de vigilância em saúde [Internet]. Brasília: Ministério da Saúde ; 2017 [citado 2018 fev 20]. p. 309-40. Disponível em: Disponível em: http://portalarquivos2.saude.gov.br/images/pdf/2017/setembro/05/Guia-de-Vigilancia-em-Saude-2017-Volume-2.pdf . [ Links ]
54 Durães SMB, Guedes LS, Cunha MD, Magnanini MMF, Oliveira MLWDR. Estudo epidemiológico de 107 focos familiares de hanseníase no município de Duque de Caxias - Rio de Janeiro, Brasil. An Bras Dermatol. 2010 jun;85(3):339-45. Doi: 10.1590/S0365-05962010000300007 [Link] [ Links ]
55 Smith WCS, Aerts A. Role of contact tracing and prevention strategies in the interruption of leprosy transmission. Lepr Rev. 2014 Mar;85(1):2-17. [ Links ]
56 Lanza FM, Lana FCF. O processo de trabalho em hanseníase: tecnologias e atuação da equipe de saúde da família. Texto Contexto Enferm. 2011;20(Esp):238-46. Doi: 10.1590/S0104-07072011000500030 [Link] [ Links ]
57 Corrêa CMJ, Ivo ML, Honer MR. Incapacidades em sujeitos com hanseníase em um Centro de Referência do Centro-Oeste brasileiro entre 2000-2002. Hansen Int. 2006;31(2):21-8. [Link] [ Links ]
58 Ramos JMH, Souto FJD. Incapacidade pós-tratamento em pacientes hansenianos em Várzea Grande, Estado de Mato Grosso. Rev Soc Bras Med Trop. 2010 mai-jun;43(3):293-7. Doi: 10.1590/S0037-86822010000300016 [Link] [ Links ]
59 Mantellini GG, Gonçalves A, Padovani CR. Incapacidades físicas em hanseníase: coisa do passado ou prioridade na prevenção? Hansen Int. 2009;34(2):33-9. [Link] [ Links ]
60 Sousa BRM, Moraes FHA, Andrade JS, Lobo ES, Macêdo EA, Pires CAA, et al. Educação em saúde e busca ativa de casos de hanseníase em uma escola pública em Ananindeua, Pará, Brasil. Rev Bras Med Fam Comunidade. 2013;8(27):143-9. Doi: 10.5712/rbmfc8(27)467 [Link] [ Links ]
61 Alencar CH, Ramos Jr AN, Santos ES, Richter J, Heukelbach J. Clusters of leprosy transmission and of late diagnosis in a highly endemic area in Brazil: focus on different spatial analysis approaches. Trop Med Int Health. 2012 Apr;17(4):518-25. Doi: 10.1111/j.1365-3156.2011.02945.x [Link] [ Links ]
62 Alencar CHM, Ramos Jr AN, Sena Neto SA, Murto C, Alencar MJF, Barbosa JC, et al. Diagnóstico da hanseníase fora do município de residência: uma abordagem espacial, 2001 a 2009. Cad Saude Publica. 2012;28(9):1685-98. Doi: 10.1590/S0102-311X2012000900008 [Link] [ Links ]
63 Instituto Brasileiro de Geografia e Estatística. Censo demográfico 2010: Pará [Internet]. Rio de Janeiro: IBGE ; 2017 [citado 2017 nov 16]. Disponível em: Disponível em: http://www.ibge.gov.br/home/estatística/censo 2010 . [ Links ]
64 Sarmento APA, Pereira AM, Ribeiro F, Castro JL, Almeida MB, Ramos NM. Perfil epidemiológico da hanseníase no período de 2009 a 2013 no município de Montes Claros (MG). Rev Soc Bras Clin Med. 2015 jul-set;13(3):180-4. [Link] [ Links ]
65 Murto C, Chammartin F, Schwarz K, Costa LMM, Kaplan C, Heukelbach J. Patterns of migration and risks associated with leprosy among migrants in Maranhão, Brazil. PLoS Negl Trop Dis. 2013 Sep;7(9):e2422. Doi: 10.1371/journal.pntd.0002422 [Link] [ Links ]
66 Gracie R, Peixoto JNB, Soares FBR, Hacker MAV. Análise da distribuição geográfica dos casos de hanseníase. Rio de Janeiro, 2001 a 2012. Cienc Saude Coletiva. 2017 mai;22(5):1695-704. Doi: 10.1590/1413-81232017225.24422015 [Link] [ Links ]
67 Monteiro LD, Martins-Melo FR, Brito AL, Alencar CH, Heukelbach J. Spatial patterns of leprosy in a hyperendemic state in Northern Brazil, 2001-2012. Rev Saude Publica. 2015 Dec;49:84. Doi: 10.1590/S0034-8910.2015049005866 [Link] [ Links ]
68 Imbiriba EB, Hurtado-Guerreiro JC, Garnelo L, Levino A, Cunha MG, Pedrosa V. Perfil epidemiológico da hanseníase em menores de quinze anos de idade, Manaus (AM), 1998-2005. Rev Saude Publica. 2008 dez; 42(6):1021-6. Doi: 10.1590/S0034-89102008005000056 [Link] [ Links ]
69 Hino P, Villa TCS, Cunha TN, Santos CB. Distribuição espacial de doenças endêmicas no município de Ribeirão Preto (SP). Cienc Saude Coletiva. 2011;16 Supl 1:1289-94. Doi: 10.1590/S1413-81232011000700062 [Link] [ Links ]
70 Barreto ML, Teixeira MG, Bastos FI, Ximenes RA, Barata RB, Rodrigues LC. Successes and failures in the control of infectious diseases in Brazil: social and environmental context, policies, interventions, and research needs. Lancet. 2011 May;377(9780):1877-89. Doi: 10.1016/S0140-6736(11)60202-X [Link] [ Links ]
Cómo citar este artículo / How to cite this article: Pereira WMM, Vieira ABR, Oliveira SS, Sadeck LWR, Narvaes IS, Adami M, et al. Lepra en metrópolis de la Amazonía brasileña: cobertura de atención básica a la salud y su relación con el perfil clínico y la distribución espacio-temporal de la enfermedad en Belém, estado de Pará, Brasil, de 2006 a 2015. Rev Pan Amaz Saude. 2019;10:e201900069. Doi: http://dx.doi.org/10.5123/S2176-6223201900069.
Recibido: 07 de Abril de 2018; Aprobado: 21 de Mayo de 2019











 texto em
texto em