Artigo atualizado em 19/12/2023
INTRODUÇÃO
Tomé-Açu é um dos polos de desenvolvimento da agricultura comercial mais importantes do estado do Pará, Brasil. Na região onde se encontra o Município, há também empreendimentos de mineração. Essas atividades podem provocar transformações ambientais capazes de alterar a fauna e o comportamento de insetos, incluindo os vetores dos agentes causadores das leishmanioses, aumentando assim a incidência da doença em humanos.
Em 2015, Tomé-Açu foi incluído em uma pesquisa clínica com o propósito de se identificar a diversidade de espécies de Leishmania infectando os doentes portadores de leishmaniose cutânea, por meio de PCRs, sequenciamento e filogenia, utilizando diferentes marcadores moleculares. Além de Leishmania (Viannia) braziliensis e Leishmania (Viannia) shawi, a Leishmania (Leishmania) infantum foi encontrada associada a lesões cutâneas de quatro dos 18 pacientes examinados (Garcez LM et al. 2017, dados não publicados), um achado incomum em portadores de leishmaniose cutânea, apenas relatado em dois Estados brasileiros: Rio de Janeiro e Mato Grosso do Sul1,2.
Apesar das transformações ambientais que vêm ocorrendo em Tomé-Açu, um município endêmico para as leishmanioses visceral e cutânea e com associação dessa forma clínica com L. (L.) infantum, espécie preferencialmente viscerotrópica, estudos ecológicos sobre flebotomíneos inexistem. Considerando que os níveis de virulência do protozoário são afetados pela sua passagem em vetores3,4, e que esses são impactados pelas modificações ambientais, o estudo dos flebotomíneos é fundamental para se conhecer as espécies com potencial para transmitir Leishmania spp. A identificação da fauna de flebotomíneos presente em áreas de risco em Tomé-Açu constitui-se, portanto, no objetivo do presente estudo, por meio de um levantamento realizado durante o verão e o inverno amazônicos.
MATERIAIS E MÉTODOS
CARACTERIZAÇÃO DO MUNICÍPIO
O município de Tomé-Açu, no nordeste paraense, dista aproximadamente 200 km em linha reta da capital, Belém (Figura 1). A população estimada, em 2014, era de 59.978 pessoas, com baixa densidade demográfica (10,98 habitantes/km2). Grande parte da população (~80%) mora em residências de madeira, palha ou taipa e sem saneamento básico5.
Fonte: Base cartográfica do Instituto Brasileiro de Geografia e Estatística.
Figura 1 - Mapa do estado do Pará indicando a localização do município de Tomé-Açu em relação à capital do Estado, Belém
Dentre as constantes modificações ambientais, destaca-se a perda de cobertura vegetal, pois o Município possui uma extensão territorial de 5.169 km² e, até 2014, 57,40% (2967,2 km2) dessa extensão já havia sido deflorestada6.
INQUÉRITO ENTOMOLÓGICO
Seleção dos locais de captura
A partir de indicações da Secretaria Municipal de Saúde (SMS), duas áreas rurais de Tomé-Açu com casos notificados de leishmanioses foram selecionadas: comunidades Ubim e Vila Socorro. O procedimento amostral teve início com a quantificação e o mapeamento de todas as unidades domiciliares de ambas as áreas. Em seguida, foram selecionadas, aleatoriamente, cinco unidades domiciliares em cada comunidade, para a amostragem de flebotomíneos, compreendidas nos seguintes limites geográficos: Ubim (02°18'28.7" - 20'52.6" S; 048°23'41.2" - 24'24.3" W) e Vila Socorro (02°15'11.0" - 22.3" S; 048°17'35.2" - 51.4" W).
Em cada residência, foram dispostas três armadilhas luminosas tipo CDC7, sendo uma no intradomicílio e outras duas no extradomicílio, uma em um abrigo animal (galinheiro, curral ou chiqueiro) e outra em vegetação secundária no entorno do domicílio (pomar, açaizal ou capoeira). As armadilhas permaneceram em cada local durante 12 h, sendo ligadas às 18:00 e desligadas às 06:00 do dia seguinte. Esse procedimento foi realizado durante três noites consecutivas, totalizando 180 h de esforço amostral/área/período. As capturas ocorreram em dois períodos, seco (setembro/outubro de 2014) e chuvoso (março de 2015).
Procedimentos no laboratório
Os espécimes foram segregados por área, data e ambiente, armazenados em frascos de plástico contendo álcool a 70% e devidamente etiquetados, para posterior clarificação, identificação e quantificação.
Os espécimes foram identificados utilizando chaves dicotômicas de Young & Duncan8 e Galati9,10. A classificação seguiu a proposta de Galati9 e a abreviação dos gêneros e subgêneros foi feita conforme proposto por Marcondes11.
Adicionalmente, todos os espécimes foram montados entre lâmina e lamínula, utilizando o fluído de Berlese,
e incorporados à coleção de flebotomíneos do Laboratório de Epidemiologia Aplicada às Leishmanioses da Seção de Parasitologia do Instituto Evandro Chagas (IEC/SVS/MS).
RESULTADOS
As capturas totalizaram 1.129 espécimes, agrupados em 35 espécies e 12 gêneros (Bichromomyia, Brumptomyia, Evandromyia, Lutzomyia, Micropygomyia, Nyssomyia, Psathyromyia, Psychodopygus, Sciopemyia, Trichopygomyia, Trichophoromyia e Viannamyia). A quantidade de espécimes capturados, no período chuvoso, foi cerca de 2,27 vezes maior do que no seco (784 e 345, respectivamente). Em ambas as comunidades, durante o período chuvoso, a quantidade de fêmeas foi 1,77 vezes maior que a de machos (501 e 283, respectivamente). No período seco, observou-se que a quantidade de machos foi 1,41 vezes maior que a de fêmeas (202 e 143, respectivamente) (Tabela 1).
Tabela 1 - Número, distribuição por sexo e frequência de flebotomíneos capturados nos períodos chuvoso e seco em duas áreas do município de Tomé-Açu, estado do Pará, Brasil
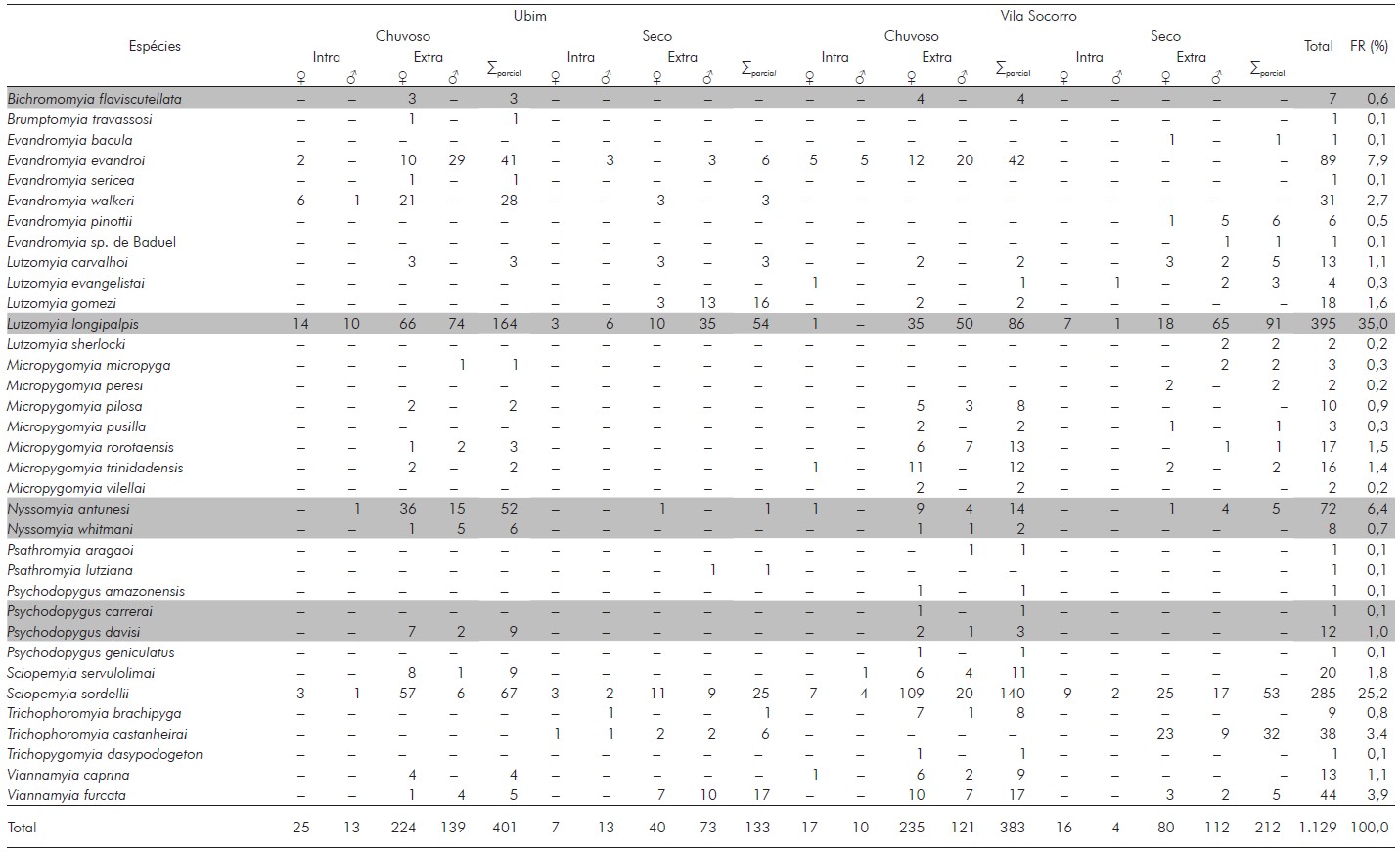
Intra: Intradomicílio; Extra: Extradomicílio; ∑parcial: Total parcial de espécimes; FR: Frequência relativa. As linhas destacadas indicam as espécies de comprovada importância na epidemiologia da doença. Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
Das 35 espécies registradas, os gêneros com maior representatividade foram Micropygomyia (sete), Evandromyia (seis), Psychodopygus (quatro) e Lutzomyia (cinco), conforme dados sumarizados na Tabela 1.
Lutzomyia longipalpis foi a espécie predominante, representando 35,0% (395) da amostra, seguida por Sciopemyia sordellii (25,2%; 285), Evandromyia evandroi (7,9%; 89) e Nyssomyia antunesi (6,4%; 72). Lu. longipalpis predominou tanto no período seco (12,8%; 145) quanto no chuvoso (22,1%; 250), como mostra a Tabela 1.
Outras espécies que também tiveram uma notável representatividade no período seco foram Sc. sordellii (6,9%; 78), Trichophoromyia castanheirai (3,4%; 38), Viannamyia furcata (1,9%; 22) e Lutzomyia gomezi (16). No período chuvoso, foram Sc. sordellii (18,3%; 207), Ev. evandroi (7,4%; 83) e Ny. antunesi (5,8%; 66) (Tabela 1).
Quanto aos ambientes intra e extradomiciliar, foi observada maior frequência de flebotomíneos no extradomicílio, com 90,7% (1.024), e apenas 9,3% (105) no intra. Incursões de flebotomíneos ao ambiente intradomiciliar foram maiores no período chuvoso (5,8%; 65) do que no seco (3,5%; 40). No extradomicílio, a maior frequência de flebotomíneos foi também durante o período chuvoso (63,7%; 719) do que no seco (27,0%; 305) (Tabela 1).
Foram registradas nove espécies no ambiente intradomiciliar no período chuvoso e cinco no período seco, enquanto que, no ambiente extradomiciliar, foram registradas 28 e 20 espécies nos períodos chuvoso e seco, respectivamente (Tabela 2).
Tabela 2 - Matriz de ocorrência dos flebotomíneos capturados nos períodos chuvoso e seco em ambientes intra e extradomiciliares, nas áreas rurais do município de Tomé-Açu, Pará, Brasil

Intra: Intradomicílio; Extra: Extradomicílio; RO: Roça; MS: Mata secundária; PO: Pomar; CR: Curral; GA: Galinheiro; CH: Chiqueiro; AL: Açaizal; CA: Capoeira; QA: Quantidade de ambientes. Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
No extradomicílio, exclusivamente em galinheiros, foram coletadas sete espécies no período chuvoso e seis no seco, com destaque para as espécies Ev. evandroi, Lu. longipalpis, Lu. gomezi, Micropygomyia peresi, Micropygomyia pusilla, Micropygomyia rorotaensis e Micropygomyia trinidadensis que estavam nesse tipo de estrutura artificial em ambos os períodos (Tabela 2).
Lu. longipalpis foi predominante com 395 exemplares identificados, dos quais 42 (10,6%) foram capturados no intradomicílio e 353 (89,3%) no extradomicílio. A espécie foi detectada em todas as residências amostradas e nessas havia criação de galinhas nos galinheiros construídos nos peridomicílios. Considerando o total de flebotomíneos capturados (1.129 exemplares), esses valores equivalem a 3,7% e 31,2% dos indivíduos capturados no intra e peridomicílio, respectivamente.
DISCUSSÃO
Na Região Norte do Brasil, foram registradas 200 espécies de flebotomíneos; só no estado do Pará, aproximadamente 130 espécies10. O total de espécies de flebotomíneos registrado neste estudo equivale a 26,9% do que está registrado para o Estado, mostrando quão rica é a fauna de flebotomíneos na área de estudo.
No presente estudo, uma maior quantidade de espécimes foi capturada durante o período chuvoso, o que pode ser explicado pela influência de fatores climáticos, tais como elevada umidade, altas temperaturas e maior disponibilidade de recursos alimentares12. A quantidade de fêmeas também foi maior que a de machos durante a época chuvosa (1,77:1), o que pode estar relacionado principalmente aos fatores climáticos.
Entre a fauna amostrada em Tomé-Açu, foram identificadas espécies de importância epidemiológica por serem vetoras ou suspeitas de transmitirem Leishmania spp., tais como Bichromomyia flaviscutellata, Ny. antunesi, Psychodopygus davisi, Psychodopygus carrerai, Psychodopygus amazonensis, Lu. gomezi, Nyssomyia whitmani, Lu. longipalpis13,14,15.
Bi. flaviscutellata está amplamente distribuída na América do Sul e é considerada transmissora de Leishmania (Leishmania) amazonensis13,14,15. A pouca quantidade de espécimes de Bi. flaviscutellata capturada neste estudo possivelmente está relacionada ao método de captura utilizado (armadilha CDC) pois, segundo Shaw e Lainson16, métodos que utilizam iscas vivas, como roedores, são mais efetivos na captura dessa espécie. Exemplares dessa espécie foram capturados nos ambientes de roça, capoeira e mata secundária; embora Bi. flaviscutellata seja tipicamente silvestre, mais abundante em campinas e campinaranas17, pode eventualmente explorar, de forma diferencial, áreas degradadas, geralmente ocupadas por populações humanas, propiciando o contato homem-vetor.
Ny. antunesi, provável vetor de Leishmania (Viannia) lindenbergi18, foi capturada em ambos os períodos, com destaque para o período chuvoso, quando a espécie foi capturada em quase todos os ambientes extradomiciliares e no intradomicílio. Apesar da quantidade de indivíduos da espécie não ter sido expressiva, a presença dela no intradomicílio, durante a época chuvosa, não pode ser negligenciada.
De forma geral, as espécies do gênero Psychodopygus são antropofílicas, picando o homem avidamente, e são frequentemente encontradas em áreas de floresta preservada. As quatro espécies de Psychodopygus identificadas neste estudo foram capturadas no período chuvoso, em áreas de capoeira e mata secundária; adicionalmente, Ps. davisi foi registrada também em galinheiro. Ps. davisi é vetora de Leishmania (Viannia) naiffi e L. (V.) braziliensis no Brasil19,20; Ps. carrerai é transmissora de L. (V.) braziliensis na Bolívia21; e Ps. amazonensis já foi encontrada naturalmente infectada com tripanossomatídeos (não Leishmania) na Serra dos Carajás, Pará22, e ainda é considerada como possível vetor de L. (V.) naiffi no Brasil23.
Lu. gomezi é implicada na transmissão de Leishmania (Viannia) panamensis nas Américas do Sul e Central e também foi encontrada infectada por L. (V.) braziliensis na Venezuela15,24. Souza et al.25 encontraram um espécime de Lu. gomezi naturalmente infectado com L. (V.) shawi, sugerindo o provável envolvimento da espécie na transmissão da leishmaniose cutânea na Região Amazônica. No presente estudo, a espécie foi capturada somente em ambientes extradomiciliares.
Ny. whitmani é possivelmente um complexo de espécies e, portanto, sua importância como vetor de Leishmania spp., nas Regiões Nordeste, Sudeste, Sul e Centro-Oeste do Brasil, deve ser reavaliada15. Apesar de ser considerada silvestre, evidências apontam uma forte tendência para habitar áreas de mata alteradas pelo homem e também o peridomicílio26. No presente estudo, a espécie foi registrada em áreas alteradas, como roças e capoeira, e em galinheiros, reforçando essas evidências de adaptação também na Região Norte do país.
No que diz respeito à Sc. sordellii, apesar da expressiva quantidade de indivíduos capturados e por ter sido registrada em todos ecótopos avaliados, a espécie é considerada sem importância epidemiológica, embora já tenha sido encontrada infectada naturalmente por tripanossomatídeos27.
Ambientes próximos dos domicílios, com condições favoráveis à atração de vetores, seja para refúgio e/ou devido à disponibilidade de fontes alimentares (p.ex. galinheiros, currais e chiqueiros), favorecem a aproximação dos vetores às residências humanas. No presente estudo, 18 espécies de flebotomíneos foram registradas em galinheiros no período chuvoso e 12 no período seco. Dessas, quatro foram capturadas exclusivamente neste tipo de anexo peridoméstico. As aves tendem a exercer forte atração aos flebotomíneos, e a presença de galinheiros próximos às residências sugere que esse tipo de ambiente desempenha importante papel epidemiológico, por propiciar o estabelecimento e a manutenção do ciclo de transmissão das leishmanias nessas áreas, como já mencionado por outros autores28. Essa informação também foi corroborada por Afonso et al.29, que mostraram, após a análise de identificação de fontes alimentares de Lu. longipalpis, uma alta porcentagem de preferência alimentar desse vetor por aves, em comparação a outras fontes identificadas.
Lu. longipalpis, o principal vetor de L. (L.) infantum e encontrada naturalmente infectada por Leishmania (Viannia) sp. em área com casos humanos atribuíveis a L. (V.) braziliensis30,31, ambas associadas a casos de leishmaniose em Tomé-Açu, é uma espécie de grande plasticidade adaptativa a tipos de ambientes, além de ser uma espécie eclética quanto às fontes alimentares. Nas áreas rurais do município de Tomé-Açu, a presença de abrigos de animais (e.g. galinheiros, chiqueiros e currais) é comum nos arredores das residências, constituindo micro-habitats propícios ao estabelecimento do vetor, pois são ricos em matéria orgânica, oferecendo condições para o desenvolvimento da fase imatura dos insetos (larvas). Os animais domésticos estão entre os que mais exercem atração sob a espécie para o repasto sanguíneo32, haja vista que a presença de Lu. longipalpis foi detectada em todas as residências incluídas no estudo e em todas havia a criação de galinhas nos galinheiros construídos em suas proximidades.
Outro fator importante na dinâmica do vetor são as constantes transformações da paisagem do entorno, que resultam na ampliação de áreas de plantio e que, aliadas à grande plasticidade adaptativa observada em Lu. longipalpis28, geram um cenário propício para o estabelecimento da espécie, devido à vasta disponibilidade de micro-habitats ricos em micronutrientes para o desenvolvimento do vetor.
CONCLUSÃO
A fauna de flebotomíneos das áreas estudadas foi mais abundante durante o período chuvoso.
Os galinheiros, com as aves domésticas, mostraram-se como os ecótopos mais atrativos para os vetores, devido ao elevado número de espécies que foi registrado nesse tipo de estrutura artificial em ambas as estações, indicando uma possível associação entre os insetos e as aves domésticas.
A abundância de Lu. longipalpis, em ambas as estações, em galinheiros instalados próximos às unidades domiciliares, associada à falta de efetivas barreiras físicas, favorece o contato homem-vetor no intradomicílio e aumenta o risco de transmissão da leishmaniose visceral nas áreas rurais de Tomé-Açu.
O papel desempenhado por Bi. flaviscutellata, Ny. antunesi, Ny. whitmani, Ps. davisi e Sc. sordellii, na transmissão da leishmaniose cutânea no Município, deve ser melhor caracterizado.
A construção de abrigos para os animais distante das unidades domiciliares e a melhoria das residências, por meio da adição de barreiras físicas (telas em janelas, portas e forros), associadas a campanhas de educação em saúde, possivelmente consistiriam em importantes medidas profiláticas na transmissão de Leishmania spp. a humanos no Município.
Espera-se que as informações fornecidas neste trabalho sirvam como linha de base para a orientação das ações de vigilância e controle vetorial em Tomé-Açu.











 texto em
texto em 


