Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Pan-Amazônica de Saúde
Print version ISSN 2176-6215On-line version ISSN 2176-6223
Rev Pan-Amaz Saude vol.10 Ananindeua 2019 Epub Nov 20, 2019
http://dx.doi.org/10.5123/s2176-6223201901632
ARTÍCULO ORIGINAL
Reevaluación de laboratorio de la infección por el virus de la hepatitis C en pacientes en diálisis atendidos en la década de 1990, en Belém, estado de Pará, Brasil
1 Hospital Universitário João de Barros Barreto, Belém Pará, Brasil
2 Instituto Evandro Chagas/SVS/MS, Seção de Hepatologia, Belém, Pará, Brasil
3 NefroCentro, Belém, Pará, Brasil
OBJETIVO:
Describir aspectos del diagnóstico de laboratorio serológico y molecular de la infección por el virus de la hepatitis C (VHC - en inglés hepatitis C virus), en pacientes sometidos a tratamiento en una clínica de diálisis de Belém, estado de Pará, Brasil, en el período de 1990 a 1993.
MATERIALES Y MÉTODOS:
Estudio retrospectivo para reevaluación de muestras de suero de pacientes dializados, utilizando pruebas serológicos para la detección del VHC (anti-VHC y Ag-Ab VHC) y VHC-ARN, por la técnica molecular de RT-PCR.
RESULTADOS:
Se incluyeron 115 pacientes dializados con muestras de suero recolectadas en el período del estudio. El análisis de esas muestras presentó prevalencia de 16,5% de anti-VHC reactivo, entre las cuales un 4,3% presentaron indicador de replicación viral activa (VHC-ARN reactivo). Se detectó una tasa de seroconversión en 55,2% de los pacientes en el período analizado. El grupo anti-VHC, Ag-Ab VHC y VHC-ARN reactivo fue el más prevalente (41,7%). En relación a las muestras anti-VHC no reactivas, se verificó replicación viral con VHC-ARN reactivo en 22,7%. Fueron detectados los genotipos 1 y 3. El genotipo 1 fue prevalente en 73,0% de las muestras.
CONCLUSIÓN:
Cuando se introdujo la selección de laboratorio para VHC (anti-VHC) en la clínica de diálisis, fue posible observar: alta prevalencia de infección por VHC entre los pacientes en tratamiento; altos índices de seroconversión; equiparación entre resultados serológicos, utilizando los métodos de ELISA de segunda y tercera generación; presencia de replicación viral entre los pacientes anti-VHC no reactivos; y mayor prevalencia del genotipo 1 de VHC.
Palabras clave: Virus de la Hepatitis C; Pruebas Serológicas; Hemodiálisis
INTRODUCCIÓN
La hepatitis C es una causa importante de morbilidad y mortalidad en todo el mundo; según la Organización Mundial de la Salud, aproximadamente 71 millones de personas están infectadas crónicamente con el virus de la hepatitis C (VHC - del inglés hepatitis C virus), responsable de la muerte de 399.000 personas cada año1. Esta enfermedad puede evolucionar de forma asintomática, oligosintomática o sintomática, lenta y muchas veces silenciosa, durante décadas, y también puede progresar a cirrosis, descompensación hepática y hepatocarcinoma, convirtiéndose en la causa más frecuente de trasplante hepático en Brasil y en el mundo2.
Aunque la hipótesis de la existencia de un nuevo agente viral, asociado con casos de hepatitis aguda postransfusional, se ha planteado desde principios de la década de 19703, el VHC no se descubrió hasta 1989. En ese año, los investigadores de Chiron Corporation describieron la clonación molecular del genoma viral de plasma de chimpancé infectado, experimentalmente, con sangre de un paciente con hepatitis no A no B, proporcionando la identificación del agente etiológico entonces llamado virus de la hepatitis C, un hallazgo que subsidió el desarrollo posterior de la primer prueba serológica para detección de anticuerpos anti-VHC4,5.
La diálisis es un tipo de terapia que se utiliza para tratar la uremia en pacientes que desarrollan insuficiencia renal, siendo responsable por la supervivencia de aproximadamente 34.000 personas en Brasil6. Los pacientes con insuficiencia renal crónica, sometidos a tratamiento de diálisis, están predispuestos a la infección por VHC por transfusión de sangre, donación de órganos o incluso por exposición a pacientes infectados que acuden a la misma clínica de diálisis; así, la enfermedad hepática causada por el VHC es una causa importante de morbilidad y mortalidad en pacientes con insuficiencia renal crónica sometidos a diálisis7.
En Brasil, el reglamento técnico para el funcionamiento de los servicios sustitutivos de terapia renal fue creado a través de la Ordenanza GM/MS Nº 2.042, del 11 de octubre de 1996. A partir de ese momento, las unidades de diálisis comenzaron a seguir normas estrictas, pasando por una reestructura casi inmediata de todos los servicios de terapia renal sustitutiva en Brasil. La Ordenanza GM/MS Nº 82, de 3 de enero de 2000, es otro intento de redefinir los criterios mínimos para el funcionamiento de las unidades de diálisis, para reducir los riesgos a los que se exponen los pacientes al someterse a diálisis y definir reglas específicas para el registro en el Sistema Único de Salud8,9.
Durante el período de enero de 1990 a junio de 1993, se realizó un cribado serológico de 178 muestras de suero de pacientes en tratamiento de diálisis peritoneal y hemodiálisis en una unidad de diálisis con antecedentes de brote de hepatitis en Belém, en el estado de Pará, Brasil. Los resultados de la serología indicaron una positividad anti-VHC de 9% y 70% en individuos sometidos a diálisis peritoneal y hemodiálisis, respectivamente. La alta seroconversión concomitante sugirió que la alta seroprevalencia estaba relacionada con la transmisión del VHC no solo con respecto al tratamiento, sino también al tiempo de tratamiento de diálisis al que se sometió el paciente10,11,12.
Con el objetivo de contribuir con información sobre las características epidemiológicas y de laboratorio de la infección por VHC durante la detección temprana del virus en pacientes en diálisis en Brasil, el presente estudio desarrolló una reevaluación de la ocurrencia de VHC en las muestras de suero de pacientes en tratamiento en esa clínica de diálisis, durante el período ya estudiado (1990-1993), utilizando muestras que fueron depositadas en el banco de la Sección de Hepatología (SAHEP), del Instituto Evandro Chagas (IEC), de la Secretaría de Vigilancia en Salud (SVS), del Ministerio de Salud (MS), aplicando métodos más recientes de diagnóstico serológico y molecular del VHC. Dichos métodos tenían como objetivo evaluar la ocurrencia de Ag-Ab VHC y/o VHC-ARN en los casos en que no hubo conversión serológica a anti-VHC, además de caracterizar los genotipos del VHC circulantes en el período, proporcionando así información para ayudar en el cribado y en el control de la infección por VHC en unidades de diálisis.
MATERIALES Y MÉTODOS
Estudio epidemiológico, descriptivo, retrospectivo, de reevaluación de las muestras de suero y datos de los pacientes sometidos a tratamiento dialítico en una clínica de diálisis de Belém, entre 1990 y 1993. En esa ocasión hubo un brote de hepatitis en la referida clínica, motivando la realización de una investigación con el objetivo, en la época, de determinar la etiología de la enfermedad11.
Fueron seleccionados para el estudio 115 pacientes sometidos a tratamiento dialítico, que tenían más de tres muestras de suero colectadas en el período del estudio y que estaban en un criobanco (-20º C) bajo la responsabilidad de SAHEP/IEC. Se excluyeron los pacientes cuyas muestras estaban agotadas y las informaciones demográficas mínimas no pudieron ser rescatadas. Todos los exámenes de laboratorio se realizaron en la SAHEP/IEC, según el algoritmo presentado por la figura 1 se obedeció el criterio de tres meses (90 días) entre la primera y la última muestra examinada. Para este estudio, no se comparó en el momento específico de la seroconversión.
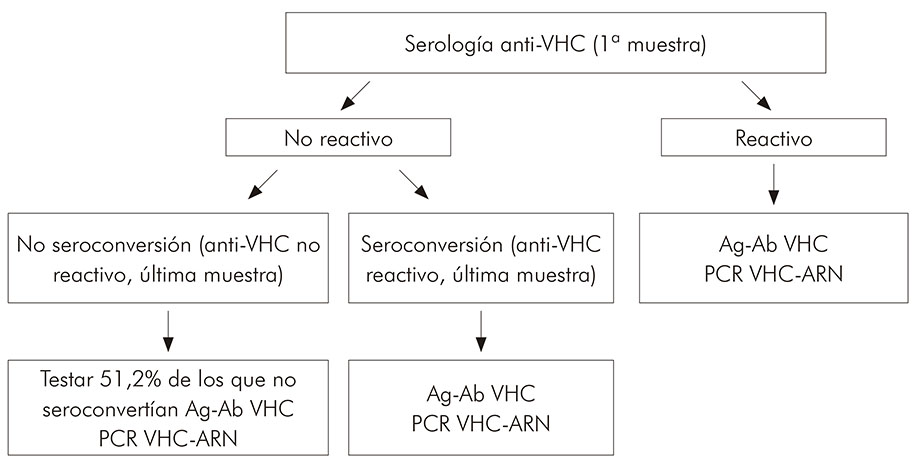
Figura 1 - Algoritmo para ejecución de pruebas de laboratorio en muestras de suero de pacientes sometidos a tratamiento en una clínica de diálisis de Belém, estado de Pará, Brasil, en el período de 1990 a 1993
Las pruebas serológicas anti-VHC se realizaron por técnica inmunoenzimática, tipo ELISA, con kits comerciales (Ortho® VHC 3.0 ELISA Test System, Ortho-Clinical Diagnostics, Inc., New Jersey, EUA), ejecutados e interpretados según la orientación de los fabricantes. Las muestras de los individuos con serología anti-VHC reactiva se sometieron al análisis del marcador serológico Ag-Ab VHC (Monolisa® VHC Ag-Ab ULTRA, Bio-Rad, Marnes - La Coquette, França).
Las muestras de suero se sometieron a estudio del ARN (por Nested RT-PCR) por amplificación de un fragmento de aproximadamente 230 pb de la región 5' no traducida (5' UTR) viral, utilizando primers y condiciones de termociclado previamente descritas13.
La detección del ARN-VHC amplificado se realizó mediante electroforesis en gel de agarosa al 1%. Las muestras positivas de ARN-VHC se sometieron a secuenciación de nucleótidos mediante el método de Sanger et al.14. Los productos de la PCR se secuenciaron utilizando el kit de secuenciación de ciclos BigDye® Terminator v3.1 (Applied Biosystems, Foster City, CA, EE. UU.) En el secuenciador automático ABI 3500 (Applied Biosystems, EE. UU.).
Para la caracterización de los genotipos de las muestras positivas se analizaron las secuencias obtenidas en el estudio mediante el programa Geneious v5.6.5, para el montaje de las secuencias consenso, y, posteriormente, se alinearon con secuencias de referencia de los genotipos del VHC, obtenidas de GenBank, utilizando el programa Clustal W integrado con el paquete Geneious.
Los datos obtenidos y los resultados de las pruebas se almacenaron en una base de datos utilizando el software Hepatoware, desarrollado en la SAHEP/IEC. Los análisis estadísticos se realizaron utilizando el programa BioEstat v516. En la construcción de gráficos y tablas se utilizó Microsoft Excel 2007 y Harvard Graphics 98.
Conforme con la Resolución CNS Nº 466/2012 de la Comisión Nacional de Ética en Investigación15, el proyecto de esta investigación fue aprobado por el Comité de Ética en Investigación con Seres Humanos del Instituto Evandro Chagas, con fecha de aprobación del 22 de setiembre de 2011 y parecer Nº 029/2011.
RESULTADOS
Entre las muestras examinadas de los 115 pacientes, se observó una frecuencia de 53,0% (61/115) para el sexo masculino. El análisis serológico, utilizando tanto el método ELISA de segunda generación, realizado en la época de la recolección de las muestras, como el método ELISA de tercera generación, demostraron frecuencias iguales de anti-VHC reactivo de 62,6% (72/115) en ambos métodos (Tabla 1).
Tabla 1 - Frecuencia de anti-VHC+, por sexo, utilizando métodos ELISA de segunda y tercera generación, en muestras de suero de pacientes sometidos a tratamiento en una clínica de diálisis de Belém, estado de Pará, Brasil, en el período de 1990 a 1993
| Sexo | Nº dializados | % | ELISA 2ª generación | ELISA 3ª generación | ||
|---|---|---|---|---|---|---|
| N | % | N | % | |||
| Masculino | 61 | 53,0 | 37 | 60,6 | 35 | 57,4 |
| Femenino | 54 | 47,0 | 35 | 64,8 | 37 | 68,5 |
| Total | 115 | 100,0 | 72 | 62,6 | 72 | 62,6 |
Fuente: SAHEP/IEC/SVS/MS.
N: número de muestras examinadas; %: frecuencia.
Entre las muestras recolectadas en la admisión de cada uno de los 115 pacientes, se hallaron prevalencias de 16,5% (19/115) para anti-VHC+, 13,0% (15/115) para Ag-Ab VHC+ y 4,3% (5/115) para VHC-ARN+.
En las 115 muestras iniciales de los pacientes estudiados, utilizando métodos ELISA de tercera generación, hubo prevalencia de 16,5% (19/115) para anti-VHC+. Con relación a la presencia de seroconversión (Tabla 2), en las últimas 96 muestras examinadas de los pacientes estudiados que eran inicialmente no reactivos para el VHC, se detectó la presencia de seroconversión para VHC+ en 55,2% (53/96), siendo superior en el sexo masculino, con 61,4% (27/44).
Tabla 2 - Prevalencia de anti-VHC+, por sexo, utilizando métodos ELISA de tercera generación en las primeras y últimas muestras de suero de pacientes sometidos a tratamiento en una clínica de diálisis de Belém, estado de Pará, Brasil, en el período de 1990 a 1993
| Sexo | ELISA 3ª generación | ELISA 3ª generación | ||||
|---|---|---|---|---|---|---|
| Nº dializados Primera muestra | N | % | Nº dializados Última muestra | N | % | |
| Masculino | 61 | 9 | 14,7 | 44 | 27 | 61,4 |
| Femenino | 54 | 10 | 18,5 | 52 | 26 | 50,0 |
| Total | 115 | 19 | 16,5 | 96 | 53 | 55,2 |
Fuente: SAHEP/IEC/SVS/MS.
N: número de muestras reactivas; %: prevalencia.
Entre las primeras y las últimas muestras anti-VHC+ detectadas en las pruebas ELISA de tercera generación, se encontraron resultados que permitieron clasificarlos en cuatro grupos: (I) solo anti-VHC+; (II) anti-VHC+, Ag-Ab VHC+ y VHC-ARN no reactivo (VHC-ARN-); (III) anti-VHC+, Ag-Ab VHC+ y VHC-ARN+; (IV) anti-VHC+, VHC-ARN+ y Ag-Ab VHC¯ (Tabla 3). Entre las últimas muestras examinadas, el grupo III fue el más prevalente con 49,0% (26/53), diferente de las primeras muestras, en las cuales el más frecuente fue el grupo II con 57,9% (11/19).
Tabla 3 - Distribución de pruebas anti-VHC, Ag-Ab VHC y VHC-ARN por grupos, en muestras de suero de pacientes reactivos para VHC+ sometidos a tratamiento en una clínica de diálisis de Belém, estado de Pará, Brasil, en el período de 1990 a 1993
| Grupos | Total | Primera muestra | Última muestra | |||
|---|---|---|---|---|---|---|
| N | % | N | % | N | % | |
| Grupo I | 7 | 9,7 | 3 | 4,2 | 4 | 5,5 |
| Grupo II | 29 | 40,3 | 11 | 15,3 | 18 | 25,0 |
| Grupo III | 30 | 41,7 | 4 | 5,5 | 26 | 36,1 |
| Grupo IV | 6 | 8,3 | 1 | 1,4 | 5 | 7,0 |
| Total | 72 | 100,0 | 19 | 26,4 | 53 | 73,6 |
Fuente: SAHEP/IEC/SVS/MS.
Grupo I: solo anti-VHC+; Grupo II: anti-VHC+, Ag-Ab VHC+ y VHC-ARN¯; Grupo III: anti-VHC+, Ag-Ab VHC+ y VHC-ARN+; Grupo IV: anti-VHC+, Ag-Ab VHC¯ y VHC-ARN+; N: número de muestras; %: prevalencia.
Conforme lo presentado en la sección de metodología, entre los 37,4% (43/115) pacientes con serología anti-VHC¯ en las primeras y últimas muestras, 51,2% (22/43) de estas fueron probadas nuevamente para detección de Ag-Ab VHC y VHC-ARN. Los resultados encontrados permitieron clasificarlos en dos grupos: (I) anti-VHC, Ag-Ab VHC y VHC-ARN¯; y (II) anti-VHC, Ag-Ab VHC¯ y VHC-ARN+. En 22,7% (5/22) de los dializados, aún con anti-VHC¯ y Ag-Ab VHC¯, se detectó positividad del VHC-ARN.
Fue posible determinar el genotipo en 97,2% (35/36) de las muestras con anti-VHC+ y VHC-ARN+ (Tabla 3). Se detectaron los genotipos 1 y 3 entre las muestras examinadas, siendo que o genotipo 1 fue el más prevalente en 75,0% (27/36) de los individuos tanto en el sexo masculino como en el femenino, seguido por el genotipo 3 con 19,4% (7/36). En una paciente, no fue posible determinar el genotipo (2,8%; 1/36).
DISCUSIÓN
Brasil tiene el tercer grupo más grande de pacientes en hemodiálisis del mundo; a pesar de ello, se desconocen la tasa de supervivencia y los factores de riesgo de mortalidad de esta población17. Aún se detectan altas prevalencias de VHC en las unidades de diálisis de todo el mundo, y la infección por VHC tiene una influencia negativa tanto en la supervivencia de los pacientes en hemodiálisis como en los pacientes sometidos a trasplante renal18. Según Sesso et al.19, las tasas de prevalencia de serología reactiva para hepatitis B y C mostraron una tendencia a la baja, de 2013 a 2016, de 1,4% a 0,7% para hepatitis B y 4,2%., al 3,7% para la hepatitis C.
La ocurrencia de infección por VHC en pacientes en hemodiálisis, aunque es mayor que en la población general, ha ido disminuyendo gradualmente a partir de la década de 1990, debido al mejor conocimiento de la enfermedad y a la adopción de una serie de medidas para reducir la transmisión del VHC en las unidades. De hemodiálisis20. Un estudio con dializados mostró que el 25% de los pacientes que se sometieron a este tipo de terapia no tenía conocimiento de la existencia de hepatitis virales, relatando que la falta de información sobre el tema podría estar asociada al bajo nivel educativo de la población estudiada. Sin embargo, como estos individuos formaban parte de un grupo en riesgo de infectarse por el VHC, al realizar el procedimiento de diálisis, el hecho de la falta de información también podría ser catalogado como un factor de riesgo para la adquisición de hepatitis virales21.
La Encuesta Brasileña de Diálisis Crónica de 2016 mostró que el 57% de los pacientes en hemodiálisis son hombres y más de dos quintos tienen más de 40 años19. El presente estudio reveló una prevalencia de infección por VHC entre los pacientes en diálisis del 53,0% para los hombres. Un estudio realizado en Dourados, estado de Mato Grosso, mostró un predominio de mujeres en el 53,1%, correlacionado con el hecho de que las mujeres tenían una supervivencia más larga que la de los hombres, debido a la mayor preocupación por su salud19. En la Región Norte, un estudio realizado con 46 pacientes inscritos en cinco unidades de hemodiálisis en Belém encontró una incidencia de hepatitis C del 67,4% después de iniciar diálisis, con una alta prevalencia de hombres, que representan dos tercios de los pacientes entrevistados, edad prevalente superior a 50 años22.
En el presente estudio se observó una alta prevalencia de anti-VHC+ en el 62,6% de los sujetos examinados, tanto para las pruebas ELISA de segunda generación como para los de tercera generación, revelando que las pruebas serológicas fueron y siguen siendo útiles para el cribado de la hepatitis C en esta población.
La importancia de las pruebas serológicas para la detección de anti-VHC en el cribado de los infectados por este virus, ha sido confirmada por investigaciones que utilizaron pruebas ELISA de segunda generación, en las que se encontró una prevalencia de anti-VHC+ del 29,8% en Porto Alegre, estado de Rio Grande do Sul, y 35,3% en Goiânia, estado de Goiás23,24. Un estudio, realizado en una unidad de diálisis de Alicante, España, que evaluó a 116 pacientes en hemodiálisis, encontró que las pruebas ELISA de segunda generación tenían una sensibilidad del 100% y una especificidad del 94,1%, considerándose bastante útiles para la diagnóstico de VHC entre dializados, y que las pruebas ELISA de tercera generación presentaban, como principales ventajas en relación a las de segunda generación, la reducción del tiempo medio de detección de la seroconversión y una mayor sensibilidad para la detección del VHC, tanto en donantes de sangre como en enfermos hepáticos25. Sin embargo, en este estudio, hubo una equiparación de resultados entre las pruebas ELISA de segunda y tercera generación, lo que demuestra la utilidad del cribado diagnóstico de hepatitis C para ambas pruebas.
Se encontró que, al momento de la primera recolección de muestras, el 16,5% de los dializados ya tenía anti-VHC+ y que al menos el 4,3% también tenía VHC-ARN+ demostrando la presencia de replicación viral y el gran riesgo de transmisión del VHC en el entorno dialítico. Un análisis de muestras de suero recolectadas entre 1980 y 1992, revelando 12 años de la historia natural de la infección por VHC entre dializados, demostró una prevalencia del 39,6% de anti-VHC+, superior a la encontrada en el presente estudio, y que, entre estos, el 47,7% también había adquirido el VHC antes del proceso de diálisis26.
La seroconversión del 55,2%, detectada entre los pacientes que al inicio del tratamiento de diálisis eran anti-VHC¯, confirmó la presencia de circulación viral y la existencia, en ese momento, de transmisión hospitalaria en la unidad de diálisis analizada. Un estudio, realizado en 1994, reveló datos similares, en el que el 52,3% de los pacientes también tuvieron seroconversión durante el período de diálisis, lo que confirma la ocurrencia de transmisión hospitalaria del VHC27.
Antes de la regulación de los servicios de hemodiálisis en Brasil, que ocurrió en 1996, las medidas de control y prevención eran deficientes, lo que contribuía a las altas tasas de infección por VHC entre estos servicios28. Una encuesta realizada en las unidades de hemodiálisis en 2008, luego de la implementación de la Ordenanza GM/MS No. 2.042/1996, reveló que, solo después de la implementación efectiva de las medidas de prevención y control, fue posible reducir significativamente el número de casos de infección por HCV6,8.
Algunas medidas de control y prevención podrían prevenir la transmisión del VHC de pacientes portadores a no portadores, tales como: el uso de guantes al manipular equipos y al contacto con pacientes; realizar procedimientos de desinfección en las áreas ocupadas por pacientes; y la separación de los pacientes que se sabe que tienen el virus de la hepatitis B y el VHC de otros pacientes no infectados29.
El estudio detectó anti-HCV+, Ag-Ab HCV¯ y HCV-RNA¯ en el 9,7% de las muestras. Esto se puede explicar por los resultados falsos positivos, derivados de la propia técnica inmunoenzimática, que es bastante frecuente; una cicatriz serológica de una infección previa por VHC; el desarrollo de anticuerpos contra proteínas residuales, cuando se produce el antígeno recombinante, a partir del kit serológico comercial disponible; enfermedades de autoinmunidad o incluso la degradación de proteínas que pueden ocurrir debido a los largos períodos de almacenamiento de los sueros y/o su almacenamiento inadecuado30.
Valores bajos de ARN-VHC y anti-VHC+ pueden significar tanto resultados falso negativos de la PCR, ya que el paciente en diálisis tiene la característica de presentar viremia intermitente, así como un resultado falso positivo de anti-VHC por técnica de análisis utilizada31. Además, la manipulación o incluso el almacenamiento inadecuado de las muestras de sangre pueden conducir a que no se detecte el ARN del VHC en hasta el 40% de las muestras32.
La detección del 40,3% de pacientes anti-VHC+ y Ag-Ab VHC+ con VHC-ARN¯ pudo haber ocurrido debido a la concentración y calidad de los ácidos nucleicos virales, extraídos de las muestras y utilizados por la técnica de PCR, afectados por factores como el método de recolección, manipulación, transporte, almacenamiento de las muestras, la técnica de extracción de ácido nucleico que, teniendo en cuenta la naturaleza lábil del ARN, puede degradar el material genético viral y dificultar la detección molecular del virus. Por estos motivos, un resultado no reactivo en una muestra puede ocurrir simplemente por la degradación del ARN y no por la ausencia de infección, ya que, en este estudio, las muestras fueron recolectadas hace dos décadas, contribuyendo para eso el hecho de que, el uso de la heparina, como en el proceso de diálisis, podría inactivar la PCR.
En el 41,7% de los pacientes anti-VHC+ se pudo comprobar la presencia de infección activa por VHC con Ag-Ab VHC y VHC-ARN positivos, confirmando la falta de control de la propagación viral que se produjo en la unidad de diálisis en estudio. Una encuesta, realizada en una población de pacientes en hemodiálisis en el Brasil Central, reveló una prevalencia de anti-VHC+ del 39%, siendo que, la presencia de viremia (VHC-ARN+) fue de 63,5% de las muestras y en el 10,3% de los pacientes con anti-VHC¯, lo que sugiere que la transmisión hospitalaria puede desempeñar un papel importante en la propagación del VHC en unidades de diálisis y que, además del anti-VHC, la detección del ARN-VHC por PCR es necesaria para diagnosticar la hepatitis C en dializados33.
Leão et al.18, en estudio desarrollado en Juiz de Fora, estado de Minas Gerais, relataron una menor prevalencia que el estudio actual, con anti-VHC+ de 14,8%, de los cuales 71,6% tenía VHC-ARN+, confirmando la presencia de infección crónica por el VHC.
Incluso con anti-VHC y VHC-ARN reactivos, el 8,3% de las muestras tenía Ag-Ab VHC¯, mostrando desacuerdo en los resultados serológicos entre las pruebas ELISA de tercera generación y las pruebas de Monolisa Ag-Ab VHC, revelando una sensibilidad menor que lo esperado según la literatura. Alados-Arboletas et al.34 argumentan que la sensibilidad de la prueba de Monolisa Ag-Ab VCH en pacientes en diálisis es superior a la de la prueba de Ortho anti-VHC (100% y 70,8%, respectivamente). Además, Monolisa reduciría significativamente el tiempo de la ventana inmunológica al VHC hasta en 72 días.
Los estudios han demostrado que Monolisa Ag-Ab VHC fue capaz de detectar una respuesta serológica positiva entre el 40% y el 90% de las muestras de VHC-ARN+ con anti-VHC¯ obtenidas durante el período de ventana inmunológica, mejorando así la detección precoz de anticuerpos contra la hepatitis C35. Sin embargo, el ensayo Ag-Ab VHC no detecta la infección por VHC tan pronto como la PCR de VHC-ARN, con un retraso promedio de 30,3 días36.
En relación a los dializados que se mantuvieron anti-VHC¯ durante todo el período de estudio, fueron analizadas 51,2% de las muestras de esos pacientes, revelando que, en 22,7%, fue posible detectar la positividad del VHC-ARN, comprobando viremia, aun en ausencia de detección serológica del VHC. Una posible explicación para este hecho podría ser la baja sensibilidad de la prueba serológica para la detección del anticuerpo viral, sea por la presencia de bajos títulos de anticuerpos, porque el antígeno utilizado en la prueba serológica no fue capaz de detectar la respuesta de los anticuerpos séricos, o por la presencia de enfermedades inmunosupresoras, como la insuficiencia renal crónica7.
La detección de viremia en ausencia de anticuerpos entre dializados podría ocurrir dentro de una infección reciente, antes del desarrollo de anticuerpos, en un período conocido como "ventana inmunológica" o por la propia inmunosupresión del paciente, provocada por insuficiencia renal26.
Un estudio realizado en Porto Alegre, estado de Rio Grande do Sul, con 71 pacientes en diálisis, detectó 12,5% de anti-VHC¯ con VHC-ARN+, informando que, en algunos pacientes, la investigación anti-VHC puede ser no reactiva , incluso con viremia positiva, lo que sugiere que la detección de VHC-ARN es fundamental para mejorar el diagnóstico de hepatitis C en pacientes en diálisis37.
La presencia de HCV-ARN+ con anti-HCV¯ sugeriría que la baja viremia, entre algunos pacientes con VHC, podría ser responsable de los niveles bajos y fluctuantes de anticuerpos, similar al encontrado en otro estudio que mostró una correlación positiva entre la titulación de anti-VHC y la carga de VHC-ARN31.
Los resultados encontrados en este estudio mostraron que, entre las muestras anti-VHC¯, el 77,3% tenían VHC-ARN también negativo, lo que indica que no había infección, lo que no es posible decir en el caso de pacientes renales crónicos en hemodiálisis. La principal dificultad para el diagnóstico de la infección viral en pacientes renales crónicos es la presencia de viremia intermitente, en la que los resultados negativos de VHC-ARN, en determinaciones aisladas, no pueden interpretarse como ausencia de replicación viral, proponiendo así que las determinaciones seriadas de HCV-ARN definirían correctamente la viremia38.
A pesar del deterioro inmunológico causado por la uremia y agravado por la hemodiálisis, se argumenta que este procedimiento preservaría al paciente de un curso agresivo de hepatitis C al reducir la carga viral. Los mecanismos por los cuales el procedimiento de diálisis reduciría la viremia se explicarían por el paso de partículas virales a través del dializador, provocando que el virus quede atrapado en la superficie de la membrana. Además, puede estar involucrado un mecanismo del huésped mediado indirectamente, que involucra la producción de interferón alfa, factor de crecimiento de hepatocitos y otras citocinas producidas con actividad antiviral durante las sesiones de hemodiálisis39. Sin embargo, a diferencia de este estudio, otros investigadores informaron que durante el proceso de diálisis se produjo un aumento significativo del ARN-VHC sérico hasta 180 min después del inicio de la hemodiálisis40.
En el presente estudio, entre los ratones VHC-RNA+, se detectaron los genotipos 1 y 3, siendo el genotipo 1 el más prevalente en el 73,0% de las muestras examinadas. En los ensayos con pacientes de sexo masculino, el genotipo 1 mostró una prevalencia del 45,9% y el genotipo 3, del 18,9%. En cuanto al sexo femenino, 27,1% eran genotipo 1 y el 5,4% genotipo 3. En el estudio de Araújo et al.41, realizado en Manaus, estado de Amazonas, en 2011, se detectaron los genotipos 1, 2 y 3, con respecto a los hombres, se detectó el genotipo 1 en 76,1%, el genotipo 3 en 19,6% y el genotipo 2 en 4,3%; y, entre las mujeres, el genotipo 1 fue el más prevalente (54,2%), seguido de los genotipos 3 (25,0%) y 2 (20,8%)41.
Una investigación, realizada entre dializados en Rio Grande do Sul, relató una mayor prevalencia del genotipo 1 (63,5%), seguido por los genotipos 3 (34,8%) y 2 (1,5%) del VHC24. En Pelotas, también en Rio Grande do Sul, se detectó la prevalencia de VHC de 18,2%, con concordancia entre el anti-VHC y el RT-PCR de 94%. Tres pacientes fueron no reactivos para anti-VHC por ELISA, con RT-PCR+. El genotipo 1 fue el más prevalente (46,7%), y el subtipo 1a el más frecuente (74,1%)42.
Un estudio, desarrollado en Belo Horizonte, estado de Minas Gerais, con pacientes portadores de hepatitis C crónica, también observó una alta prevalencia del genotipo 1 (78,4%), con los subtipos 1b (40,4%) y 1a (37,5%) los más frecuentes; y el genotipo 3a estuvo presente en 17,9% de los pacientes43.
Resultado semejante se observó en un estudio realizado en Salvador, en el estado de Bahia, donde el genotipo 1 también predominó, seguido por el genotipo 3, observando que aún teniendo 80% de su población negra o mestiza, ningún genotipo africano fue encontrado44.
CONCLUSIÓN
Por este estudio, fue posible concluir que: las frecuencias de anti-VHC+, tanto por los métodos ELISA de segunda como de tercera generación, fueron semejantes (62,6%); hubo conversión serológica durante el tratamiento dialítico; se encontraron los genotipos 1 y 3 del VHC; y en 22,7% de los dializados, aún con anti-VHC¯ y Ag-Ab VHC¯, se detectó positividad del VHC-ARN.
Pacientes con insuficiencia renal crónica sometidos a hemodiálisis tienen alto riesgo de infectarse por el VHC, principalmente por la contaminación hospitalaria, a través de procedimientos relacionados a las punciones venosas frecuentes y al uso de equipamientos comunes a los pacientes. La prevalencia alta de infección por el VHC encontrada entre los pacientes en tratamiento en la clínica de diálisis estudiada, en los años iniciales a la introducción de cribado para la detección del VHC, mostró la importancia de la infección por el VHC en pacientes sometidos al tratamiento dialítico y las dificultades para el control de la transmisión en unidades de diálisis. La evolución tecnológica de marcadores para cribado, confirmación de la infección, cuantificación y genotipado del VHC, en los últimos años, permitieron la confirmación diagnóstica de los casos en la actualidad, así como la utilización de pruebas de biología molecular y del antígeno del core y anticuerpos del VHC no accesibles en la época de la recolección de las muestras. Siendo así, esos tests podrán ser útiles para la comprobación de viremia de la hepatitis C, particularmente en pacientes de riesgo, como los dializados, que no presenten reactividad al anti-VHC.
El presente estudio contribuye al describir, retrospectivamente, la situación vigente en los años que antecedieron a la introducción de las medidas de intervención, propiciadas por el descubrimiento del VHC y de la investigación de sus marcadores serológicos y moleculares.
REFERENCIAS
1 World Health Organization. Global hepatitis report, 2017 [Internet]. Geneva: World Health Organization; 2017 [cited 2018 Jul 31]. Available from: Available from: https://www.who.int/hepatitis/publications/global-hepatitis-report2017/en/ . [ Links ]
2 Sociedade Brasileira de Hepatologia; Sociedade Brasileira de Infectologia. Consenso. Recomendações das Sociedades Brasileiras de Hepatologia (SBH) e Infectologia (SBI) para o tratamento da hepatite C no Brasil com novos medicamentos antivirais de ação direta (DAAs). Braz J Infect Dis. 2016 Mar;20(2 Supl 1):S2-7. [Link] [ Links ]
3 Prince AM, Grady GF, Hazzi C, Brotman B, Kuhns WJ, Levine RW, et al. Long-incubation post-transfusion hepatitis without serological evidence of exposure to hepatitis-B virus. Lancet. 1974 Aug;304(7875):241-6. Doi: 10.1016/S0140-6736(74)91412-3 [Link] [ Links ]
4 Choo QL, Kuo G, Weiner AJ, Overby LR, Bradley DW, Houghton M. Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome. Science. 1989 Apr;244(4902):359-62. Doi: 10.1126/science.2523562 [Link] [ Links ]
5 Kuo G, Choo QL, Alter HJ, Gitnick GL, Redeker AG, Purcell RH, et al. An assay for circulating antibodies to a major etiologic virus of human non-A, non-B hepatitis. Science. 1989 Apr;244(4902):362-4. Doi: 10.1126/science.2496467 [Link] [ Links ]
6 Spínola CG, Oliveira LA, Schuengue CMOL. O impacto da Portaria 2.042 nos serviços de terapia renal substitutiva. Rev Edu Meio Amb Saude. 2008;3(1):137-47. [Link] [ Links ]
7 Pereira BJG, Levey AS. Hepatitis C virus infection in dialysis and renal transplantation. Kidney Int. 1997 Apr;51(4):981-99. Doi: 10.1038/ki.1997.139 [Link] [ Links ]
8 Brasil. Ministério da Saúde. Gabinete do Ministro. Portaria nº 2042, de 11 de outubro de 1996. Estabelece o regulamento técnico para o funcionamento dos serviços de terapia renal substitutiva e as normas para cadastramento desses estabelecimentos junto ao Sistema Único de Saúde. Diário Oficial da União, Brasília (DF), 1996 out 14; Seção 1:142. [ Links ]
9 Brasil. Ministério da Saúde. Gabinete do Ministro. Portaria nº 82, de 03 de janeiro de 2000. Estabelece o Regulamento Técnico para o funcionamento dos serviços de diálise e as normas para cadastramento destes junto ao Sistema Único de Saúde. Diário Oficial da União, Brasília (DF), 2000 fev 8; Seção 1:32. [ Links ]
10 Fundação Nacional de Saúde (BR). Instituto Evandro Chagas: relatório qüinqüenal 1991/1995. Belém: Funasa; 1996. 366 p. [ Links ]
11 Alves DM, Soares MCP, Bensabath G, Andrade SB, Souza JF. Surto de hepatite C em uma unidade de hemodiálise no Estado do Pará, Brasil - resultados preliminares. In: 16º Congresso Brasileiro de Nefrologia; 1992; Rio de Janeiro. [ Links ]
12 Cartágenes PRB, Soares MCP, Bensabath G, Alves DM. Estudo comparativo entre a frequência do anticorpo anti-HCV e o tempo de tratamento em pacientes submetidos a hemodiálise no Estado do Pará. In: Anais do 12º Congresso Brasileiro de Hepatologia; 1993; Salvador, BA. p. 88. [ Links ]
13 Campiotto S, Pinho JRR, Carrilho FJ, Silva LC, Souto FJD, Spinelli V, et al. Geographic distribution of hepatitis C virus genotypes in Brazil. Braz J Med Biol Res. 2005 Jan;38(1):41-9. Doi: 10.1590/S0100-879X2005000100007 [Link] [ Links ]
14 Sanger F, Nicklen S, Coulson AR. DNA sequencing with chain-terminating inhibitors. Proc Natl Acad Sci USA. 1977 Dec;74(12):5463-7. [Link] [ Links ]
15 Brasil. Ministério da Saúde. Conselho Nacional de Saúde. Resolução nº 466, de 12 de dezembro de 2012. Aprova as diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília (DF), 2013 jun 13; Seção 1:59. [ Links ]
16 Ayres M, Ayres Jr M, Ayres DL, Santos ASS. BioEstat 5.0: aplicações estatísticas nas áreas das ciências biológicas e médicas. Belém: Sociedade Civil Mamirauá; 2007. 364 p. [ Links ]
17 Matos JPS, Almeida JR, Guinsburg A, Marelli C, Barra ABL, Vasconcellos MS, et al. Avaliação da sobrevida de cinco anos em hemodiálise no Brasil: uma coorte de 3.082 pacientes incidentes. J Bras Nefrol. 2011 out-dez;33(4):436-41. Doi: 10.1590/S0101-28002011000400008 [Link] [ Links ]
18 Leão JR, Pace FHL, Chebli JMF. Infecção pelo vírus da hepatite C em pacientes em hemodiálise: prevalência e fatores de risco. Arq Gastroenterol. 2010 jan-mar;47(1):28-34. Doi: 10.1590/S0004-28032010000100006 [Link] [ Links ]
19 Sesso RC, Lopes AA, Thomé FS, Lugon JR, Martins CT. Inquérito brasileiro de diálise crônica 2016. J Bras Nefrol. 2017 jul-set;39(3):261-6. Doi: 10.5935/0101-2800.20170049 [Link] [ Links ]
20 Riella MC. Princípios de nefrologia e distúrbios hidroeletrolíticos. 4. ed. Rio de Janeiro: Guanabara Koogan; 2008. [ Links ]
21 Azevedo PS. Conhecimento dos usuários em tratamento dialítico sobre prevenção das hepatites virais [trabalho de conclusão de curso]. Dourados (MS): Universidade Estadual de Mato Grosso; 2010. [ Links ]
22 Móia LJMP, Amaral ISA, Soares MCP, Vale CSF, Guimarães AV. Aspectos epidemiológicos de pacientes com doença renal crônica e hepatite C submetidos a hemodiálise em Belém (PA). Rev Para Med. 2014 jan-mar;28(1):15-21. [Link] [ Links ]
23 Karohl C, Manfro RC, Senger MB, Thomé FS, Gonçalves LFS, Rigatto M, et al. Prevalência de anticorpos anti-vírus da hepatite C em pacientes em hemodiálise crônica de Porto Alegre. J Bras Nefrol. 1995;17(1):40-6. [ Links ]
24 Naghettini AV, Daher RR, Martin RMB, Doles J, Vanderborght B, Yoshida CFT, et al. Soroprevalência do vírus da hepatite C na população em diálise de Goiânia, GO. Rev Soc Bras Med Trop. 1997 mar-abr;30(2):113-7. Doi: 10.1590/S0037-86821997000200005 [Link] [ Links ]
25 Bustillo EM, Torralba FJ, Llobregat R, Llopis A. Ausencia de viremia del VHC por PCR en pacientes en diálisis ELISA2 (-). Nefrologia. 1998;18(6):513-4. [Link] [ Links ]
26 Brandão ABM, Fuchs SC, Silva MAA, Emer LF. Diagnóstico da hepatite C na prática médica: revisão da literatura. Rev Panam Salud Publica. 2001 mar;9(3):161-8. Doi: 10.1590/s1020-49892001000300005 [Link] [ Links ]
27 Simon N, Couroucé AM, Lemarrec N, Trépo C, Ducamp S. A twelve year natural history of hepatitis C virus infection in hemodialyzed patients. Kidney Int. 1994;46(2):504-11. [Link] [ Links ]
28 Lazzarini FAS, Andrade D, Rossi LA, Ferraz AEP. Incidência de soroconversão para o vírus da hepatite C após a implementação de programa de prevenção e controle em unidade de hemodiálise. Rev Latino-Am Enfermagem. 2000 out;8(5):7-12. Doi: 10.1590/S0104-11692000000500002 [Link] [ Links ]
29 Buriol ACS. Análise de marcadores laboratoriais utilizados no diagnóstico do vírus da hepatite C (HCV) em pacientes hemodialisados de Porto Alegre-RS [dissertação]. Canoas (RS): Universidade Luterana do Brasil; 2007. [Link] [ Links ]
30 Garcia FB, Gomide GPM, Pereira GA, Moraes-Souza H. Importância dos testes sorológicos de triagem e confirmatórios na detecção de doadores de sangue infectados pelo vírus da hepatite C. Rev Bras Hematol Hemoter. 2008;30(3):218-22. Doi: 10.1590/S1516-84842008000300011 [Link] [ Links ]
31 Busch MP, Wilber JC, Johnson P, Tobler L, Evans CS. Impact of specimen handling and storage on detection of hepatitis C virus RNA. Transfusion. 1992 Jun;32(5):420-5. Doi: 10.1046/j.1537-2995.1992.32592327714.x [Link] [ Links ]
32 Melo MR, Martins AR, Barbosa IV, Romano P, Shcolnik W. Coleta, transporte e armazenamento de amostras para diagnóstico molecular. J Bras Patol Med Lab. 2010 out;46(5):375-81. Doi: 10.1590/S1676-24442010000500006 [Link] [ Links ]
33 Carneiro MAS, Martins RMB, Teles SA, Silva SA, Lopes CL, Cardoso DDP, et al. Hepatitis C prevalence and risk factors in hemodialysis patients in Central Brazil: a survey by polymerase chain reaction and serological methods. Mem Inst Oswaldo Cruz. 2001 Aug;96(6):765-9. Doi: 10.1590/S0074-02762001000600003 [Link] [ Links ]
34 Alados-Arboledas JC, Calbo-Torrecillas L, López-Prieto MD, Francisco-Ramírez JL, Miguel-Sastre C. Clinical assessment of Monolisa HCV Ag-Ab ULTRA (Bio-Rad) in a general hospital. Enferm Infecc Microbiol Clin. 2007 Mar;25(3):172-6. Doi: 10.1157/13099368 [Link] [ Links ]
35 Yagci S, Padalko E. Comparison of Monolisa HCV Ag/Ab ULTRA with two anti-HCV assays for the detection of HCV infection in hospital setting. Curr Microbiol. 2012 Feb;64(2):148-51. Doi: 10.1007/s00284-011-0046-7 [Link] [ Links ]
36 Laperche S, Le Marrec N, Girault A, Bouchardeau F, Servant-Delmas A, Maniez-Montreuil M, et al. Simultaneous detection of hepatitis C virus (HCV) core antigen and anti-HCV antibodies improves the early detection of HCV infection. J Clin Microbiol. 2005 Aug;43(8):3877-83. Doi: 10.1128/JCM.43.8.3877-3883.2005 [Link] [ Links ]
37 Callegaro FP, Kupski C, Nascimento RC, Schmitt VM. Comportamento da hepatite viral C nos pacientes em programa de hemodiálise do Hospital São Lucas de PUCRS. Scientia Medica. 2006 jul-set;16(3):115-8. [ Links ]
38 Peres RM, Ferraz MLG. Hepatite crônica C no paciente renal crônico. Rev Hosp Univ Pedro Ernesto. 2006 jan-jun;5(1):49-54. [ Links ]
39 Fabrizi F, Messa P, Martin P. Impact of hemodialysis therapy on hepatitis C virus infection: a deeper insight. Int J Artif Organs. 2009 Jan;32(1):1-11. Doi: 10.1177/039139880903200101 [Link] [ Links ]
40 Putz-Bankuti C, Kessler HH, Schilcher G, Schneditz D, Konrad PM, Rosenkranz AR, et al. Increase of HCV RNA concentration during hemodialysis treatment in patients with chronic hepatitis C. J Clin Virol. 2012 Jun;54(2):110-4. Doi: 10.1016/j.jcv.2012.02.009 [Link] [ Links ]
41 Araújo AR, Almeida CM, Fraporti L, Garcia N, Lima TA, Maia LPV, et al. Caracterização do vírus da hepatite C em pacientes com hepatite crônica: genótipos no Estado do Amazonas, Brasil. Rev Soc Bras Med Trop. 2011 set-out;44(5):638-40. Doi: 10.1590/S0037-86822011000500024 [Link] [ Links ]
42 Vidales-Braz BM, Silva NMO, Lobato R, Germano FN, Mota LD, Barros EJG, et al. Detection of hepatitis C virus in patients with terminal renal disease undergoing dialysis in southern Brazil: prevalence, risk factors, genotypes, and viral load dynamics in hemodialysis patients. Virol J. 2015 Feb;12:18. Doi: 10.1186/s12985-015-0238-z [Link] [ Links ]
43 Perone C, Del Castillo DM, Pereira GL, Carvalho NO, Januário JN, Teixeira R. Alta prevalência do genótipo 1 em portadores de hepatite C crônica em Belo Horizonte, MG. Rev Soc Bras Med Trop. 2008 mai/jun;41(3):238-42. Doi: 10.1590/S0037-86822008000300003 [Link] [ Links ]
44 Paraná R, Vitvitski L, Berby F, Portugal M, Cotrim HP, Cavalcante A, et al. HCV infection in northeastern Brazil: unexpected high prevalence of genotype 3a and absence of African genotypes. Arq Gastroenterol. 2000 Oct-Nov;37(4):213-6. Doi: 10.1590/S0004-28032000000400005 [Link] [ Links ]
Cómo citar este artículo / How to cite this article: Baia KSM, Soares MCP, Alves DM, Sarmento VP, Malheiros AP, Souza AJS, et al. Reevaluación de laboratorio de la infección por el virus de la hepatitis C en pacientes en diálisis atendidos en la década de 1990, en Belém, estado de Pará, Brasil. Rev Pan Amaz Saude. 2019;10:e201901632. Doi: http://dx.doi.org/10.5123/S2176-6223201901632
Recibido: 26 de Febrero de 2018; Aprobado: 21 de Noviembre de 2018











 text in
text in 


