INTRODUÇÃO
A hepatite C é uma importante causa de morbidade e mortalidade mundial; segundo a Organização Mundial da Saúde, aproximadamente 71 milhões de pessoas estão cronicamente infectadas pelo vírus da hepatite C (HCV - do inglês hepatitis C virus), sendo responsável pelo óbito de 399.000 pessoas a cada ano1. Essa doença pode evoluir de forma assintomática, oligossintomática ou sintomática, lenta e frequentemente silenciosa, por décadas, podendo ainda progredir para cirrose, descompensação hepática e hepatocarcinoma, tornando-se a causa mais frequente de transplante hepático no Brasil e no mundo2.
Apesar da hipótese da existência de um novo agente viral, associado a casos de hepatite aguda pós-transfusional, ter sido levantada desde o início da década de 19703, a descoberta do HCV só ocorreu no ano de 1989. Nesse ano, pesquisadores da Chiron Corporation descreveram a clonagem molecular do genoma viral a partir do plasma de chimpanzé infectado, de forma experimental, com sangue de paciente com hepatite não A não B, proporcionando a identificação do agente etiológico então denominado vírus da hepatite C, descoberta que subsidiou o posterior desenvolvimento do primeiro teste sorológico para detecção de anticorpos anti-HCV4,5.
A diálise é um tipo de terapêutica utilizada no tratamento da uremia nos pacientes que desenvolvem insuficiência renal, sendo responsável pela sobrevida de aproximadamente 34.000 pessoas no Brasil6. Portadores de insuficiência renal crônica, em tratamento por diálise, estão predispostos à infecção pelo HCV por transfusão de sangue, doação de órgãos ou mesmo pela exposição a pacientes infectados que comparecem à mesma clínica de diálise; portanto, a doença hepática causada pelo HCV é uma importante causa de morbimortalidade em pacientes com insuficiência renal crônica que estão em tratamento dialítico7.
No Brasil, o regulamento técnico para funcionamento dos serviços de terapia renal substitutiva foi criado por meio da Portaria GM/MS nº 2.042, de 11 de outubro de 1996. A partir desse momento, as unidades de diálise passaram a seguir normas rígidas, tendo um processo de reestruturação quase que imediata de todos os serviços de terapia renal substitutiva no Brasil. A Portaria GM/MS nº 82, de 3 de janeiro de 2000, é mais uma tentativa de redefinir os critérios mínimos para o funcionamento das unidades de diálise, de reduzir os riscos aos quais os pacientes ficam expostos ao serem submetidos ao processo dialítico e de definir normas específicas para cadastramento junto ao Sistema Único de Saúde8,9.
Durante o período de janeiro de 1990 a junho de 1993, foi realizada a triagem sorológica de 178 amostras de soro dos pacientes submetidos a tratamento de diálise peritoneal e hemodiálise em uma unidade de diálise com histórico de surto de hepatite em Belém, no estado do Pará, Brasil. Os resultados de sorologia indicaram positividade ao anti-HCV de 9% e 70% nos indivíduos submetidos à diálise peritoneal e hemodiálise, respectivamente. A concomitante elevada soroconversão sugeria que a alta soroprevalência estava relacionada com a transmissão do HCV não apenas referente ao tratamento, mas também ao tempo do tratamento de diálise ao qual o paciente estava submetido10,11,12.
Objetivando contribuir com informações sobre as características epidemiológicas e laboratoriais da infecção por HCV durante os primórdios da detecção do vírus entre dialisados no Brasil, o presente estudo desenvolveu uma reavaliação da ocorrência do HCV nas amostras de soro dos pacientes submetidos a tratamento naquela clínica de diálise, durante o período já estudado (1990-1993), utilizando amostras que estavam depositadas no banco da Seção de Hepatologia (SAHEP), do Instituto Evandro Chagas (IEC), da Secretaria de Vigilância em Saúde (SVS), do Ministério da Saúde (MS), aplicando métodos mais recentes de diagnóstico sorológico e molecular do HCV. Tais métodos visaram avaliar a ocorrência de Ag-Ab HCV e/ou HCV-RNA nos casos em que não houve conversão sorológica para anti-HCV, além de caracterizar os genótipos do HCV circulantes no período, fornecendo, dessa forma, informações que auxiliem na triagem e no controle da infecção pelo HCV em unidades de diálise.
MATERIAIS E MÉTODOS
Estudo epidemiológico, descritivo, retrospectivo, de reavaliação das amostras de soro e dados dos pacientes submetidos a tratamento dialítico em uma clínica de diálise de Belém, entre 1990 e 1993. Nessa ocasião ocorreu um surto de hepatite na referida clínica, motivando a realização de uma pesquisa com o objetivo, à época, de determinar a etiologia da doença11.
Foram selecionados para o estudo 115 pacientes submetidos a tratamento dialítico, que possuíam mais de três amostras de soro coletadas no período em questão e que estavam em criobanco (-20 ºC) sob a responsabilidade da SAHEP/IEC. Foram excluídos os pacientes cujas amostras estavam esgotadas e as informações demográficas mínimas não puderam ser resgatadas. Todos os exames laboratoriais foram realizados na SAHEP/IEC, segundo o algoritmo apresentado pela figura 1. Foi obedecido o critério de três meses (90 dias) entre a primeira e a última amostra examinada. Para este estudo, não foi aferido o momento específico da soroconversão.
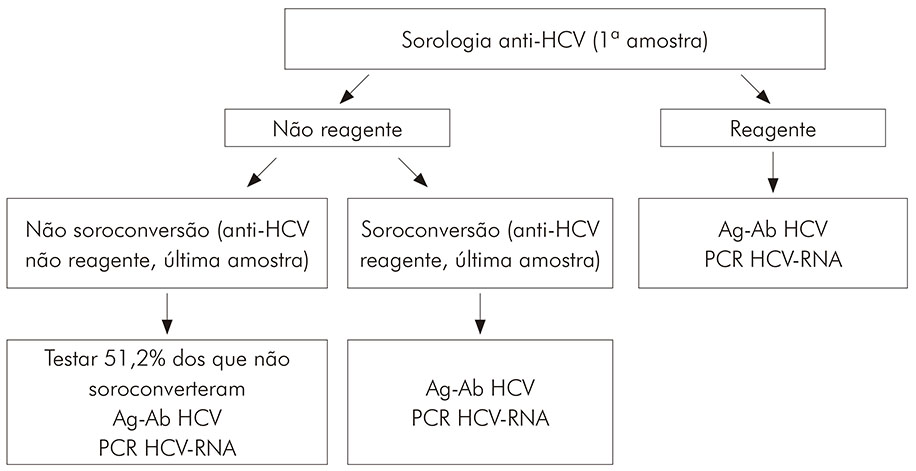
Figura 1 - Algoritmo para execução de testes laboratoriais em amostras de soro de pacientes submetidos a tratamento em uma clínica de diálise de Belém, estado do Pará, Brasil, no período de 1990 a 1993
Os testes sorológicos anti-HCV foram realizados por técnica imunoenzimática, tipo ELISA, com kits comerciais (Ortho® HCV 3.0 ELISA Test System, Ortho-Clinical Diagnostics, Inc., New Jersey, EUA), executados e interpretados conforme orientação dos fabricantes. As amostras dos indivíduos com sorologia anti-HCV reagente foram submetidas à análise do marcador sorológico Ag-Ab HCV (Monolisa® HCV Ag-Ab ULTRA, Bio-Rad, Marnes - La Coquette, França).
As amostras de soro foram submetidas à pesquisa do RNA (por Nested RT-PCR) pela amplificação de um fragmento de aproximadamente 230 pb da região 5' não traduzida (5' UTR) viral, utilizando primers e condições de termociclagem previamente descritas13.
A detecção do HCV-RNA amplificado foi realizada por eletroforese em gel de agarose 1%. As amostras positivas para HCV-RNA foram submetidas a sequenciamento nucleotídico pelo método de Sanger et al.14. Os produtos de PCR foram sequenciados com o uso do kit BigDye® Terminator v3.1 Cycle Sequencing (Applied Biosystems, Foster City, CA, EUA) no sequenciador automático ABI 3500 (Applied Biosystems, EUA).
Para a caracterização dos genótipos das amostras positivas, as sequências obtidas no estudo foram analisadas por meio do programa Geneious v5.6.5, para a montagem das sequências consenso, e, posteriormente, alinhadas com sequências de referência dos genótipos de HCV, obtidas no GenBank, utilizando o programa Clustal W integrado ao pacote Geneious.
Os dados obtidos e os resultados dos testes foram armazenados em uma base de dados empregando-se o software Hepatoware, desenvolvido na SAHEP/IEC. As análises estatísticas foram realizadas por meio do programa BioEstat v516. Na construção de gráficos e tabelas, foram utilizados os programas Microsoft Excel 2007 e Harvard Graphics 98.
Em conformidade com a Resolução CNS Nº 466/2012 da Comissão Nacional de Ética em Pesquisa15, o projeto desta pesquisa foi aprovado pelo Comitê de Ética em Pesquisa Envolvendo Seres Humanos do Instituto Evandro Chagas, com data de aprovação de 22 de setembro de 2011 e parecer nº 029/2011.
RESULTADOS
Entre as amostras examinadas dos 115 pacientes, observou-se uma frequência de 53,0% (61/115) para o sexo masculino. A análise sorológica, utilizando tanto o método ELISA de segunda geração, realizado na época da coleta das amostras, quanto o método ELISA de terceira geração, demonstraram frequências iguais de anti-HCV reagente de 62,6% (72/115) em ambos os métodos (Tabela 1).
Tabela 1 - Frequência de anti-HCV+, por sexo, utilizando métodos ELISA de segunda e terceira geração, em amostras de soro de pacientes submetidos a tratamento em uma clínica de diálise de Belém, estado do Pará, Brasil, no período de 1990 a 1993
| Sexo | Nº dialisados | % | ELISA 2ª geração | ELISA 3ª geração | ||
|---|---|---|---|---|---|---|
| N | % | N | % | |||
| Masculino | 61 | 53,0 | 37 | 60,6 | 35 | 57,4 |
| Feminino | 54 | 47,0 | 35 | 64,8 | 37 | 68,5 |
| Total | 115 | 100,0 | 72 | 62,6 | 72 | 62,6 |
Fonte: SAHEP/IEC/SVS/MS.
N: número de amostras examinadas; %: frequência.
Entre as amostras coletadas na admissão de cada um dos 115 pacientes, foram encontradas prevalências de 16,5% (19/115) para anti-HCV+, 13,0% (15/115) para Ag-Ab HCV+ e 4,3% (5/115) para HCV-RNA+.
Nas 115 amostras iniciais dos pacientes estudados, utilizando métodos ELISA de terceira geração, houve prevalência de 16,5% (19/115) para anti-HCV+. Quanto à presença de soroconversão (Tabela 2), nas últimas 96 amostras examinadas dos pacientes estudados que eram inicialmente não reagentes para o HCV, foi detectada a presença de soroconversão para HCV+ em 55,2% (53/96), sendo essa maior no sexo masculino, com 61,4% (27/44).
Tabela 2 - Prevalência de anti-HCV+, por sexo, utilizando métodos ELISA de terceira geração nas primeiras e últimas amostras de soro de pacientes submetidos a tratamento em uma clínica de diálise de Belém, estado do Pará, Brasil, no período de 1990 a 1993
| Sexo | ELISA 3ª geração | ELISA 3ª geração | ||||
|---|---|---|---|---|---|---|
| Nº dialisados Primeira amostra | N | % | Nº dialisados Última amostra | N | % | |
| Masculino | 61 | 9 | 14,7 | 44 | 27 | 61,4 |
| Feminino | 54 | 10 | 18,5 | 52 | 26 | 50,0 |
| Total | 115 | 19 | 16,5 | 96 | 53 | 55,2 |
Fonte: SAHEP/IEC/SVS/MS.
N: número de amostras reagentes; %: prevalência.
Entre as primeiras e últimas amostras anti-HCV+ detectados nos testes ELISA de terceira geração, foram encontrados resultados que permitiram classificá-los em quatro grupos: (I) somente anti-HCV+; (II) anti-HCV+, Ag-Ab HCV+ e HCV-RNA não reagente (HCV-RNA-); (III) anti-HCV+, Ag-Ab HCV+ e HCV-RNA+; (IV) anti-HCV+, HCV-RNA+ e Ag-Ab HCV- (Tabela 3). Entre as últimas amostras examinadas, o grupo III foi o mais prevalente com 49,0% (26/53), diferente das primeiras amostras, no qual o mais frequente foi o grupo II com 57,9% (11/19).
Tabela 3 - Distribuição de testes anti-HCV, Ag-Ab HCV e HCV-RNA por grupos, em amostras de soro de pacientes reagentes para HCV+ submetidos a tratamento em uma clínica de diálise de Belém, estado do Pará, Brasil, no período de 1990 a 1993
| Grupos | Total | Primeira amostra | Última amostra | |||
| N | % | N | % | N | % | |
| Grupo I | 7 | 9,7 | 3 | 4,2 | 4 | 5,5 |
| Grupo II | 29 | 40,3 | 11 | 15,3 | 18 | 25,0 |
| Grupo III | 30 | 41,7 | 4 | 5,5 | 26 | 36,1 |
| Grupo IV | 6 | 8,3 | 1 | 1,4 | 5 | 7,0 |
| Total | 72 | 100,0 | 19 | 26,4 | 53 | 73,6 |
Fonte: SAHEP/IEC/SVS/MS.
Grupo I: somente anti-HCV+; Grupo II: anti-HCV+, Ag-Ab HCV+ e HCV-RNA‒; Grupo III: anti-HCV+, Ag-Ab HCV+ e HCV-RNA+; Grupo IV: anti-HCV+, Ag-Ab HCV‒ e HCV-RNA+; N: número de amostras; %: prevalência.
Conforme apresentado na seção de metodologia, entre os 37,4% (43/115) pacientes com sorologia anti-HCV- nas primeiras e últimas amostras, 51,2% (22/43) destas foram retestadas para detecção de Ag-Ab HCV e HCV-RNA. Os resultados encontrados permitiram classificá-los em dois grupos: (I) anti-HCV, Ag-Ab HCV e HCV-RNA-; e (II) anti-HCV, Ag-Ab HCV- e HCV-RNA+. Em 22,7% (5/22) dos dialisados, mesmo com anti-HCV- e Ag-Ab HCV-, detectou-se positividade do HCV-RNA.
Foi possível determinar o genótipo em 97,2% (35/36) das amostras com anti-HCV+ e HCV-RNA+ (Tabela 3). Foram detectados os genótipos 1 e 3 entre as amostras examinadas, sendo que o genótipo 1 foi o mais prevalente em 75,0% (27/36) dos indivíduos tanto no sexo masculino como no feminino, seguido pelo genótipo 3 com 19,4% (7/36). Em uma paciente, não foi possível determinar o genótipo (2,8%; 1/36).
DISCUSSÃO
O Brasil possui o terceiro maior grupo de pacientes em hemodiálise no mundo; apesar disso, a taxa de sobrevida e os fatores de risco de mortalidade dessa população são desconhecidos17. Prevalências elevadas de HCV ainda são detectadas em unidades de diálise no mundo inteiro, e a infecção pelo HCV influi negativamente tanto na sobrevida dos pacientes em hemodiálise como também nos pacientes que se submetem ao transplante renal18. Segundo Sesso et al.19, as taxas de prevalência de sorologia reagente para as hepatites B e C apresentaram tendência de redução, de 2013 para 2016, de 1,4% para 0,7% para a hepatite B e de 4,2%, para 3,7% para a hepatite C.
A ocorrência da infecção pelo HCV, entre pacientes hemodialisados, mesmo sendo maior que na população geral, vem diminuído gradualmente após a década de 1990, pelo melhor conhecimento da doença e pela adoção de uma série de medidas para a redução da transmissão do HCV nas unidades de hemodiálise20. Um estudo com dialisados demonstrou que 25% dos pacientes que se submetiam a esse tipo de terapia não tinham nenhum conhecimento sobre a existência das hepatites virais, relacionando que a falta de informações sobre o assunto poderia estar associada ao baixo nível educacional da população estudada. Entretanto, como esses indivíduos faziam parte de um grupo de risco para se infectar pelo HCV, pela realização do procedimento dialítico, o fato da falta de informação também poderia ser classificado como fator de risco para a aquisição das hepatites virais21.
O Inquérito Brasileiro de Diálise Crônica de 2016 mostrou que 57% dos pacientes em hemodiálise são do sexo masculino e mais de dois quintos estão acima dos 40 anos de idade19. O presente estudo revelou uma prevalência de infecção por HCV entre os dialisados de 53,0% para o sexo masculino. Um estudo realizado em Dourados, estado do Mato Grosso, demonstrou predomínio do sexo feminino em 53,1%, correlacionado ao fato de que as mulheres apresentavam uma sobrevida maior que a dos homens, pela maior preocupação com a sua saúde19. Na Região Norte, um estudo realizado com 46 pacientes matriculados em cinco unidades de hemodiálise de Belém encontrou incidência de hepatite C após início de tratamento dialítico de 67,4%, constatando-se elevada prevalência do sexo masculino, representando dois terços dos pacientes entrevistados, com idade prevalente maior que 50 anos22.
No presente estudo, foi observada elevada prevalência de anti-HCV+ em 62,6% das amostras examinadas, tanto para os testes ELISA de segunda geração quanto para os de terceira geração, revelando que os testes sorológicos foram e ainda são úteis para a triagem da hepatite C nessa população.
A importância dos testes sorológicos, para a detecção de anti-HCV na triagem dos infectados por esse vírus, foi constatada por pesquisas que utilizaram testes ELISA de segunda geração, nas quais foram encontradas prevalências de anti-HCV+ de 29,8% em Porto Alegre, estado do Rio Grande do Sul, e de 35,3% em Goiânia, estado de Goiás23,24. Um estudo, realizado em uma unidade de diálise em Alicante, Espanha, que avaliou 116 pacientes em hemodiálise, constatou que os testes ELISA de segunda geração tiveram sensibilidade de 100,0% e especificidade de 94,1%, sendo considerados bastante úteis para o diagnóstico de HCV entre dialisados, e que os testes ELISA de terceira geração apresentaram, como principais vantagens em relação aos de segunda geração, a redução do tempo médio de detecção da soroconversão e uma maior sensibilidade para detecção do HCV, tanto em doadores de sangue quanto em hepatopatas25. Porém, neste estudo, houve equiparação de resultado entre os testes ELISA de segunda e de terceira geração, comprovando a utilidade da triagem diagnóstica da hepatite C para ambos os testes.
Verificou-se que, no momento da primeira coleta de amostras, 16,5% dos dialisados já possuíam anti-HCV+ e que pelo menos 4,3% também apresentavam HCV-RNA+, demonstrando a presença de replicação viral e o grande risco de transmissão do HCV no ambiente dialítico. Uma análise de amostras de soros, coletadas entre 1980 e 1992, revelando 12 anos da história natural de infecção pelo HCV entre dialisados, demonstrou prevalência de 39,6% de anti-HCV+, maior que a encontrada no presente estudo, e que, entre esses, 47,7% também já haviam adquirido o HCV anteriormente ao processo dialítico26.
A soroconversão de 55,2%, detectada entre pacientes que no início do tratamento dialítico eram anti-HCV-, comprovou a presença de circulação viral e a existência, naquele período, da transmissão nosocomial na unidade de diálise analisada. Um estudo, realizado em 1994, revelou dados semelhantes, no qual 52,3% dos pacientes também apresentaram soroconversão durante o período de diálise, confirmando a ocorrência de transmissão nosocomial do HCV27.
Antes da regulamentação dos serviços de hemodiálise no Brasil, ocorrida em 1996, as medidas de controle e prevenção eram deficitárias, contribuindo para elevadas taxas de infecção pelo HCV entre esses serviços28. Uma pesquisa desenvolvida em unidades de hemodiálise, em 2008, após a implementação da Portaria GM/MS nº 2.042/1996, revelou que, somente após a implantação efetiva das medidas de prevenção e controle, foi possível uma redução significativa do número de casos de infecção pelo HCV6,8.
Algumas medidas de controle e prevenção poderiam evitar a transmissão do HCV de pacientes portadores para não portadores, tais como: a utilização de luvas, quando houver manuseio de equipamentos e contato com os pacientes; a realização de procedimentos de desinfecção das áreas ocupadas pelos pacientes; e a separação de pacientes conhecidamente portadores do vírus da hepatite B e do HCV dos demais não infectados29.
O estudo detectou anti-HCV+, Ag-Ab HCV- e HCV-RNA- em 9,7% das amostras. Isso pode ser explicado por resultados falso-positivos, decorrentes da própria técnica imunoenzimática, o que é bastante frequente; uma cicatriz sorológica decorrente de infecção anterior pelo HCV; o desenvolvimento de anticorpos contra proteínas residuais, quando da produção do antígeno recombinante, do kit comercial sorológico disponibilizado; as doenças de autoimunidade ou mesmo a degradação proteica que pode ocorrer em virtude dos longos períodos de estocagem dos soros e/ou pela sua armazenagem inadequada30.
Valores baixos de HCV-RNA e anti-HCV+ podem significar tanto resultados falso-negativos do PCR, uma vez que o paciente submetido ao tratamento dialítico tem a característica de apresentar viremia intermitente, quanto de um resultado falso-positivo do anti-HCV devido à própria técnica de análise utilizada31. Além disso, a manipulação ou mesmo o armazenamento inadequado das amostras de sangue podem levar à falha em detectar HCV-RNA em até 40% das amostras32.
A detecção de 40,3% amostras de pacientes anti-HCV+ e Ag-Ab HCV+ com HCV-RNA- pode ter ocorrido devido à concentração e à qualidade dos ácidos nucleicos virais, extraídos das amostras e utilizados por técnica de PCR, serem afetadas por fatores como método de coleta, manuseio, transporte, armazenamento das amostras, a técnica de extração do ácido nucleico que, levando em consideração a natureza lábil do RNA, pode degradar o material genético viral e dificultar a detecção molecular do vírus. Por essas razões, um resultado não reagente em uma amostra pode ocorrer meramente pela degradação do RNA e não pela ausência de infecção, uma vez que, neste estudo, as amostras foram coletadas há duas décadas, concorrendo para isso o fato de que o uso de heparina, como no processo da diálise, poderia inativar a PCR.
Em 41,7% dos pacientes anti-HCV+, foi possível verificar a presença de infecção ativa pelo HCV com Ag-Ab HCV e HCV-RNA positivos, confirmando a falta de controle na disseminação viral ocorrida na unidade de diálise em estudo. Uma pesquisa, realizada em população de hemodialisados no Brasil Central, revelou prevalência de 39% de anti-HCV+, sendo que a presença da viremia (HCV-RNA+) foi de 63,5% das amostras e em 10,3% dos pacientes com anti-HCV-, sugerindo que a transmissão nosocomial pode desempenhar um papel importante na propagação do HCV em unidades de diálise, e que, além do anti-HCV, a detecção do HCV-RNA pela PCR é necessária para diagnosticar a hepatite C em dialisados33.
Leão et al.18, em estudo desenvolvido em Juiz de Fora, estado de Minas Gerais, relataram menor prevalência do que o estudo atual, com anti-HCV+ de 14,8%, dos quais 71,6% tinham HCV-RNA+, confirmando a presença de infecção crônica pelo HCV.
Mesmo com anti-HCV e PCR HCV-RNA reagentes, 8,3% das amostras apresentaram Ag-Ab HCV-, demonstrando discordância nos resultados sorológicos entre os testes ELISA de terceira geração e Monolisa Ag-Ab HCV, revelando uma sensibilidade menor do que a esperada segundo a literatura. Alados-Arboletas et al.34 defendem que a sensibilidade do teste Monolisa Ag-Ab HCV em pacientes dialisados é maior do que o teste Ortho anti-HCV (100% e 70,8%, respectivamente). Além disso, o Monolisa reduziria significativamente o tempo de janela imunológica pelo HCV por até 72 dias.
Estudos demonstraram que o Monolisa Ag-Ab HCV foi capaz de detectar resposta sorológica positiva entre 40% a 90% das amostras HCV-RNA+ com anti-HCV- obtidas durante o período de janela imunológica, melhorando assim a detecção precoce de anticorpos da hepatite C35. Entretanto, o ensaio Ag-Ab HCV não detecta a infecção pelo HCV tão precocemente quanto o PCR HCV-RNA, tendo um atraso médio de 30,3 dias36.
Em relação aos dialisados que se mantiveram anti-HCV- durante todo o período de estudo, foram analisadas 51,2% das amostras desses pacientes, revelando que, em 22,7%, foi possível detectar a positividade do HCV-RNA, comprovando viremia, mesmo na ausência de detecção sorológica do HCV. Uma possível explicação para esse fato poderia ser a baixa sensibilidade do teste sorológico para a detecção do anticorpo viral, seja pela presença de baixos títulos de anticorpos, porque o antígeno utilizado no teste sorológico não foi capaz de detectar a resposta dos anticorpos séricos, ou mesmo pela presença de doenças imunossupressoras, como a insuficiência renal crônica7.
A detecção de viremia na ausência de anticorpos entre dialisados poderia ocorrer dentro de uma infecção recente, antes do desenvolvimento de anticorpos, em um período conhecido como "janela imunológica" ou pela própria imunossupressão do paciente, ocasionada pela insuficiência renal26.
Um estudo realizado em Porto Alegre, estado do Rio Grande do Sul, com 71 pacientes dialisados, detectou 12,5% anti-HCV- com HCV-RNA+, relatando que, em alguns pacientes, a pesquisa de anti-HCV pode ser não reagente, mesmo com viremia positiva, sugerindo que a detecção do HCV-RNA é fundamental para melhorar o diagnóstico da hepatite C entre dialisados37.
A presença de HCV-RNA+ com anti-HCV- sugeriria que a baixa viremia, entre alguns portadores de HCV, poderia ser responsável pelos baixos e oscilantes níveis de anticorpos, à semelhança do encontrado em outro estudo que mostrou uma correlação positiva entre a titulação de anti-HCV e a carga de HCV-RNA31.
Os resultados encontrados neste estudo mostraram que, entre as amostras anti-HCV-, 77,3% possuíam HCV-RNA também negativo, indicando que não ocorreu infecção, o que não é possível afirmar no caso dos renais crônicos submetidos à hemodiálise. A principal dificuldade no diagnóstico da infecção viral em pacientes renais crônicos é a presença de viremia intermitente, na qual resultados negativos do HCV-RNA, em determinações isoladas, não poderiam ser interpretados como ausência de replicação viral, propondo, dessa forma, que determinações seriadas do HCV-RNA definiriam corretamente a viremia38.
Apesar do comprometimento imunológico causado pela uremia e exacerbado pela hemodiálise, defende-se que esse procedimento preservaria o paciente de um curso agressivo da hepatite C pela redução da carga viral. Os mecanismos pelos quais o procedimento dialítico reduziria a viremia seriam explicados pela passagem de partículas virais pelo dialisador, gerando o aprisionamento do vírus na superfície da membrana do mesmo. Além disso, um mecanismo hospedeiro mediado indireto, envolvendo a produção de interferon alfa, fator de crescimento de hepatócitos e outras citocinas produzidas com atividade antiviral durante as sessões de hemodiálise pode estar envolvido39. Entretanto, em contraste com este estudo, outros pesquisadores relataram que durante o processo dialítico houve aumento significativo do HCV-RNA no soro até 180 min após o início da hemodiálise40.
No presente estudo, entre as amostras HCV-RNA+, foram detectados os genótipos 1 e 3, sendo que o genótipo 1 foi o mais prevalente em 73,0% das amostras examinadas. Nas amostras de pacientes do sexo masculino, o genótipo 1 mostrou prevalência de 45,9% e o genótipo 3, de 18,9%. Em relação ao sexo feminino, 27,1% eram genótipo 1 e 5,4% genótipo 3. No estudo de Araújo et al.41, realizado em Manaus, estado do Amazonas, em 2011, houve a detecção dos genótipos 1, 2 e 3, sendo que, em relação aos homens, o genótipo 1 foi detectado em 76,1%, o genótipo 3 em 19,6% e o genótipo 2 em 4,3%; e, entre as mulheres, o genótipo 1 foi o mais prevalente (54,2%), seguido pelos genótipos 3 (25,0%) e 2 (20,8%)41.
Uma pesquisa, realizada entre dialisados no Rio Grande do Sul, relatou maior prevalência do genótipo 1 (63,5%), seguindo pelos genótipos 3 (34,8%) e 2 (1,5%) do HCV24. Em Pelotas, também no Rio Grande do Sul, foi detectada a prevalência de HCV de 18,2%, com concordância entre o anti-HCV e o RT-PCR de 94%. Três pacientes foram não reagentes para anti-HCV por ELISA, com RT-PCR+. O genótipo 1 foi o mais prevalente (46,7%), e o subtipo 1a foi o mais frequente (74,1%)42.
Um estudo, desenvolvido em Belo Horizonte, estado de Minas Gerais, com pacientes portadores de hepatite C crônica, também observou alta prevalência do genótipo 1 (78,4%), sendo os subtipos 1b (40,4%) e 1a (37,5%) os mais frequentes; e o genótipo 3a esteve presente em 17,9% dos pacientes43.
Resultado semelhante foi observado em um estudo realizado em Salvador, no estado da Bahia, onde o genótipo 1 também predominou, seguido pelo genótipo 3, observando que mesmo tendo 80% de sua população negra ou miscigenada, nenhum genótipo africano foi encontrado44.
CONCLUSÃO
Por este estudo, foi possível concluir que: as frequências de anti-HCV+, tanto pelos métodos ELISA de segunda como de terceira geração, foram semelhantes (62,6%); houve conversão sorológica durante o tratamento dialítico; foram encontrados os genótipos 1 e 3 do HCV; e em 22,7% dos dialisados, mesmo com anti-HCV- e Ag-Ab HCV-, detectou-se positividade do HCV-RNA.
Pacientes com insuficiência renal crônica submetidos à hemodiálise têm alto risco de se infectar pelo HCV, principalmente pela contaminação nosocomial, por meio de procedimentos relacionados às punções venosas frequentes e ao uso de equipamentos comuns aos pacientes. A alta prevalência de infecção pelo HCV encontrada entre os pacientes em tratamento na clínica de diálise pesquisada, nos anos iniciais à introdução de triagem para a detecção do HCV, mostrou a importância da infecção pelo HCV em pacientes submetidos ao tratamento dialítico e as dificuldades para o controle da transmissão em unidades de diálise. A evolução tecnológica de marcadores para triagem, confirmação da infecção, quantificação e genotipagem do HCV, nos últimos anos, permitiram a confirmação diagnóstica dos casos na atualidade, assim como a utilização de provas de biologia molecular e do antígeno core e anticorpo do HCV não acessíveis na época da coleta das amostras. Sendo assim, esses testes poderão ser úteis para a comprovação de viremia da hepatite C, particularmente em pacientes de risco, como os dialisados, que não apresentarem reatividade para o anti-HCV.
O presente estudo contribuiu ao descrever retrospectivamente a situação vigente nos anos que antecederam a introdução das medidas de intervenção propiciadas pela descoberta do HCV e da pesquisa de seus marcadores sorológicos e moleculares.











 texto em
texto em 


