Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Pan-Amazônica de Saúde
Print version ISSN 2176-6215On-line version ISSN 2176-6223
Rev Pan-Amaz Saude vol.10 Ananindeua 2019 Epub Dec 02, 2019
http://dx.doi.org/10.5123/s2176-6223201900080
ARTÍCULO ORIGINAL
Desempeño del Pediatric Risk of Mortality (PRISM) y Pediatric Index of Mortality 2 (PIM2) en unidad de terapia intensiva pediátrica terciaria en la Amazonía brasileña
1 Hospital Fundação Santa Casa de Misericórdia do Pará, Departamento Pediatria, Unidade de Terapia Intensiva Pediátrica, Belém, Pará, Brasil
2 Instituto Evandro Chagas, Seção de Virologia, Laboratório Epstein-Barr Vírus, Belém, Pará, Brasil
OBJETIVO:
Evaluar el desempeño de los escores de mortalidad Pediatric Risk of Mortality (PRISM) y Pediatric Index of Mortality 2 (PIM2) en la Unidad de Terapia Intensiva Pediátrica (UTIP) Terciaria de la Fundación Santa Casa de Misericordia de Pará (FSCMPA).
MATERIALES Y MÉTODOS:
Estudio de cohorte retrospectivo, incluyendo pacientes admitidos en la UTIP, entre enero de 2017 y abril de 2018, con permanencia por más de 8 h. Los criterios de exclusión fueron: permanencia superior a 90 días; parada cardiorrespiratoria sin estabilidad en 12 h; cuidados paliativos; y muerte encefálica. Para calcular los sistemas de puntajes y desenlace, se utilizaron las variables Standardized Mortality Rate (SMR), calibración y discriminación, que fueron comparadas por las pruebas goodness-of-fit y curvas Receiver Operating Characteristic (ROC), respectivamente.
RESULTADOS:
Entre las 458 internaciones, 429 (93,7%) fueron incluidas. La mortalidad general fue de 17,5%, siendo 64,0% menores de 2 años y 58,7% de los que evolucionaron a óbito fueron sometidos a ventilación mecánica por un período superior a siete días. La media de probabilidad de muerte estimada del PRISM fue 9,85%, mientras que la media del PIM2 fue de 14,2%. El SMR fue de 1,35 (1,26-1,72) para el PRISM y de 1,23 (1,13-1,58) para el PIM2. El área bajo la curva ROC fue de 0,89 (IC 95% 0,81-0,91) para el PRISM y 0,87 (IC 95% 0,83-0,91) para el PIM2.
CONCLUSIÓN:
En la UTIP de la FSCMPA, el PRISM y el PIM2 tuvieron una buena calibración y buen poder discriminatorio. El SMR fue superior a uno.
Palabras clave: Medición de Riesgo; Unidades de Terapia Intensiva Pediátrica; Pronóstico; Mortalidad; Puntuación de Mortalidad
INTRODUCCIÓN
Pronosticar es el arte del intensivismo1. A pesar de la poesía y del concepto filosófico de la frase, realizar esa tarea es extremadamente arduo en el diario vivir de la terapia intensiva pediátrica, destacando que, tan difícil como diagnosticar, es pronosticar, exigiendo del intensivista el pleno uso de su capacidad técnico-científica y vivencia clínica.
A partir de la generalización, el aumento de la complejidad de los casos y el número de individuos que necesitan cuidados intensivos, ya sea por terapias más modernas o por nuevas morbilidades, surgió la necesidad de estratificar a estos usuarios2. Así, se desarrollaron los primeros sistemas de puntuación pronóstica, en la década de 1970, para determinar y evaluar qué tipo de paciente necesitaba este cuidado, la tasa de mortalidad y el tratamiento, en un intento por resolver cuestiones inherentes a la práctica diaria en las unidades de cuidados intensivos: ¿Qué tan grave está este paciente? ¿Cuál es el riesgo de muerte? De hecho, esto juega un papel fundamental a la hora de determinar y decidir la conducta médica.
Los sistemas de puntuaciones pronosticadas son herramientas que proporcionan la probabilidad de resultados, basados en variables compuestas con carácter predictivo y clasificadas por su importancia en la determinación de este resultado3. Las dos causas básicas principales de la dificultad para aplicar las puntuaciones pronosticadas son: la diferencia en las condiciones clínicas individuales, y la diferencia en las condiciones de trabajo e infraestructura de cada unidad de terapia intensiva pediátrica (UTIP)4.
El Pediatric Risk of Mortality (PRISM)5 fue desarrollado a partir del Physiological Stability Index (PSI)6. A través de técnicas estadísticas, las 34 variables del PSI, consideradas en la admisión, se simplificaron, resultando en 14 variables medidas normalmente en UTIP en las primeras 24 h de internación.
De todos los puntajes desarrollados para uso en UTIP, el PRISM7,8 es el más utilizado; sin embargo, su versión más nueva, el PRISM IV8, todavía precisa de mejores evaluaciones de desempeño en otras poblaciones y todavía está bajo dominio privado, lo que reduce su uso de forma más amplia en las UTIs. Su versión III7, actualmente disponible en dominio público, está siendo utilizada y validada.
El Pediatric Index of Mortality (PIM)9 surge como una alternativa al PRISM, con más practicidad y accesibilidad. Slater et al.10, en 2003, revisaron los datos utilizados en la elaboración del PIM y crearon el PIM2, con la justificativa de cambios en el perfil de pacientes y de tratamiento.
El PIM210 utiliza el análisis de 10 variables cuando el paciente ingresa a la UCIP, mientras que en el PRISM los datos se recogen en las primeras 24 h de ingreso en la UCIP. Actualmente existe una versión actualizada, el PIM311, todavía en proceso de validación externa a nivel mundial.
La utilización de sistemas de puntuación pronóstica, que reflejen la gravedad de los pacientes atendidos en la UCIP de forma adecuada y estandarizada, es de suma utilidad y de gran importancia para orientar procedimientos médicos y planes terapéuticos12, ya sea para la correcta asignación de recursos técnicos y humanos, mejorar la calidad de la atención al paciente e identificar la fragilidad del servicio ante situaciones específicas, o comparar diferentes unidades y su idoneidad futura.
Por ello, el presente trabajo tiene como objetivo evaluar el desempeño de PRISM y PIM2 en la UCIP Terciaria de la Fundación Santa Casa de Misericordia de Pará (FSCMPA), en Belém, estado de Pará, Brasil.
MATERIALES Y MÉTODOS
Se realizó un estudio de cohorte retrospectivo, con datos obtenidos de las historias clínicas de todos los pacientes ingresados en la UCIP de FSCMPA, hospital de referencia en salud materno infantil en la Región Amazónica de Brasil, entre septiembre de 2015 y julio de 2017. Para este estudio se utilizó el Libro de admisiones y altas de la Unidad.
La UCIP FSCMPA cuenta con 10 camas y atiende a niños con enfermedades de alta complejidad, provenientes de la emergencia de hospitales del Sistema Único de Salud, salas y sectores quirúrgicos del hospital.
Los criterios de inclusión fueron: pacientes hospitalizados en el período y permanencia en la UCIP por más de 8 h; y, en caso de fallecimiento, una estancia hospitalaria de 4 horas o superior. Los criterios de exclusión fueron: pacientes con permanencia inferior a 8 h; pacientes ingresados en parada cardiorrespiratoria que no alcanzaron la estabilidad de los signos vitales en 12 h; y aquellos en cuidados paliativos u orden de no reanimar y con muerte encefálica.
Las variables estudiadas constituyeron tres grupos: variables de caracterización clínica y epidemiológica; variables para el cálculo de los sistemas de puntuación; y variables de resultado. Se incluyeron variables demográficas y clínicas para la estratificación de la muestra.
Se construyó una base de datos, basada en datos organizados en hojas de cálculo utilizando el software Microsoft Excel® 2010 (Washington, EE. UU.) Para la calibración de modelos estadísticos se utilizó la prueba de Hosmer-Lemeshow13. El análisis se realizó dividiendo a los pacientes en 10 niveles de riesgo de mortalidad, para comparar la mortalidad observada y la mortalidad esperada. Para la discriminación de sobrevivientes y óbitos, se calculó el área bajo la curva de Receiver Operating Characteristic (ROC)14.
Para cuantificar la calidad de la atención brindada en la UCIP a través del puntaje de mortalidad se utilizó la Standardized Mortality Rate (SMR)15, que compara la estimación de muertes con la mortalidad observada. La comparación entre grupos se realizó mediante la prueba U de Mann-Whitney.
En el presente estudio, se adoptaron los preceptos de la Resolución Nº 466/12 del Consejo Nacional de Salud, y el proyecto fue aprobado, el 8 de julio de 2017, por el Comité de Ética en Investigación de la FSCMPA, basado en el parecer consultivo 22012001, CAAE: 69404417.6.0000.
RESULTADOS
Durante el período de estudio, hubo 458 hospitalizaciones, de las cuales se incluyeron 429, lo que corresponde al 93,7% del universo de investigación.
De los 429 pacientes seleccionados, 284 (66,2%) eran de Enfermería. La mayoría era de sexo masculino 232 (54,1%) y tenía un promedio de edad de 24 meses, variando de 1 mes a 18 años. El grupo de edad más frecuente de hospitalización fue de niños hasta los 2 años, totalizando 226 (52,7%) (Tabla 1).
Tabla 1 - Distribución de las variables sociodemográficas y soporte terapéutico evaluados de pacientes internados en la UTIP de la FSCMPA, en Belém, estado de Pará, Brasil, de setiembre de 2015 a julio de 2017
| Variables | Admisión | Óbito | ||
|---|---|---|---|---|
| N | % | N | % | |
| Sexo | ||||
| Masculino | 232 | 54,1 | 37 | 49,3 |
| Femenino | 197 | 45,9 | 38 | 50,7 |
| Idade (años) | ||||
| < 2 | 226 | 52,7 | 48 | 64,0 |
| 2-5 | 100 | 23,3 | 11 | 14,7 |
| 6-12 | 79 | 18,4 | 12 | 16,0 |
| > 12 | 24 | 5,6 | 4 | 5,3 |
| Procedencia | ||||
| Enfermería | 284 | 66,2 | 36 | 48,0 |
| Ambulatorio | 7 | 1,6 | 1 | 1,3 |
| Externo | 138 | 32,2 | 38 | 50,7 |
| Uso de droga vasoactiva | ||||
| Sí | 232 | 54,1 | 70 | 93,3 |
| No | 197 | 45,9 | 5 | 6,7 |
| Uso de ventilación mecánica invasiva | ||||
| Sí | 375 | 87,4 | 75 | 100,0 |
| No | 54 | 12,6 | - | - |
| Tiempo de ventilación mecánica invasiva (días) | ||||
| 0-3 | 108 | 25,2 | 13 | 17,3 |
| 3-7 | 132 | 30,7 | 18 | 24,0 |
| 7-10 | 39 | 9,1 | 8 | 10,7 |
| 10-14 | 27 | 6,3 | 11 | 14,7 |
| > 14 | 123 | 28,7 | 25 | 33,3 |
| Uso de nutrición parenteral | ||||
| Sí | 41 | 9,6 | 12 | 16,0 |
| No | 388 | 90,4 | 63 | 84,0 |
| Uso de catéter venoso central | ||||
| Sí | 370 | 86,2 | 73 | 97,3 |
| No | 59 | 13,8 | 2 | 2,7 |
Señal convencional utilizada: - Dato numérico igual a cero, no resultante de redondeo.
Se observó que la mayoría de los niños procedía de hospitalización clínica (364; 84,8%). Las enfermedades infecciosas no sépticas fueron las más frecuentes (118; 27,5%), seguidas de los problemas respiratorios (87; 20,3%) y los trastornos neurológicos (72; 16,8%). La sepsis aisladamente presentó una proporción de 58.0% (249), de los cuales el 47.8% (119) presentó sepsis con shock séptico y/o disfunción multiorgánica (DMO) (Tabla 2).
Tabla 2 - Distribución de las variables clínicas evaluadas de pacientes internados en la UTIP de la FSCMPA, en Belém, estado de Pará, Brasil, de setiembre de 2015 a julio de 2017
| Variables | Admisión | Óbito | ||
|---|---|---|---|---|
| N | % | N | % | |
| Grupos de enfermedades primarias | ||||
| Infecciosas* | 118 | 27,5 | 47 | 62,7 |
| Respiratorias | 87 | 20,3 | 15 | 20,0 |
| Neurológicas | 72 | 16,8 | 4 | 5,3 |
| Postoperatorio | 65 | 15,1 | 7 | 9,4 |
| Metabólica/Inmunológica | 27 | 6,3 | - | - |
| Cardiológicas | 11 | 2,6 | - | - |
| Onco-hematológicas | 11 | 2,6 | 1 | 1,3 |
| Renales | 11 | 2,6 | 1 | 1,3 |
| Prematuridad | 8 | 1,8 | - | - |
| Desnutrición energético-proteica/Tracto gastrointestinal | 7 | 1,6 | - | - |
| Monitorización | 12 | 2,8 | - | - |
| Enfermedad crónica compleja | ||||
| Sí | 230 | 53,6 | 25 | 33,3 |
| No | 199 | 46,4 | 50 | 66,7 |
| Clasificación de morbilidad | ||||
| Respiratorio | 91 | 21,2 | 9 | 12,0 |
| Neuromuscular | 50 | 11,6 | 6 | 8,0 |
| Gastrointestinal/Hepático | 20 | 4,7 | 2 | 2,7 |
| Endócrino/metabólico | 20 | 4,7 | 1 | 1,3 |
| Cardiovascular | 14 | 3,3 | 1 | 1,3 |
| Renal | 10 | 2,3 | 2 | 2,7 |
| Defectos congénitos/genéticos | 10 | 2,3 | 2 | 2,7 |
| Prematuridad | 9 | 2,1 | 1 | 1,3 |
| Otros | 6 | 1,4 | 1 | 1,3 |
| Sin morbilidades | 199 | 46,4 | 50 | 66,7 |
| Sepsis continuum † | ||||
| Sepsis | 130 | 52,2 | 26 | 36,6 |
| Shock séptico/Disfunción múltiple de órganos | 119 | 47,8 | 45 | 63,4 |
| Tiempo de permanencia hospitalaria (días) | ||||
| < 5 | 140 | 32,6 | 22 | 29,3 |
| 6-10 | 100 | 23,3 | 15 | 20,0 |
| 11-15 | 53 | 12,4 | 15 | 20,0 |
| 16-20 | 34 | 7,9 | 5 | 6,6 |
| 21-25 | 32 | 7,5 | 11 | 14,7 |
| 26-30 | 13 | 3,0 | 3 | 4,0 |
| 31-35 | 10 | 2,3 | 2 | 2,7 |
| > 35 | 47 | 11,0 | 2 | 2,7 |
* Excluyendo sepsis; † Admisión = 249 y óbito = 71; Señal convencional utilizada - Dato numérico igual a cero, no resultante de redondeo.
En relación al tiempo de ventilación mecánica invasiva (VMI), se encontró una mediana de seis días e intervalo intercuartil de tres a 15 días, variando de menor que uno a 2.190 días; 87,3% de los pacientes fueron sometidos a la VMI las primeras 72 h de internación. Entre los pacientes que fueron sometidos a la VMI, 55,9% (240) fueron ventilados hasta siete días, 15,4% (66) de siete a 14 días y superior a 14 días la tasa porcentual fue de 28,7% (123) (Tabla 1). El tiempo medio de VMI, entre los pacientes que evolucionaron a óbito, fue de 13,46 (DP = 15,2) y la mediana de nueve días e intervalo intercuartil de cuatro a 18 días, variando la amplitud de uno a 90 días.
La estancia hospitalaria media fue de 13,2 días (DE = 24,1) y una mediana de ocho días y un intervalo intercuartil entre cinco y 20 días. La tasa de ocupación de la UCIP fue del 84,4% y el número medio de días-paciente fue de 8,17 pacientes/día. Entre los pacientes que fallecieron como resultado, se obtuvo una estadía promedio de 37 días, con una mediana de nueve días e intervalo intercuartil entre cuatro y 19 días, con un rango de uno a 90 días, mientras que en los que sobrevivieron el tiempo promedio fue de 19,7 días, con una mediana de ocho días e intervalo intercuartil entre cinco y 20 días, con un rango de uno a 90 días.
La tasa de mortalidad global fue del 17,5% y entre los menores de 2 años se produjeron 48 defunciones (64,0%). En cuanto a la mortalidad y la VMI, se observó una mayor frecuencia de defunciones en los niños sometidos a la VMI por un período superior a 14 días (25; 33,3%). La comorbilidad alcanzó a 230 niños (53,6%), con óbito correspondiente al 33,3%.
Considerando los diagnósticos de grupos de enfermedades primarias, 47 (62,7%) pacientes con enfermedades infecciosas fallecieron como resultado, seguidos de 15 (20,0%) en el grupo de trastornos respiratorios y siete (9,4%) en el casos quirúrgicos. En pacientes con shock séptico y/o DMO, la tasa de mortalidad fue del 63,4% (45) (Tabla 2).
El promedio general de la probabilidad de mortalidad del PRISM fue de 9,85% (DP = 8,24), con mediana de ocho (intervalo intercuartil de cuatro a 14), y el promedio general del PIM2 fue de 14,2% (DP=24,7%), con mediana de 3,7% (intervalo intercuartil de 0,8 a 12,7%).
La mortalidad estimada por el PRISM fue de 55,14 y por el PIM2 de 61 pacientes. Esto corresponde a un SMR (IC=95%) de 1,35 (1,26-1,72) para PRISM y 1,23 (1,13-1,58) para PIM2. La mediana de PIM2 y PRISM, para supervivientes y no supervivientes, fue 2,3% (0,6-7,8%) y 13,4% (6,5-62%) y 2,8% (1,4-9,1%) y 18,7% (6,2-55,9%) respectivamente; sin embargo, no hubo diferencias estadísticamente significativas entre los grupos (p> 0,05) usando la prueba U de Mann-Whitney.
El modelo PIM2 final, estimado a partir de toda la muestra de la puntuación original, también fue bien discriminado y calibrado (ROC 0,90 [0,89-0,91]; prueba de ajuste de Hosmer-Lemeshow χ2 = 11,56, gl = 8, p = 0.17), así como la muestra aquí estudiada (ROC 0.87 [0.83-0.91]; prueba de ajuste de Hosmer-Lemeshow χ2 = 0.48, gl = 8, p = 0,99).
La tabla 3 muestra las semejanzas en las mortalidades observada y esperada en 10 intervalos de riesgo de mortalidad, a través de la prueba de ajuste de Hosmer-Lemeshow, para el PRISM y para el PIM2. Se obtuvo un área bajo la curva ROC de 0,89 (IC 95% 0,81-0,91) para el PRISM y 0,87 (IC 95% 0,83-0,91) para el PIM2 (Figura 1). Los resultados encontrados mostraron que las pruebas tienen buen poder de discriminación entre sobrevivientes y no sobrevivientes.
Tabla 3 - Calibración de los puntajes PRISM y PIM2, por medio de la prueba de ajuste de Hosmer-Lemeshow, en estratos de riesgo para mortalidad y supervivencia de pacientes internados en la UTIP de la FSCMPA, en Belém, estado de Pará, Brasil, de setiembre de 2015 a julio de 2017
| Riesgo % | Admisión | Sobrevivencia observada | Sobrevivencia esperada | Mortalidad observada | Mortalidad esperada |
|---|---|---|---|---|---|
| PRISM %* | |||||
| 0,0-1,0 | 54 | 53 | 53,7 | 1 | 0,33 |
| 1,0-1,5 | 52 | 50 | 51,3 | 2 | 0,66 |
| 1,5-2,5 | 56 | 53 | 54,9 | 3 | 1,14 |
| 2,5-5,0 | 78 | 69 | 75,3 | 9 | 2,71 |
| 5,0-10,0 | 53 | 43 | 49,3 | 10 | 3,72 |
| 10,0-20,0 | 62 | 48 | 53,4 | 14 | 8,60 |
| 20,0-30,0 | 23 | 15 | 17,3 | 8 | 5,74 |
| 30,0-40,0 | 8 | 5 | 5,2 | 3 | 2,80 |
| 40,0-50,0 | 8 | 3 | 4,3 | 5 | 3,68 |
| > 50,0 | 35 | 15 | 9,2 | 20 | 25,76 |
| Total | 429 | 354 | 373,9 | 75 | 55,14 |
| PIM2 %* | |||||
| 0,0-1,0 | 121 | 114 | 120,5 | 7 | 0,50 |
| 1,0-1,5 | 42 | 41 | 41,5 | 1 | 0,49 |
| 1,5-2,5 | 29 | 28 | 28,4 | 1 | 0,57 |
| 2,5-5,0 | 49 | 44 | 47,2 | 5 | 1,79 |
| 5,0-10,0 | 65 | 50 | 60,3 | 15 | 4,72 |
| 10,0-20,0 | 42 | 30 | 36,2 | 12 | 5,80 |
| 20,0-30,0 | 18 | 12 | 13,4 | 6 | 4,61 |
| 30,0-40,0 | 10 | 8 | 6,5 | 2 | 3,46 |
| 40,0-50,0 | 12 | 7 | 6,5 | 5 | 5,53 |
| > 50,0 | 41 | 20 | 7,4 | 21 | 33,57 |
| Total | 429 | 354 | 367,9 | 75 | 61,04 |
* Los resultados encontrados fueron semejantes para el PRISM (χ2 = 0,205; p = 0,999) y el PIM2 (χ2 = 0,479; p = 0,999).
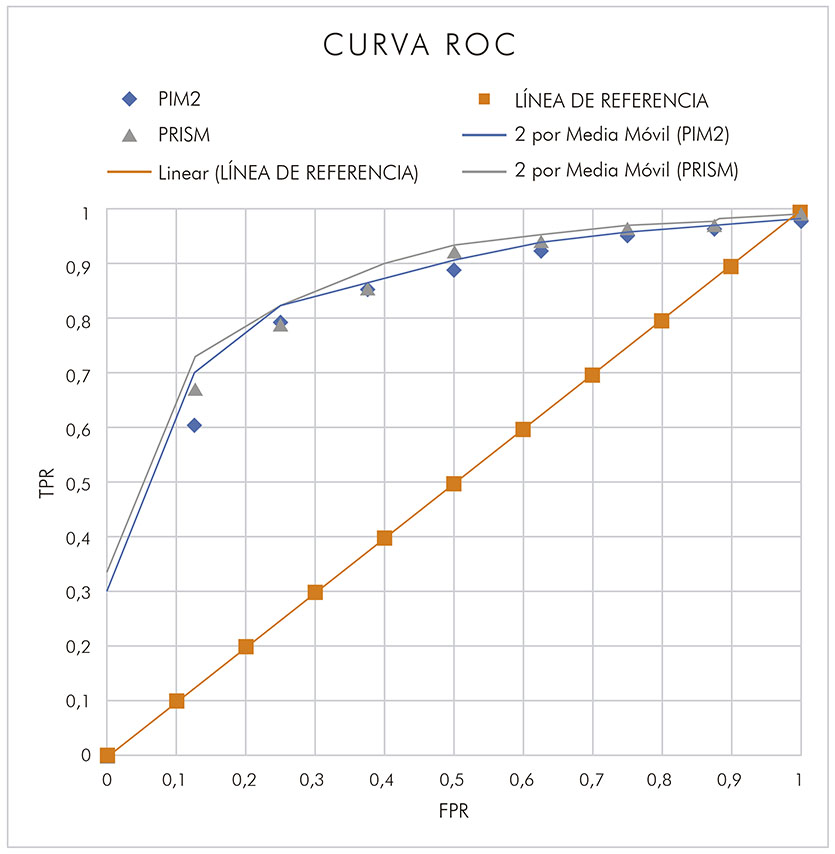
IC: Intervalo de confianza; TPR: Tasa de verdaderos positivos (true positive rate); FPR: tasa de falsos positivos (false positive rate).
Figura 1 - Superposición de curva ROC, 0,89 (IC 95% 0,81-0,91) para el PRISM y 0,87 (IC 95% 0,83-0,91) para el PIM2, de pacientes internados en la UTIP de la FSCMPA, en Belém, estado de Pará, Brasil, de setiembre de 2015 a julio de 2017
DISCUSIÓN
No se validaron modelos de predicción de mortalidad en UTIP de la Región Amazónica, por lo tanto existe la necesidad de validación externa en una población tan peculiar del punto de vista étnico, cultural y geográfico. La aplicación y la validación externa de sistemas de puntaje de pronóstico, en poblaciones diferentes, son esenciales para determinar la funcionalidad de esos sistemas en dichas poblaciones.
La población estudiada presentó una distribución por grupo de edad semejante a las demás series16,17,18,19,20,21. En relación al diagnóstico de admisión, se observaron divergencias en los hallazgos en relación a otros estudios17,22,23,24,25,26; en esos, los principales diagnósticos fueron enfermedades respiratorias y neurológicas, mientras que en este estudio, las principales enfermedades fueron infecciosas, seguidas de enfermedades respiratorias y neurológicas. Eso puede ocurrir debido al perfil de la unidad estudiada, que es referencia en Pará, y a la dificultad de acceso al servicio en otras localidades, por las distancias geográficas de un Estado continental.
Al evaluar el poder de calibración de las puntuaciones, utilizando la prueba de ajuste de Hosmer-Lemeshow, se observó que los resultados, tanto del PIM2 como del PRISM, tienen una buena calibración para determinar la relación entre la mortalidad observada y la esperada por las puntuaciones. Al utilizar el área bajo la curva ROC para evaluar el poder discriminatorio de las puntuaciones de mortalidad, se demostró que ambas puntuaciones mostraron buen poder de discriminación.
Al comparar los resultados obtenidos, en relación a los datos clínicos y demográficos, se observa que la población de este estudio y el PRISM5 original muestran una gran similitud. La población base del puntaje tuvo una variación de amplitud de edad entre 15 y 36 meses, motivo clínico de ingreso del 39 al 81%, procedentes del servicio de urgencias del 53 al 93%, estadía promedio entre dos (+/- 0,1) y 7,3 (+/- 1,4) días, enfermedad crónica entre 18 y 48% y tasa de mortalidad entre 3 y 17,6%.
Muchos autores relataron que el puntaje PRISM superestima3,16,17,18 la mortalidad y que no presenta buena calibración y discriminación en poblaciones específicas19,20,21. En el presente estudio, el PRISM presentó buena capacidad de calibración y discriminación, a pesar de haber subestimado la mortalidad, corroborando con otros estudios19,20,21,27,28,29,30.
En relación al PIM2, los datos obtenidos en este estudio se asemejan a los de la población original de desarrollo del puntaje10, donde: la mediana de edad fue de 19 meses; 42% era de niños con hasta 12 meses; los pacientes con problemas respiratorios constituyeron 21,5%; y el porcentaje de pacientes ventilados en la primera hora, luego de la admisión, estuvo entre 23 y 93%. En la presente casuística, la mediana de edad fue de 24 meses, siendo que 38,2% tenía edad de hasta 12 meses, y los pacientes con problemas respiratorios contabilizaron 20,3%; sin embargo, la tasa de mortalidad fue de 17,5%, y el principal diagnóstico de admisión fue en el grupo de problemas infecciosos (27,5%), mientras que, en la población original, la mortalidad fue de 5,3%, y los pacientes con problemas cardiovasculares constituyeron el principal grupo (25,5%).
El PIM2 se calibró correctamente y tuvo una buena discriminación en el presente estudio, aunque hay una ligera variación entre las muertes observadas y las predichas. Estos resultados son consistentes con la calibración y la discriminación satisfactoria, como se describió anteriormente. En otros estudios, la discriminación del PIM2 fue adecuada y su calibración fue variable, dependiendo de la ubicación geográfica de la UCIP y del subgrupo de comparación18,22,24. En varios estudios se destacan divergencias al utilizar los subgrupos edad y la presencia de enfermedades crónicas. Pocos estudios han utilizado subgrupos con estancia hospitalaria y duración de la ventilación mecánica. Los resultados aquí encontrados fueron similares a otros descritos en la literatura31,32,33,34,35,36; en todos los casos, la mortalidad observada fue superior a la esperada.
Esta variación en la calibración está asociada a múltiples justificaciones, como la inadecuada infraestructura del servicio de asistencia, particularmente si la mortalidad observada es mayor a la esperada. Esto es más importante en los países en desarrollo, donde los recursos son más limitados. Otros factores incluyen diferentes combinaciones de casos, patrón de enfermedad y falla en la ecuación del sistema de puntuación para modelar la situación real con precisión35,36,37,38,39,40.
Entre las limitaciones del presente estudio, están: el hecho de que se basa en revisiones retrospectivas de historiales, ocasionando un bies de colecta e interpretación; ser un estudio unicéntrico; y un número muestral reducido. Los estudios prospectivos, a pesar de también estar expuestos a sesgos, sobre todo relacionados a las posibilidades de respuestas durante la colecta, son esenciales para endosar los datos descritos en estudios retrospectivos.
CONCLUSIÓN
En la UTIP Terciaria de la FSCMPA, tanto el PRISM como el PIM2 tuvieron buena discriminación y calibración en el escenario de la Amazonía. Ambos modelos predictivos fueron validados para la Región y la población.
Considerando la calidad de cuidados, el SMR fue superior a uno; por lo tanto, los puntajes empleados subestimaron la mortalidad real con la prevista, sugiriendo inadecuación tecnológica de la unidad y/o de recursos humanos. Vale destaca que tal resultado no está relacionado con la escasez de recursos humanos y tecnológicos, una vez que la Institución completa los criterios vigentes de la Agencia Nacional de Vigilancia Sanitaria y de la Asociación de Medicina Intensiva Brasileña, aunque puede deberse al pequeño número de la muestra y a la alta morbilidad presente en los pacientes admitidos en nuestra unidad.
AGRADECIMIENTOS
A los gestores del Hospital Fundación Santa Casa de Misericordia de Pará y a los miembros del equipo de la Unidad de Terapia Intensiva Pediátrica Dr. Sidney Barbosa, que permitieron y auxiliaron en la colecta de datos y, así, tornaron posible la realización de este artículo: Rosangela Brandão Monteiro, Presidencia; Rosane Marques Rosado Gomes, Directorio Administrativo y Financiero; Norma Suely Carvalho Fonseca Assunção, Directorio Técnico Asistencial; Cinthya Francinete Pereira Pires, Directorio Asistencial Técnico Operacional; Pilar Maria de Oliveira Moraes, Directorio de Enseñanza e Investigación; Ana Cristina Marques, Gerencia de Pediatría; Bruna da Cunha Gammachi; y Valéria Terezinha dos Santos.
REFERENCIAS
1 Carvalho WB, Hirschheimer MR, Matsumoto T. Terapia intensiva pediátrica. 3. ed. São Paulo: Atheneu; 2006. [ Links ]
2 Cullen DJ, Civetta JM, Briggs BA, Ferrara LC. Therapeutic intervention scoring system: a method for quantitative comparison of patient care. Crit Care Med. 1974 Mar-Apr;2(2):57-60. [ Links ]
3 Costa GA, Delgado AF, Ferraro A, Okay TS. Application of the pediatric risk of mortality (PRISM) score and determination of mortality risk factors in a tertiary pediatric intensive care unit. Clinics (Sao Paulo). 2010;65(11):1087-92. [ Links ]
4 Espuñes SP, Villanueva AM, Torre AC, Galán CR, Cuervo SM, Hernández MC. Asistencia a los niños críticamente enfermos en Asturias: características y efectividad. An Pediatr. 2002;57(1):22-8. [ Links ]
5 Pollack MM, Ruttimann UE, Getson PR. Pediatric risk of mortality (PRISM) score. Crit Care Med. 1988 Nov;16(11):1110-6. [ Links ]
6 Yeh TS, Pollack MM, Ruttimann UE, Holbrook PR, Fields AI. Validation of a physiologic stability index for use in critically ill infants and children. Pediatr Res. 1984 May;18(5):445-51. [ Links ]
7 Pollack MM, Patel KM, Ruttimann UE. PRISM III: an updated pediatric risk of mortality score. Crit Care Med. 1996 May;24(5):743-52. [ Links ]
8 Pollack MM, Holubkov R, Funai T, Dean JM, Berger JT, Wessel DL, et al. The pediatric risk of mortality score: update 2015. Pediatr Crit Care Med. 2016 Jan;17(1):2-9. [ Links ]
9 Shann F, Pearson G, Slater A, Wilkinson K. Paediatric index of mortality (PIM): a mortality prediction model for children in intensive care. Intensive Care Med. 1997 Feb;23(2):201-7. [ Links ]
10 Slater A, Shann F, Pearson G, Paediatric Index of Mortality (PIM) Study Group. PIM2: a revised version of the Paediatric Index of Mortality. Intensive Care Med. 2003 Feb;29(2):278-85. [ Links ]
11 Straney L, Clements A, Parslow RC, PearsonG, Shann F , Alexander J, et al. Paediatric index of mortality 3: an updated model for predicting mortality in pediatric intensive care. Pediatr Crit Care Med. 2013 Sep;14(7):673-81. [ Links ]
12 Poses RM, Bekes C, Copare FJ, Scott WE. The answer to "what are my chances, doctor?" depends on whom is asked: prognostic disagreement and inaccuracy for critically ill patients. Crit Care Med. 1989 Aug;17(8):827-33. [ Links ]
13 Hosmer DW, Lemeshow S. Applied logistic regression. 3rd ed. New York: Wiley; 2013. [ Links ]
14 Hanley JA, McNeil BJ. A method of comparing the areas under receiver operating characteristic curves derived from the same cases. Radiology. 1983 Sep;148(3):839-43. [ Links ]
15 Vandenbroucke JP. A shortcut method for calculating the 95 per cent confidence interval of the standardized mortality ratio. Am J Epidemiol. 1982 Feb;115(2):303-4. [ Links ]
16 Slater A , Shann F , ANZICS Paediatric Study Group. The suitability of the pediatric index of mortality (PIM), PIM2, the pediatric risk of mortality (PRISM), and PRISM III for monitoring the quality of pediatric intensive care in Australia and New Zealand. Pediatr Crit Care Med. 2004 Sep;5(5):447-53. [ Links ]
17 Turner EL, Nielsen KR, Jamal SM, von Saint André-von Arnim A, Musa NL. A review of pediatric critical care in resource-limited settings: a look at past, present, and future directions. Front Pediatr. 2016 Feb;4:5. [ Links ]
18 Gómez-Hernández PE, Cruz-Lara I, Borbolla-Sala ME. Score PRISM y Anión gap sérico predictores de mortalidad en la UTIP de un hospital pediátrico. Salud Tabasco. 2013 ene-abr;19(1):3-9. [ Links ]
19 Nyirasafari R, Corden MH, Karambizi AC, Kabayiza JC, Makuza JD, Wong R, et al. Predictors of mortality in a paediatric intensive care unit in Kigali, Rwanda. Paediatr Int Child Health. 2016 Dec;37(2):109-15. [ Links ]
20 St-Louis E, Séguin J, Roizblatt D, Deckelbaum DL, Baird R, Razek T. Systematic review and need assessment of pediatric trauma outcome benchmarking tools for low-resource settings. Pediatr Surg Int. 2017 Mar;33(3):299-309. [ Links ]
21 Manotas H, Ibarra M, Arteaga Á, Romero A, Sanchez J. Lesión renal aguda en niños críticos. Acta Colomb Cuid Intensivo. 2018 oct-dic;18(4):207-11. [ Links ]
22 Qureshi AU, Ali AS, Ahmad TM. Comparison of three prognostic scores (PRISM, PELOD and PIM 2) at pediatric intensive care unit under Pakistani circumstances. J Ayub Med Coll Abbottabad. 2007 Apr-Jun;19(2):49-53. [ Links ]
23 Taori RN, Lahiri KR, Tullu MS. Performance of PRISM (Pediatric Risk of Mortality) score and PIM (Pediatric Index of Mortality) score in a tertiary care pediatric ICU. Indian J Pediatr. 2010 Mar;77(3):267-71. [ Links ]
24 Thukral A, Lodha R, Irshad M, Arora N. Performance of Pediatric Risk of Mortality (PRISM), Pediatric Index of Mortality (PIM), and PIM2 in a pediatric intensive care unit in a developing country. Pediatr Crit Care Med. 2006 Jul;7(4):356-61. [ Links ]
25 Martha VF, Garcia PCR, Piva JP, Einloft PR, Bruno F, Rampon V. Comparação entre dois escores de prognóstico (PRISM e PIM) em unidade de terapia intensiva pediátrica. J Pediatr (Rio J). 2005;81(3):259-64. [ Links ]
26 Leteurtre S, Leclerc F, Martinot A, Cremer R, Fourier C, Sadik A, et al. Can generic scores (Pediatric Risk of Mortality and Pediatric Index of Mortality) replace specific scores in predicting the outcome of presumed meningococcal septic shock in children? Crit Care Med. 2001 Jun;29(6):1239-46. [ Links ]
27 ElNawawy A. Evaluation of the outcome of patients admitted to the pediatric intensive care unit in Alexandria using the pediatric risk of mortality (PRISM) score. J Trop Pediatr. 2003 Apr;49(2):109-14. [ Links ]
28 Namachivayam P, Shann F , Shekerdemian L, Taylor A, van Sloten I, Delzoppo C, et al. Three decades of pediatric intensive care: who was admitted, what happened in intensive care, and what happened afterward. Pediatr Crit Care Med. 2010 Sep;11(5):549-55. [ Links ]
29 Sacco Casamassima MG, Salazar JH, Papandria D, Fackler J, Chrouser K, Boss EF, et al. Use of risk stratification indices to predict mortality in critically ill children. Eur J Pediatr. 2014 Jan;173(1): 1-13. [ Links ]
30 Cogo PE, Poole D, Codazzi D, Boniotti C, Capretta A, Langer M, et al. Outcome of children admitted to adult intensive care units in Italy between 2003 and 2007. Intensive Care Med. 2010 Aug;36(8):1403-9. [ Links ]
31 Ciofi degli Atti ML, Cuttini M, Ravà L, Rinaldi S, Brusco C, Cogo P, et al. Performance of the pediatric index of mortality 2 (PIM-2) in cardiac and mixed intensive care units in a tertiary children's referral hospital in Italy. BMC Pediatr. 2013 Jun;13:100. [ Links ]
32 Hendricks CL, McKerrow NH, Hendricks RJ. Factors present on admission associated with increased mortality in children admitted to a paediatric intensive care unit (PICU). SAJCH. 2016 Mar;10(1):57-62. [ Links ]
33 Abebe T, Girmay M, G/Michael G, Tesfaye M. The epidemiological profile of pediatric patients admitted to the general intensive care unit in an Ethiopian university hospital. Int J Gen Med. 2015 Jan;2015(8):63-7. [ Links ]
34 Hariharan S, Krishnamurthy K, Grannum D. Validation of Pediatric Index of Mortality-2 scoring system in a pediatric intensive care unit, Barbados. J Trop Pediatr. 2011 Feb;57(1):9-13. [ Links ]
35 Mestrovic J, Kardum G, Polic B, Omazic A, Stricevic L, Sustic A. Applicability of the Australian and New Zealand Paediatric Intensive Care Registry diagnostic codes and Paediatric Index of Mortality 2 scoring system in a Croatian paediatric intensive care unit. Eur J Pediatr. 2005 Dec;164(12):783-4. [ Links ]
36 Wolfler A, Silvani P, Musicco M, Salvo I, Italian Pediatric Sepsis Study (SISPe) Group. Pediatric Index of Mortality 2 score in Italy: a multicenter, prospective, observational study. Intensive Care Med. 2007 Aug;33(8):1407-13. [ Links ]
37 Fernández AL, Arias López MP, Ratto ME, Saligari L, Siaba Serrate A, Rosa M, et al. Validation of the Pediatric Index of Mortality 2 (PIM2) in Argentina: a prospective, multicenter, observational study. Arch Argent Pediatr. 2015 Jun;113(3):221-8. [ Links ]
38 Imamura T, Nakagawa S, Goldman RD, Fujiwara T. Validation of pediatric index of mortality 2 (PIM2) in a single pediatric intensive care unit in Japan. Intensive Care Med. 2012 Apr;38(4):649-54. [ Links ]
39 Salamati P, Talaee S, Eghbalkhah A, Chaman R, Mokhtari Z, Azarshahin M. Validation of pediatric index of mortality -2 scoring system in a single pediatric intensive care unit in Iran. Iran J Pediatr. 2012 Dec;22(4):481-6. [ Links ]
40 Canonero I, Figueroa A, Cacciamano A, Olivier E, Cuestas E. Validation of PRISM and PIM2 scores of mortality in a pediatric intensive care unit in Cordoba. Arch Argent Pediatr. 2010 Oct;108(5):427-33. [ Links ]
Cómo citar este artículo / How to cite this article: Farias ECF, Carvalho PB, Nascimento LMPP, Mello MLFMF, Santana AA, Diniz SS, et al. Desempeño del Pediatric Risk of Mortality (PRISM) y Pediatric Index of Mortality 2 (PIM2) en unidad de terapia intensiva pediátrica terciaria en la Amazonía brasileña. Rev Pan Amaz Saude. 2019;10:e201900080. Doi: http://dx.doi.org/10.5123/S2176-6223201900080.
Recibido: 10 de Agosto de 2018; Aprobado: 16 de Abril de 2019











 text in
text in 


