INTRODUÇÃO
A infecção pelo vírus da hepatite C (VHC) ainda constitui grave problema de saúde pública no Brasil e no mundo1. Segundo a European Association for the Study of the Liver (EASL), 71 milhões de pessoas estão infectadas cronicamente pelo VHC ao redor do mundo, e, nas Américas, estima-se que sejam 7 milhões2. Desse número, apenas 25% foram diagnosticadas2,3. No Brasil, entre 1,4 e 1,7 milhão de indivíduos podem estar infectados com o VHC4.
As hepatites virais afetam cronicamente cerca de 325 milhões de pessoas em todo o mundo, sendo que 95% dos infectados desconhecem sua doença e menos de 1% têm acesso ao tratamento3. A hepatite C é geralmente assintomática, com sinais e sintomas ocorrendo principalmente em estágios avançados da doença4. Milhões de pessoas podem progredir de forma lenta para cirrose, descompensação hepática e hepatocarcinoma, tornando essa infecção a causa mais frequente de transplante hepático no mundo1,2,4. Apenas 10% dos pacientes desenvolvem icterícia e menos de 20% possuem sintomas inespecíficos mais graves, como anorexia, náuseas, vômitos, diarreia, mal-estar, dor abdominal, entre outros5.
A transmissão ocorre por meio do compartilhamento de objetos pessoais; seringas e agulhas para uso de drogas injetáveis4. O diagnóstico tardio da hepatite C contribui para a transmissão da doença e sua alta mortalidade1,3.
A hepatite C foi primeiramente observada em doadores de sangue na década de 1980 e caracterizada como hepatite "não A e não B" (HNANB)6. Denominada inicialmente como "hepatite pós-transfusional não-A e não-B de transmissão parenteral", a etiologia da hepatite C foi elucidada em 19897. O agente da hepatite C foi classificado na família Flaviviridae, gênero Hepacivirus e espécie Hepacivirus C, depois do advento de técnicas moleculares8.
Dessa forma, estudos retrospectivos sobre frequência de infecção pelo VHC são importantes fontes de reconhecimento da história natural da doença9, mas são escassos na Região Amazônica brasileira. Esse paralelo temporal também permite a comparação do perfil epidemiológico dos doentes em dois cenários distintos, antes e após a aquisição dos testes de diagnóstico e do tratamento da doença. Este estudo objetiva descrever a prevalência da infecção pelo VHC em amostras de soro de pacientes diagnosticados como HNANB, entre 1982 e 1988, provenientes da Amazônia Legal.
MATERIAIS E MÉTODOS
Estudo descritivo, transversal, retrospectivo, que utilizou 396 amostras sorológicas provenientes do biobanco da Seção de Hepatologia (SAHEP) do Instituto Evandro Chagas (IEC), Secretaria de Vigilância em Saúde (SVS), Ministério da Saúde (MS), armazenadas a -20 ºC por mais de 30 anos. Essas amostras foram coletadas, no período de 1982 a 1988, de pacientes atendidos com quadro clínico compatível com HNANB aguda e, com marcadores sorológicos negativos para hepatites A e B, de um total de 2.223 casos consecutivos atendidos na Região Amazônica. Para a coleta dos dados clínicos, demográficos e laboratoriais, foram realizadas pesquisas em livros de registro e fichas epidemiológicas dos casos triados.
As 396 amostras de soro foram testadas para pesquisa de anticorpos anti-VHC IgG, pelo método ELISA, com kits comerciais de quarta geração (DIA.PRO Diagnostic Bioprobes®, San Giovanni, Itália), obedecendo os procedimentos e interpretação indicados pelos fabricantes. O volume reduzido das amostras impossibilitou o uso de aparelho automatizado no diagnóstico sorológico.
O resultado final das amostras foi dado em densidade óptica, obtida pela leitura em espectrofotômetro (Leitora de Microplaca BIOTEK EL800). O valor de cut-off desse teste foi calculado adicionando-se o valor 0.350 à média da absorbância dos controles negativos. Os resultados que excederam o valor de cut-off acrescido de 20% foram considerados reagentes. Os valores de densidade óptica abaixo do valor de cut-off menos 20% foram considerados não reagentes. Os resultados com densidade óptica até 20% acima ou abaixo do valor de cut-off foram caracterizados como inconclusivos.
As amostras que apresentaram resultados inconclusivos foram submetidas ao teste sorológico para detecção do anti-VHC, pelo método ELISA, com kits comerciais de terceira geração (ORTHO VHC Version 3.0® ELISA Test System, New Jersey, EUA). As interpretações dos resultados se deram pelo espectrofotômetro (Leitora de Microplaca BIOTEK EL800); para a determinação de cut-off, acrescentou-se a constante 0,600 ao valor da média de absorbância dos controles negativos.
Amostras reagentes para anti-VHC foram selecionadas para detecção e caracterização molecular do VHC. O VHC-RNA foi pesquisado por técnica de RT-qPCR e RT-PCR. A extração do RNA foi processada de forma automatizada (equipamento m24sp/m2000rt - Abbott®), com volume final de 60 µL. Após a extração, foram realizadas a amplificação e a detecção do VHC-RNA, com o uso do kit comercial Abbott RealTime VHC (Abbott®, EUA), segundo as instruções do fabricante. A detecção do VHC-RNA foi realizada com o sistema TaqMan® utilizando primers e sondas TaqMan® específicos. O ensaio Abbott RealTime VHC apresenta uma linearidade de 12 a 100.000.000 UI/mL. O RNA das amostras, extraído por método automatizado (equipamento m24sp/m2000rt - Abbott®), foi utilizado para a síntese de cDNA, feita com primers randômicos (IDT) sob as seguintes condições de termociclagem: 15 min a 25 °C, seguido de 1 h a 37 °C e incubação final de 95 °C por 15 min.
O cDNA das amostras foi utilizado em ensaios de RT-PCR para amplificação parcial das regiões NS5B e 5'UTR do VHC, subsequente sequenciamento nucleotídico e análise filogenética para genotipagem do vírus. A amplificação da região NS5B foi desenvolvida por ensaios de hemi-nested RT-PCR para produção de um fragmento de 382 pares de base. Durante as etapas de 1º round de PCR, 5 µL de cDNA de
cada amostra foram acrescidos aos iniciadores Pr3 (5'TATGAYACCCGCTGYTTTGACTC3') e Pr4 (5' GCNGARTAYCTVGTCATAGCCTC3') e submetidos à condição de termociclagem, conforme descrito por Morice et al.10 e Sandres-Sauné et al.11. As reações de 2º round de PCR foram realizadas com os iniciadores Pr3 e Pr5 (5' GCTAGTCATAGCCTCCGT 3') nas condições de ciclagem10,11. Para a região 5'UTR, foi realizado nested RT-PCR, visando a amplificação de um fragmento de 230 pares de base (pb) do gene que codifica a região 5'UTR. Foram utilizados 5 µL de cDNA, na reação de PCR, usando os iniciadores PTC1 (5'CGTTAGTATGAGTGTCGTGC3') e NCR2 (5'ATACTCGAGGTGCACGGTCTACGAGACCT3') nas condições de ciclagem12. A segunda PCR foi realizada com os iniciadores PTC3 (5'AGTGTCGTGCAGCCTCCAGG 3') e NCR4 (5'CACTCTCGAGCACCCTATCAGGCAGT 3') nas mesmas condições de ciclagem da primeira PCR.
A detecção dos amplicons foi realizada em gel de agarose a 1% (Ultra Pure Agarose-Invitrogen, Espanha), SYBR® Safe DNA Gel Stain (Invitrogen, EUA) e marcador de peso molecular (50 pb DNA Ladder, Invitrogen, USA). A visualização e a captura das imagens foram feitas com equipamento de fotodetecção (TFX-35M GIBCO BRL W Transluminador). Foram consideradas positivas as amostras que apresentaram produtos de amplificação com tamanho próximo ao esperado, 230 pb para a região 5'UTR e 382 pb para a região NS5B.
Os produtos amplificados foram purificados com o kit EXO/SAP-IT (GE Healthcare Bio-Sciences, Buckinghamshire, Reino Unido) e, posteriormente, sequenciados, nos sentidos senso e antissenso, com os primers Pr3 e Pr5 para a região NS5B e PTC3 e NCR4 para a região 5'UTR, respectivamente, utilizados junto com o kit BigDye® Terminator v3.1 Cycle Sequencing (Applied Biosystems, Vilnius, Lituânia) no sequenciador automático ABI 3500 (Applied Biosystems). Todas as reações foram desenvolvidas de acordo com as orientações dos fabricantes. As sequências obtidas foram editadas e alinhadas no programa Geneious v8.1.3 e, juntamente com as sequências dos diferentes genótipos e subgenótipos do VHC, disponibilizadas no GenBank. As árvores filogenéticas foram construídas usando o método Neighbor-Joining e modelo Kimura 2-parâmetros no programa MEGA v7.
O teste do qui-quadrado (χ2) da homogeneidade serviu para comparar as proporções das variáveis de interesse (manifestações clínicas, sexo, idade, procedência) em duas ou mais populações (infectados pelo VHC ou não infectados pelo VHC). A análise de resíduos mostrou como as diversas proporções da tabela de contingência contribuem para o valor final do χ2 calculado (p = 0,05). Foi utilizado o programa BioEstat v5.013.
Obedecendo à Resolução Nº 466, de 12 de dezembro de 2012, do Conselho Nacional de Saúde/MS14, o presente projeto foi aprovado pelo Comitê de Ética em Pesquisa em Seres Humanos do IEC/SVS/MS, sob Parecer de Aprovação nº 1.947.422, em 3 de março de 2017.
RESULTADOS
Os pacientes tinham idades variando de 1 mês a 85 anos, com média de 29,9 (± 17,9) e mediana de 26 anos, encontrando-se, a maioria, entre 21 e 30 anos de idade (28,0%). A proporção de homens e mulheres foi semelhante, embora ligeiramente maior a frequência para o sexo masculino (55,3%). Todas as amostras eram de pacientes da zona urbana, dos municípios de Belém e Ananindeua, Região Metropolitana do estado do Pará. O maior número de portadores de HNANB era residente do bairro do Marco (11,1%). Dentre os registros dos pacientes que continham informações sobre ocupação, a maior frequência era de estudantes (22,2%). Contudo, houve prejuízos na interpretação dos resultados pela alta frequência de campos vazios, p. ex. "não informado". Os principais destaques sobre o perfil demográfico dos doentes constam na tabela 1.
As manifestações clínicas relatadas pelos pacientes, que buscaram a SAHEP/IEC na década de 1980 e que receberam o diagnóstico de HNANB, foram coletadas de 322 das 396 fichas preenchidas e disponíveis, destacando-se: colúria (180/322; 55,9%), icterícia (161/322; 50,0%), febre (148/322; 46,0%), vômito (106/322; 32,9%), mialgia (93/322; 28,9%), mal-estar (90/322; 27,9%), anorexia (76/322; 23,6%), náuseas (76/322; 23,6%) e diarreia (41/322; 12,7%).
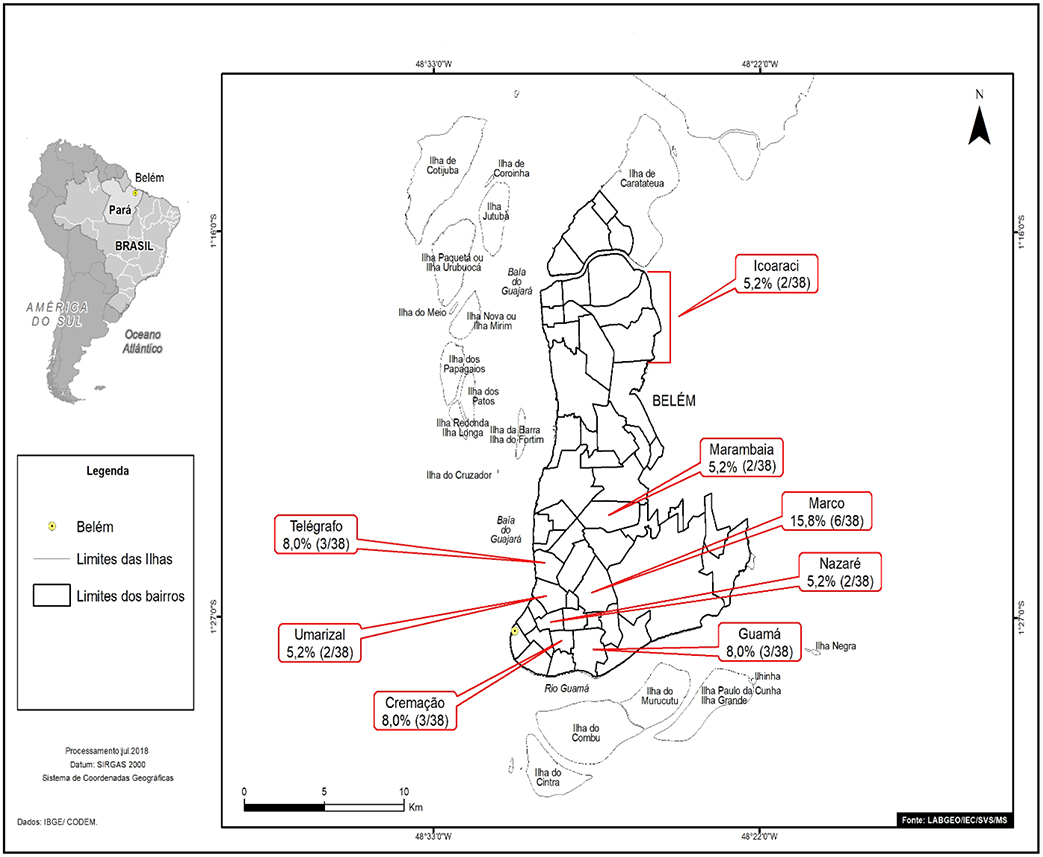
Os indivíduos positivos para anti-VHC residentes em Belém eram oriundos, em sua maioria, do bairro do Marco (6/38; 15,8%). A figura 1 destaca os bairros com dois ou mais casos de anti-VHC reagentes (23/38; 60,5%).
No município de Ananindeua, a maioria das amostras positivas (3/5; 60,0%) era de pacientes que residiam no bairro da Cidade Nova (Figura 2).
Anticorpos anti-VHC foram detectados em 10,9% (43/396) das amostras, com prevalência semelhante entre sexos. As frequências mais elevadas de anti-VHC foram observadas em adultos com mais de 20 e menos de 60 anos de idade, destacando-se a faixa etária de 51 a 60 anos. Não houve significância estatística entre sexo e faixa etária quando correlacionados com a presença de anticorpo do VHC. Foi possível detectar a presença do RNA viral em 55,8% (24/43) das amostras sororreagentes ao VHC. Para os resultados positivos, segundo sexo e faixa etária, não houve significância estatística quando correlacionados à infecção pelo VHC (Tabela 2).
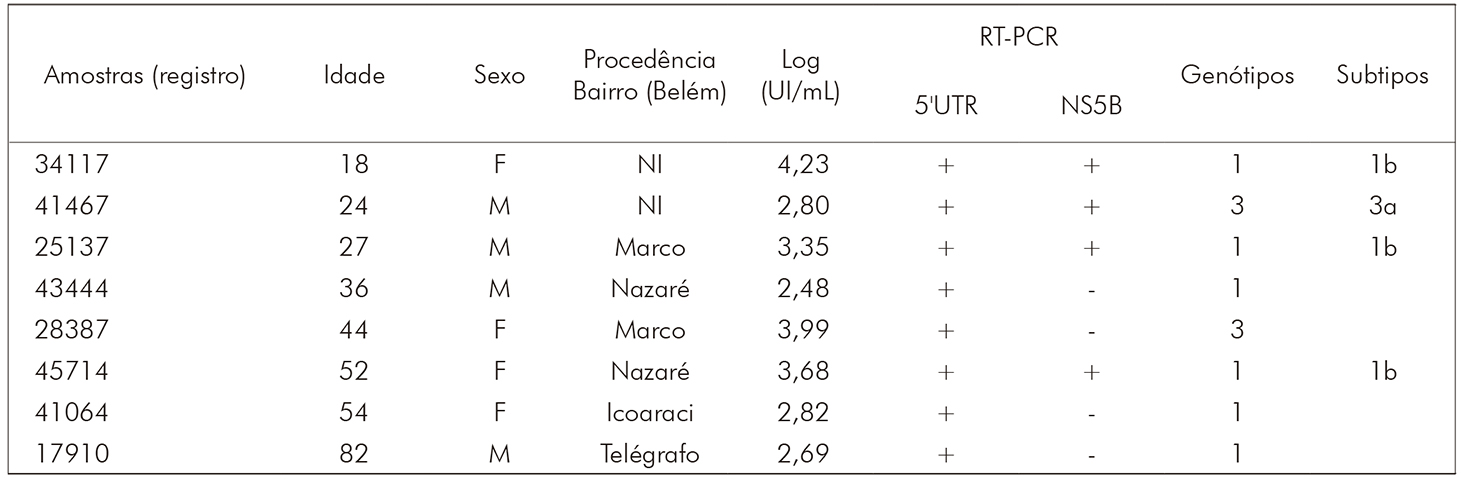
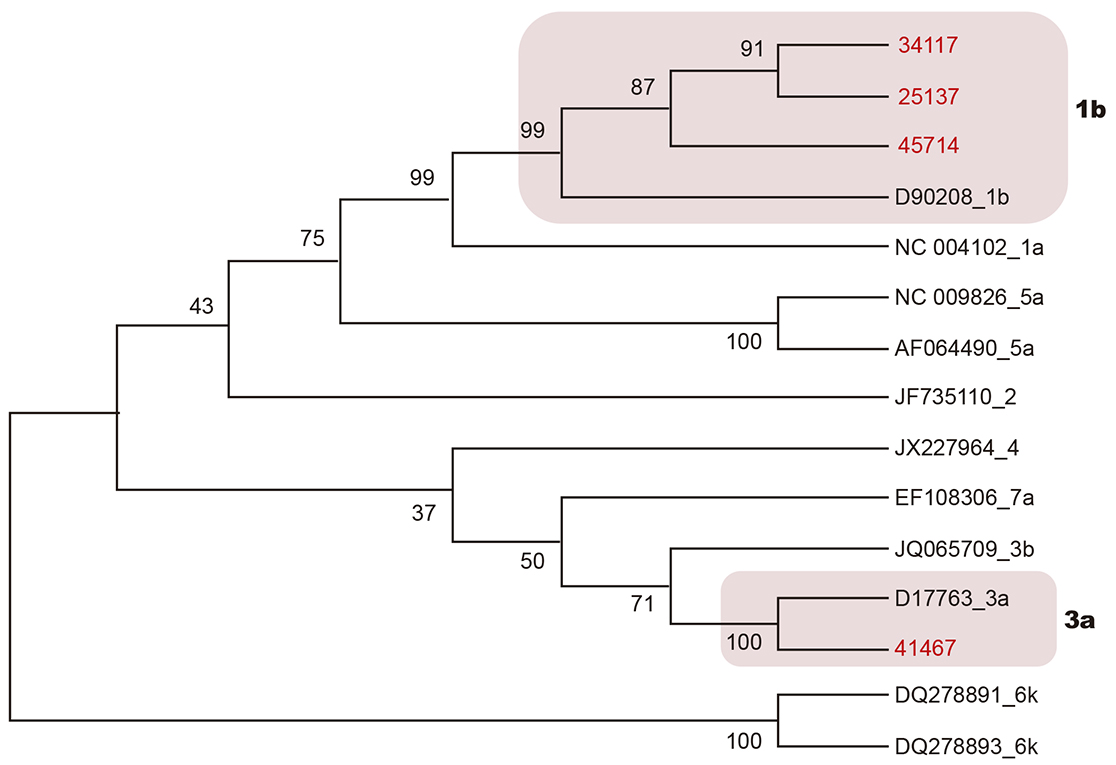
Por meio da genotipagem, foram encontrados dois genótipos (1 e 3), subtipos 1b e 3a, respectivamente, em oito (33,3%) dos 24 RNA detectados (Quadro 1). O cladograma desenvolvido para as amostras de VHC teve por base o alinhamento de sequências da região NS5B (382 pb). Três amostras agruparam com sequências do genótipo 1, subtipo 1b, e uma agrupou com o genótipo 3, subtipo 3a (Figura 3).
A análise filogenética da região 5'UTR não permitiu a determinação dos subtipos do VHC, pois os amplicons dessa região apresentaram sequências com um número limitado de bases nucleotídicas (< 230 pb), o que impossibilitou a inferência das relações filogenéticas.
Tabela 1 − Distribuição dos pacientes diagnosticados com HNANB, segundo sexo, faixa etária, procedência e ocupação, de 1982 a 1988, em Belém e Ananindeua, estado do Pará, Brasil
| Variáveis | N = 396 | % |
|---|---|---|
| Sexo | ||
| Masculino | 219 | 55,3 |
| Feminino | 177 | 44,7 |
| Faixa etária (anos) | ||
| ≤ 10 | 63 | 15,9 |
| 11-20 | 75 | 19,0 |
| 21-30 | 111 | 28,0 |
| 31-40 | 57 | 14,4 |
| 41-50 | 40 | 10,1 |
| 51-60 | 23 | 5,8 |
| ≥ 61 | 27 | 6,8 |
| Procedência | ||
| Belém | 349 | 88,1 |
| Ananindeua | 47 | 11,9 |
| Bairros | ||
| Belém | ||
| Marco | 44 | 11,1 |
| Marambaia | 23 | 5,8 |
| Nazaré | 21 | 5,3 |
| Umarizal | 20 | 5,0 |
| Pedreira | 19 | 4,8 |
| Telégrafo | 18 | 4,5 |
| Jurunas | 16 | 4,0 |
| Canudos | 14 | 3,6 |
| Guamá | 14 | 3,6 |
| Sacramenta | 14 | 3,6 |
| São Brás | 14 | 3,6 |
| Icoaraci | 12 | 3,0 |
| Terra Firme | 12 | 3,0 |
| Batista Campos | 11 | 2,7 |
| Coqueiro | 5 | 1,3 |
| Cremação | 9 | 2,3 |
| Val-de-Cans | 5 | 1,3 |
| Campina | 4 | 1,0 |
| Souza | 4 | 1,0 |
| Outros bairros | 19 | 4,8 |
| Não informado | 51 | 12,8 |
| Ananindeua | ||
| Cidade Nova | 16 | 4,0 |
| Coqueiro | 6 | 1,5 |
| Guanabara | 5 | 1,3 |
| Outros bairros | 14 | 3,6 |
| Não informado | 6 | 1,5 |
| Ocupação | ||
| Estudante | 88 | 22,2 |
| Doméstica | 38 | 9,6 |
| Menor sem ocupação | 33 | 8,3 |
| Do lar | 24 | 6,1 |
| Comerciante | 14 | 3,5 |
| Professor | 9 | 2,3 |
| Servidor público | 7 | 1,8 |
| Motorista | 7 | 1,8 |
| Pedreiro | 7 | 1,8 |
| Aposentado | 6 | 1,5 |
| Auxiliar de escritório | 4 | 1,0 |
| Outras ocupações | 82 | 20,7 |
| Não informado | 77 | 19,4 |
N: Número amostral; %: Frequência.
Fonte: Laboratório de Geoprocessamento (LabGeo/IEC/SVS/MS).
Figura 1 - Distribuição, por bairros de Belém, das amostras positivas para anticorpos anti-VHC de pacientes diagnosticados com HNANB atendidos na SAHEP/IEC, de 1982 a 1988, em Belém, estado do Pará, Brasil
Tabela 2 - Prevalência de anti-VHC+ e de VHC-RNA+, segundo sexo e faixa etária, em pacientes diagnosticados com HNANB atendidos na SAHEP/IEC, de 1982 a 1988, em Belém e Ananindeua, estado do Pará, Brasil
| Variáveis | Examinados N = 396 | Anti-VHC+ N = 43 | % | p valor α = 0,05 | VHC-RNA+ N = 24 | % | p valor α = 0,05 |
|---|---|---|---|---|---|---|---|
| Sexo | |||||||
| Masculino | 219 | 22 | 10,0 | 0.6775* | 14 | 58,3 | 0,7574† |
| Feminino | 177 | 21 | 11,9 | 10 | 41,7 | ||
| Faixa etária (anos) | |||||||
| ≤ 10 | 63 | 3 | 4,8 | 0,2694‡ | - | - | |
| 11-20 | 75 | 6 | 8,0 | 1 | 4,2 | ||
| 21-30 | 111 | 15 | 13,5 | 9 | 37,5 | ||
| 31-40 | 57 | 8 | 14,0 | 5 | 20,8 | 0,5719‡ | |
| 41-50 | 40 | 3 | 7,5 | 3 | 12,5 | ||
| 51-60 | 23 | 6 | 26,1 | 5 | 20,8 | ||
| ≥ 61 | 27 | 2 | 7,4 | 1 | 4,2 |
N: Número amostral; %: Prevalência; Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento; * χ2 (Yates) =0,173; † χ2 (Yates) = 0,095; ‡ Teste G para amostras independentes.

Figura 2 - Distribuição, por bairros de Ananindeua, das amostras positivas para anticorpos anti-VHC de pacientes diagnosticados com HNANB atendidos na SAHEP/IEC, de 1982 a 1988, em Ananindeua, estado do Pará, Brasil
Sequências obtidas do GenBank estão identificadas com o número de acesso.
Figura 3 - Cladograma da região NS5B do VHC, inferida com método Neighbor-Joining (Kimura 2-parâmetros) no programa MEGA v7
DISCUSSÃO
Estudos retrospectivos sobre a prevalência e a caracterização do VHC são importantes para a compreensão do seu comportamento na população e da sua dispersão à época em que o diagnóstico específico não estava disponível9. A despeito dos sensíveis e avançados métodos moleculares, disponíveis atualmente para o diagnóstico das hepatites virais, o longo período de armazenamento das amostras, ainda que criopreservadas (-20 ºC), certamente induziu alterações em nível molecular capazes de prejudicar as análises laboratoriais, por se tratar de um vírus RNA extremamente suscetível à degradação, elevando esses circunstanciais prejuízos15. Não obstante, este estudo revelou resultados inéditos sobre a ocorrência de hepatite C na Amazônia brasileira no período analisado (1982 a 1988).
Antes da descoberta da hepatite C e de seu agente etiológico, a incidência da HNANB nos Estados Unidos da América, na década de 1980, era considerada estável, apresentando uma média de 7,1 casos por 100.000 habitantes, segundo o Centers for Disease Control and Prevention que, por um período de sete anos (1982-1988), desenvolveu um estudo em quatro municípios-sentinela, utilizando amostras de pacientes com HNANB, coletadas entre 1985 e 1988, as quais foram testadas para anti-VHC, demonstrando 45% de positividade16.
Um estudo prospectivo, realizado na Espanha, entre 1978 e 1984, com 54 pacientes diagnosticados com HNANB pós-transfusional, detectou 85% de anticorpos para o VHC17. Em Paris, no período entre 1980 e 1989, 39,6% dos pacientes submetidos à hemodialise estavam infectados pelo VHC e esse hepatovírus foi responsável por 91% dos casos de HNANB18.
No Brasil, Focaccia et al.19 relataram prevalência de infecção pelo VHC de 1,4% na população do município de São Paulo. Um estudo retrospectivo de reavaliação laboratorial da infecção pelo VHC, em amostras de 1990 a 1993, em Belém, descreveu prevalência de 62,6% para o anticorpo do VHC20. Valois et al.21 observaram 1,1% de prevalência para o anti-VHC entre candidatos à doação de sangue na capital paraense.
A soroprevalência para o anti-VHC, na casuística estudada, foi de 10,9%, superior ao observado por Fonseca et al.22, que encontraram positividade de 0,2% de anti-VHC, em estudo retrospectivo realizado no município de Manaus, estado do Amazonas, no período de 1989 a 1998, em pacientes com diagnóstico de hepatite aguda. Porém, similar ao relatado por Teixeira23, que observou positividade de 14,3% de anti-VHC em uma pesquisa de reavaliação clínico-laboratorial de casos notificados como HNANB, no período de 1994 a 1996, também em Belém e Ananindeua.
No presente estudo, a positividade para o anti-VHC foi semelhante entre os sexos, sendo mais elevada em adultos com idade entre 51 e 60 anos. Martins et al.24 sugeriram que a maior prevalência de hepatite C, observada após os 50 anos de idade, pode ser explicada pelo diagnóstico tardio de uma exposição ao VHC.
Em relação ao sexo e à faixa etária, um estudo de Santos et al.25, com pacientes que tiveram diagnóstico de HNANB, mostrou que todos os indivíduos reagentes para o anti-VHC eram do sexo masculino, com idade variando entre 27 e 36 anos. Simon et al.26, em estudo realizado na cidade de Paris, França, entre hemodialisados com HNANB, observaram que a idade média dos portadores de anti-VHC reagente era de 50 anos, sendo a maioria do sexo masculino. Valois et al.21, ao analisarem uma população de candidatos à doação de sangue, em Belém, encontraram o sexo masculino como predominante entre os casos de anti-VHC reagente, com maior prevalência na faixa etária entre 30 e 39 anos.
A abordagem da ocupação profissional é uma variável relevante em estudos epidemiológicos. Neste estudo, a ocupação profissional mostrou-se heterogênea, sobressaindo-se o grupo de estudantes. Morais e Oliveira27, em um estudo realizado no sudoeste baiano, entre 2003 e 2014, relataram prevalência de 0,96% de anti-VHC entre estudantes.
Na presente pesquisa, todas as amostras eram de pacientes da zona urbana, dos municípios de Belém (a maioria) e Ananindeua. O bairro do Marco apresentou a maior prevalência de anti-VHC reagente entre os bairros de Belém; e a Cidade Nova, entre os bairros de Ananindeua, o que poderia ser explicado por se tratarem de bairros bastante populosos.
Apesar das limitações relacionadas ao tempo de armazenamento e acondicionamento das amostras de soro, foi possível detectar, no presente estudo, o RNA viral em 55,8% dos 43 pacientes sororeagentes. Resultados inferiores foram relatados por Fonseca et al.28, que observaram uma prevalência de 5% de RNA viral detectado no estado do Amazonas, com amostras criopreservadas coletadas durante os anos de 1981 a 1986, de pacientes com HNANB aguda.
No estudo de Simon et al.26, com hemodialisados portadores de HNANB, realizado em Paris, 82,6% (19/23) foram positivos para o RNA do VHC.
No Brasil, um estudo retrospectivo de reavaliação laboratorial da infecção pelo VHC, em amostras de dialisados, do período de 1990 a 1993, no município de Belém, descreveu 4,3% de RNA viral detectado20.
Oliveira et al.29 demonstraram 62,5% de RNA viral em um estudo entre ribeirinhos do município de Cametá, no Pará. Freitas et al.30 relataram 5,3% de detecção para o VHC-RNA em pacientes com anti-VHC reagente, em Belém. No estudo sobre os "Aspectos epidemiológicos da infecção pelo VHC em usuários de drogas não injetáveis no estado do Pará, leste da Amazônia", houve prevalência do RNA viral de 28%31.
Os dados de detecção do VHC-RNA, do presente estudo, assemelham-se ao encontrado por Oliveira et al.29, com importante destaque para o fato de que as amostras de soro testadas na pesquisa citada, ao contrário das testadas na presente casuística, eram recém-coletadas. As variações encontradas, em diferentes estudos, podem ser explicadas pelas diferenças entre os grupos estudados e/ou amostras criopreservadas, e pelo tempo decorrido entre a coleta e a realização dos testes.
Além da importância para a filogenia, a genotipagem do VHC é um fator importante para o manejo de indivíduos infectados e para fins epidemiológicos, indica a via de aquisição e afeta o resultado clínico e a resposta ao tratamento32,33. O genótipo 1, subtipo 1b, é mais resistente a determinadas terapias, e o genótipo 3, subtipo 3a, está expressivamente associado às formas mais agressivas da doença32.
A genotipagem do VHC deste estudo foi realizada por sequenciamento das regiões 5'UTR e NS5B. Foi possível a genotipagem em oito dos 24 RNAs detectados, sendo a maioria genotipada na região 5'UTR. Dois genótipos (1 e 3) foram identificados nas duas regiões, nas mesmas amostras de soro, e dois subtipos (1b e 3a) foram caracterizados na região NS5B.
A 5'UTR é altamente conservada; consequentemente, a região de anelamento do primer, nessa região, é bem mais conservada em relação à NS5B34. Devido ao alto nível de conservação e sensibilidade da 5'UTR, essa região tem sido mais utilizada por laboratórios clínicos para genotipagem do VHC35. Assim, tais características podem explicar a detecção de mais genótipos na região 5'UTR do que na NS5B pesquisadas.
Não foi possível a discriminação de subtipos dentro dos genótipos detectados na região 5'UTR. A região 5'UTR, ao contrário da NS5B, devido seu alto nível de conservação, não possui variação suficiente para discriminar as classificações do VHC em nível de subtipo viral34,35,36. Assim, as árvores filogenéticas da 5'UTR são menos capazes de agrupar subtipos do mesmo genótipo em clados do que árvores de sequências da NS5B, independentemente do método utilizado para inferência filogenética34.
Os genótipos 1 e 3 do VHC são a causa mais comum de infecções ao redor do mundo1,37. No Brasil, o genótipo 1 é considerado o mais prevalente, seguido do genótipo 3 e do genótipo 21,12,37. Dentre as regiões do Brasil, a Região Norte apresenta a maior frequência de genótipo 1 (51,7% a 74,1%); a Região Centro-Oeste, de genótipo 2 (11,4%); a Região Sul, de genótipo 3 (43,2%); e na Região Sudeste, no estado de São Paulo, foram descritos os genótipos 4 e 5, raramente encontrados12.
Perone et al.38 realizaram um estudo com pacientes portadores de hepatite C crônica, atendidos nos Centros de Referência em Hepatites Virais de Belo Horizonte, estado de Minas Gerais, entre 2002 e 2006, e observaram alta prevalência do genótipo 1 (78,4%) e do genótipo 3 (17,9%). Oliveira et al.39 relataram detecção de 77,1% para o genótipo 1 e 19,82% para o genótipo 3 em estudo realizado em um hospital de referência em doenças infectocontagiosas no estado do Goiás.
Nesta casuística, foi possível a genotipagem de um terço das amostras positivas para VHC-RNA, com predominância do genótipo 1, assemelhando-se ao estudo de Sawada et al.36, que concluiu que, na distribuição do VHC em diferentes categorias de exposição no Pará, há predominância do genótipo 1.
A distribuição de genótipos identificados na presente pesquisa foi semelhante ao encontrado por Baia20, que descreveu detecção de 73% para o genótipo 1 e 24,3% para o genótipo 3 em estudo retrospectivo entre dialisados, no período de 1990 a 1993, em Belém.
Os dados do estudo atual também foram semelhantes a achados de outros autores na Região Norte, demonstrando a importância dos genótipos 1 e 3 na epidemiologia dessa virose: Campiotto et al.12 descreveram detecção de 74,1% para o genótipo 1 e 24,7% para o genótipo 3 na Região Norte; Araújo et al.40 encontraram prevalência de 76,1% para o genótipo 1 e 19,6% para o genótipo 3 em pacientes com hepatite crônica no estado do Amazonas; Oliveira et al.39 observaram 76,9% de genótipo 1 e 23,1% de genótipo 3 em usuários de drogas não injetáveis no Pará; Guimarães et al.41 detectaram 72,4% de genótipo 1 e 23,3% de genótipo 3 na população em geral, no estado do Pará, e descreveram prevalência de 76,7% para o genótipo 1 e 20,7% para o genótipo 3 na Região
Metropolitana de Belém.
Um estudo de caráter retrospectivo, realizado no Amazonas, também analisou amostras de soro criopreservadas a -70 ºC, coletadas no período de 1981 a 1986, para posterior análise do VHC28. Outro estudo, também de caráter retrospectivo, foi realizado por Baia20 em amostras acondicionadas em biobanco (-20 ºC) por mais de 20 anos. Esses estudos corroboram com a presente pesquisa, destacando a importância do uso de biobancos institucionais na pesquisa em saúde.
CONCLUSÃO
Apesar das limitações do estudo, pelo longo tempo de armazenamento das amostras (três décadas), foi possível detectar 10,9% de anticorpos anti-VHC e caracterizar o VHC em soros oriundos de biobanco, revelando a circulação à época de pelo menos dois genótipos e dois subtipos do vírus: a) o genótipo 1, detectado na maioria das amostras genotipadas e, na atualidade, exibindo maior resistência a fármacos que os demais genótipos conhecidos; e b) o genótipo 3, menos frequente na amostra do estudo, mas, na atualidade, associado a maior virulência.
Concluiu-se que a análise de amostras do biobanco permitiu a identificação de linhagens do VHC, podendo favorecer estudos futuros com o objetivo de elucidar aspectos evolutivos associados à resistência e virulência desse patógeno.
Sugere-se que as instituições avaliem qual seria a melhor forma de acondicionamento de amostras de soro, a exemplo de congelamento a temperaturas mais baixas, alíquotas, liofilização, etc.; bem como, o custo-benefício da modernização desses procedimentos nos biobancos institucionais visando à pesquisa em saúde, pela extrema relevância para estudos presentes e futuros.











 text in
text in