Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude vol.10 Ananindeua 2019 Epub 09-Dez-2019
http://dx.doi.org/10.5123/s2176-6223201900096
ARTÍCULO ORIGINAL
Hepatitis C en la década de 1980: rescate de casos de las antiguas hepatitis "no A y no B" de un servicio de hepatología en la Amazonía, Brasil
1 Instituto Evandro Chagas/SVS/MS, Belém, Pará, Brasil
2 Universidade do Estado do Pará, Belém, Pará, Brasil
OBJETIVO:
La infección frecuente por el virus de la hepatitis C (VHC) en muestras séricas de pacientes diagnosticados como hepatitis "no A y no B", observada en un instituto de investigación amazónico entre 1982 y 1988.
MATERIALES Y MÉTODOS:
Investigación descriptiva, transversal y retrospectiva, incluyendo 396 muestras séricas, conservadas a -20 °C y probadas para anticuerpos Anti-VHC IgG por ELISA. Las muestras procedían de pacientes de ambos sexos, que oscilaban entre los 1 mes y los 85 años de edad, procedentes de los municipios de Belém y Ananindeua, Pará, Brasil. En el caso de las muestras reactivas contra el VHC, se investigó la presencia de ARN viral y, en la detección, se llevaron a cabo secuenciaciones y genotipado.
RESULTADOS:
Se detectaron anticuerpos anti-VHC en el 10,9% (43/396) del suero examinado. El ARN del VHC se detectó en el 55,8% (24/43) de los sueros reactivos. Para el 33,3% (8/24) de estas muestras, fue posible distinguir los genotipos 1 (75,0%; 6/8) y 3 (25,0%; 2/8), con la confirmación de dos subtipos (1b y 3a).
CONCLUSIÓN:
A pesar de las limitaciones, debido al largo tiempo de almacenamiento de las muestras (tres décadas), fue posible detectar y caracterizar el VHC en el suero del biobanco, revelando la circulación de dos genotipos y dos subtipos virales en ese momento: genotipo 1, detectado en la mayoría de las muestras genotipos y, hoy en día, exhibiendo una mayor resistencia a los fármacos que otros genotipos conocidos; y genotipo 3, menos frecuente en la muestra de estudio, asociado con una mayor virulencia. El análisis permitió la identificación de cepas de VHC, favoreciendo futuros estudios para dilucidar aspectos evolutivos asociados con la resistencia y virulencia de este patógeno.
Palabras clave: Virus de la Hepatitis C; Diagnóstico Molecular; Perfil genotípico; Epidemiología
INTRODUCCIÓN
La infección por el virus de la hepatitis C (VHC) sigue siendo un grave problema de salud pública en Brasil y en todo el mundo1. Según la Asociación Europea para el Estudio del Hígado (EASL), 71 millones de personas están infectadas crónicamente con el VHC en todo el mundo, y en las Américas se estima en 7 millones2. De esta cifra, sólo el 25% fue diagnosticado2,3. En Brasil, entre 1,4 y 1,7 millones de individuos pueden estar infectados con VHC4.
La hepatitis viral afecta crónicamente a unos 325 millones de personas en todo el mundo, con un 95% de los infectados que desconoce su enfermedad y menos del 1% tienen acceso al tratamiento3. La hepatitis C suele ser asintomática, y los signos y síntomas se producen principalmente en estadios avanzados de la misma4. Millones de personas pueden progresar lentamente a cirrosis, descompensación hepática y hepatocarcinoma, haciendo de esta infección la causa más frecuente de trasplante hepático en el mundo1,2,4. Sólo un 10% de los pacientes desarrollan ictericia y menos del 20% tiene síntomas inespecíficos más graves, como anorexia, náuseas, vómitos, diarrea, malestar abdominal, entre otros5.
La transmisión se produce a través del intercambio de objetos personales; jeringas y agujas para el uso de drogas inyectables4. El diagnóstico tardío de hepatitis C contribuye a la transmisión de la enfermedad y a su alta mortalidad1,3.
La hepatitis C se observó por primera vez en donantes de sangre en la década de 1980 y se caracterizó como hepatitis "no A y no B" (HNANB)6. Inicialmente conocida como "hepatitis post-transfusión no A y no B de transmisión parenteral", la etiología de la hepatitis C fue aclarada en 19897. El agente de la hepatitis C fue clasificado en la familia Flaviviridae, género Hepacivirus y especie Hepacivirus C, después de la llegada de las técnicas moleculares8.
Por lo tanto, los estudios retrospectivos sobre la frecuencia de la infección por VHC son importantes fuentes de reconocimiento de la historia natural de la enfermedad9, pero son escasos en la Región Amazónica brasileña. Este paralelismo temporal también permite la comparación del perfil epidemiológico de los pacientes en dos escenarios diferentes, antes y después de la adquisición de pruebas diagnósticas y tratamiento de la enfermedad. Este estudio tiene como objetivo describir la prevalencia de la infección por VHC en muestras séricas de pacientes diagnosticados como HNANB, entre 1982 y 1988, de la Amazonía Legal.
MATERIALES Y MÉTODOS
Este estudio descriptivo, transversal y retrospectivo utilizó 396 muestras serológicas del biobanco de la Sección de Hepatología (SAHEP) del Instituto Evandro Chagas (IEC), la Secretaría de Vigilancia de la Salud (SVS), el Ministerio de Salud (MS), almacenadas en -20 ºC durante más de 30 años. Estas muestras se recogieron de 1982 a 1988 de pacientes tratados con afecciones clínicas compatibles con HNANB aguda y, con marcadores serológicos negativos para la hepatitis A y B, de un total de 2.223 casos consecutivos tratados en la Región Amazónica. Para la recopilación de datos clínicos, demográficos y de laboratorio, la investigación se llevó a cabo en libros de registros y registros epidemiológicos de los casos examinados.
Las 396 muestras séricas fueron analizadas en busca de anticuerpos anti-VHC IgG, por el método Elisa, con kits comerciales de cuarta generación (DIA.PRO Diagnostic Bioprobes®, San Giovanni, Italia), obedeciendo los procedimientos e interpretación indicados por los fabricantes. El reducido volumen de las muestras hizo imposible el uso de un dispositivo automatizado en el diagnóstico serológico.
El resultado final de las muestras se dio en densidad óptica, obtenida mediante la lectura en espectrofotómetro (BIOTEK EL800 Microplate Reader). El valor de cut-off de esta prueba se calculó agregando el valor 0,350 a la absorbancia media de los controles negativos. Los resultados que superaron el cut-off más el 20% se consideraron reactivos. Los valores de densidad óptica por debajo del valor de cut-off menos 20% se consideraron no reactivos. Los resultados con una densidad óptica de hasta un 20% por encima o por debajo del valor de cut-off se caracterizaron por ser no concluyentes.
Las muestras que presentaron resultados no concluyentes fueron sometidas a pruebas serológicas para la detección anti-VHC, utilizando el método Elisa, con kits comerciales de tercera generación (ORTHO VHC Versión 3.0® Elisa Test System, Nueva Jersey, EE.UU.). Las interpretaciones de los resultados se hicieron con el espectrofotómetro (Biotek EL800 Microplate Reader); para la determinación del cut-off, se añadió la constante 0,600 al valor de la absorbancia media de los controles negativos.
Se seleccionaron muestras de reactivos para anti-VHC para la detección y caracterización molecular del VHC. El VHC-ARN fue investigado por RT-qPCR y RT-PCR. La extracción de ARN se procesó de forma automatizada (equipo m24sp/m2000rt - Abbott®), con un volumen final de 60 μL. Después de la extracción, amplificación y detección del VHC-ARN se realizaron, utilizando el kit comercial Abbott RealTime VHC (Abbott®, EE.UU.), de acuerdo con las instrucciones del fabricante. La detección de VHC-ARN se realizó con el TaqMan® utilizando primers y sondas TaqMan® específicos. El ensayo Abbott RealTime VHC tiene una linealidad de 12 a 100.000.000 UI/ml. El ARN de las muestras, extraído por método automatizado (equipo m24sp/m2000rt - Abbott®), se utilizó para la síntesis del cDNA, realizado con primers aleatorios (IDT) en las siguientes condiciones de termociclo: 15 min a 25 °C, seguido de 1 h a 37 °C e incubación final de 95 °C durante 15 min.
El cDNA de las muestras se utilizó en ensayos RT-PCR para la amplificación parcial de las regiones NS5B y 5'UTR del VHC, secuenciación posterior de nucleótidos y análisis filogenéticos para genotipado de virus. La amplificación de la región NS5B fue desarrollada por ensayos hemi-nested RT-PCR para producir un fragmento de 382 pares base. Durante los pasos de 1ª ronda del PCR, 5 μL de cDNA de cada muestra se añadió a los primers Pr3 (5'TATGAYACCCGCTGYTTTGACTC3') y Pr4 (5'GCNGARTAYCTVGTCATAGTC3') y se sometieron a condiciones de termociclador, como se describe en Morice et al.10 y Sandres-Sauné et al.11. Las reacciones PCR de 2ª ronda se realizaron con primers Pr3 y Pr5 (5'GCTAGTCATAGCCTCCGT3') en condiciones de ciclado10,11. Para la región 5'UTR, se realizó Nested RT-PCR con el objetivo de amplificar un fragmento de 230 pares base (pb) del gen que codifica la región 5'UTR. Utilizamos 5 μL de cDNA en la reacción PCR utilizando los primers PTC1 (5'CGTTAGTATGAGGTTGC3') y NCR2 (5'ATACTCGAGGTGCACGGTCTACGACCT3') en condiciones de ciclado12. El segundo PCR se realizó con los primers PTC3 (5'AGTGTCGTGCAGCCTCCAGG3') y NCR4 (5'CACTCTCGAGCACCCTATCAGGCAGT3') en las mismas condiciones de ciclado que el primer PCR.
Los amplicones fueron detectados en gel de agarosa al 1% (Ultra Pure Agarose-Invitrogen, España), SYBR® Safe DNA Gel Stain (Invitrogen, EE.UU.) y marcador de peso molecular (50 bp DNA Ladder, Invitrogen, USA). La visualización y captura de las imágenes se realizó con equipos de fotodetección (TFX-35M GIBCO BRL W Transluminador). Las muestras con productos de amplificación con tamaño cercano a lo esperado, 230 bp para la región 5'UTR y 382 bp para la región NS5B se consideraron positivas.
Los productos amplificados fueron purificados con el kit EXO/SAP-IT (GE Healthcare Bio-Sciences, Buckinghamshire, Reino Unido) y posteriormente secuenciados, en los sentidos senso y antisenso, con los primers Pr3 y Pr5 para la región NS5B y PTC3 y NCR4 para la región 5'UTR, respectivamente, utilizado junto con el kit BigDye® Terminator v3.1 Cycle Sequencing (Applied Biosystems, Vilnius, Lituania) en el secuenciador automático ABI 3500 (Applied Biosystems). Todas las reacciones se desarrollaron de acuerdo con las directrices de los fabricantes. Las secuencias obtenidas fueron editadas y alineadas en el programa Geneious v8.1.3 y, junto con las secuencias de los diferentes genotipos y subgenotipos de VHC, disponibles en GenBank. Los árboles filogenéticos fueron construidos utilizando el método Neighbor-Join y el modelo Kimura de 2 parámetros en el programa MEGA v7.
La prueba chi-cuadrado (χ2) de homogeneidad sirvió para comparar las proporciones de las variables de interés (manifestaciones clínicas, género, edad, origen) en dos o más poblaciones (infectadas con VHC o no infectadas por el VHC). El análisis residual mostró cómo las diversas proporciones de la tabla de contingencia contribuyen al valor final del χ 2 calculado (p = 0,05). Se utilizó el programa BioEstat v5.013.
En cumplimiento de la Resolución Nº 466, de 12 de diciembre de 2012, del Consejo Nacional de Salud/MS14, este proyecto fue aprobado por el Comité de Ética para la Investigación en Seres Humanos del IEC/SVS/MS, en virtud del Dictamen de Aprobación Nº 1.947.422, el 3 de marzo de 2017.
RESULTADOS
Los pacientes tenían entre 1 mes y 85 años, con una media de 29,9 (± 17,9) y un promedio de 26 años, la mayoría entre 21 y 30 años (28,0%). La proporción de hombres y mujeres fue similar, aunque ligeramente superior la de los hombres (55,3%). Todas las muestras procedían de pacientes del área urbana, de los municipios de Belém y Ananindeua, Región Metropolitana del estado de Pará. El mayor número de pacientes con HNANB era residente del barrio de Marco (11,1%). Entre los registros de pacientes que contenían información sobre ocupación, la frecuencia más alta fue de estudiantes (22,2%). Sin embargo, hubo pérdidas en la interpretación de los resultados por la alta frecuencia de los campos vacíos, por ejemplo, "no informados". Los principales aspectos destacados en el perfil demográfico de los pacientes se muestran en la Tabla 1.
Tabla 1 − Distribución de pacientes diagnosticados con HNANB, según género, grupo de edad, origen y ocupación, de 1982 a 1988, en Belém y Ananindeua, Estado de Pará, Brasil
| Variables | N = 396 | % |
|---|---|---|
| Sexo | ||
| Masculino | 219 | 55,3 |
| Femenino | 177 | 44,7 |
| Grupo edad (años) | ||
| ≤ 10 | 63 | 15,9 |
| 11-20 | 75 | 19,0 |
| 21-30 | 111 | 28,0 |
| 31-40 | 57 | 14,4 |
| 41-50 | 40 | 10,1 |
| 51-60 | 23 | 5,8 |
| ≥ 61 | 27 | 6,8 |
| Procedencia | ||
| Belém | 349 | 88,1 |
| Ananindeua | 47 | 11,9 |
| Barrios | ||
| Belém | ||
| Marco | 44 | 11,1 |
| Marambaia | 23 | 5,8 |
| Nazaré | 21 | 5,3 |
| Umarizal | 20 | 5,0 |
| Pedreira | 19 | 4,8 |
| Telégrafo | 18 | 4,5 |
| Jurunas | 16 | 4,0 |
| Canudos | 14 | 3,6 |
| Guamá | 14 | 3,6 |
| Sacramenta | 14 | 3,6 |
| São Brás | 14 | 3,6 |
| Icoaraci | 12 | 3,0 |
| Terra Firme | 12 | 3,0 |
| Batista Campos | 11 | 2,7 |
| Coqueiro | 5 | 1,3 |
| Cremação | 9 | 2,3 |
| Val-de-Cans | 5 | 1,3 |
| Campina | 4 | 1,0 |
| Souza | 4 | 1,0 |
| Otros barrios | 19 | 4,8 |
| No informado | 51 | 12,8 |
| Ananindeua | ||
| Cidade Nova | 16 | 4,0 |
| Coqueiro | 6 | 1,5 |
| Guanabara | 5 | 1,3 |
| Otros barrios | 14 | 3,6 |
| No informado | 6 | 1,5 |
| Ocupación | ||
| Estudiante | 88 | 22,2 |
| Doméstica | 38 | 9,6 |
| Menor sin ocupación | 33 | 8,3 |
| Dueña de casa | 24 | 6,1 |
| Comerciante | 14 | 3,5 |
| Profesor | 9 | 2,3 |
| Servidor público | 7 | 1,8 |
| Chofer | 7 | 1,8 |
| Albañil | 7 | 1,8 |
| Jubilado | 6 | 1,5 |
| Auxiliar administrativo | 4 | 1,0 |
| Otras ocupaciones | 82 | 20,7 |
| No informado | 77 | 19,4 |
N: Número muestreo; %: Frecuencia.
Las manifestaciones clínicas notificadas por los pacientes, que acudieron al SAHEP/IEC en la década de 1980 y que recibieron el diagnóstico de HNANB, fueron recogidas de 322 de los 396 formularios completados y disponibles, destacando: coluria (180/322; 55.9%), ictericia (161/322; 50.0%), fiebre (148/322; 46,0%), vómitos (106/322; 32,9%), mialgia (93/322; 28,9%), malestar (90/322; 27,9%), anorexia (76/322; 23,6%), náuseas (76/322; 23,6%) diarrea (41/322; 12,7%).
Los individuos positivos para los anti-VHC que viven en Belém eran en su mayoría del barrio do Marco (6/38; 15,8%). La Figura 1 destaca los barrios con dos o más casos de anti-VHC reactivos (23/38; 60,5%).
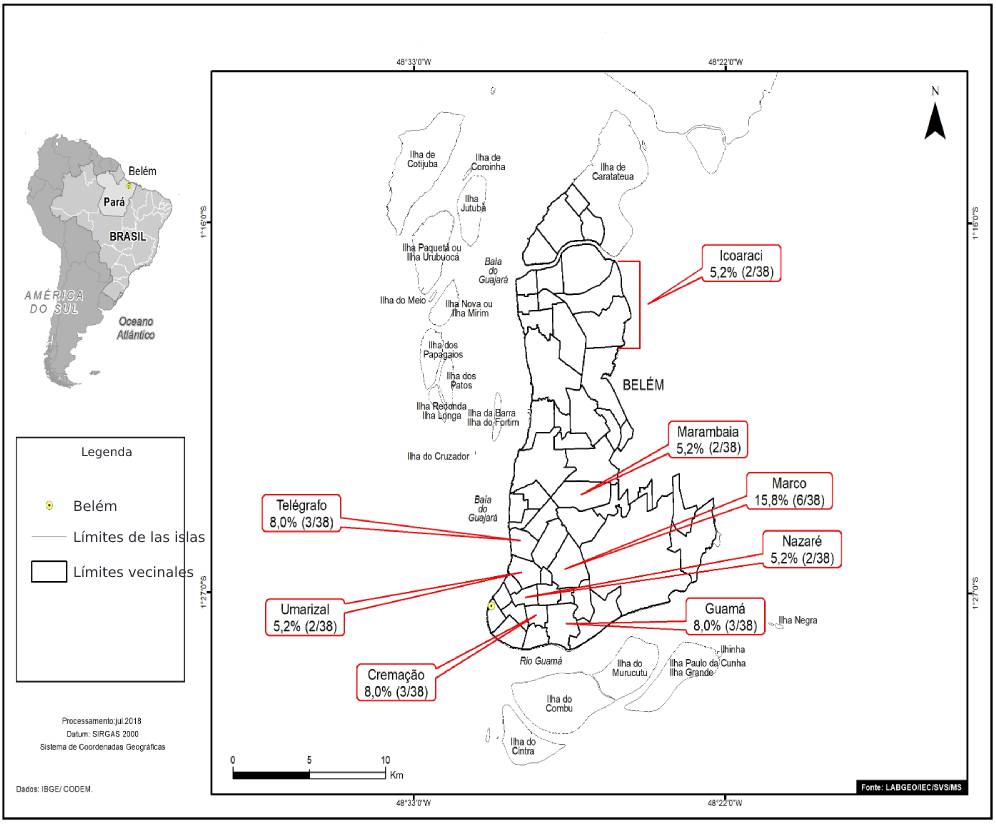
Fuente: Laboratorio de Geoprocesamiento (LabGeo/IEC/SVS/MS).
Figura 1 - Distribución, por barrios de Belém, de muestras positivas de anticuerpos anti-VHC de pacientes diagnosticados con HNANB tratados en SAHEP/IEC, de 1982 a 1988, en Belém, Estado pará, Brasil
En el municipio de Ananindeua, las muestras más positivas (3/5; 60,0%) era de pacientes que vivían en el barrio Cidade Nova (Figura 2).
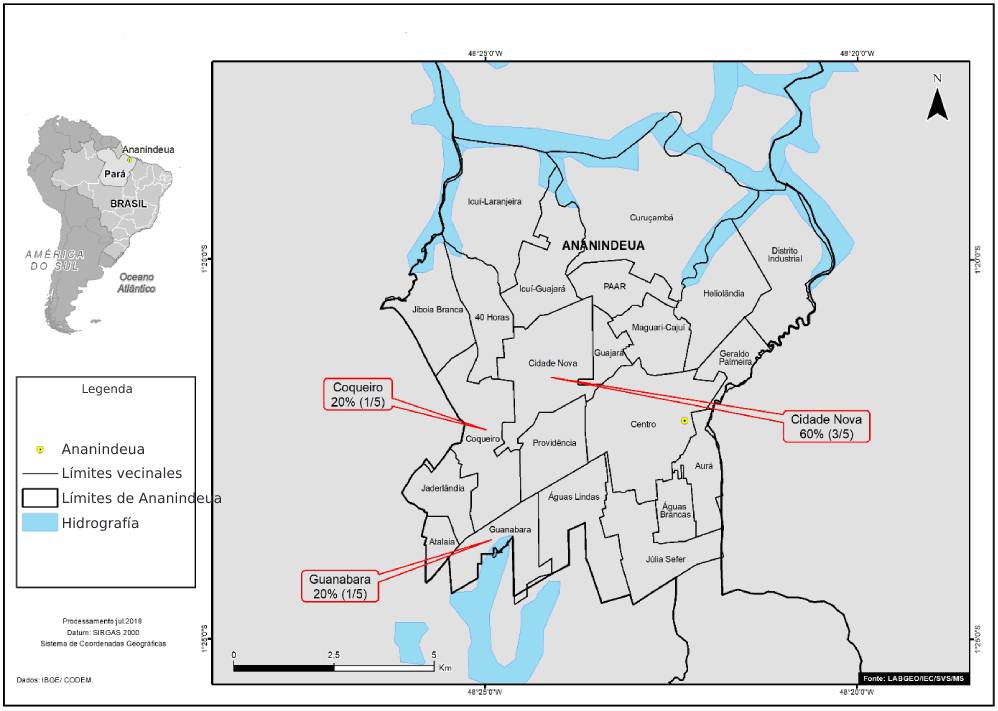
Fuente: LabGeo/IEC/SVS/MS.
Figura 2 - Distribución por los barrios de Ananindeua de muestras positivas de anticuerpos anti-VHC de pacientes diagnosticados con HNANB tratados en SAHEP/IEC, de 1982 a 1988, en Ananindeua, Estado pará, Brasil
Se detectaron anticuerpos anti-VHC en el 10,9% (43/396) de las muestras, con una prevalencia similar entre géneros. Las frecuencias más altas de anti-VHC se observaron en adultos mayores de 20 años y menores de 60 años, especialmente en el grupo de edad de 51 a 60 años. No había importancia estadística entre el género y el grupo de edad cuando se correlacionaba con la presencia de anticuerpos del VHC. Fue posible detectar la presencia de ARN viral en el 55,8% (24/43) de las muestras seroreactivas al VHC. Para los resultados positivos, según el grupo de género y edad, no hubo importancia estadística cuando correlacionado con la infección por VHC (Tabla 2).
Tabla 2 - Prevalencia de anti-VHC+ y VHC-ARN+, según el grupo de género y edad, en pacientes diagnosticados con HNANB tratados en SAHEP/IEC, de 1982 a 1988, en Belém y Ananindeua, Estado Pará, Brasil
| Variables | Examinados N = 396 | Anti-VHC+ N = 43 | % | p valor α = 0,05 | VHC-RNA+ N = 24 | % | p valor α = 0,05 |
|---|---|---|---|---|---|---|---|
| Sexo | |||||||
| Masculino | 219 | 22 | 10,0 | 0.6775* | 14 | 58,3 | 0,7574† |
| Femenino | 177 | 21 | 11,9 | 10 | 41,7 | ||
| Grupo de edad (años) | |||||||
| ≤ 10 | 63 | 3 | 4,8 | 0,2694‡ | - | - | |
| 11-20 | 75 | 6 | 8,0 | 1 | 4,2 | ||
| 21-30 | 111 | 15 | 13,5 | 9 | 37,5 | ||
| 31-40 | 57 | 8 | 14,0 | 5 | 20,8 | 0,5719‡ | |
| 41-50 | 40 | 3 | 7,5 | 3 | 12,5 | ||
| 51-60 | 23 | 6 | 26,1 | 5 | 20,8 | ||
| ≥ 61 | 27 | 2 | 7,4 | 1 | 4,2 |
N: Número de muestras; %: Prevalencia; Signo convencional utilizado: - Datos numéricos igual a cero, no resultantes de redondeo; * χ2 (Yates) = 0.173; † χ2 (Yates) = 0.095; ‡ G prueba para muestras independientes.
A través del genotipado, se encontraron dos genotipos (1 y 3), subtipos 1b y 3a, respectivamente, en ocho (33,3%) de los 24 ARN detectados (Cuadro 1). El cladograma desarrollado para muestras de VHC se basó en la alineación de secuencias de la región NS5B (382 bp). Se agruparon tres muestras con secuencias de genotipo 1, subtipo 1b y una agrupada con genotipo 3, subtipo 3a (Figura 3).
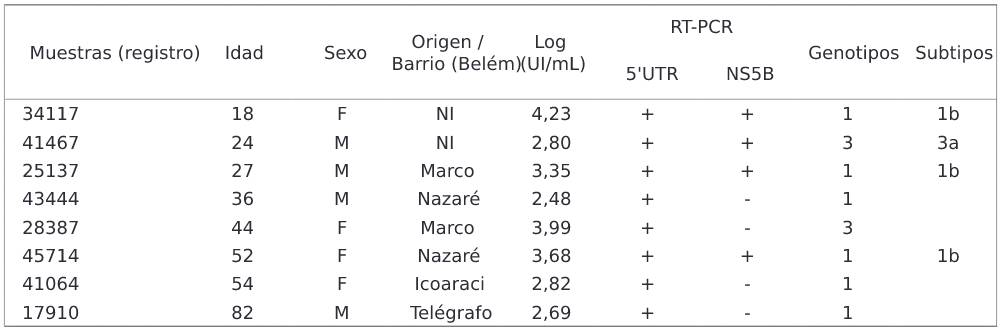
NI: No informado; +: Positivo; -: Negativo.
Cuadro 1 - Características demográficas, carga viral y genotipos del VHC de los ocho pacientes diagnosticados con HNANB con genotipos detectados, vistos en SAHEP/IEC, de 1982 a 1988, en Belém, Estado pará, Brasi
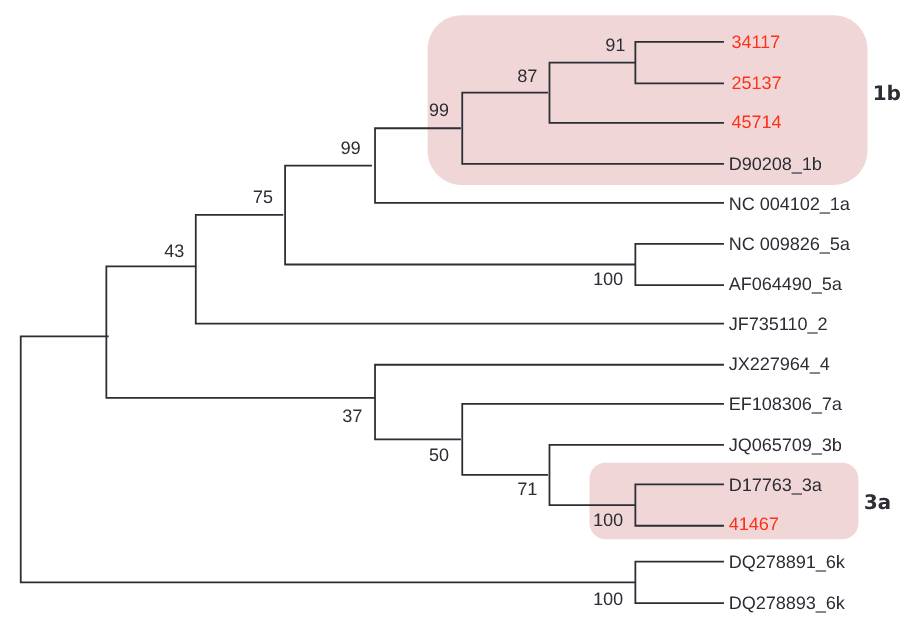
Las secuencias obtenidas de GenBank se identifican con el número de acceso.
Figura 3 - Cladograma de la región NS5B de VHC, inferido con el método Neighbor-Join (Kimura 2-parameters) en el programa Mega v7
El análisis filogenético de la región 5'UTR no permitió la determinación de subtipos de VHC, ya que los amplificadores de esta región presentaron secuencias con un número limitado de bases de nucleótidos (< 230 bp), lo que imposibilitaba inferir relaciones filogenéticas.
DISCUSIÓN
Los estudios retrospectivos sobre la prevalencia y caracterización del VHC son importantes para comprender su comportamiento en la población y su dispersión en un momento en que el diagnóstico específico no estaba disponible9. A pesar de los métodos moleculares sensibles y avanzados actualmente disponibles para el diagnóstico de hepatitis viral, el largo período de almacenamiento de las muestras, aunque criopreservado (-20 ºC), ciertamente indujo cambios a nivel molecular capaces de perjudicar los análisis de laboratorio, porque es un virus de ARN extremadamente susceptible a la degradación, aumentando estas pérdidas circunstanciales15. Sin embargo, este estudio reveló resultados sin precedentes sobre la aparición de hepatitis C en la Amazonía brasileña en el período analizado (1982-1988).
Antes del descubrimiento de la hepatitis C y su agente etiológico, la incidencia de HNANB en los Estados Unidos de América en la década de 1980, se consideró estable, presentando una media de 7,1 casos por cada 100.000 habitantes, según los Centros para el Control y la Prevención de Enfermedades, que, durante un período de siete años (1982-1988), desarrollaron un estudio en cuatro municipios centinela, utilizando muestras de pacientes con HNANB, recogidas entre 1985 y 1988, que fueron analizadas para detectar el VHC, demostrando un 45% de positividad16.
Un estudio prospectivo realizado en España entre 1978 y 1984, con 54 pacientes diagnosticados con HNANB postransfusión, detectó el 85% de los anticuerpos VHC17. En París, entre 1980 y 1989, el 39,6% de los pacientes sometidos a hemodiálisis estaba infectado con VHC y este hepatovirus era responsable del 91% de los casos de HNANB18.
En Brasil, Focaccia et al.19 reportaron una prevalencia de infección por VHC del 1,4% en la población de la ciudad de São Paulo. Un estudio retrospectivo de reevaluación de laboratorio de la infección por VHC en muestras de 1990 a 1993 en Belém describió una prevalencia del 62,6% para los anticuerpos del VHC20. Valois et al.21 observó una prevalencia del 1,1% para el anti-VHC entre los candidatos a la donación de sangre en la capital del estado.
La seroprevalencia del VHC en la muestra estudiada fue un 10,9%, superior a la observada por Fonseca et al.22, que encontró positividad del 0,2% del VHC, en un estudio retrospectivo realizado en la ciudad de Manaus, Estado de Amazonas, en el período de 1989 a 1998, en pacientes diagnosticados con hepatitis aguda. Sin embargo, similar a la reportada por Teixeira23, que observó positividad del 14,3% del VHC en un estudio de reevaluación clínico-laboratorio de casos notificados como HNANB, en el período de 1994 a 1996, también en Belém y Ananindeua.
En el presente estudio, la positividad del VHC era similar entre los sexos, siendo mayor en adultos de entre 51 y 60 años. Martins et al.24 sugirió que la mayor prevalencia de la hepatitis C, observada después de los 50 años de edad, puede explicarse por el diagnóstico tardío de la exposición al VHC.
En cuanto al género y el grupo de edad, un estudio de Santos et al.25, con pacientes diagnosticados con HNANB, demostró que todos los individuos reactivos al anti-VHC eran hombres, con edades que oscilaban entre los 27 y los 36 años. Simon et al.26, en un estudio realizado en la ciudad de París, Francia, entre pacientes con hemodiálisis con HNANB, observó que la edad promedio de los pacientes con anti-VHC reactivo era de 50 años, la mayoría de ellos hombres. Valois et al.21, al analizar una población de candidatos a la donación de sangre, en Belém, encontraron que el sexo masculino era predominante entre los casos de anti-VHC reactivo, con una mayor prevalencia en el grupo de edad entre 30 y 39 años.
El enfoque de la ocupación profesional es una variable relevante en los estudios epidemiológicos. En este estudio, la ocupación profesional fue heterogénea, destacando el grupo de estudiantes. Morais y Oliveira27, en un estudio realizado en el suroeste de Bahia entre 2003 y 2014, reportaron una prevalencia del 0,96% del anti-VHC entre los estudiantes.
En el presente estudio, todas las muestras procedían de pacientes del casco urbano, de los municipios de Belém (la mayoría) y Ananindeua. El barrio de Marco tenía la mayor prevalencia de reactivo anti-VHC entre los barrios de Belém; y la Cidade Nova, entre los barrios de Ananindeua, lo que podría explicarse por ser barrios muy populosos.
A pesar de las limitaciones relacionadas con el tiempo de almacenamiento y envasado de muestras séricas, fue posible detectar ARN viral en el 55,8% de los 43 pacientes seroragentes en el presente estudio. Fonseca y otros reportaron resultados más bajos28, que observó una prevalencia del 5% del ARN viral detectado en el estado de Amazonas, con muestras criopreservadas recogidas durante los años 1981 a 1986, de pacientes con HNANB agudo.
En el estudio de Simon et al.26, con pacientes en hemodiálisis con HNANB, realizados en París, el 82,6% (19/23) fueron positivos para el ARN del VHC.
En Brasil, un estudio retrospectivo de reevaluación de laboratorio de la infección por VHC en muestras de diálisis de 1990 a 1993, en el municipio de Belém, describió el 4,3% del ARN viral detectado20.
Oliveira et al.29 demostró el 62,5% del ARN viral en un estudio entre ribereños del municipio de Cametá, Pará. Freitas et al.30 relataron 5,3% de detección para VHC-ARN en pacientes con anti-VHC reactivo en Belém. En el estudio sobre los "Aspectos epidemiológicos de la infección por VHC en usuarios de medicamentos no inyectables en el estado de Pará, este de la Amazonía", hubo una prevalencia de ARN viral del 28%31.
Los datos de detección de VHC-RNA del presente estudio son similares a los encontrados por Oliveira et al.29, con especial énfasis en el hecho de que las muestras séricas analizadas en la investigación antes mencionada, a diferencia de las probadas en la presente serie, fueron recogidas recientemente. Las variaciones encontradas en diferentes estudios pueden explicarse por las diferencias entre los grupos estudiados y/o muestras criopreservadas, y por el tiempo transcurrido entre la recolección y el rendimiento de las pruebas.
Además de la importancia para la filogenia, el genotipado del VHC es un factor importante para el manejo de las personas infectadas y, con fines epidemiológicos, indica la vía de adquisición y afecta al resultado clínico y a la respuesta al tratamiento32,33. El genotipo 1, subtipo 1b, es más resistente a ciertas terapias, y el genotipo 3, subtipo 3a, se asocia significativamente con las formas más agresivas de la enfermedad32.
El genotipado del VHC de este estudio se realizó mediante la secuenciación de las regiones 5'UTR y NS5B. El genotipado fue posible en ocho de los 24 RNAs detectados, la mayoría de los cuales fueron genotipos en la región 5'UTR. Se identificaron dos genotipos (1 y 3) en ambas regiones, en las mismas muestras séricas, y se caracterizaron dos subtipos (1b y 3a) en la región NS5B.
El 5'UTR está muy conservado; en consecuencia, la región de anidamiento del primer en esa región se conserva mucho más en relación con NS5B34. Debido al alto nivel de conservación y sensibilidad de 5'UTR, esta región ha sido más utilizada por los laboratorios clínicos para el genotipado del VHC35. Por lo tanto, estas características pueden explicar la detección de más genotipos en la región 5'UTR que en el NS5B estudiado.
No fue posible discriminar subtipos dentro de los genotipos detectados en la región 5'UTR. La región 5'UTR, a diferencia del NS5B, debido a su alto nivel de conservación, no tiene suficiente variación para discriminar las clasificaciones de VHC a nivel de subtipo viral34,35,36. Por lo tanto, los árboles filogenéticos de 5'UTR son menos capaces de agrupar subtipos del mismo genotipo en clados que los árboles de secuencia NS5B, independientemente del método utilizado para la inferencia filogenética34.
Los genotipos 1 y 3 del VHC son la causa más común de infecciones en todo el mundo1,37. En Brasil, el genotipo 1 se considera el más frecuente, seguido del genotipo 3 y del genotipo 21,12,37. Entre las regiones de Brasil, la Región Norte tiene la mayor frecuencia de genotipo 1 (51,7% a 74,1%); la Región Centro-Oeste, genotipo 2 (11,4%); la Región Sur, genotipo 3 (43,2%); y en la Región Sudeste, en el estado de São Paulo, se describieron genotipos 4 y 5, raramente encontrados12.
Perone et al.38 realizó un estudio con pacientes con hepatitis C crónica, tratado en los Centros de Referencia para la Hepatitis Viral en Belo Horizonte, Estado de Minas Gerais, entre 2002 y 2006, y observó una alta prevalencia del genotipo 1 (78,4%) y del genotipo 3 (17,9%). Oliveira et al.39 informó de la detección del 77,1% para el genotipo 1 y del 19,82% para el genotipo 3 en un estudio realizado en un hospital de referencia para enfermedades infecciosas en el estado de Goiás.
En esta serie, fue posible genotipar un tercio de las muestras positivas para el VHC-ARN, con predominio del genotipo 1, similar al estudio de Sawada et al.36, que concluyó que, en la distribución del VHC en diferentes categorías de exposición en Pará, predomina el genotipo 1.
La distribución de los genotipos identificados en el presente estudio fue similar a la encontrada por Baia20, quien describió la detección del 73% para el genotipo 1 y el 24,3% para el genotipo 3 en un estudio retrospectivo entre diálisis, de 1990 a 1993, en Belém.
Los datos del estudio actual también fueron similares a los hallazgos de otros autores en la Región Norte, lo que demuestra la importancia de los genotipos 1 y 3 en la epidemiología de este virus: Campiotto et al.12 detalló la detección del 74,1% para el genotipo 1 y el 24,7% para el genotipo 3 en la Región Norte; Araújo et al.40 encontró una prevalencia del 76,1% para el genotipo 1 y del 19,6% para el genotipo 3 en pacientes con hepatitis crónica en el estado de Amazonas; Oliveira et al.39 observó el 76,9% del genotipo 1 y el 23,1% del genotipo 3 en los consumidores de drogas no inyectables en Pará; Guimarães et al.41 detectaron el 72,4% del genotipo 1 y el 23,3% del genotipo 3 en la población general, en el estado de Pará, y describieron una prevalencia del 76,7% para el genotipo 1 y del 20,7% para el genotipo 3 en la Región Metropolitana de Belém.
Un estudio retrospectivo, realizado en la Amazonía, también analizó muestras de suero criopreservadas a -70 ºC, recogidas de 1981 a 1986, para su posterior análisis del VHC28. Otro estudio, también retrospectivo, fue realizado por Baia20 en muestras acondicionadas en biobanco (-20 ºC) durante más de 20 años. Estos estudios corroboran la presente investigación, destacando la importancia del uso de biobancos institucionales en la investigación sanitaria.
CONCLUSIÓN
A pesar de las limitaciones del estudio, debido al largo tiempo de almacenamiento de las muestras (tres décadas), fue posible detectar el 10,9% de los anticuerpos anti-VHC y caracterizar el VHC en el suero del biobanco, revelando la circulación en el momento de al menos dos genotipos y dos subtipos del virus: a) genotipo 1, detectado en la mayoría de las muestras genotipadas y, actualmente, exhibiendo una mayor resistencia a los fármacos que otros genotipos conocidos; y b) genotipo 3, menos frecuente en la muestra de estudio, pero actualmente asociado con una mayor virulencia.
Se concluyó que el análisis de muestras del biobanco permitió la identificación de cepas del VHC, y puede favorecer futuros estudios con el objetivo de dilucidar los aspectos evolutivos asociados con la resistencia y virulencia de este patógeno.
Se sugiere que las instituciones evalúen la mejor manera de acondicionar muestras séricas, como la congelación a temperaturas más bajas, alícuotas, liofilización, etc., así como el costo beneficio de la modernización de estos procedimientos en biobancos institucionales dirigidos a la investigación sanitaria, debido a la extrema relevancia para los estudios presentes y futuros.
AGRADECIMIENTOS
A todos aquellos que participaron haciendo posible llevar a cabo el estudio; y servidores de SAHEP/IEC/SVS/MS para la colaboración para el desarrollo y revisión del artículo.
REFERENCIAS
1 Polaris Observatory HCV Collaborators. Global prevalence and genotype distribution of hepatitis C virus infection in 2015: a modelling study. Lancet Gastroenterol Hepatol. 2017 Mar;2(3):161-76. [ Links ]
2 European Association for the Study of the Liver. EASL recommendations on treatment of hepatitis C 2018. J Hepatol. 2018 Aug;69(2):461-511. [ Links ]
3 Sociedade Brasileira de Hepatologia. Sociedade Brasileira de Infectologia. Consenso. Recomendações das Sociedades Brasileiras de Hepatologia (SBH) e Infectologia (SBI) para o tratamento da hepatite C no Brasil com novos medicamentos antivirais de ação direta (DAAs). Braz J Infect Dis. 2016 mar;20(2 Supl 1):S2-7. [ Links ]
4 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Vigilância, Prevenção e Controle das IST, do HIV/Aids e das Hepatites Virais. Manual Técnico para o Diagnóstico das Hepatites Virais. 2. ed. Brasília: Ministério da Saúde; 2018. [ Links ]
5 Viana DR, Veloso NM, Carvelho Neto O, Papacota NG, Nunes GM, Guedes VR. Hepatite B e C: diagnóstico e tratamento. Rev Patol Tocantins. 2017 set;4(3):73-9. [ Links ]
6 Pawlotsky JM, Feld JJ, Zeuzem S, Hoofnagle JH. From non-A, non-B hepatitis to hepatitis C virus cure. J Hepatol. 2015 Apr;62(1 Suppl): S87-99. [ Links ]
7 Choo QL, Kuo G, Weiner AJ, Overby LR, Bradley DW, Houghton M. Isolation of a cDNA clone derived from a blood-borne non-A, non-B viral hepatitis genome. Science. 1989 Apr;244(4902):359-62. [ Links ]
8 International Committee on Taxonomy of Viruses. Virus taxonomy: 2017 release [Internet]. Birmingham (AL): ICTV; 2017 [cited 2017 Jun 17]. Available from: Available from: https://talk.ictvonline.org/taxonomy/ . [ Links ]
9 Conte VP. Hepatite crônica por vírus C. Parte 1: considerações gerais. Arq Gastroenterol. 2000 jul-set;37(3):187-94. [ Links ]
10 Morice Y, Roulot D, Grando V, Stirnemann J, Gault E, Jeantils V, et al. Phylogenetic analyses confirm the high prevalence of hepatitis C virus (HCV) type 4 in the Seine-Saint-Denis district (France) and indicate seven different HCV-4 subtypes linked to two different epidemiological patterns. J Gen Virol. 2001 May;82(Pt 5):1001-12. [ Links ]
11 Sandres-Sauné K, Deny P, Pasquier C, Thibaut V, Duverlie G, Izopet J. Determining hepatitis C genotype by analyzing the sequence of the NS5b region. J Virol Methods. 2003 May;109(2): 187-93. [ Links ]
12 Campiotto S, Pinho JR, Carrilho FJ, Silva LC, Souto FJ, Spinelli V, et al. Geographic distribution of hepatitis C virus genotypes in Brazil. Braz J Med Biol Res. 2005 Jan;38(1):41-9. [ Links ]
13 Ayres M, Ayres Jr M, Ayres DL, Santos AS. BioEstat 5.0: aplicações estatísticas nas áreas das ciências biológicas e médicas. Belém: Sociedade Civil Mamirauá; 2007. 364 p. [ Links ]
14 Brasil. Ministério da Saúde. Resolução nº 466, de 12 de dezembro de 2012. Aprova normas regulamentadoras de pesquisas envolvendo seres humanos. Diário Oficial da União, Brasília (DF), 2013 jun 12; Seção 1:59. [ Links ]
15 Moreau de Gerbehaye AI, Bodéus M, Robert A, Horsmans Y, Goubau P. Stable hepatitis C virus RNA detection by RT-PCR during four days storage. BMC Infect Dis. 2002 Oct;2:22. [ Links ]
16 Alter MJ, Hadler SC, Judson FN, Mares A, Alexander WJ, Hu PY, et al. Risk factors for acute non-A, non-B hepatitis in the United States and association with hepatitis C virus infection. JAMA. 1990 Nov;264(17):2231-5. [ Links ]
17 Esteban JI, Viladomiu L, Gonzalez A, Roget M, Genescà J, Esteban R, et al. Hepatitis C virus antibodies among risk groups in Spain. Lancet. 1989 Aug;334(8658):294-7. [ Links ]
18 Alter MJ. HCV routes of transmission: what goes around comes around. Semin Liver Dis. 2011 Nov;31(4):340-6. [ Links ]
19 Focaccia R, Conceição OJ, Sette H Jr, Sabino E, Bassit L, Nitrini DR, et al. Estimated prevalence of viral hepatitis in the general population of the Municipality of São Paulo, measured by a serologic survey of a stratified, randomized and residence-based population. Braz J Infect Dis. 1998 Dec;2(6):269-84. [ Links ]
20 Baia KSM. Reavaliação laboratorial da infecção pelo vírus da hepatite C em dialisados atendidos no período de 1990-1993, Belém, Pará, Brasil [Monografia]. Belém (PA): Universidade Federal do Pará, Faculdade de Medicina e Cirurgia do Pará; 2013. 58 p. [ Links ]
21 Valois RC, Maradei-Pereira LMC, Crescente JAB, Oliveira-Filho AB, Lemos JAR. VHC infection through perforating and cutting material among candidates for blood donation in Belém, Brazilian Amazon. Rev Inst Med Trop S Paulo. 2014 Nov-Dec;56(6):511-5. [ Links ]
22 Fonseca JCF, Brasil LM. Infecção pelo vírus da hepatite C na região Amazônica brasileira. Rev Soc Bras Med Trop. 2004;37(Supl 2):1-8. [ Links ]
23 Teixeira LSC. Hepatite não-A, não-B: reavaliação clínico-laboratorial de casos notificados nos municípios de Belém e Ananindeua, estado do Pará [Monografia]. Belém (PA): Universidade Federal do Pará, Centro de Ciências da Saúde; 1997. 81 p. [ Links ]
24 Martins T, Narciso-Schiavon JL, Schiavon LL. Epidemiologia da infecção pelo vírus da hepatite C. Rev Assoc Med Bras. 2011 jan-fev;57(1):107-12. [ Links ]
25 Santos A, Carvalho A, Bento D, Sá R, Tomaz J, Rodrigues V, et al. Epidemiologia da hepatite C na região centro de Portugal - prevalência do anti-VHC na população do Distrito de Coimbra. Acta Med Port. 1993;6:567-72. [ Links ]
26 Simon N, Couroucé AM, Lemarrec N, Trépo C, Ducamp S. A twelve year natural history of hepatitis C virus infection in hemodialyzed patients. Kidney Int. 1994 Aug;46(2):504-11. [ Links ]
27 Morais MTM, Oliveira TJ. Perfil epidemiológico e sóciodemográfico de portadores de hepatite C de um município do sudoeste baiano. Rev Saude.Com. 2015 jun;11(2):137-46. [ Links ]
28 Fonseca JCF, Brasil L, Fay F, Castilho M, Botelho R, Borborema C, et al. Prevalência da infecção pelo vírus da hepatite C (VHC) e da hepatite E (VHE) em pacientes com hepatite aguda N-A, N-B, N-D. Arch Argent Enferm Apar Dig. 1996;10:90. [ Links ]
29 Oliveira CSF, Silva AV, Santos KN, Fecury AA, Almeida MKC, Fernandes AP, et al. Infecção pelo vírus da hepatite B e C em ribeirinhos da Amazônia brasileira. Rev Soc Bras Med Trop. 2011 set-out;44(5):546-50. [ Links ]
30 Freitas MJR, Fecury AA, Almeida MKC, Freitas AS, Guimarães VS, Silva AM, et al. Prevalence of hepatitis C virus infection and genotypes in patient with chronic kidney disease undergoing hemodialysis. J Med Virol. 2013 Oct;85(10):1741-5. [ Links ]
31 Oliveira-Filho AB, Sawada L, Pinto LC, Locks D, Bahia SL, Castro JA, et al. Epidemiological aspects of HCV infection in non-injecting drug users in the Brazilian state of Pará, eastern Amazon. Virol J. 2014 Feb;11(38). [ Links ]
32 Kermani FR, Sharifi Z, Ferdowsian F, Paz Z, Zamanian M. Distribution of hepatitis C virus genotypes among chronic infected injecting drug users in Tehran, Iran. Jundishapur J Microbiol. 2013 Feb;6(3):265-8. [ Links ]
33 Moosavy SH, Davoodian P, Nazarnezhad MA, Nejatizaheh A, Eftekhar E, Mahboobi H. Epidemiology, transmission, diagnosis, and outcome of hepatitis C virus infection. Electron Physician. 2017 Oct;9(10):5646-56. [ Links ]
34 Hraber PT, Fischer W, Bruno WJ, Leitner T, Kuiken C. Comparative analysis of hepatitis C virus phylogenies from coding and non-coding regions: the 5' untranslated region (UTR) fails to classify subtypes. Virol J. 2006 Dec;3:103. [ Links ]
35 Murphy DG, Willems B, Deschênes M, Hilzenrat N, Mousseau R, Sabbah S. Use of sequence analysis of the NS5B region for routine genotyping of hepatitis C virus with reference to C/E1 and 5' untranslated region sequences. J Clin Microbiol. 2007 Apr;45(4):1102-12. [ Links ]
36 Sawada L, Pinheiro AC, Locks D, Pimenta AS, Rezende PR, Crespo DM, et al. Distribution of hepatitis C virus genotypes among different exposure categories in the State of Pará, Brazilian Amazon. Rev Soc Bras Med Trop. 2011 Jan-Feb;44(1):8-12. [ Links ]
37 Petruzziello A, Marigliano S, Loquercio G, Cozzolino A, Cacciapuoti C. Global epidemiology of hepatitis C virus infection: an up-date of the distribution and circulation of hepatitis C virus genotypes. World J Gastroenterol. 2016 Sep;22(34):7824-40. [ Links ]
38 Perone C, Del Castillo DM, Pereira GL, Carvalho NO, Januário JN, Teixeira R. Alta prevalência do genótipo 1 em portadores de hepatite C crônica em Belo Horizonte, MG. Rev Soc Bras Med Trop. 2008 mai-jun;41(3):238-42. [ Links ]
39 Oliveira TJB, Reis LAP, Barreto LSLO, Gomes JG, Manrique EJC. Perfil epidemiológico dos casos de hepatite C em um hospital de referência em doenças infectocontagiosas no estado de Goiás, Brasil. Rev Pan-Amaz Saude. 2018 mar;9(1): 51-7. [ Links ]
40 Araújo AR, Almeida CM, Fraporti L, Garcia N, Lima TA, Maia LP, et al. Caracterização do vírus da hepatite C em pacientes com hepatite crônica: genótipos no Estado do Amazonas, Brasil. Rev Soc Bras Med Trop. 2011 set-out;44(5):638-40. [ Links ]
41 Guimarães VS, Melo TG, Ferreira RCD, Almeida SF, Martins LC. Prevalence of hepatitis C virus genotypes in the State of Pará, Brazil. Rev Soc Bras Med Trop. 2018 Jul-Aug;51(4): 508-12. [ Links ]
Cómo citar este artículo / How to cite this article: Barbosa KMV, Moreira LVL, Oliveira CMA, Souza AJS, Nunes HM, Soares MCP, et al. Hepatitis C en la década de 1980: rescate de casos de las antiguas hepatitis "no A y no B" de un servicio de hepatología en la Amazonía, Brasil. Rev Pan Amaz Saude. 2019;10:e201900096. Doi: http://dx.doi.org/10.5123/S2176-6223201900096
Recibido: 28 de Septiembre de 2018; Aprobado: 08 de Abril de 2019











 texto em
texto em 


