Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude vol.11 Ananindeua 2020 Epub 10-Mar-2020
http://dx.doi.org/10.5123/s2176-6223202000127
ARTÍCULO ORIGINAL
Evaluación de la actividad antibacteriana de plantas medicinales de uso popular: Alternanthera brasiliana (Alternantera), Plantago major (Llantén), Arctostaphylos uva-ursi (Uva-ursi) y Phyllanthus niruri (Chancapiedra)
1 Universidade Regional de Blumenau, Curso de Farmácia, Blumenau, Santa Catarina, Brasil
Los estudios de sustancias obtenidas de vegetales han adquirido nuevas perspectivas, debido a los problemas asociados con la terapia de diversas infecciones, especialmente con respecto a la resistencia a los antimicrobianos.
OBJETIVOS:
Evaluar la actividad antibacteriana de las plantas medicinales frente a diferentes especies de bacterias, así como analizar sus perfiles cromatográficos.
MATERIALES Y MÉTODOS:
Extracto hidroalcohólico y fracciones de diclorometano, acetato de etilo, n-butanol y plantas acuosas Alternanthera brasiliana, Plantago major, Arctostaphylos uva-ursi y Phyllanthus niruri, que fueron probados por el método de CIMrodilución en caldo utilizando cepas genitales de Mycoplasma hominis, Ureaplasma urealyticum, Escherichia coli, Staphylococcus aureus, Staphylococcus saprophyticus, Proteus mirabilis y Klebsiella pneumoniae. Con esto, se determinó la Concentración Inhibitoria Mínima (CIM) de las muestras. El perfil cromatográfico de los extractos y fracciones se determinó mediante la técnica de cromatografía de capa delgada.
RESULTADOS:
La fracción de acetato de etilo de A. uva-ursi presentó CIM de 125 μg/mL contra M. genitalium y 31,25 μg/mL contra S. aureus, siendo este último de una excelente actividad antibacteriana. Para la misma fracción, P. niruri mostró actividad antibacteriana moderada, con valores de CIM de 250 μg/mL contra M. genitalium y S. aureus. Las especies A. brasiliana y P. major mostraron actividad débil o nula frente a las cepas probadas.
CONCLUSIÓN:
No fue posible establecer una estrecha relación entre el uso popular, la actividad antibacteriana in vitro y el perfil fitoquímico de las plantas, ya que los efectos antibacterianos de las especies vegetales estudiadas variaron en relación a diferentes bacterias con y sin pared celular.
Palabras clave: Antibacterianos; Penicilinas; Extractos de plantas; Pruebas de sensibilidad microbiana
INTRODUCCIÓN
Las infecciones del tracto urinario se encuentran entre las enfermedades infecciosas más comunes que afectan a la población1. Aproximadamente el 60% de las mujeres entre 18 y 24 años de edad tendrán al menos una infección urinaria sintomática durante su vida, y el 5% de ellas tendrán episodios recurrentes2.
Los principales microorganismos relacionados con las infecciones del tracto urinario son las enterobacterias, especialmente Escherichia coli, considerado el agente etiológico más prevalente, responsable del 80% de las infecciones. Otros uropatógenos comunes son Staphylococcus saprophyticus (15%), seguido de Klebsiella, Proteus, Enterobacter, Pseudomonas y Serratia. Los cocos grampositivos como Enterococcus, Staphylococcus aureus y Streptococcus agalactiae todavía están involucrados³.
Además de estos, los microorganismos del género Mycoplasma y Ureaplasma son clínicamente importantes, ya que son responsables por el desarrollo de diversas enfermedades, principalmente enfermedades genitourinarias y respiratorias4. Pertenecen a la clase Mollicutes y se caracterizan por ser los organismos más pequeños capaces de autorreplicarse, tener un genoma reducido y ausencia de pared celular5. Este hecho lleva a la no susceptibilidad de estos microorganismos a los antibióticos que actúan a nivel de la pared celular. La infección por estos agentes se asocia con inmunodepresión, obstrucción o instrumentación urinaria previa6.
Las especies Mycoplasma hominis y Ureaplasma urealyticum son las principales causas de infecciones urogenitales entre los micoplasmas7. El U. urealyticum se asocia a uretritis no-gonocócica. La especie M. hominis fue aislada de pacientes con pielonefritis aguda, también correlacionada con enfermedad inflamatoria pélvica, vaginosis bacteriana y, en mujeres embarazadas, abortos espontáneos, partos prematuros y fiebre posparto8. Además de estos, la especie Mycoplasma genitalium ha sido reportada como causante de uretritis en hombres y cervicitis mucopurulenta en mujeres9.
Debido a los problemas asociados al tratamiento de diversas infecciones, especialmente la resistencia a los antibióticos, las sustancias vegetales han adquirido nuevas perspectivas, como el creciente interés de su uso en la búsqueda de compuestos antimicrobianos10,11.
El uso de plantas para curar o combatir enfermedades es muy antiguo12, siendo todavía una práctica muy presente en la vida cotidiana de la población. Según datos de la Organización Mundial de la Salud, alrededor del 65 al 80% de la población mundial no tiene acceso a la atención primaria de salud y recurre a la medicina tradicional, especialmente a las plantas medicinales, en busca de alivio para muchas enfermedades10.
Estudios han demostrado que las plantas, incluidas las de uso popular, producen metabolitos activos, que presentan actividades antibacterianas, antihelmínticas, antifúngicas, antivirales, antivirales, antiinflamatorias, antioxidantes, entre otros11 descubrimientos que han hecho de las plantas una de las fuentes para el desarrollo de nuevos fármacos13.
El género Alternanthera (Amaranthaceae) está formado por 80 especies, ampliamente distribuidas por todo el mundo, el 25% de las cuales se encuentran en Brasil14. Son plantas nativas de las regiones costeras y amazónicas. La especie Alternanthera brasiliana (L.) Kuntze es comúnmente conocida como "penicilina", "terramicina" o "doril" y es utilizada en medicina tradicional para el tratamiento de diarrea, cistitis, garganta e infecciones generales15,16. La infusión de sus hojas es considerada diurética, siendo utilizada para enfermedades hepáticas y vesicales17.
Ya el género Phyllanthus (Phyllanthaceae), conocido popularmente como "chancapiedra", se encuentra en Brasil, en toda la región tropical17. Las plantas de ese género, especialmente Phyllanthus niruri L., se recomiendan en la medicina popular para el tratamiento de problemas renales, gastroenteritis, infecciones genitourinarias, hepatitis B y diabetes11,12,14,17,18,19.
Plantago major L. (Plantaginaceae), también conocida como "Llantén", es una hierba pequeña, nativa de Europa y naturalizada en todo el sur de Brasil17. Estudios etnofarmacológicos mostraron que P. major se utiliza en el tratamiento de muchas patologías, como enfermedades de piel, infecciones, problemas digestivos, respiratorios, circulatorios, entre otros20.
Arctostaphylos uva-ursi (L.) Spreng. pertenece a la familia Ericaceae y se utiliza principalmente como antiséptico, antiinflamatorio y en el tratamiento de infecciones del tracto urinario como cistitis, uretritis, disuria y pielonefritis. Esta planta fue introducida, en la práctica médica, en la región de Europa, y sigue siendo uno de los desinfectantes más comunes e importantes del tracto urinario, con respecto a las diferentes especies de hierbas medicinales. Su principal componente medicinal activo es la arbutina, un glucósido fenólico que genera hidroquinona como resultado de la glucólisis, y una pequeña cantidad de hidroquinona libre se encuentra en las hojas. El ácido p-cumárico y el ácido cafeico, también encontrados en la especie, son componentes con propiedades antibacterianas y el ácido salicílico, conocido por su acción antiinflamatoria y bacteriostática21.
Frente a este contexto, los objetivos de este trabajo fueron de evaluar la actividad antibacteriana de A. brasiliana, P. major, A. uva-ursi y P. niruri, plantas medicinales de uso popular, delante de diferentes especies de bacterias causadoras de infecciones urogenitales, bien como analizar sus perfiles cromatográficos. Es importante destacar que este es el primer trabajo que evalúa la actividad antimolicute de esas especies.
MATERIALES Y MÉTODOS
MATERIAL VEGETAL
Partes aéreas de la especie A. brasiliana fueron recolectadas en las casas de los residentes del barrio Água Verde, en la ciudad de Blumenau, Estado de Santa Catarina, Brasil. Luego de la identificación, se archivó una copia en el Herbario Dr. Roberto Miguel Klein, de la Universidad Regional de Blumenau, con el número de registro 36295. Las otras especies de plantas, P. major (Lote: 0040), A. uva-ursi (Lote: 0024) y P. niruri (Lote: 0050), de la marca NatuBlu, fueron adquiridas comercialmente en una farmacia dispensadora en el centro de Blumenau en forma de planta in natura.
En cuanto a la preparación de extractos y fracciones vegetales, la especie A. brasiliana fue sometida a secado a temperatura ambiente y luego molida en un molino de cuchillas. Las otras especies, adquiridas secas, también fueron molidas en un molino de cuchillas. Los productos obtenidos fueron macerados con solución hidroalcohólica al 70% durante siete días. A continuación, los extractos se filtraron y concentraron en un evaporador rotatorio a presión, reducidos a 45 ºC, sin necesidad de liofilización. Los extractos obtenidos fueron sometidos al proceso de partición líquido-líquido con disolventes de diferentes polaridades, con el fin de obtener las fracciones de diclorometano (DCM), acetato de etilo (AcOEt), n-butanol (BuOH) y acuosa (Aq) de cada muestra.
ANÁLISIS CROMATOGRÁFICO
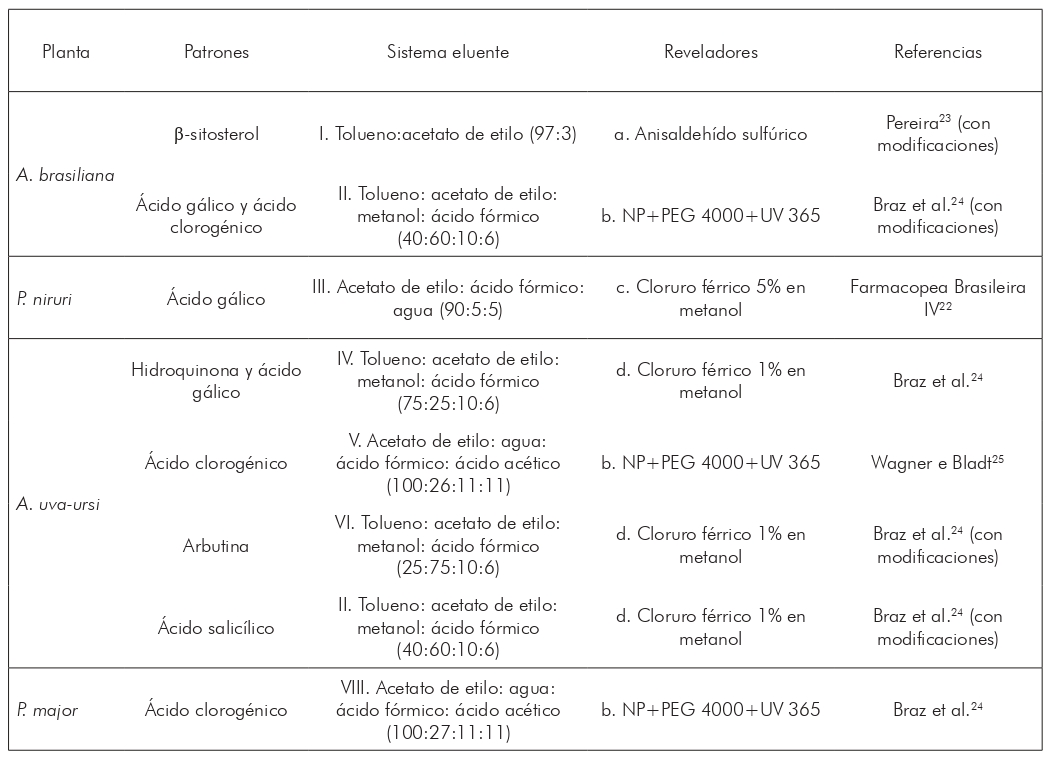
Los extractos y fracciones sometidos a análisis en cromatografía de capa delgada (CCD) fueron seleccionados según los valores de la concentración mínima de inhibición (CIM), con el fin de correlacionar los perfiles cromatográficos con la actividad antibacteriana evidenciada. Los patrones cromatográficos de A. uva-ursi y P. niruri fueron seleccionados de acuerdo con los marcadores de identificación de estas especies, según la Farmacopea Brasileña IV22; los de A. brasiliana, conforme el estudio de Pereira23; y los de P. major, según Braz et al.24. Cerca de 0,015 g de las muestras y patrones fueron pesados y diluidos en 1 ml de metanol, obteniendo una concentración final de 15 mg/ml de cada muestra.
Se utilizaron placas de sílice GF254, de 6x8 cm de tamaño, y tanque de saturación con migración ascendente. Se aplicaron alícuotas de 5 μl de muestras y patrones a las placas, con la ayuda de una pipeta automática. Los sistemas eluentes y agentes cromogénicos utilizados en este estudio fueron seleccionados de acuerdo con la información obtenida previamente de la literatura y se describen en el cuadro 1.
ACTIVIDADES BIOLÓGICAS
Se utilizaron cepas de referencia de molicutes, como M. genitalium (ATCC 33530), M. hominis (ATCC 23114), U. urealyticum (ATCC 27618), y cepas de E. coli (ATCC 25922), S. aureus (ATCC 25923), Proteus mirabilis (ATCC 25933), Klebsiella pneumoniae (ATCC 13883) y S. saprophyticus (ATCC 15305).
Las cepas de molicutes se cultivaron en el Laboratorio de Investigación de Bioanálisis de la Universidad de Blumenau, según Taylor-Robinson26, con modificaciones. Las bacterias con pared celular E. coli, S. aureus, P. mirabilis, K. pneumoniae y S. saprophyticus se cultivaron en agar sangre y se incubaron en un horno a 35 ºC, durante 24 h, en presencia de oxígeno.
Las muestras se disolvieron en agua estéril, con dimetilsulfóxido al 10% (DMSO), y se probaron por el método de microdilución, a la concentración inicial de 2 mg/ml, contra las cepas de bacterias.
La determinación de la actividad antimicrobiana frente a bacterias sin pared celular se probó mediante el método de microdilución en caldo con extractos y fracciones vegetales, según la metodología propuesta por Bebear y Robertson27,con modificaciones. En una placa de microtitulación de fondo plano con 96 pozos, se realizó una dilución en serie de los extractos y fracciones vegetales, en la que, en 100 μl de medio líquido de arginina (MLA), SP4 o medio líquido de urea (U10), se añadieron 100 μl de las muestras de forma individual, procediendo a una serie de diluciones (diluidas en proporción 2). A estas diluciones se añadieron 100 μl de un cultivo de molicutes en la fase de crecimiento log, conteniendo 10³ microorganismos por ml. Como control negativo, se realizó una dilución en serie del propio disolvente (DMSO), sin extracto vegetal; y, como control de viabilidad de la cepa, se realizó una dilución en serie del cultivo de microorganismos, sin la adición de disolvente o extracto vegetal. Finalmente, se agregaron de dos a tres gotas de vaselina a cada pozo para aislar microorganismos del medio externo y crear un ambiente de microaerofilia. Las placas se incubaron a 37 ºC durante al menos 48 h, y el crecimiento se observó, a simple vista, por el cambio de color del medio debido a la presencia del indicador rojo fenol. El CIM se determinó como la concentración correspondiente al pozo anterior adonde fue posible verificar el cambio de color.
La determinación de la actividad antimicrobiana frente a bacterias con pared celular se probó por el método de microdilución en caldo con extractos y fracciones vegetales, según el Clinical and Laboratory Standards Institute28. El CIM se determinó como la concentración correspondiente al pozo anterior a aquel donde fue posible verificar la formación del "botón".
Para el análisis de los resultados de actividad antibacteriana, se llevó en consideración el parámetro establecido por Machado et al.29: para extractos de plantas y fracciones, considerándose activos valores de CIM por debajo de 100 μg/ml; moderadamente activos, valores entre 100 y 500 μg/ml; levemente activos, valores entre 500 y 1.000 μg/ml; y, superior a 1.000 μg/ml, los extractos y fracciones fueron considerados inactivos.
RESULTADOS
Los resultados de la obtención de los extractos hidroalcohólicos (EH) y de las fracciones están en la tabla 1. Conforme los perfiles cromatográficos de las plantas evaluadas (Figura 1), A. brasiliana demostró, en las fracciones DCM y AcOEt, manchas que se asemejan al patrón β-sitosterol, cuando revelados con anisaldehído sulfúrico (Figura 1A). Las manchas de los patrones probados no se observaron en el extracto hidroalcohólico y en las fracciones de esa especie (Figura 1B). Conforme el cromatograma expuesto en la figura 1C, la fracción DCM de A. uva-ursi presentó una mancha característica para terpenos; mientras que el extracto hidroalcohólico y las fracciones AcOEt y BuOH presentaron manchas similares al patrón ácido gálico, cuando revelados con cloruro férrico 1% en metanol. Para la misma especie, los patrones ácido clorogénico y ácido salicílico no fueron observados, conforme el perfil cromatográfico revelado en las figuras 1E y 1F). Las fracciones AcOEt y BuOH de P. niruri demostraron manchas características de compuestos fenólicos (Figura 1G), así como para el extracto hidroalcohólico y la fracción AcOEt de P.major (Figura 1H).
Tabla 1 - Rendimiento del extracto hidroalcohólico y fracciones obtenidos de las especies vegetales analizadas
| Extracto/ Fracciones | Espécies vegetais | |||||||
|---|---|---|---|---|---|---|---|---|
| A. brasiliana | P. niruri | P. major | A. uva-ursi | |||||
| Peso (g) | Rendimiento (%) | Peso (g) | Rendimiento (%) | Peso (g) | Rendimiento (%) | Peso (g) | Rendimiento (%) | |
| EH* | 196,40 | 9,87 | 124,87 | 17,09 | 194,93 | 18,44 | 144,49 | 22,11 |
| DCM† | 0,44 | 2,86 | 1,10 | 6,33 | 0,26 | 0,82 | 1,77 | 6,34 |
| AcOEt† | 0,18 | 1,17 | 1,24 | 7,17 | 0,32 | 1,01 | 8,35 | 29,89 |
| BuOH† | 0,94 | 6,10 | 3,45 | 19,87 | 4,10 | 12,83 | 6,04 | 21,61 |
| Aq† | 9,11 | 59,21 | 9,55 | 55,05 | 17,83 | 55,79 | 9,22 | 32,98 |
* El rendimiento del extracto hidroalcohólico (EH), para cada especie, se calculó en relación a la muestra pulverizada seca. † El rendimiento de las respectivas fracciones (DCM, AcOEt, BuOH, Aq) fue calculado en relación al utilizado en el procedimiento de partición.

A y B: Cromatogramas de A. brasiliana (AB); C, D, E y F: Cromatogramas de A. uva-ursi (AU); G: Cromatograma de P. niruri (PN); H: Cromatogramas de P. major (PM).
Cromatogramas: A - (1) β-sitosterol, (2) Extracto hidroalcohólico AB, (3) Fracción DCM AB, (4) Fracción AcOEt AB, Eluente: I, Revelador: a. B - (5) Ácido gálico, (6) Ácido clorogénico, (2) Extracto hidroalcohólico AB, (3) Fracción DCM AB, (4) Fracción AcOEt AB, Eluente: II, Revelador: b. C - (7) Hidroquinona, (5) Ácido gálico, (8) Extracto hidroalcohólico AU, (9) Fracción DCM AU, (10) Fracción AcOEt AU, (11) Fracción BuOH AU, (12) Fracción Aq AU, Eluente: IV, Revelador: d. D - (13) Arbutina, (8) Extracto hidroalcohólico AU, (9) Fracción DCM AU, (10) Fracción AcOEt AU, (11) Fracción BuOH AU, (12) Fracción Aq AU, Eluente: VI, Revelador: d. E - (6) Ácido clorogénico, (8) Extracto hidroalcohólico, (9) Fracción DCM AU, (10) Fracción AcOEt AU, (12) Fracción Aq AU, Eluente: V, Revelador: b. F - (14) Ácido salicílico, (8) Extracto hidroalcohólico AU, (9) Fracción DCM AU, (10) Fracción AcOEt AU, (11) Fracción BuOH AU, (12) Fracción Aq AU, Eluente: II, Revelador: d. G - (5) Ácido gálico (15), Extracto hidroalcohólico PN, (16) Fracción DCM PN, (17) Fracción AcOEt PN, (18) Fracción BuOH PN, Eluente: III, Revelador: c. H - (6) Ácido clorogénico, (19) Extracto hidroalcohólico PM, (20) Fracción DCM PM, (21) Fracción AcOEt PM, Eluente: VIII, Revelador: b.
Figura 1 - Resultados del análisis cromatográfico de las especies vegetales analizadas
En las pruebas de microdilución realizadas frente a las cepas bacterianas, se verificó, de manera general, una actividad antibacteriana muy parecida entre los extractos y fracciones de las diferentes especies vegetales, mereciendo destaque la actividad de la Fracción AcOEt y extracto hidroalcohólico de A. uva-ursi, con CIM de 31,25 µg/ml y 125 µg/ml, respectivamente, frente a la cepa de S. aureus, conforme demostrado en la tabla 2.
Tabla 2 - Resultados de la evaluación de CIM de las especies vegetales analizadas frente a cepas bacterianas
| Plantas | Microorganismos | |||||||
|---|---|---|---|---|---|---|---|---|
| M. genitalium | M. hominis | U. urealyticum | E. coli | P. mirabilis | K. pneumoniae | S. aureus | S. saprophyticus | |
| A. brasiliana | CIM (µg/mL) | |||||||
| EH | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 |
| DCM | >1.000 | 1.000 | 1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 |
| AcOEt | 1.000 | 1.000 | 1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 |
| BuOH | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 |
| Aq | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 |
| A. uva-ursi | CIM (µg/mL) | |||||||
| EBH | 500 | 1.000 | 1.000 | >1.000 | >1.000 | >1.000 | 125 | 1.000 |
| DCM | 500 | 500 | 500 | >1.000 | >1.000 | >1.000 | 500 | 500 |
| AcOEt | 125 | 500 | 250 | 1.000 | 1.000 | >1.000 | 31,25 | 250 |
| BuOH | 1.000 | >1.000 | 1.000 | >1.000 | >1.000 | >1.000 | 500 | 1.000 |
| Aq | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 |
| P. niruri | CIM (µg/mL) | |||||||
| EH | 500 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 |
| DCM | 1.000 | 500 | 1.000 | >1.000 | >1.000 | >1.000 | 250 | 250 |
| AcOEt | 250 | 1.000 | 1.000 | >1.000 | >1.000 | >1.000 | 500 | 500 |
| BuOH | 500 | >1.000 | 1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 |
| Aq | 1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 |
| P. major | CIM (µg/mL) | |||||||
| EH | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 |
| DCM | 500 | 1.000 | 1.000 | >1.000 | >1.000 | >1.000 | 1.000 | 1.000 |
| AcOEt | 1.000 | 1.000 | 1.000 | >1.000 | >1.000 | >1.000 | 1.000 | 1.000 |
| BuOH | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 |
| Aq | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 | >1.000 |
DISCUSIÓN
Las plantas seleccionadas en esta investigación son muy buscadas por la población como remedio en el tratamiento de las infecciones urinarias, pero ningún estudio ha revelado aún su verdadera actividad antimicrobiana contra las cepas de molicutes.
De acuerdo con los rendimientos porcentuales, se observó que todas las especies presentaban alto rendimiento de Fracción Aq, lo que puede estar relacionado con la presencia mayoritaria de compuestos glicosilados y polímeros30. Estudios cromatográficos sugieren que la especie A. brasiliana presentó menor complejidad química en las fracciones más apolares, demostrando un perfil cuantitativo diferente, en comparación con las especies P. niruri y P. major. Se observa que estas últimas especies mostraron alto rendimiento de Fracción BuOH, mientras que A. uva-ursi mostró buen rendimiento, tanto en las fracciones AcOEt como BuOH.
La especie A. brasiliana estuvo inactiva, tanto para el extracto hidroalcohólico como para las diferentes fracciones verificadas. Frente a las cepas de molicutes, las fracciones DCM y AcOEt estaban inactivas (MIC = 1.000 μg/ml), a excepción de la cepa M. genitalium, que no tuvo su crecimiento inhibido en presencia de Fracción DCM. El extracto hidroalcohólico y las otras fracciones eran inactivos. No se evidenció ninguna actividad contra las diversas especies de bacterias con pared celular. Este resultado está en línea con el evidenciado por Coutinho et al.31, que probaron el extracto etanólico de las hojas de A. brasiliana contra cepas de E. coli, S. aureus y Pseudomonas aeruginosa, y también se consideró inactivo ante los parámetros de Machado et al.29.
Se han realizado varios estudios en la búsqueda de efectos antimicrobianos de esta especie vegetal, ya que se la conoce popularmente como "penicilina". Sin embargo, no se realizó ningún estudio con bacterias sin pared celular (molicutes). Pereira et al.32 evaluaron el extracto hidroalcohólico y la Fracción AcOEt de A. brasiliana y se encontraron valores de MIC = 1.250 μg/ml, contra S. aureus, y CIM > 2.500 μg/ml, contra E. coli y P. aeruginosa. No se evidenció actividad contra el hongo Saccharomyces cerevisiae, contra el cual el extracto hidroalcohólico fue fungistático y fungicida a una concentración de 625 μg/ml.
La ausencia de actividad antimicrobiana de A. brasiliana, reportada en el presente estudio y en trabajos anteriores, no corrobora los efectos terapéuticos reportados por el uso popular15,16,17. Este hecho puede explicarse probablemente por el hecho de que esta especie no está relacionada con la lucha contra microorganismos a través de efectos bacteriostáticos o bactericidas, sino por su acción antiinflamatoria32. El análisis fitoquímico cualitativo de diferentes extractos de A. brasiliana reveló la presencia de compuestos como carbohidratos, alcaloides, saponinas, flavonoides, fenoles, taninos y proteínas33. Los polifenoles, flavonoides y ácidos fenólicos tienen varias funciones, tales como actividad antioxidante, acción hormonal, estimulación enzimática y propiedades antibacterianas33,34. Además de estos, se reportaron la acción antiinflamatoria y la presencia de compuestos con posible acción analgésica, lo que contribuiría al alivio de los síntomas de los procesos infecciosos y podría llevar a la idea de una posible acción antibacteriana33,35. También puede haber inhibición de la formación de biopelículas, debido a un impedimento de la captación de estos microorganismos en superficies biológicas, como el arándano (Vaccinium macrocarpon)36. Las biopelículas corresponden a una asociación entre células bacterianas, formando una matriz multicelular, que puede adherirse a superficies biológicas y no biológicas. Son sistemas complejos y dinámicos, que presentan un modo de crecimiento protegido contra las defensas del huésped, así como la acción de los antibióticos, además de permitir que los ICMrorganismos sobrevivan en ambientes hostiles37,38. Tales hipótesis podrían justificar el uso de esta planta como medicina por parte de la población en procesos infecciosos in vivo.
En relación a bacterias con pared celular, Fracción AcOEt de A. uva-ursi fue capaz de inhibir el crecimiento de S. aureus a una concentración de 31,25 μg/ml, una excelente actividad que corresponde al mejor resultado de este estudio. El extracto hidroalcohólico presentó MIC = 125 μg/ml, seguido de fracciones de DCM y Buoh con MIC = 500 μg/ml, caracterizando actividad moderada. A la vista de los resultados, la fracción AcOEt fue más activa en relación al extracto hidroalcohólico y a otras fracciones. Según estudios de Cechinel Filho y Yunes30, esta fracción concentra un gran número de metabolitos secundarios, tales como flavonoides, taninos, saponinas, ácidos triterpénicos y compuestos fenólicos, incluyendo hidroquinona24. Sin embargo, se cree que algunos de los metabolitos secundarios concentrados en la fracción AcOEt pueden estar contribuyendo a la mejor actividad. Por otra parte, el alto rendimiento de esta fracción puede ser un dato interesante para estudios posteriores39. En estudios in vitro, citados por Blumenthal et al.40, se ha demostrado que los preparados a base de A. uva-ursi también tienen actividad antibacteriana frente a Proteus vulgaris, E. coli, U. urealyticum, M. hominis, S. aureus, P. aeruginosa, Enterococcus faecalis y Candida albicans.
En relación a la especie P. niruri, la fracción AcOEt presentó actividad antibacteriana moderada, con valores de CIM = 250 µg/ml, frente a la cepa M. genitalium. Contra S. aureus, las fracciones DCM y AcOEt presentaron actividad antibacteriana moderada, con CIM = 250 µg/ml y 500 µg/ml, respectivamente. P. niruri ha demostrado actividad antibacteriana in vitro contra Staphylococcus, Micrococcus y Pasteurella, bien como actividad antimalárica in vivo. Otras especies del género, como P. burchellii y P. parvulus, mostraron actividad contra E. coli, P. mirabilis, P. aeruginosa, Klebsiella oxytoca, Serratia marcescens y Bacillus subtilis (CIM ± 5 mg/ml)18. En un estudio realizado por Sumathi y Parvathi41, el CIM del extracto de las hojas de P. niruri fue de 50 μg/ml frente a Salmonella enterica sorovar Typhi y S. aureus, resultados que justifican el uso popular de esta planta para el tratamiento de la gastroenteritis. La actividad antimicrobiana de los extractos etanólicos y acetónicos de P. niruri también fue probada por el método de difusión de disco por Divya et al.42, que mostró zonas de inhibición efectiva de extractos contra aislados de Staphylococcus sp., E. coli, Pseudomonas sp. y Bacillus sp. Este resultado se debe a la presencia de taninos, flavonoides y compuestos fenólicos encontrados en la especie vegetal42. El etanol extracto de las hojas de P. niruri mostró alta actividad contra K. pneumoniae (18 mm), P. aeruginosa (16 mm) y P. mirabilis (26 mm), siendo este último superior al control positivo (23 mm)43.
P. major presentó valores de MIC inactivos contra las cepas probadas. Los resultados obtenidos para la especie son similares a los reportados en la literatura, ya que la evidencia de actividad antimicrobiana sólo fue posible en extractos con alta concentración de compuestos bioactivos. Metiner et al.44 analizaron la actividad antimicrobiana, utilizando el método de microdilución, y verificaron que el extracto acetónico era inactivo contra Bacillus cereus, con MIC = 3.562 μg/ml, así como contra las cepas de B. subtilis, P. mirabilis, P. aeruginosa y Staphylococcus epidermidis, con MIC = 28.500 μg/ml. El extracto etanólico también fue inactivo contra E. coli y B. cereus con MIC = 12.500 μg/ml. En los estudios de Okmen45, el extracto metanólico de P. major fue inactivo (MIC = 1.625 μg/ml) contra diferentes cepas de S. aureus.
El análisis cromatográfico mostró que la especie A. brasiliana presenta un metabolito con Rf similar al β-sitosterol (Rf = 0,17) en las fracciones DCM y AcOEt, con Rfs ~ 0,18, como se muestra en la figura 1A. En la composición de esta especie, se destacan los fitoesteroles, como el estigmasterol, el β-sitosterol y el espinaterol. Tales sustancias se encuentran comúnmente en verduras, y el estigmasterol y el β-sitosterol son los esteroides principales presentes en membranas celulares de la planta. Estudios previos realizados con el β-sitosterol han demostrado un efecto analgésico y antiinflamatorio significativo32. En la figura 1B no se observó la presencia de compuestos activos similares al ácido gálico (Rf = 0,56) y al ácido clorogénico (Rf = 0,11), utilizados como patrones en las muestras analizadas. Otros estudios demuestran la presencia de compuestos fenólicos46 y flavonoides47,compuestos conocidos por su efecto antibacteriano48.
Romm et al.21 sugirió que la actividad antimicrobiana de la especie A. uva-ursi está relacionada con la presencia de arbutina y su aglicona, hidroquinona. Además, según la Farmacopea Brasileña IV22, estos compuestos son considerados estándares de calidad para la identificación de esta especie. Sin embargo, de acuerdo con el perfil cromatográfico mostrado en las figuras 1C y 1D), no fue posible observar la presencia de compuestos similares a la hidroquinona/Rf = 0,40 y la arbutina/Rf = 0,24 en las muestras analizadas. Esta planta destaca por su alto contenido en glucósido de fenoles simples, siendo el principal la arbutina, cuyo contenido oscila entre el 6 y el 10%48. Braz et al.24 se demostró la presencia de hidroquinona en la fracción AcOEt de A. uva-ursi mediante CCD y en las mismas condiciones del presente estudio.
El bajo contenido o ausencia de estos compuestos en las especies vegetales analizadas puede atribuirse, por ejemplo, a la época del año en que se recogió la planta, a los procedimientos de secado y almacenamiento48, o incluso por un posible intercambio de especies. Esta última hipótesis fue descartada, ya que la autenticidad de la especie fue confirmada por parámetros de la Farmacopea Brasileña IV22. Otra hipótesis puede estar relacionada con la estabilidad de los compuestos fenólicos, que son fácilmente oxidables tanto a través de enzimas vegetales específicas, como por la influencia de la luz y el calor. La hidroquinona, por ejemplo, es un compuesto fácilmente fotodegradable y presenta alta reactividad química, y puede sufrir oxidación, dependiendo de las condiciones de temperatura, pH y presencia de oxígeno en el medio, además de las formas de almacenamiento, que no se presentan en muestras adquiridas comercialmente48,49. Además, se enfatiza la sensibilidad del método como factor de interferencia. En el análisis por CCD, los compuestos identificados suelen presentarse en mayor cantidad en los vegetales (mayoría). Las técnicas analíticas más sensibles pueden ayudar a detectar compuestos en las minorías presentes.
La especie A. uva-ursi también se caracteriza por el alto contenido de taninos, derivados del ácido gálico, y su concentración puede ser superior al 10%48. Por esta razón, también se investigó la presencia de este compuesto en las muestras, que, en la metodología utilizada (Cuadro 1), aparece en Rf = 0,12 (Figura1C). El análisis cromatográfico mostró que un metabolito similar al ácido gálico está presente en el extracto hidroalcohólico, en la fracción DCM y AcOEt, y puede ser uno de los factores responsables de la actividad antibacteriana evidenciada en la presente muestra. Además, no hubo presencia de compuestos similares al ácido clorogénico (Rf= 0,55) y al ácido salicílico (Rf= 0,74), compuestos conocidos por su acción antiinflamatoria y bacteriostática21 (Figuras1E y 1F, respectivamente).
El perfil cromatográfico de P. niruri se muestra en la (Figura 1G). Los resultados revelaron la presencia de un metabolito similar al ácido gálico (Rf = 0,73) en las fracciones AcOEt y BuOH, lo que puede haber contribuido a la actividad moderada evidenciada contra M. genitalium. El análisis fitoquímico de esta planta, en estudios previos, registró la presencia de varios flavonoides, triterpenos, lignanos, fenoles y taninos. Sin embargo, todavía existen pocos estudios que correlacionen la actividad de las plantas con una sola sustancia o al efecto sinérgico entre los diferentes constituyentes17,18.
Los resultados del perfil cromatográfico de P. major se muestran en la (Figura 1H). Es posible verificar una tinción similar al patrón de ácido clorogénico (Rf = 0,42), sugiriendo la presencia del metabolito en el extracto hidroalcohólico y en la Fracción AcOEt. Braz et al.24 evidenciaron la presencia de ácido clorogénico y ácido cafeico en la Fracción AcOEt de P. major.
Debido a los pocos informes en la literatura sobre la acción de las plantas medicinales contra las especies molicutes y la búsqueda de mejores resultados frente a bacterias con pared celular, los datos encontrados pueden ayudar a obtener moléculas farmacológicamente activas y dilucidar el uso de plantas con fines terapéuticos, así como la Fracción AcOEt de A. uva-ursi, que presentó una excelente actividad antibacteriana (31,25 μg/mL) frente a la cepa de S. aureus.
CONCLUSIÓN
No fue posible establecer una relación estrecha entre el uso popular, la actividad antibacteriana in vitro y el perfil fitoquímico de las plantas, una vez que los efectos antibacterianos de las especies vegetales estudiadas variaron frente a las diferentes especies de bacterias, y, en la mayoría de los casos, fueron considerados inactivos. Los resultados de este estudio destacaron que la especie A. brasiliana, a pesar de ser conocida popularmente como "penicilina", un potente antibiótico de la clase de los β-lactámicos, no tiene cualquier actividad antibacteriana contra las cepas probadas in vitro.
Otro resultado relevante fue que la fracción AcOEt, obtenida de A. uva-ursi, demostró una excelente actividad contra S. aureus, lo que, según datos de la literatura, debería estar relacionado a la presencia de compuestos como arbutina e hidroquinona. Sin embargo, en el análisis cromatográfico, los compuestos no se encontraron, sugiriendo, así, la existencia de más compuestos responsables por esa actividad.
REFERENCIAS
1 Vogel NW, Taschetto APD, Dall'Agnol R, Weidlich L, Ethur EM. Assessment of the antimicrobial effect of three plants used for therapy of community-acquired urinary tract infection in Rio Grande do Sul (Brazil). J Ethnopharmacol. 2011 Oct;137(3):1334-6. [ Links ]
2 Mielle Filho A. Síndromes clínicas. In: Albini CA, Souza HAPHM, Silveira ACO, organizadores. Infecções urinárias: uma abordagem multidisciplinar. Curitiba: CRV; 2012. [ Links ]
3 Santos Filho L. Epidemiologia e etiologia das infecções do trato urinário. In: Albini CA, Souza HAPHM, Silveira ACO, organizadores. Infecções urinárias: uma abordagem multidisciplinar. Curitiba: CRV; 2012. [ Links ]
4 Cordova SM, Benfatti CS, Magina MDA, Guedes A, Cordova CMM. Análise da atividade antimicrobiana de extratos isolados de plantas nativas da flora brasileira frente a Mycoplasma arginini, M. hominis e Ureaplasma urealyticum. Rev Bras Anal Clin. 2010;42(4):241-4. [ Links ]
5 Cordova CMM, Cunha RAF. Detecção de Mycoplasma genitalium, M. fermentans e M. penetrans em pacientes com sintomas de uretrite e em indivíduos infectados pelo HIV-1 no Brasil. J Bras Patol Med Lab. 2002;38(2):111-8. [ Links ]
6 Silveira ACO. Uropatógenos incomuns. In: Albini CA, Souza HAPHM, Silveira ACO, organizadores. Infecções urinárias: uma abordagem multidisciplinar. Curitiba: CRV; 2012. [ Links ]
7 Benfatti CS, Cordova SM, Guedes A, Magina MDA, Cordova CMM. Atividade antibacteriana in vitro de extratos brutos de espécies de Eugenia sp frente a cepas de molicutes. Rev Pan-Amaz Saude. 2010 jun;1(2):33-9. [ Links ]
8 Daxboeck F, Zitta S, Stadler M, Iro E, Krause R. Mycoplasma hominis and Ureaplasma urealyticum in patients with sterile pyuria. J Infect. 2005 Jul;51(1):54-8. [ Links ]
9 Kataoka S, Yamada T, Chou K, Nishida R, Morikawa M, Minami M, et al. Association between preterm birth and vaginal colonization by mycoplasmas in early pregnancy. J Clin Microbiol. 2006 Jan;44(1):51-5. [ Links ]
10 Yunes RA, Calixto JB. Plantas medicinais sob a ótica da química medicinal moderna: métodos de estudo, fitoterápicos e fitofármacos, biotecnologia, patente. Chapecó: Argos; 2001. (Série didática). [ Links ]
11 Muraina IA, Picard J, Eloff JN. Development of a reproducible method to determine minimum inhibitory concentration (MIC) of plant extract against a slow-growing mycoplasmas organism. Phytomedicine. 2009 Mar;16(2-3):262-4. [ Links ]
12 Ekwenye UN, Njoku NU. Antibacterial effect of Phyllanthus niruri (Chanca Piedra) on three enteropathogens in man. Int J Mol Med Adv Sci. 2006;2(2):184-9. [ Links ]
13 Chin YW, Balunas MJ, Chai HB, Kinghorn AD. Drug discovery from natural sources. AAPS J. 2006 Jun;8(2):E239-53. [ Links ]
14 Delaporte RH, Milaneze MA, Mello JCP, Jacomassi E. Estudo farmacognóstico das folhas de Alternanthera brasiliana (L.) Kuntze (Amaranthaceae). Acta Farm Bonaerense. 2002;21(3):169-74. [ Links ]
15 Caetano N, Saraiva A, Pereira R, Carvalho D, Pimentel MCB, Maia MBS. Determinação de atividade antimicrobiana de extratos de plantas de uso popular como antiflamatório. Rev Bras Farmacogn. 2002;12 supl 1:132-5. [ Links ]
16 Souza GC, Haas APS, von Poser GL, Schapoval EES, Elisabetsky E. Ethnopharmacological studies of antimicrobial remedies in the south of Brazil. J Ethnopharmacol. 2004 Jan;90(1):135-43. [ Links ]
17 Lorenzi H, Matos FJA. Plantas medicinais no Brasil: nativas e exóticas. Nova Odessa: Instituto Plantarum; 2002. [ Links ]
18 Mdlolo CM, Shandu JS, Oyedeji OA. Phytochemical constituents and antimicrobial studies of two South African Phyllanthus species. Afr J Biotechnol. 2008 Mar;7(5):639-43. [ Links ]
19 Calixto JB, Santos AR, Cechinel Filho V, Yunes RA. A review of the plants of the genus Phyllanthus: their chemistry, pharmacology, and therapeutic potential. Med Res Rev. 1998 Jul;18(4):225-58. [ Links ]
20 Samuelsen AB. The traditional uses, chemical constituents and biological activities of Plantago major L. A review. J Ethnopharmacol. 2000 Jul;71(1-2):1-21. [ Links ]
21 Romm A, Hardy ML, Mills S. Uva ursi. In: Botanical medicine for women's health. Amsterdam: Elsevier; 2010. p. 547-9. [ Links ]
22 Farmacopeia Brasileira. 4. ed. São Paulo: Atheneu; 2004. Acompanha as atualizações de 1996 e 2002. [ Links ]
23 Pereira DF. Morfoanatomia e histoquímica comparativa entre Alternanthera brasiliana (L.) Kuntze e Alternanthera dentata (Moench) Stuchlik; estudo fitoquímico e biológico de Alternanthera brasiliana [dissertação]. Santa Maria (RS): Universidade Federal de Santa Maria; 2007. [ Links ]
24 Braz R, Wolf LG, Lopes GC, Mello JCP. Quality control and TLC profile data on selected plant species commonly found in the Brazilian market. Rev Bras Farmacogn. 2012 Sep-Oct;22(5):1111-8. [ Links ]
25 Wagner H, Bladt S. Plant drug analysis: a thin layer chromatography atlas. 2nd ed. New York: Springer; 1996. [ Links ]
26 Taylor-Robinson D. Diagnosis of sexually transmitted diseases. In: Tully JG, Razin S, editors. Molecular and diagnostic procedures in mycoplasmology. Vol. 2. San Diego: Academic Press; 1996. p. 225-36. [ Links ]
27 Bebear C, Robertson J. Determination of the minimal inhibitory concentration. In: Tully JG, Razin S, editors. Molecular and diagnostic procedures in mycoplasmology. San Diego: Academic Press ; 1996. p. 189-97. [ Links ]
28 Clinical and Laboratory Standards Institute. Normas de desempenho para testes de sensibilidade antimicrobiana; 15º suplemento informativo. Wayne: CLSI; 2005. 177 p. (CLSI document, M100-S15; vol. 25, nº. 1). [ Links ]
29 Machado KE, Cechinel-Filho V, Tessarolo ML, Mallmann R, Meyre-Silva C, Cruz AB. Potent antibacterial activity of eugenia umbelliflora. Pharm Biol. 2005;43(7):636-9. [ Links ]
30 Cechinel Filho V, Yunes RA. Estudo químico de plantas medicinais orientado para a análise biológica. Obtenção, determinação e modificação estrutural de compostos bioativos. In: Yunes RA, Calixto JB, editores. Plantas medicinais sob a ótica da química medicinal moderna: métodos de estudo, fitoterápicos e fitofármacos, biotecnologia, patente. Chapecó: Argos; 2001. p. 53. (Série didática). [ Links ]
31 Coutinho HDM, Oliveira-Tintino CDM, Tintino SR, Pereira RLS, Freitas TS, Silva MAP, et al. Toxicity against drosophila melanogaster and antiedematogenic and antimicrobial activities of Alternanthera brasiliana (L.) Kuntze (Amaranthaceae). Environ Sci Pollut Res. 2018 Apr;25(11):10353-61. [ Links ]
32 Pereira DF, Santos M, Pozzatti P, Alves SH, Campos MMA, Athayde ML. Antimicrobial activity of a crude extract and fractions from Alternanthera brasiliana (L.) O. Kuntze leaves. Lat Am J Pharm. 2007;26(6):893-6. [ Links ]
33 Pratap CR. Analysis of proximate, phytochemical, elemental compositions and antioxidant property of leaf of Alternanthera brasiliana (L.) Kuntze. MOJ Food Process Technol. 2017;4(3):74-9. [ Links ]
34 Mohammed SY, Sule MS. Potency of partially purified anthocyanin from leaf extract of Guiera senegalensis against carbon tetrachloride - induced lipoperoxidation in rats. Bayero J Pure Appl Sci. 2009 Dec;2(2):155-8. [ Links ]
35 Macedo AF, Lage CL, Esquibel MA, Souza MM, Silva KL, Niero R, et al. Preliminary phytochemical and pharmacological studies on plantlets of Alternanthera brasiliana cultured under different spectral quality of lights. Acta Farm Bonaerense. 2004;23(4):515-9. [ Links ]
36 LaPlante KL, Sarkisian SA, Woodmansee S, Rowley DC, Seeram NP. Effects of cranberry extracts on growth and biofilm production on Escherichia coli and Staphylococcus species. Phytother Res. 2012 Sep;26(9):1371-4. [ Links ]
37 Fux CA, Costerton JW, Stewart PS, Stoodley P. Survival strategies of infectious biofilms. Trends Microbiol. 2005 Jan;13(1):34-40. [ Links ]
38 Branda SS, Vik A, Friedman L, Kolter R. Biofilms: the matrix revisited. Trends Microbiol. 2005 Jan;13(1):20-6. [ Links ]
39 Vučić DM, Petković MR, Rodić-Grabovac BB, Vasić SM, Čomić LR. In vitro efficacy of extracts of Arctostaphylos uva-ursi L. on clinical isolated Escherichia coli and Enterococcus faecalis strains. Kragujevac J Sci. 2013;35:107-13. [ Links ]
40 Blumenthal M, Goldberg A, Brinckmann J, editors. Herbal medicine: expanded Commission E monographs. Massachusetts: Integrative Medicine Communications; 2000. [ Links ]
41 Sumathi P, Parvathi A. Antimicrobial activity of some traditional medicinal plants. J Med Plant Res. 2010 Feb;4(4):316-21. [ Links ]
42 Divya KS, Duth AG, Chauhan JB. A study on the phytochemical and antibacterial activity of Phyllanthus niruri against the isolates of poultry feeds. J Pharmacogn Phytochem. 2018;7(3):910-6. [ Links ]
43 Nivetha S, Vetha RD. Antimicrobial studies on ethanolic extracts of Phyllanthus niruri. J Chem Pharm Res. 2015;7(6):103-6. [ Links ]
44 Metiner K, Ozkan O, AK S. Antibacterial effects of ethanol and acetone extract of Plantago major L. on gram positive and gram negative bacteria. Kafkas Univ Vet Fak Derg. 2012;18(3):503-5. [ Links ]
45 Okmen AS. Antioxidant and antibacterial activities of different plants extracts against Staphylococcus aureus isolated from soccer player's shoes and knowledge and applications about foot hygiene of the soccer players. Afr J Tradit Complement Altern Med. 2015;12(3):143-9. [ Links ]
46 Souza MM, Kern P, Floriani AEO, Cechinel-Filho V. Analgesic properties of a hydroalcoholic extract obtained from Alternanthera brasiliana. Phytother Res. 1998 Dec;12(4):279-81. [ Links ]
47 Brochado CO, Almeida AP, Barreto BP, Costa LP, Ribeiro LS, Pereira RLC, et al. Flavonol robinobiosides and rutinosides from Alternanthera brasiliana (Amaranthaceae) and their effects on lymphocyte proliferation in vitro. J Braz Chem Soc. 2003 May-Jun;14(3):449-51. [ Links ]
48 Simões CMO, Schenkel EP, Gosmann G, Mello JCP, Mentz LA, Petrovick PR, organizadores. Farmacognosia: da planta ao medicamento. 5. ed. rev. ampl. Porto Alegre/Florianópolis: Editora da UFRGS / Editora da UFSC; 2003. [ Links ]
49 OECD SIDS. Hydroquinone, CAS Nº: 123-31-9. UNEP Publications. 2002 [cited 2013 Apr 20]. Available from: https://hpvchemicals.oecd.org/UI/handler.axd?id=7ca97271-99ed-4918-90e0-5c89d1ce200c. 309 p. [ Links ]
Cómo citar este artículo / How to cite this article: Spézia FP, Siebert D, Tenfen A, Cordova CMM, Alberton MD, Guedes A. Evaluación de la actividad antibacteriana de plantas medicinales de uso popular: Alternanthera brasiliana (Alternantera), Plantago major (Llantén), Arctostaphylos uva-ursi (Uva-ursi) y Phyllanthus niruri (Chancapiedra). Rev Pan Amaz Saude. 2020;11:e202000127. Doi: http://dx.doi.org/10.5123/S2176-6223202000127
Recibido: 01 de Noviembre de 2018; Aprobado: 25 de Junio de 2019











 texto em
texto em