INTRODUÇÃO
A emergência do vírus Zika (Zika virus - ZIKV) nas Américas, que afetou gravemente o nordeste do Brasil no primeiro semestre de 2015, revelou a ocorrência de malformações congênitas durante a gestação, levando à necessidade do monitoramento integrado com outros patógenos mais frequentemente relacionados às infecções intrauterinas1. As evidências acumuladas dos estudos clínicos, particularmente os conduzidos no Brasil, embasaram os pesquisadores norte-americanos do Centers for Disease Control and Prevention que reconheceram a relação causal entre a ocorrência da microcefalia e outros danos cerebrais identificados em fetos com o vírus Zika2,3.
Atualmente, tem sido registrada uma série de alterações entre neonatos: microcefalia, desproporção crânio facial, espasticidade, convulsões, irritabilidade e anomalias cerebrais detectadas por exames de neuroimagem4. Tais mudanças atribuíveis à infecção pelo ZIKV, durante a gestação, podem sugerir uma síndrome congênita semelhante à da rubéola congênita ou infecção por citomegalovírus5,6. A avaliação desses recém-nascidos evidenciou que o ZIKV, além de ser neurotrópico, apresenta também tropismo para outros órgãos, como fígado e coração, além das alterações visuais e auditivas importantes7.
As pesquisas clínicas atuais constataram que outras anormalidades podem ser identificadas ao nascer, além da microcefalia, como a desproporção crânio-caudal, artrogripose (contraturas articulares conjuntas) e anormalidades do sistema nervoso central (calcificações e atrofias cerebrais, alargamento ventricular e hipoplasia de estruturas cerebrais)8,9. Observou-se ainda, no seguimento das crianças expostas intraútero ao ZIKV, a presença de anormalidades no desenvolvimento e crescimento, como hipertonicidade, clônus, hiper-reflexia, movimentos anormais, espasticidade, contraturas e convulsões, justificando a recomendação vigente do Ministério da Saúde de seguimento dessas crianças até os 3 anos de idade por equipe multiprofissional6,8,9.
Diante desses achados e da escassez de dados clínicos e epidemiológicos na Região Norte, o presente estudo se propõe a identificar as alterações clínicas e de imagens, precoces e tardias, em crianças expostas intraútero à infecção por ZIKV. Sob essa perspectiva, buscar-se-á, por meio do acompanhamento clínico e laboratorial, uma abordagem multiprofissional com ênfase na investigação do desenvolvimento neuropsicomotor, da visão e da audição, para a obtenção de mais informações sobre a infecção materno-fetal.
MATERIAIS E MÉTODOS
A presente pesquisa teve caráter prospectivo, longitudinal, com seguimento de crianças expostas intraútero ao ZIKV, na Região Metropolitana de Belém, no período de agosto de 2017 a julho de 2018. As atividades da pesquisa (avaliação clínica, coleta de sangue e avaliações especializadas) foram realizadas no Instituto Evandro Chagas, campus Belém. Este estudo foi estruturado e executado seguindo os preceitos da Declaração de Helsinque e do Código de Nuremberg, além de respeitadas as Normas de Pesquisa Envolvendo Seres Humanos, segundo a Resolução n° 466/12 do Conselho Nacional de Saúde, após aprovação pelo Comitê de Ética em Pesquisa do Instituto Evandro Chagas, com parecer n° 2.288.316, em 19 de agosto de 2017. Todos os responsáveis dos indivíduos envolvidos na pesquisa apresentaram o Termo de Consentimento Livre e Esclarecido assinado.
Precedendo este estudo, realizou-se a investigação de 308 grávidas com exantema e suspeita de infecção pelo ZIKV, as quais foram encaminhadas ao Instituto Evandro Chagas no período de novembro de 2015 a dezembro de 2017, sendo realizado seguimento clínico, após a confirmação laboratorial de infecção pelo ZIKV, em 134 grávidas e, dessas, 109 foram acompanhadas até o final da gravidez, contudo com os resultados ainda sob análise e que deverão contribuir para esclarecer as diferenças macrorregionais. Do total de nascidos vivos desse grupo, 92 foram selecionados para a pesquisa atual, a partir dos critérios de inclusão e por residirem na área metropolitana de Belém. Foram excluídas da pesquisa as crianças cujas responsáveis não consentiram em participar do estudo ou que desistiram durante sua realização, além daquelas as quais não foi possível o seguimento no decorrer da pesquisa.
Para a avaliação clínica detalhada de cada criança, incluindo a identificação e a descrição de malformações dos recém-nascidos e/ou lactentes, foram adotadas as definições do protocolo de Orientações Integradas de Vigilância e Atenção à Saúde no âmbito da Emergência de Saúde Pública de Importância Nacional6. O protocolo utilizado na pesquisa seguiu o questionário de investigação para microcefalia do Ministério da Saúde, presente no Protocolo de Vigilância e Resposta à Ocorrência de Microcefalia do Ministério da Saúde - Versão 1.3 de 201610.
Nesse grupo, foram realizadas avaliações clínicas de crianças previamente agendadas, seguindo um fluxograma, com intervalo de dois a três meses, para crianças de até 1 ano de idade, e intervalo de seis meses a partir de 2 anos de idade. Do total de consultas clínicas pediátricas realizadas no período de acompanhamento, a média foi de 5,7 consultas para cada criança. Na primeira consulta, foi realizada a avaliação clínica com um exame físico detalhado, com registro das medidas antropométricas (peso, altura, perímetro cefálico, perímetro torácico), investigação de anomalias congênitas, de ocorrência de convulsões e de outras complicações do período neonatal, avaliação das funções neurológicas e de desenvolvimento neurocognitivo, rastreamento dos testes de triagem neonatal, com ênfase na triagem auditiva neonatal - TAN (teste da orelhinha) e na triagem ocular neonatal - TON (teste do olhinho) e avaliação da carteira de vacinação. Quando necessário, foram solicitados exames laboratoriais específicos para o ZIKV e diagnóstico diferencial para os vírus Dengue (Dengue virus - DENV) e Chikungunya (Chikungunya virus - CHIKV), além dos agentes TORCHS (toxoplasmose, outras infecções, rubéola, infecção por citomegalovírus, herpes e sífilis).
Para a extração do RNA total dos 45 (28,9%) sangues/soros e um (1,1%) sangue de cordão umbilical, foi utilizada a plataforma de extração Maxwell (Promega), seguindo-se o protocolo do fabricante. A detecção do genoma viral foi realizada segundo o método descrito por Domingo et al.11. Essa metodologia molecular é recomendada na investigação de recém-nascidos expostos intraútero ao ZIKV, para confirmar infecção congênita.
O ensaio imunoenzimático (ELISA), para a detecção de anticorpos IgM anti-ZIKV, DENV e CHIKV, foi realizado em 64 (69,56%) soros, conforme Martin et al.12, e em 92 soros para os agentes TORCHS. Para a detecção dos antígenos virais nos 15 fragmentos placentários, empregou-se o teste de imunohistoquímoca (IHQ)13. Além disso, uma criança com características de microcefalia pós-natal realizou reação em cadeia da polimerase via transcriptase reversa (RT-PCR), por ter apresentado exames para ZIKV negativos.
Após essa etapa, a avaliação neurológica era indicada em caso de alteração no exame físico e/ou observações dos responsáveis, para posterior indicação de exames de imagem - tomografia computadorizada (TC) de crânio e ressonância magnética (RM) de crânio, além de ultrassom transfontanela (USG) e eletroencefalograma (EEG). Esses exames foram distribuídos de acordo com a indicação neuropediátrica e disponibilidade nos serviços públicos/privados.
Vale ressaltar que, se durante as consultas pediátricas fosse constatado que a criança não realizou algum teste de triagem neonatal (TAN e TON), o presente estudo promoveu avaliações em grupos (mutirões), com profissionais e serviços especializados, para a realização do mapeamento de retina (MR) e avaliação otorrinolaringológica.
A estatística analítica foi utilizada para avaliar os resultados das variáveis categóricas da amostra, por meio dos testes Qui-Quadrado Aderência, para tabelas univariadas, e Qui-Quadrado Partição, para a tabela dos achados clínicos por trimestre de gestação. As estatísticas descritiva e analítica foram realizadas no software BioEstat® v5.4.
RESULTADOS
Do total de crianças inclusas na pesquisa, 55 (59,8%) eram meninos e 37 (40,2%) meninas, não encontrando diferença significante (p = 0,0763) na proporção entre os sexos.
Em relação à idade gestacional de exposição ao vírus, identificou-se que a maioria das mães foi infectada no segundo trimestre de gestação (50,0%; n = 46), conforme a figura 1A, com incidência significante de exposição ao vírus nesse período (p = 0,0028). Contudo, na relação entre incidência de alterações clínicas identificadas durante o seguimento e o trimestre gestacional de infecção por esse arbovírus, não se observou diferença de significância estatística (p = 0,8727).
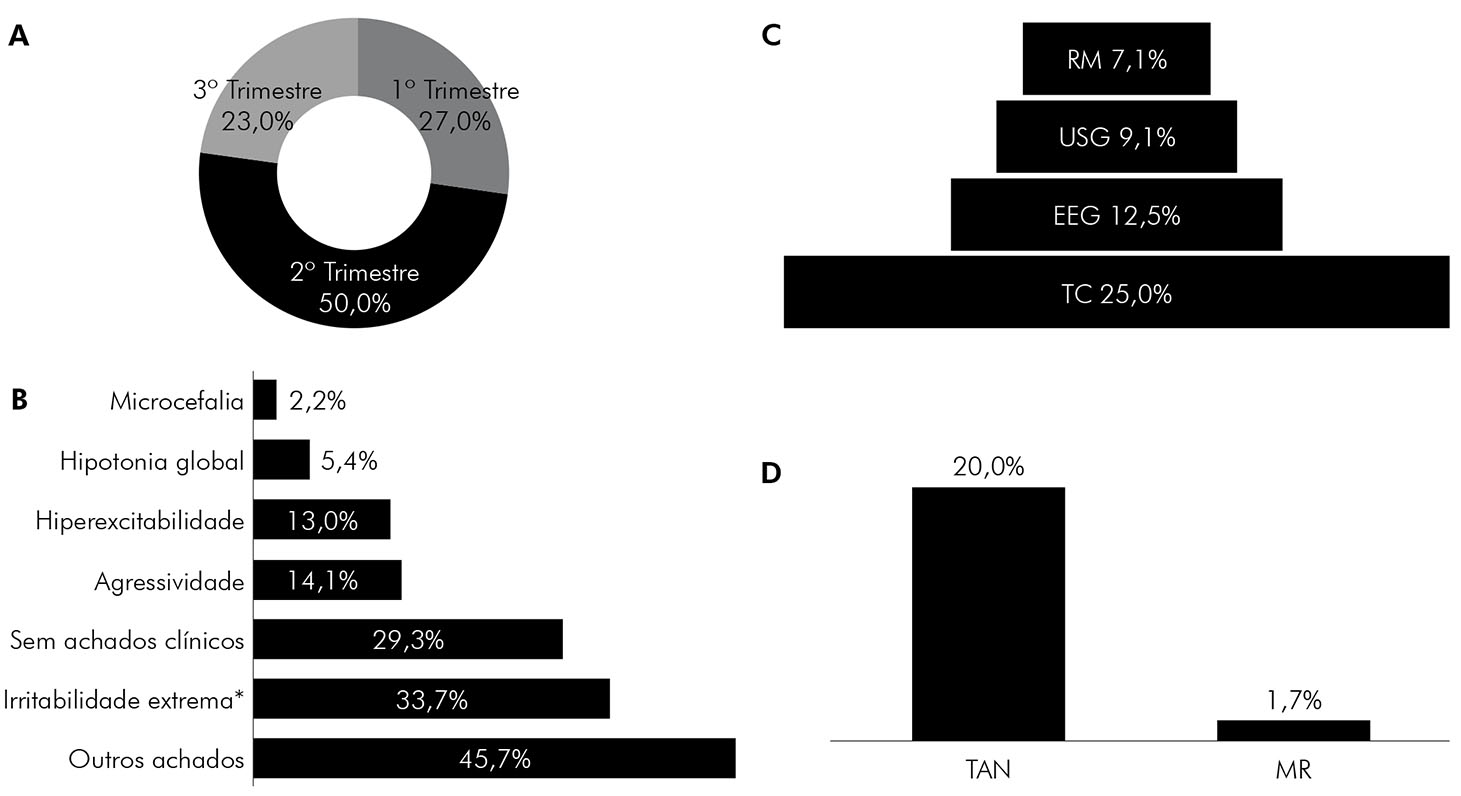
A: Distribuição das crianças de acordo com a idade gestacional em que foram expostas ao ZIKV. B: Achados clínicos identificados durante o seguimento das crianças. C: Distribuição dos exames de imagem com resultados alterados nas crianças em seguimento. D: Distribuição dos resultados alterados encontrados nos exames de triagem das crianças em seguimento.
TAN: Testes de triagem auditiva neonatal; MR: Mapeamento da retina; RM: Ressonância magnética do crânio; USG: Ultrassom transfontanela; EEG: Eletroencefalograma; TC: Tomografia computadorizada de crânio; *: p < 0,0001, Teste Qui-Quadrado Aderência.
Figura 1 - Distribuição de achados clínicos, laboratoriais e de imagem de crianças expostas intraútero ao ZIKV na Região Metropolitana de Belém, estado do Pará, Brasil, 2017-2018
Quanto à prevalência de malformações no grupo avaliado, duas (2,2%) apresentaram microcefalia ao nascimento, com confirmação laboratorial de infecção pelo ZIKV por meio da detecção dos antígenos virais na placenta materna por IHQ e anticorpos IgM anti-ZIKV no líquido cefalorraquidiano por ELISA. Ressalta-se que uma (1,1%) criança ZIKV negativo, por RT-PCR e ELISA, apresentou características clínicas compatíveis com microcefalia pós-natal, devido à desaceleração do crescimento cefálico após o primeiro ano de idade, com alteração da curva do perímetro cefálico adotada pelo Ministério da Saúde6.
No tocante às alterações neurossensoriais, descritas no protocolo do Ministério da Saúde6, foram registradas, neste estudo, irritabilidade, agressividade e hiperexcitabilidade como as mais frequentes, com 33,7% (n = 31), 14,1% (n = 13) e 13,0% (n = 12), respectivamente. Somam-se ainda, embora menos frequentes, casos de hipotonia global em cinco (5,4%) crianças. Outros achados importantes (45,7%) incluem tremor, atraso motor e na fala, telarca precoce, hiper-reflexia, convulsão, hiperatividade e implantação baixa de orelha (Figura 1B). Também foram evidenciadas alterações geniturinárias, consideradas raras na associação com o ZIKV, como sinequias de pequenos lábios, criptorquidia e hipospadia. Todas as alterações descritas foram identificadas no decorrer do seguimento clínico dessas crianças.
Na análise laboratorial das crianças, 80,4% (n = 74) foram submetidas à investigação da transmissão vertical da infecção pelo ZIKV após o nascimento. Das amostras testadas, apenas três (3,2%) crianças (duas microcefálicas e uma sem microcefalia) tiveram confirmação laboratorial de infecção intraútero pelo ZIKV. Houve um (1,1%) resultado positivo molecular e sorológico pela técnica de ELISA, e outros dois resultaram de espécimes clínicos obtidos durante o período neonatal: um em sangue do cordão umbilical, por RT-PCR, e um em fragmento de placenta, por IHQ. Todos tiveram ampliação da investigação para outros arbovírus, com resultados negativos para DENV, CHIKV e agentes TORCHS.
Em relação aos exames de imagem, 53 foram realizados, somando-se 12 TC, 11 USG, 14 RM e 16 EEG, correspondendo a 35,9% (33/92) das crianças do estudo encaminhadas após identificação de alguma alteração na avaliação clínica, neuropediátrica ou a partir de informes dos responsáveis sugestivos de alteração neurológica.
Das 12 TC realizadas, três (25,0%) apresentaram alterações: duas em crianças com microcefalia ao nascimento e uma em criança sob investigação de microcefalia pós-natal. Todas apresentavam em comum calcificações, mas em regiões distintas, como na parietal, parenquimatosa, dispersas e na substância branca. Dentre as demais alterações encontradas, destacam-se: redução volumétrica do crânio, dilatação dos ventrículos, cerebelo de pequenas dimensões, disgenesia do corpo caloso, aumento dos espaços subaracnóideos e áreas de encefalomalácia. Na USG, uma criança não microcefálica demonstrou redução do volume cerebral (área frontal), confirmada posteriormente pela RM de crânio.
Foi possível identificar que, dentre as RM de crânio realizadas, uma (7,1%) criança microcefálica exibiu anormalidades, como calcificações, anormalidades de giro, hipoplasia do corpo caloso, alterações corticais e desproporção cranioencefálica. Já com a realização do EEG, registrou-se atividade irritativa com proporções diferentes na incidência de descargas e na quantidade de áreas epileptogênica nas duas (12,5%) crianças microcefálicas ao nascimento (Figura 1C).
Para a identificação precoce da deficiência auditiva, foram realizados testes de TAN em 60 (65,2%) crianças do estudo. Dessas, 12/60 (20,0%) crianças apresentaram resposta ausente, principalmente à esquerda. Na avaliação visual, foram realizados 58/92 (63,0%) testes de TON e MR, não sendo identificada qualquer anormalidade ocular, como lesões pigmentares, atróficas ou hipoplásicas na mácula ou nervo óptico. Entretanto, houve a identificação, no MR, de catarata congênita total bilateral em uma criança e, até o momento, não há relato na literatura de associação com a infecção pelo ZIKV (Figura 1D).
DISCUSSÃO
Evidências científicas apontam que bebês com perímetro cefálico normal e sem anomalias congênitas visíveis podem apresentar danos no desenvolvimento, a médio e longo prazo, associados ao ZIKV14, o que justifica as recomendações atuais de seguimento de crianças expostas intraútero ao ZIKV, com o objetivo de identificar precocemente os sinais de atraso no desenvolvimento neuropsicomotor.
Apesar da idade gestacional no momento da infecção ser um fator relevante15, os dados encontrados, no presente estudo, não demonstram que a idade gestacional mais precoce de exposição ao vírus induza a afecção mais grave, podendo causar anomalias congênitas independentemente da idade gestacional que a mãe se infectou. Apesar disso, em 2018, Orofino et al.7 encontraram crianças com acometimento do coração que tiveram exposição intraútero ao ZIKV, em sua maioria (53,8%) no segundo trimestre de gestação.
Acresce-se a esse contexto que um dos desfechos da infecção do primeiro trimestre gestacional, observados nesta pesquisa, está relacionado à malformação do sistema nervoso central de uma das crianças microcefálicas do estudo, no período exato da 12ª semana. Em contrapartida, no estudo de Faria et al.16, foi relatado o pico de risco potencial entre a 14ª e a 17ª semana de gestação, incluindo, dessa forma, o período inicial do segundo trimestre. Esse período, no presente estudo, correspondeu ao momento da infecção congênita da segunda criança com microcefalia.
Embora a síndrome congênita associada ao ZIKV reúna alterações bem definidas, como microcefalia, achados específicos de imagem do sistema nervoso central e déficits visuais e auditivos17,18,19, tem-se observado que há um grupo de outras alterações clínicas que podem surgir durante o seguimento dessas crianças, como irritabilidade grave, hipotonia, hipertonia, hiper-reflexia, espasticidade e convulsões20.
Dessa forma, a infecção congênita por ZIKV pode resultar em manifestações neurológicas atípicas, muito além da microcefalia isolada, que vêm sendo identificadas durante o seguimento dessas crianças com sinais e sintomas como irritabilidade, hiperexcitabilidade e hipotonia, todos considerados fatores de risco para alterações no neurodesenvolvimento21.
No presente estudo, identificaram-se alterações no sistema genitourinário, como hipospadia, criptorquidia e sinequia de pequenos lábios, o que corrobora com os achados de Costello et al.22, ao sugerirem que os sistemas digestivo e geniturinário podem ser incluídos na síndrome congênita induzida pelo ZIKV, não obstante serem consideradas alterações clínicas raras no espectro clínico das crianças expostas intraútero.
Na análise das crianças submetidas à investigação laboratorial após o nascimento, três amostras foram positivas, sendo uma confirmada pela técnica de ELISA e outras duas por espécimes clínicas obtidas no período neonatal. A dificuldade na realização dos testes moleculares e sorológicos, no presente estudo, deveu-se, principalmente, à falta da coleta no momento oportuno, ao nascimento, ou de teste sorológicos mais específicos para diminuir as reações cruzadas com outros flavivírus, bem como às dificuldades logísticas de transporte e armazenamento dos materiais até o laboratório de referência. Essa situação assemelha-se aos obstáculos enfrentados por Castro et al.23, em 2017.
Os resultados dos exames laboratoriais negativos nas crianças não devem ser interpretados como determinantes para a interrupção do acompanhamento clínico longitudinal, sendo imprescindível o seguimento com os testes de triagem e exames de neuroimagem associada nas crianças expostas intraútero à infecção do ZIKV24. Nesse contexto, incluem-se, também, crianças clinicamente normocefálicas ao nascimento, como as encontradas na presente pesquisa, mas que devem receber atenção precoce quanto às técnicas complementares de estudo cerebral, uma vez que somente a exposição já é fator de risco para possíveis atrasos cognitivos nesse cenário que é silencioso e desconhecido8.
Na TC de crânio, a presença de calcificações grosseiras é considerada um critério de inclusão presumível para a infecção congênita por ZIKV, como descrito por Souza et al.25, e está associada à microcefalia. Quanto à RM de crânio, as principais anormalidades já descritas na literatura foram encontradas em uma criança microcefálica26,27. A USG em um lactente não microcefálico revelou redução de lobo frontal, achado não compatível ao descrito por Aragão et al.26, em estudo realizado em 2016, em que esse exame não possuía alteração em crianças expostas ao ZIKV, mas que, quando presente, pode sugerir dano induzido pelo vírus. Em relação ao EEG, poucos dados foram encontrados sobre a importância desse exame associado à microcefalia por Zika; porém, foram identificadas alterações do tipo ondas epileptiformes em crianças sem anomalias estruturais, o que ratifica a vigilância do desenvolvimento nas crianças expostas intraútero em longo prazo.
Até o momento, sabe-se que o comprometimento sensorial está presente com duas variáveis (auditiva e visual), dentre os três principais acometimentos da exposição do ZIKV durante a gestação, fazendo das observações e monitoramentos periódicos desses órgãos alvos imprescindíveis para o seguimento das crianças, uma vez que somente a triagem neonatal não exclui o envolvimento dos órgãos em fases posteriores da vida26.
A perda auditiva associada a outras infecções virais congênitas é bem descritas na literatura; entretanto, esse distúrbio ainda precisa ser elucidado em crianças com exposição intraútero ao ZIKV28. Em um estudo, realizado com 70 crianças microcefálicas com evidências de infecção congênita por ZIKV, foi registrado que 7,1% apresentavam perda auditiva29. Esse achado corrobora o encontrado neste estudo, no qual houve alterações ao exame emissão otoacústica evocada (EOAE) de 20,0% das crianças com resposta ausente no teste. Isso demonstra a importância da elucidação do mecanismo exato subjacente à perda auditiva.
Alterações oculares foram relatadas em crianças com infecção congênita por ZIKV confirmada ou presumida, as quais incluem: atrofia corioretiniana ou cicatrizes, mudanças de pigmentação, hipoplasia de nervo óptico, palidez do disco óptico, aumento do disco óptico, hemorragias retinianas e anormalidades da vasculatura da retina19,20. Sabe-se ainda que a associação do ZIKV com alterações oftalmológicas deve-se ao tropismo do vírus pelo órgão e estão mais bem documentadas nos portadores de microcefalia, como relatado no estudo realizado, em 2017, por Verçosa et al.30, no qual identificou que 36% de seus pacientes microcefálicos possuíam alguma anormalidade, o que não foi encontrado no presente estudo, mas que pode ser justificado pela casuística desta coorte envolver apenas duas (2,2%) crianças microcefálicas.
CONCLUSÃO
A partir dos resultados obtidos nesta pesquisa, foi possível observar que, além do quadro já bem definido da síndrome congênita associada ao ZIKV, há um cenário desafiador de seguimento dessas crianças, uma vez que os achados clínicos, como irritabilidade extrema, agressividade e hiperexcitabilidade, observados durante o desenvolvimento infantil, impõem a necessidade de um olhar biopsicossocial e multiprofissional, permitindo, dessa forma, identificar alterações precoces e, assim, promover medidas de intervenção visando atenuar as complicações neuropsicomotoras.
Sobre a triagem neonatal e os exames adicionais, como o mapeamento de retina, é imprescindível o rastreio periódico, estando claro que alterações podem surgir em fases mais tardias da infância. Com isso, salienta-se a importância de determinar se as crianças que sofreram exposição a esse arbovírus durante a gestação terão flutuações ou progressões para anormalidades.
Portanto, diante do exposto, faz-se necessário que sejam realizados mais estudos de seguimento nas crianças expostas intraútero ao ZIKV, para a avaliação das consequências, em longo prazo, no desenvolvimento infantil e, assim, ocorrer a promoção do conhecimento e intervenções precoces no seguimento dessas crianças.











 texto em
texto em 
 Curriculum ScienTI
Curriculum ScienTI

