Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Pan-Amazônica de Saúde
versión impresa ISSN 2176-6215versión On-line ISSN 2176-6223
Rev Pan-Amaz Saude vol.11 Ananindeua 2020 Epub 25-Jun-2020
http://dx.doi.org/10.5123/s2176-6223202000259
ARTÍCULO ORIGINAL
Cuantificación de colágeno tipos I y III en lesiones de piel de pacientes portadores de lepra
1 Universidade do Estado do Pará, Centro de Ciências Biológicas e da Saúde, Departamento de Morfologia e Ciências Fisiológicas, Belém, Pará, Brasil
2 Universidade Federal do Pará, Belém, Pará, Brasil
3 Centro Universitário do Pará, Belém, Pará, Brasil
4 Universidade do Estado do Pará, Centro de Ciências Biológicas e da Saúde, Departamento de Morfologia e Ciências Fisiológicas, Laboratório de Morfofisiologia Aplicada à Saúde, Belém, Pará, Brasil
5 Universidade do Estado do Pará, Centro de Ciências Biológicas e da Saúde, Ambulatório de Dermatologia, Belém, Pará, Brasil
OBJETIVO:
Cuantificar las fibras de colágeno tipos I y III en las formas clínicas polares e inicial de la lepra.
MATERIALES Y MÉTODOS:
Se analizaron treinta y nueve muestras cutáneas conservadas en bloques de parafina, distribuidas en los siguientes grupos: indeterminadas - MHI (9), tuberculoide - MHT (16) y virchowian - MHV (14) y sometidas a microtomía y tinción picrosirius rojo. Las imágenes fueron analizadas por el programa Image J y, para el análisis estadístico, se utilizó la prueba ANOVA (p < 0,05).
RESULTADOS:
El colágeno tipo I ocupó, en MHI, MHT y MHV, respectivamente, el 69% (DE ± 14,94), el 54% (SD ± 18,66) y el 44% (DE ± 18,06) del área de la dermis, con diferencia estadísticamente significativa entre MHI y MHV (p < 0,01). El colágeno tipo III ocupó, en MHI, MHT y MHV, respectivamente, el 1,6% (DE ± 1,524), el 2,6% (SD ± 1,787) y el 4,5% (DE ± 2,325), con diferencias estadísticamente significativas entre MHI y MHV (p < 0,01) y entre MHV y MHT (p < 0,05). En cuanto a la correlación de los tipos de colágeno I y III, se obtuvo una correlación negativa, fuerte y estadísticamente significativa en la forma MHI (r = -0,7000; p = 0,0433); para la MHT se obtuvo una correlación negativa, moderada y estadísticamente significativa (r = -0,5029; p = 0,0471); mientras que para MHV no hubo significación estadística (p = 0,7253; r = -0,1033).
CONCLUSIÓN:
El tipo de lepra y sus aspectos inmunopatológicos asociados son determinantes en los niveles de colágeno identificados, observándose gradualmente pérdida del colágeno tipo I y aumento del colágeno tipo III en MHI, MHV y MHT.
Palabras clave: Lepra; Colágeno Tipo I; Colágeno Tipo III
INTRODUCCIÓN
El elevado poder de incapacitar a la persona infectada hace con que la lepra sea caracterizada como un problema de salud pública. Según datos del Ministerio de la Salud1, en 2018, se notificaron 28.660 casos de lepra en Brasil, distribuyéndose en las regiones de la siguiente manera: Nordeste (40,9%), Centro-Oeste (23,2%), Norte (20,2%), Sudeste (12,9%) y Sul (2,8%).
La lepra es una infección granulomatosa, crónica y degenerativa causada por Mycobacterium leprae, que afecta principalmente los nervios periféricos y la piel. Alrededor del 95% de las personas expuestas al bacilo de M. leprae son resistentes a la infección, con un 5% susceptible2. En casos susceptibles, las diversas formas en las que se manifiesta la enfermedad dan lugar a diferentes clasificaciones, y Ridley y Jopling3 son las principales, en las que se tienen en cuenta los cambios histopatológicos asociados a alteraciones inmunológicas3. También se evidenció, en algunos estudios, que sólo la exposición a M. leprae no es suficiente para el desarrollo de la enfermedad, y varios factores genéticos están involucrados, responsables de la susceptibilidad a la lepra y su amplio espectro de manifestaciones4.
La manifestación inicial de la enfermedad se caracteriza generalmente por la forma indeterminada (MHI), un estado transitorio que se puede encontrar en individuos cuya respuesta inmunológica al bacilo no se ha definido, generalmente en niños. Esta forma puede, entonces, evolucionar a la curación espontánea o a otras manifestaciones clínicas5.
Debido a que es una enfermedad espectro, la respuesta inmune transita entre los polos extremos. En la forma tuberculoide (MHT), se evidencia el polo de resistencia, marcado por una intensa respuesta celular mediada por linfocitos T de perfil 1-asistencia (Th1) que son responsables de la producción de una serie de citoquinas proinflamatorias, como el factor de necrosis tumoral (TNF-α), estimulando el reclutamiento de linfocitos y monocitos al sitio de la infección. Este perfil de respuesta influye en la proliferación bacilar y, en consecuencia, en las características histopatológicas de MHT - formación de granulomas6,7.
Por su parte, el polo virchowiano (MHV) se caracteriza por la susceptibilidad al bacilo, y la respuesta inmunológica está mediada por linfocitos de perfil 2 (Th2), asociados a citoquinas inmunosupresoras, como el factor de crecimiento del transformador beta (TGF-β), responsable del desarrollo y reparación tisular, control, diferenciación y proliferación celular. Este perfil de respuesta contribuye a la proliferación de linfocitos B y a la secreción de anticuerpos que no son efectivos en la destrucción del bacilo, dando lugar a grandes cambios histopatológicos en el sitio de la lesión, evidenciados por la presencia de un denso infiltrado inflamatorio con macrófagos parasitados por el bacilo6,7.
Uno de los aspectos más relevantes de la lepra es la lesión neuronal, resultado del proceso inflamatorio en un intento de destruir el bacilo. Una de las principales causas de neuropatía en la lepra es la fibrosis, y en el MHV hay desmielinización y pérdida axonal, además de una fibrosis endoneural y perineural densa. En la MHT, los nervios son total o parcialmente destruidos y reemplazados por tejido fibroso, mientras que en el MHI hay un número mínimo de infiltrados en los nervios8.
El proceso inflamatorio es responsable de cambios importantes en los componentes de la matriz extracelular (MEC) - colágeno, proteoglucanos, fibras elásticas y fibronectina - asociados con el tipo de respuesta inmune en cada tipo de lepra, contribuyendo a la atrofia, degeneración tardía y, en consecuencia, cambios biológicos en las funciones de la piel en la lepra9.
Siendo los colágenos tipo I y III los más abundantes en la dermis, su estudio en la lepra es de gran relevancia para la comunidad científica.
El colágeno tipo I es el más común y representa el 90% del colágeno total en los mamíferos, siendo sintetizado por fibroblastos, odontoblastos y osteoblastos, confiriendo resistencia a las estructuras. TGF-β y factor de crecimiento derivado de plaquetas estimulan la producción de tipo colágeno de I a través de fibroblastos; glucocorticoides, por otro lado, inculcaría su síntesis7,10. El colágeno tipo III es sintetizado por fibroblastos, adipocitos y células de Schwann (en el sistema nervioso periférico), aportando fibras cortas y delgadas que suelen encontrarse en tejidos que tienen un cierto grado de elasticidad, como piel, músculos, fascias y ligamentos. Además, se encuentra en las primeras etapas de curación asociadas con el colágeno tipo I durante la fibrosis y la fibrogénesis10.
Por lo tanto, la evaluación del colágeno en muestras de piel de pacientes con lepra es relevante, porque esta enfermedad se manifiesta principalmente en forma de lesiones dérmicas y porque el colágeno es un componente importante del MEC de la DERMIS, responsable de mantener el marco normal. Así, el actual estudio apuntó cuantificar y establecer una correlación entre los tipos I e III de las fibras del colágeno en las formas clínicas polares (MHT y MHV) e iniciales (MHI) de la lepra.
MATERIALES Y MÉTODOS
SELECCIÓN DE LAS MUESTRAS
Se seleccionaron treinta y nueve muestras de piel de pacientes preservados en bloques de parafina del archivo de patología del Servicio de Dermatología de la Universidad Estadual de Pará, con diagnóstico clínico confirmado de lepra y evaluación histopatológica realizada, descritas en los informes como: lesiones cutáneas de MHI (nueve), cuya dermis presentaba infiltración linfohistiocitaria perivascular y perineural sin formar granulomas (en los cortes teñidos por Fite-Faraco, no se observó BAAR); lesiones cutáneas de MHT (16), que se caracterizaron por la presencia de granulomas epitelioides con células gigantes multinucleadas de tipo Langhans que involucran vasos, apéndice cutáneo y filetes de nervios dérmicos (los cortes teñidos por Fite-Faraco no revelan BAAR); y lesiones cutáneas de MHV (14), en las que los cortes se caracterizaron por una epidermis delgada, con rectificación papilar y banda Unna subepidérmica. En la dermis se observó un abundante infiltrado inflamatorio formado por histiocitos con grandes citoplasmas claros, a veces dilatados, rellenos de ADR evidenciados, formando grandes globias en secciones teñidas por Fite-Faraco. Infiltran la disposición difusa presentada, bosquejando raramente granulomas malformados y extendidos a través de la dermis y del segmento hipodérmico representado, observando la infiltración perineural.
Las muestras de piel seleccionadas pertenecían a pacientes mayores de 18 años, de ambos sexos, que no habían iniciado la poliquimioterapia en el momento de la biopsia.
Este estudio fue aprobado por el Comité de Ética en Investigación de la Universidad del Estado de Pará, Centro de Ciencias Biológicas y de la Salud, el 18 de noviembre de 2016, bajo la opinión Nº 1.827.246.
PROCESAMIENTO HISTOLÓGICO DE LAS MUESTRAS
Se realizaron cortes con espesura de 5 µm (Micrótomo Leica modelo RM2255) y, posteriormente, teñidos con Picrosirius Red (Direct Red 80 - Sigma-Aldrich, Saint Louis, EUA) para observación de las fibras de colágeno tipos I y III.
ANÁLISIS DE LAS MUESTRAS Y CUANTIFICACIÓN DE COLÁGENO
Las secciones histológicas fueron observadas en microscopio óptico bajo luz polarizada. Este método nos permitió observar la diferenciación del tipo I (naranja-amarillento a naranja y rojo) y tipo III (birrefringencia verde amarillento).
Para la captura de las imágenes, se utilizó una cámara de alta resolución (AxioCam MRc, Zeiss), acoplada al microscopio Axio Scope.A1 Zeiss y a un ordenador con el sistema operativo Microsoft Windows, que contenía el programa AxioVision 4.2 (Zeiss). De cada diapositiva, todos los campos de la dermis aumentados en 100x fueron seleccionados y fotografiados. Las imágenes obtenidas fueron analizadas con ayuda del software Image J, con el plugin Threshold Colour, obteniendo el porcentaje de colágeno, mediante el análisis de partículas automatizado por la selección y medición de las áreas en función del color. El método estandarizado por Bedoya et al.11 utilizado en este trabajo para la cuantificación de la zona de colágeno, a través del umbral de color, dieron los siguientes valores: tono 0-40 para el color rojo (colágeno tipo I) y 45-120 para el color verde (colágeno tipo III), saturación 0-255 y brillo 5-225 para ambos tipos de colágeno. Tras el análisis de todos los campos, se realizó la media de los mismos, obteniéndose la media de cada muestra dentro de los grupos.
RESULTADOS
Los cambios en los niveles de colágeno de tipo I y III fueron observados de una manera estandardizada al analizar las micrografías de la piel de pacientes con MHI, MHT y MHV. El análisis, a través del programa Image J ha permitido destacar y cuantificar las áreas relacionadas con los colágenos en los tres tipos de lepra estudiados. Para ejemplificar estas afirmaciones, la Figura 1 presenta las micrografías originales obtenidas bajo luz polarizada, evidenciando colágenos tipo I y III, y sus análisis para la identificación y cuantificación de colágenos para MHI (A, D y G), MHT (B, E y H) y MHV (C, F e I). Los valores se expresaron como porcentaje de área. La Figura 1 muestra que entre las formas MHI, MHT y MHV, los niveles de colágeno tipo I disminuyen mientras que, para el colágeno tipo III, los niveles aumentan.
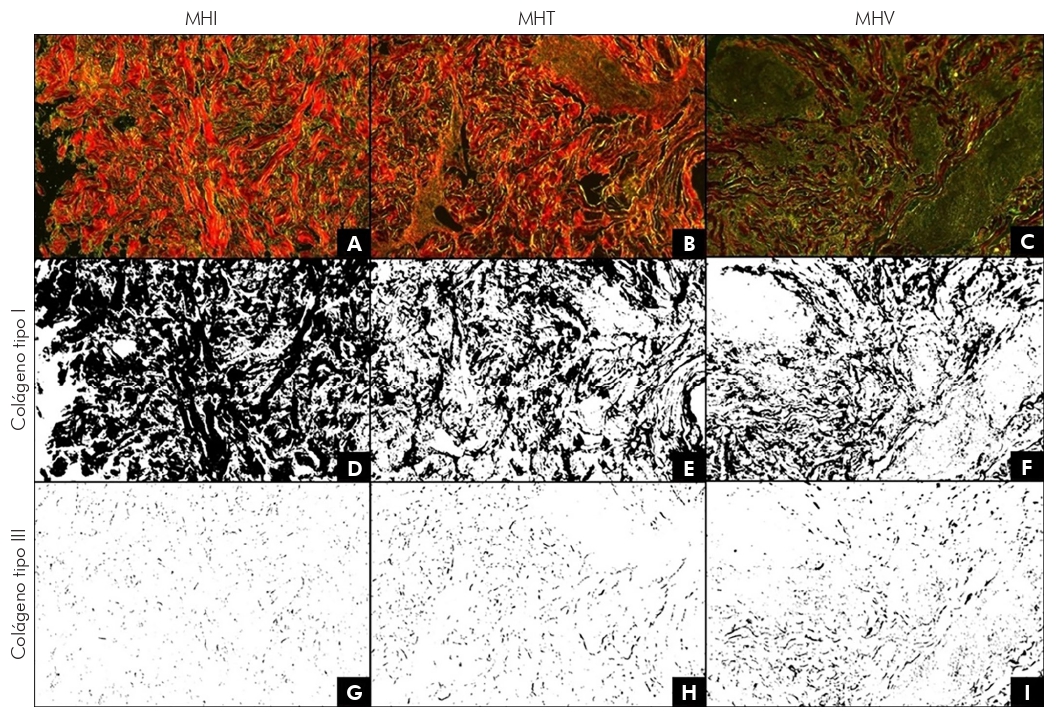
Las imágenes fueron analizadas por el programa Image J, para la selección de áreas pertenecientes a colágenos tipo I y III. En D, se comprueba el área correspondiente al colágeno tipo I (61,5%) y, en G, al colágeno tipo III (1,2%), en relación a la micrografía A; en E, se realiza la selección del área correspondiente al colágeno tipo I (37,6%) y, en H, al colágeno tipo III (2,6%), en relación a la micrografía B; y, en F, se realiza la selección del área correspondiente al colágeno tipo I (26,7%) y, en I, al colágeno tipo III (5,3%), en relación a la micrografía C. Valores expresados en porcentaje de área.
Figura 1 - Micrografías de luz polarizada de una muestra cutánea de pacientes con MHI (A), MHT (B) y MHV (C), que evidencian, en rojo, colágeno tipo I y, en verde, colágeno tipo III (Picrosirius Red)
En las lesiones de MHI, el tipo colágeno de I ocupó por término medio el 69% del área de la dermis (SD ± 14,94) y el tipo de colágeno III, 1,6% (SD ± 1.524). En las lesiones de MHT, el tipo de colágeno I ocupó por término medio el 54% del área de la dermis (SD ± 18,66) y el tipo de colágeno III, 2,6% (SD ± 1,787). En lesiones de MHV, el tipo de colágeno I era el 44% (SD ± 18,06) y el tipo de colágeno III era 4,5% (SD ± 2.325). Sin embargo, hubo una tendencia a una mayor presencia de colágeno tipo I en las lesiones del MHI (69%), seguido del MHT (54%) y el MHV (44%), con diferencia estadísticamente significativa entre MHI y MHV (p < 0,01). Por otro lado, el colágeno tipo III fue más predominante en las lesiones por MHV (4,5%), seguido de la MHT (2,6%) y el MHI (1,6%), con diferencias estadísticamente significativas entre MHI y MHV (p < 0,01) y entre MHT y MHV (p < 0,05) (Gráficos 1 y 2).
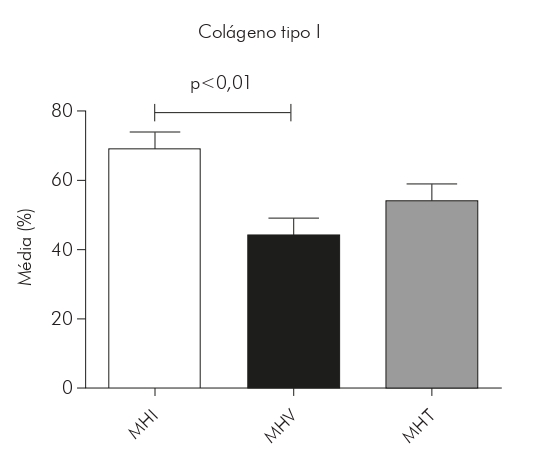
Gráfico 1 - Medias, expresadas en porcentaje, del área de colágeno tipo I en lesiones de piel de pacientes portadores de lepra en las formas MHI (N = 14), MHV (N = 9) y MHT (N = 16), luego del análisis de las imágenes por el programa Image J y la realización de las medias por paciente y, enseguida, por grupo
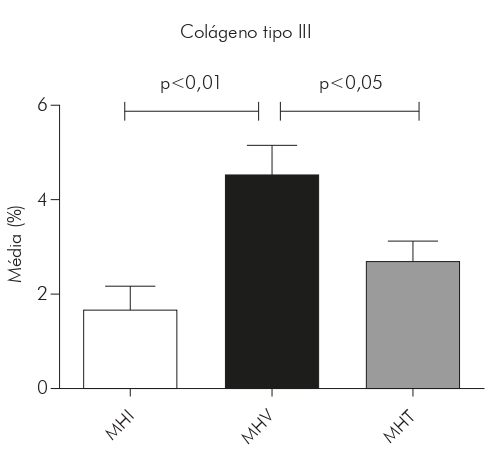
Gráfico 2 - Medias, expresadas en porcentaje, del área de colágeno tipo III en lesiones de piel de pacientes portadores de lepra de las formas MHI (N= 14), MHV (N = 9) y MHT (N = 16), luego del análisis de las imágenes por el programa Image J y la realización de las medias por paciente y, enseguida, por grupo
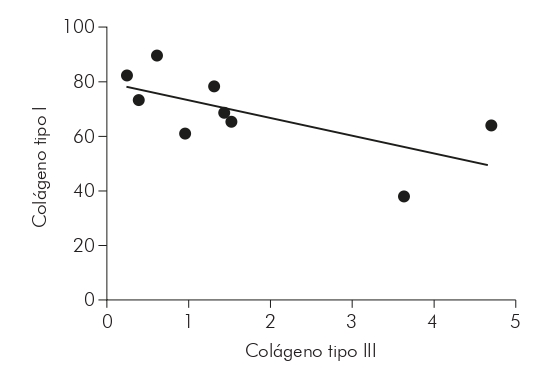
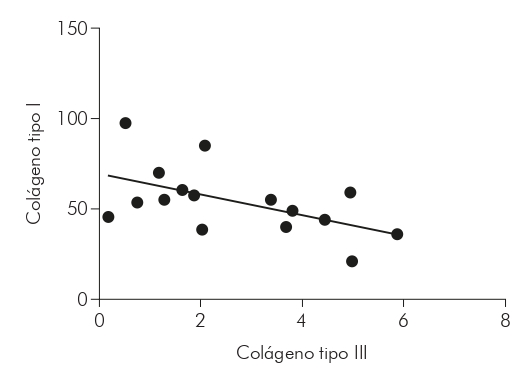
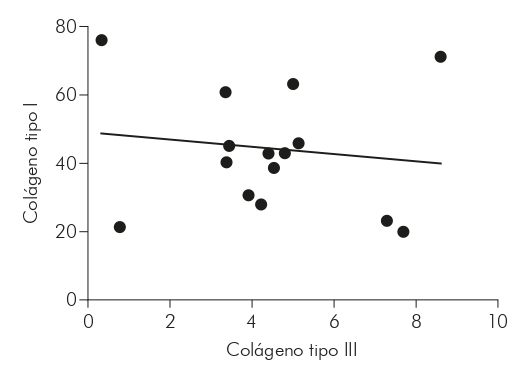
Con relación a la correlación del colágeno tipos I y III en las formas estudiadas, a través del test de Spearman, se obtuvo, en la forma MHI (Gráfico 3), una correlación negativa, fuerte y con significancia estadística (r = -0,7000; p = 0,0433); en la MHT (Gráfico 4), se obtuvo una correlación negativa, moderada y con significancia estadística (r = -0,5029; p = 0,0471); mientras que en la MHV (Gráfico 5), no hubo significancia estadística para la correlación (r = -0,1033; p = 0,7253).
DISCUSIÓN
El análisis de los componentes de la matriz extracelular dérmica de las lesiones cutáneas de la lepra por Antunes et al.9, reveló la remodelación de la matriz extracelular dérmica compacta por una matriz suelta en las regiones ocupadas por granulomas. Una matriz floja facilita la renovación celular promovida por la deposición de colagenasa, elastasa y fibronectina, que se produjo más intensamente en MHV en relación con MHT. También se verificó, por inmunodemarcación, la sustitución de fibras de colágeno entrelazadas densas por una malla reticular, observándose con mayor intensidad en el polo MHV9).
Durante el proceso inflamatorio, son esenciales los componentes vasculares, epiteliales y del MEC, estimulando la migración de leucocitos, secretando citoquinas estimulantes o funcionando como sustrato de adhesión. El intercambio de matriz extracelular densa por una matriz suelta proporciona el ambiente ideal para el desempeño de mediadores y citoquinas del proceso inflamatorio. La sustitución del MEC ocurre principalmente por colagenólisis, degradación de proteoglicanos, elastólisis y neosíntesis de colágeno, influenciados por factores como la colagenasa y la elastasa producidas por los macrófagos, encargados de eliminar los componentes originales de la matriz extracelular, la deposición de fibronectina y la producción de fibroblastos, que son responsables por crear un nuevo sustrato esencial para la invasión de células mononucleares y la producción de colágeno estimulado por citoquinas fibrogénicas12).
Por lo tanto, el equilibrio de citocinas fibrogénicas y fibrolíticas es responsable de los niveles del colágeno identificados en lesiones inflamatorias. Así, los moduladores inmunológicos pueden influir en los niveles de colágeno observados durante el proceso inflamatorio causado por el bacilo.
Desde esta perspectiva, se sabe que la interleucina-1 (IL-1) es un importante modulador estimulante de la fibrogénesis, mientras que el interferón-gamma (IFN-y) es un inhibidor de este proceso13. En MHV, hay una disminución de IFN-y13), y puede ser, especulativamente asociado, con que la alteración en los niveles de colágeno observados en este estudio, fue influenciado por la acción de esta enzima.
El TGF-β es un estimulador fundamental de la activación de los tipos de producción de colágeno I e III, estimulando la producción de mRNA a partir de las metaloproteinasas de la matriz y el factor de crecimiento nervioso en las células de Schwann. Entre los eventos destacados por la acción de esta citoquina, destacamos la reprogramación del fenotipo celular, influyendo en el proceso de fibrogénesis, y la evolución de las lesiones nerviosas y la apoptosis durante el proceso de la enfermedad7,14.
Estudios recientes han demostrado la participación de nuevos tipos de linfocitos th productores de mediadores que intensifican la respuesta inflamatoria en la forma resistente de la enfermedad, como las células CD4+ y Th17, que producen citoquinas, como la interleucina 17 (IL-17), encargada de reclutar monocitos y neutrófilos al sitio de infección15.
La IL-17 induce una lesión nerviosa, estimulando una respuesta inflamatoria dirigida a mantener la matriz extracelular. Además, IL-17 regula negativamente la producción del factor de crecimiento nervioso (NGF) y del receptor NGF (NGF R)15,16.
El estudio de Aaron et al.17 reveló una alta expresión de IL-17 en MHT, responsable por accionar un proceso inflamatorio para mantenimiento de la matriz dérmica. Además, mostró una alta expresión de NGF y NGF R en MHV, que son responsables por procesos como la regeneración nerviosa de la piel y la estimulación de fibroblastos que inducen el proceso de cura, ya que en MHV existe un alto grado de degradación de la matriz dérmica acompañada de baja respuesta inmune. Así, se puede sugerir que el colágeno tipo III elevado en MHV está siendo influenciado por la presencia de estos mediadores17.
Entre las formas de lepra utilizadas en este estudio (MHI, MHT y MHV), se destaca la característica histológica de cada una de ellas, respectivamente: la presencia de infiltrados discretos, la formación de granulomas, siendo responsables por una fuerte respuesta inmune, y la presencia de infiltrados inflamatorios difusos, con macrófagos parasitados por bacilos y globias en MHV6. Al comparar las características histopatológicas de la lepra identificadas en otras patologías, también se observaron cambios en los niveles de colágeno18,19,20).
El trabajo de Silva-Almeida et al.18 con ratas infectadas por Leishmania amazonensis mostraron que, en regiones donde había un infiltrado inflamatorio intenso, hubo mayor producción de colágeno tipo III, mientras que en otras regiones, donde el proceso inflamatorio fue más discreto, los niveles de colágeno fueron más cercanos a los valores del grupo control. También se observó que, en ratas infectadas, hubo alteraciones en la estructura normal de la dermis, caracterizados por la destrucción del colágeno tipo I. Estos resultados refuerzan los hallazgos de esta investigación, ya que, en muestras de cambios histopatológicos intensos (MHV), se encontraron mayores niveles de colágeno tipo III en relación a muestras cuyas principales alteraciones fueron granulomas (MHT) e infiltrados inflamatorios leves (MHI).
Investigación de Abreu-Silva et al.19), en infecciones experimentales por L. amazonensis en piel de ratón, se demostró la sustitución del colágeno tipo I por el tipo III durante la infección. Este aumento en el colágeno tipo III también fue identificado en los estudios de Gonçalves et al.20 en perros infectados con Leishmania chagasi con neumonitis intersticial crónica. La presencia de fibras reticulares en este caso fue identificada con frecuencia en áreas de infiltrado inflamatorio intenso.
Los resultados encontrados en la literatura coinciden con los hallazgos del presente estudio, ya que se identificó la disminución del colágeno tipo I y el aumento del colágeno tipo III en un proceso de lesión crónica, y se identificó una correlación de ambos tipos de colágeno con significación estadística, la misma relación encontrada en los procesos de reparación tisular.
Estos resultados están en línea con los hallazgos de este estudio, ya que se identificó una mayor producción de colágeno tipo III en las lesiones de los pacientes del grupo MHV, seguido de MHT y MHI. Se sabe que en MHV el proceso inflamatorio es más intenso que en MHT6.
Se cree que la prevalencia de infiltrados inflamatorios inespecíficos en MHI, granulomas nodulares en MHT e infiltrados inflamatorios difusos en el MHV6 determinan, en este orden, el aumento de los niveles de gravedad de las manifestaciones clínicas de la lepra, ya que se produce una mayor pérdida de colágeno tipo I y un aumento de los niveles de colágeno tipo III, según la gravedad de las manifestaciones clínicas/histopatológicas, como se destaca en la Figura 1 en tres micrografías, cada una referida a un tipo de lepra investigada en este estudio.
También se observó una correlación negativa y fuerte entre los tipos de colágenos evaluados en MHI y negativos y moderados en MHV, indicando una relación inversamente proporcional en los niveles de colágeno. Se cree que, debido al daño a la matriz extracelular causado por el proceso inflamatorio de la enfermedad, los niveles de colágeno tipo III han aumentado en detrimento de los niveles de colágeno tipo I. Esto se debe a la asociación entre estas fibras, que se encuentran en la dermis, especialmente en los procesos de reparación tisular21.
CONCLUSIÓN
Así, se cree que las lesiones en la fase inicial y polar de la lepra presentan diferencias en la cantidad de fibras de colágeno tipo I y III, debido al proceso inflamatorio persistente, característico de la enfermedad, que se produce a diferentes intensidades según la forma clínica de lepra observada. Esta diferencia ocurre gradualmente, de acuerdo con la gravedad de la lesión causada por las diferentes manifestaciones de la lepra, y el MHI causa lesiones menos graves, seguido de MHT y MHV.
Dentro de esta perspectiva, fue observado que los niveles del colágeno fueron encontrados en estos mismos patrones, y mientras que el tipo colágeno de I disminuyó progresivamente en lesiones del MHI, de MHT y de MHV, el tipo colágeno de III aumentó de la misma secuencia.
La pérdida de colágeno tipo I causada por lesión persistente puede dar lugar a la destrucción del marco normal de la dermis y al reemplazo de la matriz densa original por una matriz floja, propicia al proceso de renovación del tejido, asociada a los niveles crecientes de tipo colágeno de tipo III observados en áreas de infiltrado inflamatorio intenso.
Además, también es evidente que existe una correlación inversamente proporcional en los niveles de colágeno tipo I y III, considerados fuertes y moderados para MHI y MHT, respectivamente. Se considera, hasta entonces, que lo mismo ocurre debido al proceso de remodelación de la matriz extracelular causado por la presencia de la lesión.
También es importante destacar la necesidad de evaluar, en futuros estudios, la influencia de diversos moduladores inmunológicos en la patogénesis de la lepra, así como su participación en el proceso inflamatorio.
AGRADECIMIENTOS
Al Laboratorio de Morfofisiología Aplicada a la Salud de la Universidad del Estado de Pará, por los materiales, equipamientos y el espacio necesario para el desarrollo de esta investigación; y a Sirley Adriana Ortiz Bedoya, de la Universidad Federal de Viçosa, por el inmenso auxilio y apoyo con la metodología de cuantificación de colágeno.
REFERENCIAS
1 Ministério da Saúde (BR). Casos novos de hanseníase por estados e regiões, Brasil, 1990 a 2018 [Internet]. Brasília: Ministério da Saúde; 2019 [citado 2019 mai 23]. Disponível em: Disponível em: https://www.saude.gov.br/images/pdf/2019/julho/17/Casos-novos-de-hansen--ase-por-estados-e-regi--es--Brasil--1990-a-2018.pdf . [ Links ]
2 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde . Hanseníase. Bol Epidemiol. 2018;49(4):1-10. [ Links ]
3 Ridley DS, Jopling WH. Classification of leprosy according to immunity: a five-group system. Int J Lepr Other Mycobact Dis. 1966;34(3):255-73. [ Links ]
4 Silvestre MPSA, Lima LNGC. Hanseníase: considerações sobre o desenvolvimento e contribuição (institucional) de instrumento diagnóstico para vigilância epidemiológica. Rev Pan-Amaz Saude. 2016;7(no. esp):93-8. [ Links ]
5 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Vigilância e Doenças Transmissíveis. Guia prático sobre a hanseníase. Brasília: Ministério da Saúde; 2017. [ Links ]
6 Obadia DL, Verardino G, Alves MFGS. Hanseníase: correlação clínico-histopatológica. Rev Hosp Univ Pedro Ernesto. 2011 mar;10(1):20-3. [ Links ]
7 Sousa JR, Silva PYA, Soares LPMA, Aarão TLS, Pinto DS, Fuzii HT, et al. Imunoexpressão de TNF-α e TGF-β em lesões de pacientes nas diversas formas clínicas da hanseníase por meio da técnica de imunoistoquímica. Rev Pan-Amaz Saude. 2013 jun;4(2):45-53. [ Links ]
8 Chimelli L. Valor da biópsia de nervo no diagnóstico da hanseníase - auxílio à clínica nos casos de forma neural pura e reativação. Hansen Int Special. 1998:89-92. [ Links ]
9 Antunes SL, Gallo ME, Almeida SM, Mota E, Pelajo M, Lenzl HL. Dermal extracellular matrix in cutaneous leprosy lesions. Int J Lepr Other Mycobact Dis. 1999 Mar;67(1):24-35. [ Links ]
10 CalviENC, Nahas FX, Barbosa MV, Calil JA, IharaSSM, Silva MS, et al. An experimental model for the study of collagen fibers in skeletal muscle. Acta Cir Bras. 2012 Oct;27(10):681-6. [ Links ]
11 Bedoya SAO, Conceição LG, Viloria MIV, Loures FH, Valente FL, Amorim RL, et al. Caracterização de colágenos tipos I e III no estroma do carcinoma de células escamosas cutâneo em cães. Arq Bras Med Vet Zootec. 2016 jan-fev;68(1):147-54. [ Links ]
12 Ferraz FB, Fernandez JH. Integrinas na adesão, migração e sinalização celular: associação com patologias e estudos clínicos. Rev Cient Fac Med Campos. 2014;9(2):25-34. [ Links ]
13 Nogueira N, Kaplan G, Levy E, Sarno EN, Kushner P, Granelli-Piperno A, et al. Defective gamma interferon production in leprosy. Reversal with antigen and interleukin 2. J Exp Med. 1983 Dec;158(6):2165-70. [ Links ]
14 Petito RB, Amadeu TP, Pascarelli BMO, Jardim MR, Vital RT, Antunes SL, et al. Transforming growth factor-β may be a key mediator of the fibrogenic properties of neural cells in leprosy. J Neuropathol Exp Neurol. 2013 Apr;72(4):351-65. [ Links ]
15 Saini C, Ramesh V, Nath I. CD4+ Th17 cells discriminate clinical types and constitute a third subset of non Th1, Non Th2 T cells in human leprosy. PLoS Negl Trop Dis. 2013 Jul;7(7):e2338. [ Links ]
16 Stettner M, Lohmann B, Wolffram K, Weinberger JP, Dehmel T, Hartung HP, et al. Interleukin-17 impedes Schwann cell-mediated myelination. J Neuroinflammation. 2014;11:63. [ Links ]
17 Aarão TLS, Sousa JR, Botelho BS, Fuzii HT, Quaresma JAS. Correlation between nerve growth factor and tissue expression of IL-17 in leprosy. Microb Pathog. 2016 Jan;90:64-8. [ Links ]
18 Silva-Almeida M, Carvalho LOP, Abreu-Silva AL, Souza CSF, Hardoim DJ, Calabrese KS. Extracellular matrix alterations in experimental Leishmania amazonensis infection in susceptible and resistant mice. Vet Res. 2012;43:10. [ Links ]
19 Abreu-Silva AL, Calabrese KS, Mortara RA, Tedesco RC, Cardoso FO, Carvalho LOP, et al. Extracellular matrix alterations in experimental murine Leishmania (L.) amazonensis infection. Parasitology. 2004 Apr;128(4):385-90. [ Links ]
20 Gonçalves R, Tafuri WL, Melo MN, Raso P, Tafuri WL. Chronic interstitial pneumonitis in dogs naturally infected with Leishmania (Leishmania) chagasi: a histopathological and morphometric study. Rev Inst Med Trop S Paulo. 2003 May-Jun;45(3):153-8. [ Links ]
21 Tazima MFGS, Vicente YAMVA, Moriya T. Biologia da ferida e cicatrização. Medicina (Ribeirão Preto). 2008;41(3):259-64. [ Links ]
Cómo citar este artículo / How to cite this article: Lima IC, Wu SV, Silva LM, Freitas JJS, Carneiro FRO, Oliveira FRT. Cuantificación de colágeno tipos I y III en lesiones de piel de pacientes portadores de lepra. Rev Pan Amaz Saude. 2020;11:e202000259. Doi: http://dx.doi.org/10.5123/S2176-6223202000259
Recibido: 05 de Abril de 2019; Aprobado: 01 de Marzo de 2020











 texto en
texto en