Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Pan-Amazônica de Saúde
versão impressa ISSN 2176-6215versão On-line ISSN 2176-6223
Rev Pan-Amaz Saude vol.11 Ananindeua 2020 Epub 20-Ago-2020
http://dx.doi.org/10.5123/s2176-6223202000468
ARTÍCULO ORIGINAL
Efectividad del tratamiento con drogas antivirales de acción directa en pacientes con hepatitis C atendidos en un centro de referencia en el estado de Pará, Brasil, de 2017 a 2019
1 Universidade do Estado do Pará, Belém, Pará, Brasil
2 Universidade Federal do Pará, Belém, Pará, Brasil
3 Fundação Santa Casa de Misericórdia do Pará, Grupo do Fígado, Belém, Pará, Brasil
OBJETIVO:
Evaluar la efectividad y la tolerabilidad del tratamiento de la hepatitis C con antivirales de acción directa en pacientes portadores de hepatitis C crónica, atendidos en el Ambulatorio de Hepatología de la Fundación Santa Casa de Misericordia de Pará, en Belém, estado de Pará, Brasil.
MATERIALES Y MÉTODOS:
Estudio transversal, realizado con 305 pacientes en tratamiento con sofosbuvir (SOF), daclatasvir (DAC) o simeprevir (SMV) de mayo de 2017 a marzo de 2019. Se analizaron las historias clínicas de 250 pacientes que concluyeron el tratamiento en ese período, de las cuales se evaluaron datos demográficos y clínicos.
RESULTADOS:
Predominó el género masculino (50,40%), edad media de 61,21 años y procedentes de Belém (69,20). La mayoría (54,00%) tenía cirrosis y el 40,80% informó tratamiento previo. El genotipo 1 se encontró en el 73,60%, y el genotipo 3, en el 23,20% de los casos. El régimen de tratamiento más utilizado fue SOF, DAC y ribavirina (RBV) durante 12 semanas. La tasa de respuesta virológica global (RVS) encontrada fue del 97,2%. Los no respondedores fueron cuatro del genotipo 3 y tres del genotipo 1, y se utilizaron tres esquemas con SOF+DAC+RBV durante 12 semanas; dos esquemas con SOF+DAC durante 12 semanas; un esquema con SOF+DAC durante 24 semanas; y un esquema con SOF+SMV durante 12 semanas.
CONCLUSIÓN:
Los resultados de este estudio mostraron una población masculina predominantemente urbana, la mayoría de los cuales eran cirróticos, con predominio del genotipo 1. Se enfatiza la buena tolerancia y la alta efectividad de los nuevos antivirales de acción directa con una tasa general de RVS del 97,2%.
Palabras clave: Hepatitis C Crónica; Antivirales; Sofosbuvir; Simeprevir; Ribavirina; Combinación de medicamentos
INTRODUCCIÓN
La infección por el virus de la hepatitis C (VHC) se constituye, a nivel mundial, un grave problema de salud pública. La Organización Mundial de la Salud (OMS) estima que 71 millones de personas, en todo el mundo, vivan con la forma crónica de la infección por VHC (prevalencia global del 1%), y que 1,75 millones de nuevos casos ocurran anualmente1.
En Brasil, se notificaron 359.673 casos entre 1999 y 2018. En el análisis de la distribución de casos por regiones, el 63,1% ocurrió en el Sureste, el 25,2% en el Sur, el 6,1% en el Noreste, el 3,2% en el Medio Oeste y el 2,5% en el Norte. El estado de Pará ocupó el tercer lugar entre los estados de la Región Norte, con 2.659 casos confirmados en el mencionado período2.
La tasa de cronificación de la enfermedad, considerada como la permanencia de la infección por un período igual o superior a seis meses, es alta, en torno al 50-80%. La forma crónica puede causar problemas hepáticos graves, como la progresión a etapas avanzadas de fibrosis y cirrosis, en aproximadamente el 20% de los casos, y cáncer de hígado, complicaciones que aumentan la posibilidad de muerte3. Por esta razón, se debe recomendar el tratamiento para todo paciente diagnosticado.
El tratamiento de la hepatitis C pasó por varias etapas hasta llegar a los moldes actuales. Anteriormente, se recomendaba el uso de interferón-α, ribavirina e interferón pegilado en varios esquemas, dependiendo del genotipo del virus4. Dichos esquemas terapéuticos tuvieron una larga duración, causaron varios eventos adversos de difícil tolerancia, como fatiga, depresión y exacerbación de enfermedades autoinmunes, y tuvieron baja eficacia, con tasas de respuesta virológica sostenida (RVS) en torno al 50%5. A partir de 2011, los ensayos clínicos han demostrado que la asociación con agentes antivirales de acción directa fue una estrategia efectiva para el tratamiento, aumentando ligeramente la tasa de RVS. Así, boceprevir y telaprevir fueron opciones incorporadas al tratamiento de la hepatitis C, en asociación con ribavirina e interferón pegilado, formando un triple esquema que, sin embargo, continuó presentando efectos indeseables6. A partir de 2014, se ha utilizado una segunda generación de antivirales de acción directa, teniendo como representantes sofosbuvir, daclatasvir y simeprevir, lo que representó un hito importante en el tratamiento de la hepatitis C, debido a que estos nuevos fármacos presentaron tasas de RVS de alrededor del 90% y permitieron la terapia sin necesidad de usar interferón, reduciendo así drásticamente los eventos adversos previamente encontrados, simplificando el tratamiento y acortando su duración5),(7.
En Brasil, desde 2015, el Ministerio de Salud, a través del Protocolo Clínico y Directrices Terapéuticas (PCDT) para hepatitis C y coinfecciones, recomienda el uso de nuevos agentes antivirales de acción directa. Los fármacos incorporados fueron sofosbuvir, simeprevir y daclatasvir8. Posteriormente, los nuevos PCDT incluyeron nuevos fármacos en el arsenal terapéutico y eliminaron otros. Actualmente, los fármacos propuestos por el PCDT 20199 son: daclatasvir, sofosbuvir, ledipasvir, elbasvir, glecaprevir y velpatasvir.
La eficacia de los nuevos medicamentos ha sido probada por ensayos clínicos realizados en poblaciones y lugares variados de todo el mundo. Sin embargo, incluso con experiencias exitosas en varios lugares, existe una gran necesidad de estudios brasileños, y particularmente estudios regionales, después de la implementación del nuevo tratamiento para la hepatitis C por parte del Sistema Único de Salud (SUS), con el objetivo de investigar el impacto y el beneficio también en la población brasileña y, específicamente, amazónica. Así, el presente estudio tuvo como objetivo evaluar el impacto del tratamiento de la hepatitis C, propuesto por el PCDT para la hepatitis C y las coinfecciones 201710, respecto a la tasa de RVS de los pacientes con hepatitis C crónica, atendidos en la Clínica Ambulatoria de Hepatología de la Fundación Santa Casa de Misericordia de Pará (FSCMPA), referente de tratamiento en el estado.
MATERIALES Y MÉTODOS
En este estudio transversal, se recogieron datos de 305 registros médicos de pacientes con hepatitis C crónica, atendidos en la Clínica Ambulatoria de Hepatología de FSCMPA, en Belém, entre mayo de 2017 y marzo de 2019. La recolección de datos observó los preceptos de la Resolución 466/2012 del Consejo Nacional de Salud y fue autorizada por el Comité de Ética e Investigación del FSCMPA, bajo parecer No. 2.085.121, el 26 de mayo de 2017.
Se incluyeron en la muestra pacientes mayores de 18 años que tuvieron tratamiento completo entre mayo de 2017 y marzo de 2019, con los agentes sofosbuvir, daclatasvir o simeprevir, asociados o no a ribavirina, con cualquier genotipo viral, estadio de fibrosis o experiencia previa con esquemas alternativos. Los pacientes sin datos de seguimiento fueron excluidos del estudio. El esquema de tratamiento propuesto fue responsabilidad del médico tratante vinculado a la FSCMPA, de acuerdo con los medicamentos disponibles por el SUS, según el PCDT 2017, sin participación de los investigadores en esta decisión. Se evaluaron datos demográficos y clínicos, como sexo, edad, origen por municipio, grado de fibrosis, experiencia previa en tratamiento, genotipo y carga viral, esquema de tratamiento propuesto, presencia de eventos adversos y efectividad del esquema según la RVS, a través de su propio protocolo de investigación. De acuerdo con el PCDT de 2017, la RVS se consideró como la ausencia de ARN-VHC en el examen de reacción en cadena de la polimerasa (PCR), en la semana 12 o 24 después del final del tratamiento farmacológico. En el Laboratorio Central de Pará se realizaron técnicas de transcriptasa inversa moleculares (RT-PCR) (HCV-RNA) (Abbott®) y genotipado del VHC por secuenciación o INNO-LiPA®. El grado de fibrosis se midió mediante biopsia hepática, registrada en historias médicas, o métodos no invasivos como la puntuación del índice de relación AST a Platelet Ratio Index (APRI), la puntuación Fibrosis-4 (FIB-4) y la prueba de elastografía hepática FibroScan®, correlacionada con la puntuación histológica METAVIR.
La información obtenida fue organizada y sometida a análisis estadístico por protocolo mediante prueba de chi-cuadrado con corrección de Yates. Se utilizaron los softwares de Microsoft Office Excel 2010 y BioEstat v5.3 para el análisis de datos.
RESULTADOS
Entre las 305 historias clínicas, 55 fueron excluidas por la ausencia de información relacionada con el seguimiento, resultando una muestra final de 250 pacientes.
La información clínica y demográfica de la población estudiada, según el esquema de tratamiento propuesto, se muestra en la tabla 1. Entre los 250 pacientes analizados, 126 (50,40%) eran varones. La edad media fue de 61,21 años; 155 (62%) tenían 60 años o más, 92 (36,80%) tenían entre 40 y 59 años y tres (1,20%) eran menores de 40 años. La mayoría, 173 (69,20%), residía en Belém. En cuanto a los datos clínicos, 93 (37,20%) tenían carga viral previa al tratamiento superior a 800.000 UI/ml; 175 (70,00%) recibieron tratamiento con sofosbuvir y daclatasvir, 69 (27,60%) con sofosbuvir y simeprevir y seis (2,40%) con otros esquemas. El genotipo 1 fue el más frecuente (73,60%), seguido del genotipo 3 (23,20%) y el genotipo 2 (3,20%). Del total de pacientes analizados, 102 (40,80%) tenía alguna experiencia previa en el tratamiento y 135 (54,00%) tenía cirrosis hepática. Se agregó ribavirina en 121 (48,40%) casos; y 212 (84,80%) pacientes tuvo una duración de tratamiento de 12 semanas. La tasa global de RVS fue del 97,20%, con fallo terapéutico en solo siete (2,80%) casos. Los eventos adversos fueron informados por 54 (21,60%) individuos.
Tabla 1 - Características clínicas y demográficas, por esquema de tratamiento, de pacientes con hepatitis C crónica tratados con agentes antivirales de acción directa en la FSCMPA en Belém, estado de Pará, Brasil, entre mayo de 2017 y marzo de 2019
| Variables | SOF+DAC±RBV | SOF+SMV±RBV | Otros | Total | p-valor* | ||||
|---|---|---|---|---|---|---|---|---|---|
| Media | Mín.-máx. | Media | Mín.-máx. | Media | Mín.-máx. | Media | Mín.-máx. | ||
| Edad | 61,55 | 38-81 | 60,21 | 30-76 | 62,66 | 48-73 | 61,21 | 30-81 | 0,559000 |
| N = 175 | % | N = 69 | % | N = 6 | % | N = 250 | % | ||
| Sexo | |||||||||
| Masculino | 91 | 52,00 | 35 | 50,72 | 3 | 50,00 | 126 | 50,40 | 0,857519 |
| Femenino | 84 | 48,00 | 34 | 49,28 | 3 | 50,00 | 124 | 49,60 | |
| Genotipo | |||||||||
| 1 total | 116 | 66,29 | 68 | 98,55 | - | - | 184 | 73,60 | < 0,00001 |
| 1 no especificado | 30 | 25,86 | 12 | 17,65 | - | - | 42 | 22,83 | 0,963072 |
| 1a | 27 | 23,28 | 17 | 25,00 | - | - | 44 | 23,91 | 0,091977 |
| 1b | 59 | 50,86 | 39 | 57,35 | - | - | 98 | 53,26 | 0,001065 |
| 2 | 3 | 1,71 | - | - | 5 | 83,33 | 8 | 3,20 | NA |
| 3 | 56 | 32,00 | 1 | 1,45 | 1 | 16,67 | 58 | 23,20 | 0,000001 |
| Carga viral (UI/mL) | |||||||||
| < 800.000 | 105 | 60,00 | 49 | 71,01 | 3 | 50,00 | 157 | 62,80 | 0,108294 |
| ≥ 800.000 | 70 | 40,00 | 20 | 28,99 | 3 | 50,00 | 93 | 37,20 | |
| Tratamiento anterior | |||||||||
| Sí | 74 | 42,29 | 27 | 39,13 | 1 | 16,67 | 102 | 40,80 | 0,652236 |
| No | 101 | 57,71 | 42 | 60,87 | 5 | 83,33 | 148 | 59,20 | |
| Fibrosis | |||||||||
| F0-F3 | 73 | 41,71 | 39 | 56,52 | 3 | 50,00 | 115 | 46,00 | 0,036585 |
| F4 | 102 | 58,29 | 30 | 43,48 | 3 | 50,00 | 135 | 54,00 | |
| Duración del tratamiento | |||||||||
| 12 semanas | 137 | 78,29 | 69 | 100,00 | 6 | 100,00 | 212 | 84,80 | NA |
| 24 semanas | 38 | 21,71 | - | - | - | - | 38 | 15,20 | |
| Adición de RBV | |||||||||
| Sí | 98 | 56,00 | 17 | 24,64 | 6 | 100,00 | 121 | 48,40 | 0,000010 |
| No | 77 | 44,00 | 52 | 75,36 | - | - | 129 | 51,60 | |
| RVS | |||||||||
| Sí | 169 | 96,57 | 68 | 98,55 | 6 | 100,00 | 243 | 97,20 | 0,683030 |
| No | 6 | 3,43 | 1 | 1,45 | - | - | 7 | 2,80 | |
| Eventos adversos | |||||||||
| Sí | 38 | 21,71 | 15 | 21,74 | 1 | 16,67 | 54 | 21,60 | 0,996618 |
| No | 137 | 78,29 | 54 | 78,26 | 5 | 83,33 | 196 | 78,40 | |
| Ciudad | |||||||||
| Belém | 173 | 69,20 | |||||||
| Otros | 77 | 30,80 | |||||||
SOF: sofosbuvir; DAC: daclatasvir; RBV: ribavirina; SMV: simeprevir; NA: no se aplica; RVS: respuesta virológica sostenida. *Comparación entre SOF + DAC ± RBV y SOF + SMV ± RBV. Señal convencional utilizada: - Dato numérico igual a cero, no resultante de redondeo.
La mayoría de los pacientes que recibió tratamiento con sofosbuvir y daclatasvir tenía infección por genotipo 1 (66,29%) y genotipo 3 (32,00%), 102 (58,29%) tenía cirrosis hepática; y 74 (42,29%) había probado otros tratamientos previamente. La información sobre la tasa total de RVS y categorizada por algunas características clínicas de este grupo de pacientes se puede encontrar en la Figura 1. La tasa total de RVS encontrada en este subgrupo fue del 96,57%. Este esquema mostró una ligera superioridad en la tasa de RVS para los pacientes con genotipo 1 (98,27%), en comparación con los pacientes con genotipo 3 (92,85%); sin embargo, esta diferencia no mostró relevancia estadística (p > 0,05). Todos los pacientes con genotipo 2 presentaron RVS. La frecuencia de efectos adversos fue de 21,71%, los principales son mostrados en la Figura 2.
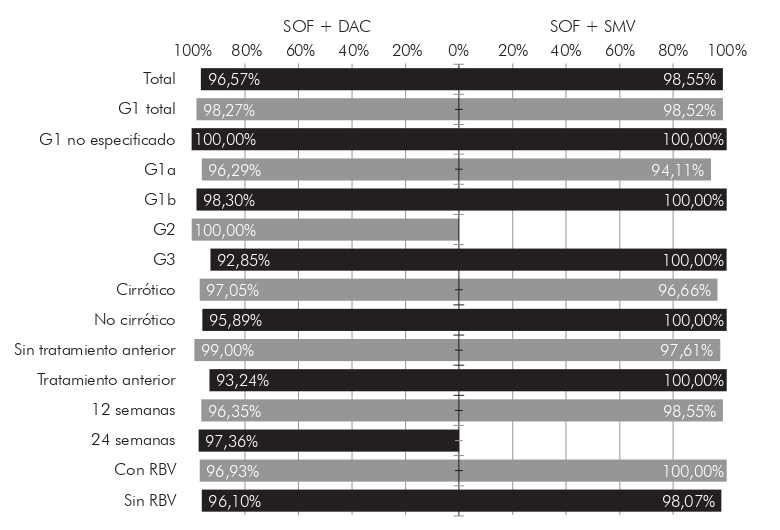
* Total y de acuerdo con las características clínicas de los pacientes. SOF: sofosbuvir; DAC: daclatasvir; SMV: simeprevir; G1: genotipo 1; G2: genotipo 2; G3: genotipo 3; RBV: ribavirina.
Figura 1 - Tasas de RVS, por esquema de tratamiento, de pacientes con hepatitis C crónica tratados con agentes antivirales de acción directa en la FSCMPA en Belém, estado de Pará, Brasil, entre mayo de 2017 y marzo de 2019*
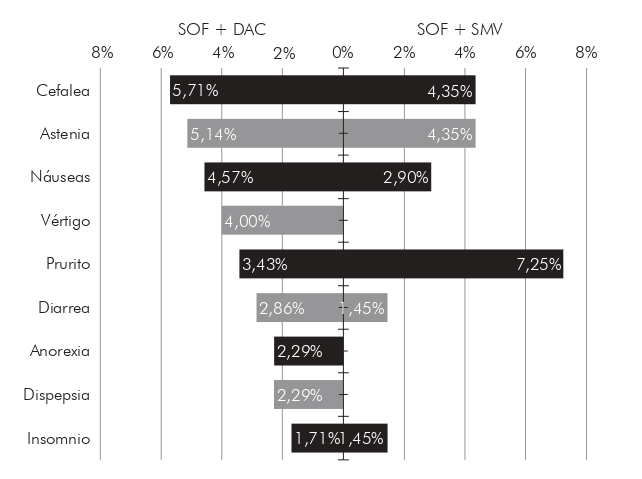
SOF: sofosbuvir; DAC: daclatasvir; SMV: simeprevir.
Figura 2 - Frecuencia de eventos adversos, por esquema de tratamiento, de pacientes con hepatitis C crónica tratados con agentes antivirales de acción directa en la FSCMPA en Belém, estado de Pará, Brasil, entre mayo de 2017 y marzo de 2019
Los pacientes que recibieron tratamiento con sofosbuvir y simeprevir fueron infectados casi en su totalidad por el genotipo 1 (98,55%), con un sólo paciente infectado con el genotipo 3 y ninguno con el genotipo 2; 30 (43,48%) tenían cirrosis hepática; y 27 (39,13%) había probado algún tratamiento previamente. La información sobre la tasa total de RVS y categorizada por características clínicas de este grupo de pacientes se puede encontrar en la Figura 1. La tasa total de RVS encontrada en este subgrupo fue del 98,55%, ligeramente superior a la tasa de los que recibieron sofosbuvir y daclatasvir; sin embargo, sin significación estadística (p > 0,05). La frecuencia de efectos adversos en este esquema fue del 21,74%, muy similar a la encontrada en el grupo que recibió sofosbuvir y daclatasvir. Los más frecuentes fueron cefalea, astenia y prurito, como se muestra en la Figura 2.
Un total de seis pacientes recibió esquemas alternativos, cinco de ellos con sofosbuvir y ribavirina, todos infectados por el genotipo 2, y uno con sofosbuvir, interferón pegilado y ribavirina, infectados por el genotipo 3. Todos ellos tenían SVR. La información clínica sobre este subgrupo se puede encontrar en la Tabla 2.
Tabla 2 - Tasas de respuesta virológica sostenida y características clínicas de pacientes que recibieron esquemas alternativos para hepatitis C crónica en la FSCMPA en Belém, estado de Pará, Brasil, entre mayo de 2017 y marzo de 2019
| Esquema propuesto | SOF+INF+RBV | SOF+RBV |
|---|---|---|
| Número de pacientes | 1 | 5 |
| Duración en semanas | 12 (100,00%) | 12 (100,00%) |
| Genotipo | 3 (100,00%) | 2 (100,00%) |
| Cirrosis (%) | 100,00% | 80,00% |
| Tratamiento anterior (%) | 100,00% | - |
| RVS (%) | 100,00% | 100,00% |
SOF: sofosbuvir; INF: interferón alfa; RBV: ribavirina; RVS: respuesta virológica sostenida. Señal convencional utilizada: - Dato numérico igual a cero, no resultante de redondeo.
En este estudio, se encontraron siete pacientes no respondedores, en su mayoría, mujeres (71,43%), con edad promedio de 62 años, infectados por el genotipo 3 (57,14%), pacientes portadores de cirrosis (57,14%), con tratamiento con duración de 12 semanas (85,71%). La tasa de RVS en el genotipo 3 fue la menor entre todas (93,10%). Otras características clínicas y demográficas sobre esos pacientes se muestran en el Cuadro 1 y en la Tabla 3.
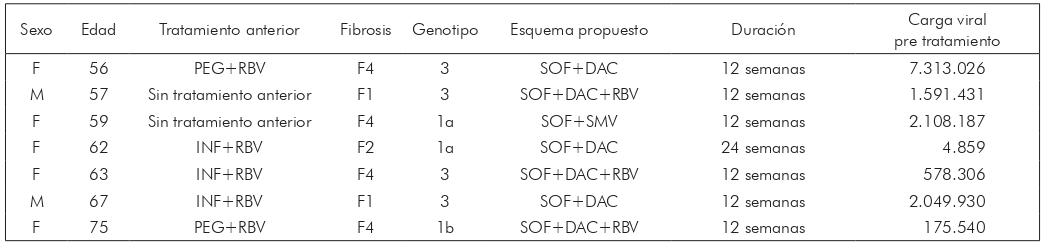
F: femenino; M: masculino; PEG: interferón pegilado; RBV: ribavirina; SOF: sofosbuvir; DAC: daclatasvir; SMV: simeprevir; IFN: interferón alfa.
Cuadro 1 - Características clínicas y demográficas de los pacientes no respondedores a los agentes antivirales de acción directa en la FSCMPA en Belém, estado de Pará, Brasil, entre mayo de 2017 y marzo de 2019
Tabla 3 - Características clínicas y demográficas de pacientes no respondedores a los agentes antivirales de acción directa en la Fundación Santa Casa de Misericordia en Belém, Pará, entre mayo de 2017 y marzo de 2019, por esquema de tratamiento
| Variables | SOF + DAC ± RBV | SOF + SMV ± RBV | Total | |||
|---|---|---|---|---|---|---|
| Edad | Media | Mín.-máx. | Media | Mín.-máx. | Media | Mín.-máx. |
| 63,33 | 56-75 | 59 | 59 | 62,71 | 56-75 | |
| N = 6 | % | N = 1 | % | N = 7 | % | |
| Sexo | ||||||
| Masculino | 2 | 33,33 | - | - | 2 | 28,57 |
| Femenino | 4 | 66,67 | 1 | 100,00 | 5 | 71,43 |
| Genotipo | ||||||
| 1 total | 2 | 33,33 | 1 | 100,00 | 3 | 42,86 |
| 1a | 1 | 50,00 | 1 | 100,00 | 2 | 66,67 |
| 1b | 1 | 50,00 | - | - | 1 | 33,33 |
| 2 | - | - | - | - | - | - |
| 3 | 4 | 66,67 | - | - | 4 | 57,14 |
| Carga viral (UI/mL) | ||||||
| < 800.000 | 3 | 50,00 | - | - | 3 | 42,86 |
| ≥ 800.000 | 3 | 50,00 | 1 | 100,00 | 4 | 57,14 |
| Tratamiento anterior | ||||||
| Sí | 5 | 83,33 | - | - | 5 | 71,43 |
| No | 1 | 16,67 | 1 | 100,00 | 2 | 28,57 |
| Fibrosis | ||||||
| F0-F3 | 3 | 50,00 | - | - | 3 | 42,86 |
| F4 | 3 | 50,00 | 1 | 100,00 | 4 | 57,14 |
| Duración del tratamiento | ||||||
| 12 semanas | 5 | 83,33 | 1 | 100,00 | 6 | 85,71 |
| 24 semanas | 1 | 16,66 | - | - | 1 | 14,29 |
| Adición de RBV | ||||||
| Sí | 3 | 50,00 | - | - | 3 | 42,86 |
| No | 3 | 50,00 | 1 | 100,00 | 4 | 57,14 |
SOF: sofosbuvir; DAC: daclatasvir; RBV: ribavirina; SMV: simeprevir. Señal convencional utilizada: - Dato numérico igual a cero, no resultante de redondeo.
Se realizaron análisis estadísticos para buscar posibles asociaciones entre las características clínicas y la existencia de RVS. Las variables analizadas fueron sexo, edad superior o inferior a 60 años, genotipo, existencia de tratamiento previo, cirrosis, tiempo de tratamiento entre 12 y 24 semanas, esquema de tratamiento con sofosbuvir y daclatasvir o sofosbuvir y simeprevir, carga viral mayor o inferior a 800.000 UI/ml y adición de ribavirina. Ninguna asociación mostró significación estadística (p > 0,05). Los detalles sobre estos análisis se pueden ver en la (Figura 3).
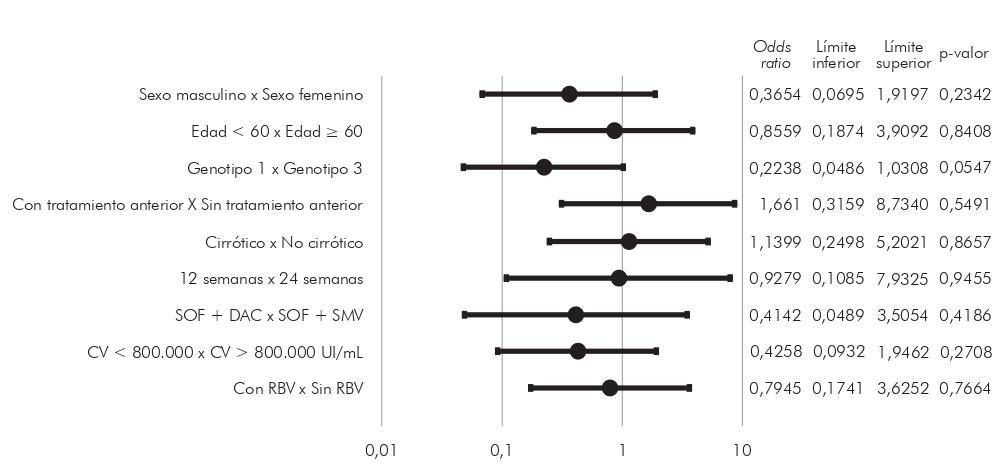
SOF: sofosbuvir; DAC: daclatasvir; SMV: simeprevir; CV: carga viral; RBV: ribavirina.
Figura 3 - Análisis estadístico de posibles predictores de RVS de pacientes con hepatitis C crónica tratados con agentes antivirales de acción directa en FSCMPA en Belém, Estado de Pará, Brasil, entre mayo de 2017 y marzo de 2019
DISCUSIÓN
Los antivirales de acción directa de segunda generación demostraron una alta efectividad en la población sometida a tratamiento en la FSCMPA, con una tasa general de RVS del 97,20%. Este resultado está de acuerdo con estudios internacionales, como COSMOS11 y OPTIMIST-112, y también con los realizados a nivel nacional y en varias regiones de Brasil. En la Región Sur, estudios realizados por Ferreira et al.13, Holzmann et al.14 y Molinar et al.15 encontraron tasas de RVS de 91,60%, 93,40% y 94,20% en los estados de Paraná, Rio Grande do Sul y Santa Catarina, respectivamente. En la Región Nordeste, Rolim et al.16 encontraron un porcentaje del 95% en la ciudad de Fortaleza, estado de Ceará. En la Región Sudeste, Azevedo17 encontró un porcentaje de 96,30% en la ciudad de Río de Janeiro. Un estudio a nivel nacional realizado por Cheinquer et al.18, en el que se evaluaron pacientes de varias ciudades, mostró la misma tendencia, con tasas de RVS que oscilaron entre el 88% y el 97%, dependiendo del genotipo del virus. Todos estos datos confirman la eficacia de estos fármacos.
La población estudiada también mostró características clínicas y demográficas similares a las de las poblaciones analizadas en otros estudios, como los estudios nacionales mencionados anteriormente14),(15),(16),(17),(18, mostrando una población predominantemente masculina, anciana, urbana, con un alto porcentaje de pacientes cirróticos y pacientes con tratamientos previos.
Con respecto al genotipo, la mayor prevalencia correspondió al genotipo 1 (73,60%), seguido del genotipo 3 (23,20%), según la prevalencia de estos genotipos a nivel nacional19. La infección por el genotipo 3 se ha considerado difícil de tratar, especialmente cuando se asocia con cirrosis, con tasas más bajas de RVS, demostradas en estudios internacionales como FISSION20, POSITRON21 y ALLY-322. En el presente análisis, cuatro de los siete pacientes no respondedores estaban infectados con el genotipo 3, y sólo dos de estos pacientes eran cirróticos. La tasa de RVS en el genotipo 3 fue la más baja entre todas (93,10%). Sin embargo, el pequeño número de pacientes en este estudio dificulta el análisis.
Es importante destacar que la mayoría de los pacientes (54,00%) tenía cirrosis hepática. Posiblemente, estos hallazgos se asocian con la dificultad para diagnosticar la hepatitis C en las primeras etapas debido a su carácter mayormente asintomático, y también debido a la baja eficacia y tolerabilidad de los tratamientos con interferón utilizados anteriormente. En la presente muestra, el 40,80% de los pacientes había probado, sin éxito, alguna de estas modalidades de tratamiento.
Los principales eventos adversos encontrados en pacientes que recibieron sofosbuvir y daclatasvir fueron cefalea (5,71%), astenia (5,14%) y náuseas (4,57%). Un resultado similar se encontró en los estudios realizados por Sulkowski et al.23 y Medeiros et al.24 con pacientes que recibieron el mismo esquema de tratamiento, y los mismos eventos adversos mencionados se mostraron con mayor frecuencia. En los pacientes que recibieron sofosbuvir y simeprevir, el efecto adverso más frecuente fue el prurito (7,25%), seguido de los otros ya mencionados. Estos resultados confirman la buena tolerabilidad de los antivirales de acción directa y la baja frecuencia de eventos adversos.
En cuanto a la adición de ribavirina al esquema terapéutico, este no pareció ser un factor importante en el alcance de RVS, con poca diferencia proporcional en las tasas de RVS tanto en el grupo que recibió sofosbuvir y daclatasvir (96,93% vs.96,10%) como en el grupo que recibió sofosbuvir y simeprevir (100,00% vs. 98,07%).
Es importante señalar que, entre los pacientes que recibieron sofosbuvir y simeprevir, uno de ellos estaba infectado por el genotipo 3, y para este genotipo, según el PCDT 2017 (vigente en el momento del inicio de la investigación) no se recomendó simeprevir, demostrando un posible fallo en la atención. Aun así, el paciente en cuestión presentó RVS, lo que no resultó en deterioro. Además, desde febrero de 2019, el simeprevir ha dejado de ser recomendado por el PCDT del Ministerio de Salud9 ha sido excluido del arsenal farmacológico del SUS debido a la introducción de nuevas alternativas terapéuticas de mayor efectividad, como glecaprevir/pibrentasvir y velpatasvir/sofosbuvir, por ejemplo, que se consideran esquemas pangenotípicos porque tratan todos los genotipos del VHC, mientras que el simeprevir estaba indicado solo para pacientes monoinfectados con VHC genotipo 1, sin cirrosis o con cirrosis Infantil-A25.
La hepatitis C crónica también persiste como una de las principales causas de cirrosis y trasplante hepático en adultos en la mayoría de los países26),(27. Ante este escenario, la OMS ha adoptado el objetivo de eliminar el VHC para 203028. Por lo tanto, es importante centrar la atención en la prevención de la enfermedad, así como en el diagnóstico y el tratamiento tempranos, evitando las complicaciones resultantes de la infección crónica por VHC. La adopción de antivirales de acción directa de última generación en Brasil podría corroborar el objetivo de eliminar el virus, así como aumentar el número de pacientes tratados por no especialistas, ampliando así el acceso al tratamiento29.
Las limitaciones del presente estudio pueden ser algún sesgo de selección debido a la imposibilidad de evaluar a todos los pacientes tratados con antivirales de acción directa durante el período de recolección de datos, debido a la falta de información de seguimiento (resultado) de muchos pacientes, que tuvieron que ser excluidos de la muestra final, lo que hace imposible identificar con precisión el número de pacientes que respondieron y no respondieron al nuevo tratamiento.
CONCLUSIÓN
Los resultados de este estudio observacional, en una muestra de pacientes crónicamente infectados con VHC en el estado de Pará, mostraron que los antivirales de acción directa de segunda generación (daclatasvir, sofosbuvir y simeprevir) presentaron una alta tasa de RVS, reflejando una excelente efectividad y tolerabilidad de pleno acuerdo con estudios previos realizados en otros países y otras regiones de Brasil.
REFERENCIAS
1 World Health Organization. Hepatitis C: fact sheets. Geneva: World Health Organization; 2019. [ Links ]
2 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Hepatites virais 2019. Bol Epidemiol. 2019 jul;50(17):1-71. [ Links ]
3 Li HC, Lo SY. Hepatitis C virus: virology, diagnosis and treatment. World J Hepatol. 2015 Jun;7(10):1377-89. [ Links ]
4 Coelho ME. Progressos terapêuticos na hepatite C [dissertação]. Porto (PT): Universidade do Porto, Faculdade de Medicina; 2015. [ Links ]
5 Mello CEB. Tratamento da hepatite crônica pelo vírus C: novas perspectivas. J Bras Med. 2014 jan-fev;102(1):23-32. [ Links ]
6 Lanini S, Mammone A, Puro V, Girardi E, Bruzzi P, Ippolito G. Triple therapy for hepatitis C improves viral response but also increases the risk of severe infections and anaemia: a frequentist meta-analysis approach. New Microbiol. 2014 Jul;37(3):263-76. [ Links ]
7 Islam MMSU, Sarker MN, Rahman M, Uddin MR, Rahman ATMA, Biswas G. Management of hepatitis C virus infection - new era has been started. Faridpur Med Coll J. 2014 Jul;9(2):92-7. [ Links ]
8 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Vigilância, Prevenção e Controle das Infecções Sexualmente Transmissíveis, do HIV/Aids e das Hepatites Virais. Protocolo clínico e diretrizes terapêuticas para hepatite C e coinfecções. Brasília: Ministério da Saúde; 2015. [ Links ]
9 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de DST, Aids e Hepatites Virais. Protocolo clínico e diretrizes terapêuticas para hepatite C e coinfecções. Brasília: Ministério da Saúde ; 2019. [ Links ]
10 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de DST, Aids e Hepatites Virais. Protocolo clínico e diretrizes terapêuticas para hepatite C e coinfecções. Brasília: Ministério da Saúde ; 2017. [ Links ]
11 Lawitz E, Sulkowski MS, Ghalib R, Rodriguez-Torres M, Younossi ZM, Corregidor A, et al. Simeprevir plus sofosbuvir, with or without ribavirin, to treat chronic infection with hepatitis C virus genotype 1 in non-responders to pegylated interferon and ribavirin and treatment-naive patients: the COSMOS randomised study. Lancet. 2014 Nov;384(9956):1756-65. [ Links ]
12 Kwo P, Gitlin N, Nahass R, Bernstein D, Etzkorn K, Rojter S, et al. Simeprevir plus sofosbuvir (12 and 8 weeks) in hepatitis C virus genotype 1-infected patients without cirrhosis: OPTIMIST-1, a phase 3, randomized study. Hepatology. 2016 Aug;64(2):370-80. [ Links ]
13 Ferreira VL, Borba HHL, Wiens A, Pedroso MLA, Radunz VFC, Ivantes CAP, et al. Effectiveness and tolerability of direct-acting antivirals for chronic hepatitis C patients in a Southern state of Brazil. Braz J Infect Dis. 2018 May-Jun;22(3):186-92. [ Links ]
14 Holzmann I, Tovo CV, Minmé R, Leal MP, Kliemann MP, Ubirajara C, et al. Effectiveness of chronic hepatitis C treatment with direct-acting antivirals in the Public Health System in Brazil. Braz J Infect Dis. 2018 Jul-Aug;22(4):317-22. [ Links ]
15 Molinar E, Oliveira JV, Biff MM, Bez PR. Perfil epidemiológico e resposta virológica sustentada de pacientes com hepatite C crônica em resposta ao tratamento com os novos antivirais de ação direta em dois serviços de referência do extremo sul catarinense. Arq Catarin Med. 2019 jan-mar;48(1):10-21. [ Links ]
16 Rolim FE, Braga LLBC, Lima JMC, Mello FSF, Pinho CS, Hyppolito EB. Hepatite crônica pelo vírus C: avaliação da resposta virológica ao tratamento com os novos antivirais de ação direta. Rev Med UFC. 2018 dez;58(4):8-12. [ Links ]
17 Azevedo DAF. Tratamento de hepatite C crônica com drogas antivirais de ação direta de segunda geração: Sofosbuvir, Simeprevir, Daclatasvir - resposta virológica sustentada no ambulatório de doenças do fígado do Hospital Universitário Gaffrée e Guinle [dissertação]. Rio de Janeiro (RJ): Universidade Federal do Estado do Rio de Janeiro; 2018. [ Links ]
18 Cheinquer H, Coelho HS, Aires RS, Quintela ED, Lobato C, Medeiros Filho JE, et al. New direct action antivirals containing regimes to treat patients with hepatitis C chronic infection: first results from a national real-world registry of the Brazilian Hepatology Society. J Hepatol. 2017;66(1 Suppl): S508. [ Links ]
19 Campiotto S, Pinho JRR, Carrilho FJ, Da Silva LC, Souto FJD, Spinelli V, et al. Geographic distribution of hepatitis C virus genotypes in Brazil. Braz J Med Biol Res. 2005 Jan;8(1):41-9. [ Links ]
20 Lawitz E, Mangia A, Wyles D, Rodriguez-Torres M, Hassanein T, Gordon SC, et al. Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med. 2013 May;368(20):1878-87. [ Links ]
21 Jacobson IM, Gordon SC, Kowdley KV, Yoshida EM, Rodriguez-Torres M, Sulkowski MS, et al. Sofosbuvir for hepatitis C genotype 2 or 3 in patients without treatment options. N Engl J Med. 2013 May;368(20):1867-77. [ Links ]
22 Nelson DR, Cooper JN, Lalezari JP, Lawitz E, Pockros PJ, Gitlin N, et al. All-oral 12-week treatment with daclatasvir plus sofosbuvir in patients with hepatitis C virus genotype 3 infection: ALLY-3 phase III study. Hepatology. 2015 Jan;61(4):1127-35. [ Links ]
23 Sulkowski MS, Gardiner DF, Rodriguez-Torres M, Reddy KR, Hassanein T, Jacobson I, et al. Daclatasvir plus sofosbuvir for previously treated or untreated chronic HCV infection. N Engl J Med. 2014 Jan;370(3):211-21. [ Links ]
24 Medeiros T, Salviato CM, do Rosário NF, Saraiva GDN, Esberard EBC, Almeida JR, et al. Adverse effects of direct acting antiviral-based regimens in chronic hepatitis C patients: a Brazilian experience. Int J Clin Pharm. 2017 Oct;39(6):1304-11. [ Links ]
25 Ministério da Saúde (BR). Secretaria de Ciência, Tecnologia e Insumos Estratégicos. Comissão Nacional de Incorporação de Tecnologias no SUS. Simeprevir para o tratamento da hepatite C. Brasília: Ministério da Saúde ; 2019. Relatório de recomendação, n.º 428. [ Links ]
26 World Health Organization. Global health sector strategy on viral hepatitis 2016-2021 [Internet]. Genebra: World Health Organization; 2016 [cited 2017 Mar 10]. Available from: Available from: https://www.who.int/hepatitis/strategy2016-2021/ghss-hep/en/ . [ Links ]
27 World Health Organization. Global hepatitis report, 2017 [Internet]. Genebra: World Health Organization ; 2017 [cited 2017 Mar 10]. Available from: Available from: https://www.who.int/hepatitis/publications/global-hepatitis-report2017/en/ . [ Links ]
28 World Health Organization. Combating hepatitis B and C to reach elimination by 2030 [Internet]. Genebra: World Health Organization ; 2016 [cited 2016 Dez 11]. Available from: Available from: https://www.who.int/hepatitis/publications/hep-elimination-by-2030-brief/en/ . [ Links ]
29 Cohn J, Roberts T, Amorosa V, Lemoine M, Hill A. Simplified diagnostic monitoring for hepatitis C, in the new era of direct-acting antiviral treatment. Curr Opin HIV AIDS. 2015 Sep;10(5):369-73. [ Links ]
Cómo citar este artículo / How to cite this article: Borges Neto FC, Souza MGL, Novaes ICRB, Silveira VS, Nunes MP, Miranda GCBM, et al. Efectividad del tratamiento con drogas antivirales de acción directa en pacientes con hepatitis C atendidos en un centro de referencia en el estado de Pará, Brasil, de 2017 a 2019. Rev Pan Amaz Saude. 2020;11:e202000468. Doi: http://dx.doi.org/10.5123/S2176-6223202000468
Recibido: 23 de Agosto de 2019; Aprobado: 08 de Junio de 2020











 texto em
texto em 


