INTRODUÇÃO
A industrialização e o crescimento desenfreado das atividades associadas à agricultura e ao comércio têm gerado consequências prejudiciais à saúde humana e ambiental. Diversos estudos evidenciaram a presença de resíduos de substâncias químicas nos alimentos, nas águas, no solo e em diversos organismos, devido ao uso indiscriminado de agrotóxicos, que possuem propriedades bioacumulativas1,2,3,4.
Dados do Sistema Nacional de Informações Tóxico-Farmacológicas (Sinitox) mostraram quase 30.000 casos de pessoas intoxicadas por agrotóxicos, no período de 2007 a 2014, o equivalente à média de oito intoxicações diárias. A mortalidade foi de 0,26% (78/30.000 casos)5,6. Com a atualização dos dados, no ano de 2017, foi verificado um aumento significativo tanto no número total de casos (76.115) como na média de intoxicação diária (cerca de 18), mas com a mortalidade no mesmo patamar5. Em 2019, o governo brasileiro liberou mais de 200 tipos de agrotóxicos, dos quais 43% são altamente tóxicos7.
Os pesticidas podem ser agrupados em duas categorias: químicos ou biológicos, de acordo com a Agência de Proteção Ambiental dos Estados Unidos (Environmental Protection Agency). Dentre a categoria dos químicos estão os organofosforados, carbamatos, organoclorados, piretroides e dicarboximidas8. Nessa última está o produto deste estudo, que é da classe dos herbicidas seletivos de ação não sistêmica do grupo químico ciclohexenodicarboximida, classificação dicarboximida, cujo mecanismo de ação está pautado na inibição da enzima protoporfirinogênio oxidase. Tais herbicidas necessitam ser ativados pela luz para promover a peroxidação de lipídios, que produzem espécies reativas de oxigênio e causam a morte da célula9. No Brasil, esse composto é classificado toxicologicamente como classe II e classe III quanto ao potencial de periculosidade ambiental e é usado para o controle de ervas daninhas, como a corda de viola (Ipomoea grandifolia) e a erva quente (Spermacoce latifolia), no cultivo da soja, feijão e algodão, e a poaia branca (Richardia brasiliensis), na cultura de milho10,11. Segundo a recomendação do fabricante, o herbicida com flumioxazina é perigoso ao meio ambiente e, pela classificação da Agência Internacional de Pesquisa em Câncer (International Agency for Research on Cancer)12, está incluído no grupo 3, portanto, não carcinogênico para humanos.
Dessa forma, a preocupação com a exposição a essas classes de agrotóxicos se deve ao fato da maioria desses agentes serem capazes de interagir com o material genético das células, causando lesões que não são possíveis de serem reparadas. Esse acúmulo de danos mutagênicos causa danos genotóxicos que acabam levando à carcinogênese13. Porém, vale ressaltar que todos os agentes mutagênicos são genotóxicos e nem todas as substâncias genotóxicas são mutagênicas, justamente porque nem todas são capazes de interagir diretamente com o DNA14. Tofolo et al.15 alertaram sobre esses riscos à saúde de agricultores submetidos à exposição de pesticidas. Profissionais da indústria agrária são os mais expostos a esses compostos ao manipular, diluir, preparar, aplicar e monitorar as lavouras; porém, não somente esses, mas também aqueles indiretamente expostos, como os indivíduos que moram próximos às lavouras e os familiares que entram em contato com a roupa do profissional que fez o uso de agrotóxicos16.
Alguns ensaios de avaliação de genotoxicidade são capazes de detectar aberrações cromossômicas, troca de cromátides irmãs e micronúcleos, enquanto que o ensaio cometa, que é um teste complementar, é utilizado para verificar danos no DNA de forma mais específica17,18. O bioensaio com Allium cepa utiliza o aparecimento de anormalidades cromossômicas como um de seus bioindicadores para analisar os efeitos tóxicos, citotóxicos, genotóxicos e mutagênicos de um composto químico em raízes de cebolas. Fiskesjö19 ressalta o uso de diferentes sistemas vegetais em ensaios testes para determinações de certos malefícios advindos de compostos químicos. Dentre os vegetais, espécies do gênero Allium são as mais utilizadas para estudos dos mecanismos básicos e de determinação dos efeitos de alguns agentes químicos. Apesar de existirem certas diferenças entre o metabolismo de vegetais e animais, a ativação pró-mutagênica em plantas possui alta relevância, pois seres humanos estão continuamente expostos a esses riscos ao consumir vegetais tratados com agentes químicos20. Dentro desse gênero, a Royal Swedish Academy of Sciences tem a espécie A. cepa como organismo modelo21, além de ser considerado padrão ouro na avaliação de efeitos clastogênicos e aneugênicos sobre o material genético22.
O composto escolhido como controle positivo, neste estudo, foi o benzoato de sódio 1%23,24,25. Um estudo avaliou o potencial citotóxico do glutamato monossódico e do benzoato de sódio 1% por A. cepa e observou toxicidade celular ao reduzir ou, até mesmo, inibir o crescimento das raízes e causar danos celulares. O mesmo estudo mostrou que o estresse nas raízes foi maior no tratamento com o benzoato de sódio 1%, evidenciado pela diferenciação celular precoce26. Esse composto foi utilizado como controle positivo para efeito de citotoxicidade e auxiliou na validação da técnica em relação à exposição dos bulbos a outra substância que não a testada.
Os ensaios utilizando A. cepa têm baixo custo e podem ser realizados em um curto período de tempo, auxiliando nos estudos de prevenção e controle de danos ao meio ambiente19. Além disso, destacam-se, ainda, por possuírem elevada sensibilidade e boa correlação com outros sistemas-testes, sendo possível realizar diversas exposições a um mesmo composto para fins de monitoramento. São testes fáceis que apresentam um crescimento rápido de suas raízes, além da facilidade na análise por gerar um grande número de células em divisão22,26.
Pela relevância em se investigar possíveis efeitos do uso de agrotóxicos e os riscos à saúde humana, o objetivo deste estudo foi investigar o potencial genotóxico de um herbicida com flumioxazina pelo bioensaio A. cepa em duas concentrações diferentes.
MATERIAIS E MÉTODOS
O presente estudo foi desenvolvido seguindo protocolos adaptados de Krüger23, e Aiub e Felzenswalb24.
PREPARO DA AMOSTRA
Foram utilizadas 30 cebolas, adquiridas comercialmente, de mesma procedência e tamanho, saudáveis e não enraizadas. Foi feita a raspagem superficial dos bulbos, os quais foram colocados em contato com água destilada, para crescimento das raízes, em copos descartáveis, suspensos por palitos de dente. Essa exposição foi feita no período da manhã, quando ocorre maior número de divisões mitóticas24. Foram assim mantidas durante 48 h23,24,25, com trocas dos copos e da água a cada 24 h para que não houvesse a proliferação de fungos. Os horários de troca foram definidos a partir da primeira exposição. Todos os 30 bulbos expostos à água destilada apresentaram crescimento das raízes após o período de exposição de 48 h.
Após esse período, os bulbos foram aleatoriamente distribuídos em quatro grupos: controle negativo (CN), com água destilada; controle positivo (CP), com benzoato de sódio 1%; teste 1, com a substância teste (flumioxazina) à concentração 0,5 g/L (concentração indicada para o uso); e teste 2, com flumioxazina a 1,0 g/L. A amostra foi então exposta por mais 48 h. Os grupos controle foram determinados de acordo com a proporção de 10% para o número total de cebolas testadas (N = 30), representando aproximadamente 30% do grupo teste (N = 10), isso é, 3CP e 3CN; para os grupos teste, 40% do total de bulbos, 12 em cada.
PREPARO PARA A ANÁLISE MACROSCÓPICA DE TOXICIDADE
Ao término do período de exposição de 48 h, foi feita a análise macroscópica das raízes. O número total de raízes de todos os 30 bulbos foi contabilizado, e o comprimento das três maiores raízes de cada bulbo foi medido com o auxílio de uma régua. Os resultados obtidos, em relação aos tamanhos das raízes (em centímetros) nas substâncias testes, foram comparados aos grupos controle (positivo e negativo) para determinação da toxicidade.
PREPARO PARA A ANÁLISE MICROSCÓPICA DE CITOTOXICIDADE E GENOTOXICIDADE
Na análise citotóxica, as raízes medidas na análise macroscópica foram colocadas sobre a lâmina de acordo com a indicação (por meio de uma seta) da direção da coifa, por ser essa a parte da raiz com maior número de células novas e em divisão celular. As raízes foram então submetidas à coloração com orceína-acética 2% e aquecidas no bico de Bunsen para fixação e ruptura da parede celular. Foi feita a lavagem das raízes com água destilada para a remoção do excesso de corante e, em seguida, o esmagamento manual com lamínula. Foram contadas 1.000 células em cada uma das raízes. O índice mitótico (IM) foi obtido por meio do total de células em divisão (prófases, pré-metáfases, metáfases, pré-anáfases, anáfases e telófases) em cada 1.000 células analisadas, conforme fórmula a seguir23:
Para a contagem de aberrações cromossômicas (AC), visando à análise da genotoxicidade, foram quantificadas as seguintes anormalidades: micronúcleos, pontes anafásicas, cromossomos retardatários, quebra cromossômica, anormalidades do fuso e alterações nucleolares. O número total de AC encontradas em 1.000 células foi dividido por 1.000 e multiplicado por 100.
A presença de micronúcleos foi o parâmetro utilizado para analisar o efeito mutagênico. A quantificação foi feita por meio do número de micronúcleos contados em 1.000 células por raiz. No presente estudo, essa presença foi associada ao parâmetro de mutagenicidade, conforme Leme e Marin-Morales25 e Carvalho et al.27.
ANÁLISE ESTATÍSTICA
A análise estatística foi realizada por meio do programa SPSS v17.0. Foi realizado o teste de normalidade Kolmogorov-Smirnov. As correlações dos fatores interferentes no crescimento das raízes foram realizadas pelo teste de correlação de Spearman's Rho. As análises de comparação entre os grupos foram obtidas por meio dos testes não paramétricos para amostras independentes (Kruskal-Wallis, para mais de duas amostras, e Mann-Whitney para duas amostras), considerando significante quando p < 0,05.
RESULTADOS
ANÁLISE MACROSCÓPICA DAS RAÍZES
A análise macroscópica foi realizada de forma descritiva em relação ao número, tamanho (Tabela 1) e aspecto das raízes.
Tabela 1 - Média e desvio padrão dos grupos controle e teste, de acordo com o número de raízes de cada bulbo de A. cepa e o tamanho, em cm, das três maiores
| Grupos | Número de raízes | Tamanho (cm) |
|---|---|---|
| Controle negativo | 25 ± 3,46 (mín. = 21; máx. = 27) | 1,05 ± 0,08 |
| Controle positivo | 18 ± 5,30 (mín. = 14; máx. = 24) | 0,32 ± 0,01 |
| Flumioxazina 0,5 g/L | 27 ± 12,10 (mín. = 9; máx. = 44) | 1,23 ± 0,02 |
| Flumioxazina 1,0 g/L | 31 ± 13,60 (mín. = 14; máx. = 68) | 1,00 ± 0,03 |
mín.: Mínimo; máx.: Máximo.
Com relação ao aspecto, os bulbos tratados com o CP apresentaram inibição no crescimento das raízes (Figura 1A). No tratamento com flumioxazina 0,5 g/L (Figura 1B), não houve inibição do crescimento. Raízes endurecidas, escuras e contorcidas, bem como a presença de necrose nas pontas, foram observadas em ambas as concentrações do herbicida (Figuras 1B e 1C).
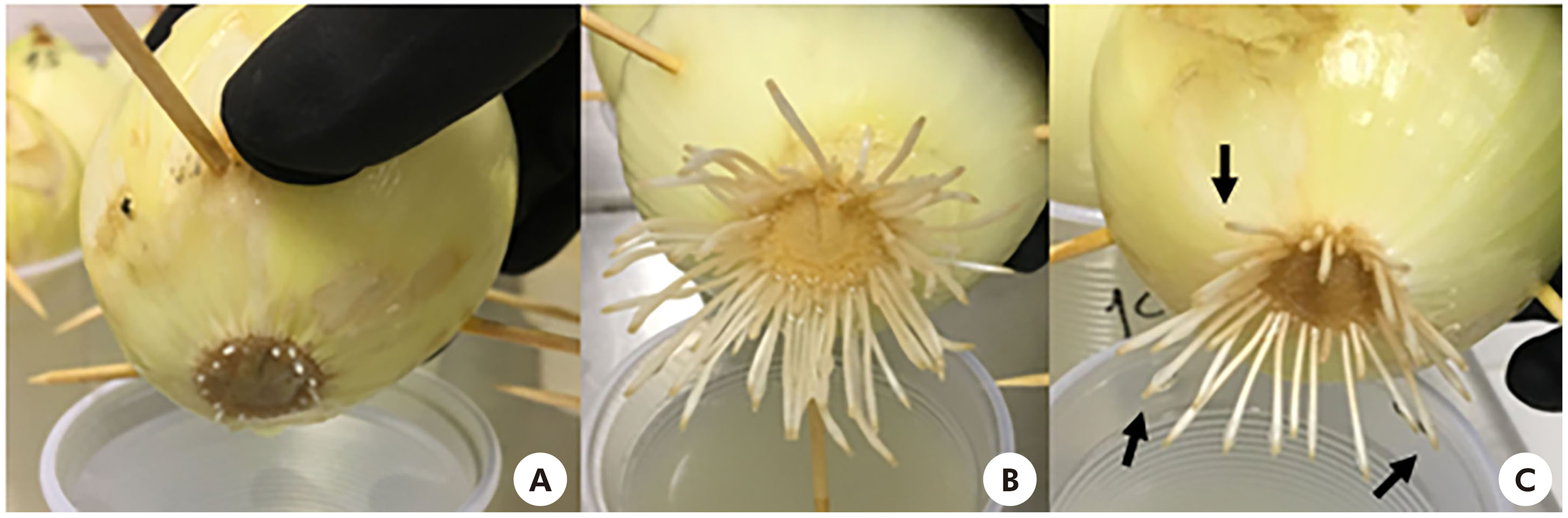
Fotos: Lais Gonçalves Parvan.
A: Inibição do crescimento da raiz tratada com benzoato de sódio 1% (CP); B: Raízes tratadas com flumioxazina 0,5 g/L; C: Anormalidades, como necrose (setas) e escurecimento da raiz, observadas em ambas as concentrações do herbicida.
Figura 1 - Bulbos de A. cepa após a completa exposição à flumioxazina
ANÁLISE MICROSCÓPICA DAS RAÍZES
O efeito citotóxico das cebolas foi analisado pelo cálculo do IM (Tabela 2), o efeito genotóxico por contagem de AC e o efeito mutagênico por contagem de micronúcleos. A citotoxicidade foi calculada observando células em todas as fases do ciclo: prófases, pré-metáfases, metáfases, pré-anáfases, anáfases e telófases24.
Tabela 2 - Resultado dos valores do IM de cada grupo
| Grupos | IM (média ± desvio padrão) |
|---|---|
| Controle negativo | 0,0003 ± 0,0005 (mín. = 0; máx. = 0,0001) |
| Controle positivo | 0,0036 ± 0,005 (mín. = 0,00008; máx. = 0,007) |
| Flumioxazina 0,5 g/L | 0,0033 ± 0,0037 (mín. = 0,00016; máx. = 0,012) |
| Flumioxazina 1,0 g/L | 0,0020 ± 0,0041 (mín. = 0; máx. = 0,01) |
mín.: Mínimo; máx.: Máximo.
A frequência de AC foi apresentada na tabela 3. Não foram observadas AC no grupo CN. A análise microscópica das raízes nas concentrações teste mostrou AC como pontes anafásicas (Figuras 2A-B), anormalidades do fuso (Figura 2C), metáfase com quebra cromossômica (Figura 2D), cromossomos vagantes (Figuras 2E-F), metáfase anormal (Figura 2G), micronúcleos (Figura 2H) e células necróticas (Figura 2I).
Tabela 3 - Frequência de AC entre os grupos
| Grupos | AC (média ± desvio padrão) |
|---|---|
| Controle negativo | - |
| Controle positivo | 0,0002 ± 0,00021 (mín. = 0,00005; máx. = 0,00035) |
| Flumioxazina 0,5 g/L | 0,01 ± 0,01 (mín. = 0; máx. = 0,0002) |
| Flumioxazina 1,0 g/L | 0,00004 ± 0,00005 (mín. = 0; máx. = 0,00016) |
mín.: Mínimo; máx.: Máximo; Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
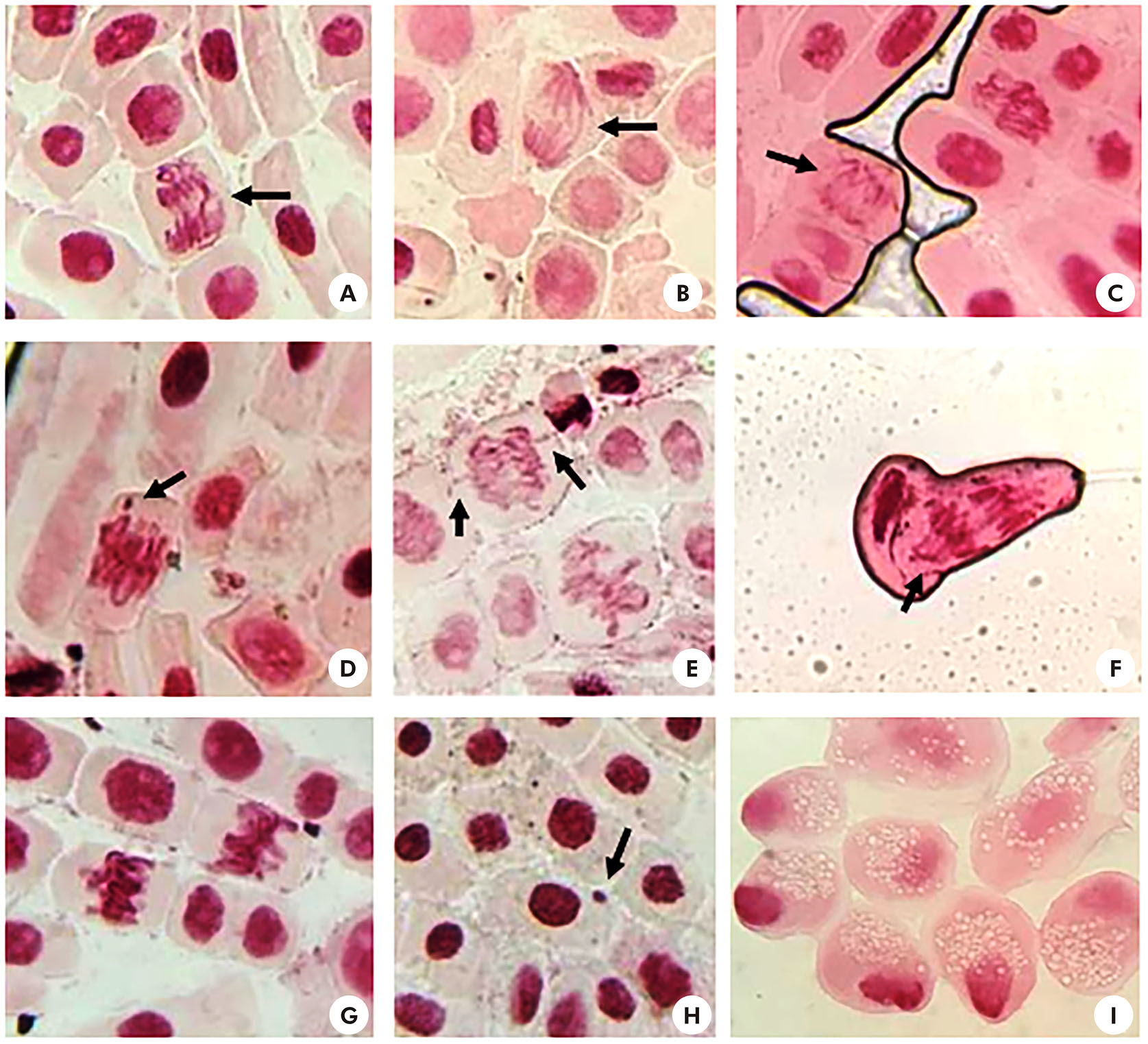
Fotos: Lais Gonçalves Parvan.
Aumento de 40x. A-B: ponte anafásica (seta); C: anormalidades do fuso (seta); D: metáfase com quebra cromossômica (seta); E-F: cromossomo vagante (seta); G: metáfase anormal; H: micronúcleo (seta); I: células necróticas.
Figura 2 - Células meristemáticas de A. cepa tratadas com flumioxazina nas concentrações 0,5 e 1,0 g/L
Os grupos CN e CP não apresentaram micronúcleos em 1.000 células contadas. As cebolas testadas em flumioxazina (0,5 g/L) apresentaram média de 0,1 ± 0,13 (mín. = 0; máx. = 0,4), enquanto as testadas em concentração 1,0 g/L apresentaram média de 0,3 ± 0,7 (mín. = 0; máx. = 0,2).
ANÁLISE ENTRE OS GRUPOS
Macroscopicamente, o número e o tamanho das raízes de cada grupo foram comparados. Houve associação entre as substâncias testadas e o tamanho das raízes quando analisadas entre todos os grupos (p = 0,03). Porém, não houve associação entre o número de raízes e as substâncias testadas (p = 0,06) (Tabela 4).
Tabela 4 - Análise geral entre os grupos testados
| Grupos | Análise macroscópica | Análise microscópica | |||
|---|---|---|---|---|---|
| Nº de raízes | Tamanho (cm) | IM (análise de efeito citotóxico) | AC (análise de efeito genotóxico) | Micronúcleos (análise de efeito mutagênico) | |
| Controle negativo | 25 | 1,05 | 0,0003 | - | - |
| Controle positivo | 18 | 0,32 | 0,0036 | 0,0002 | - |
| Flumioxazina 0,5 g/L | 27 | 1,23 | 0,0033 | 0,01 | 0,1 |
| Flumioxazina 1,0 g/L | 31 | 1,00 | 0,0020 | 0,00004 | 0,3 |
| Estatisticamente significante? | Não (p = 0,06) | Sim, entre todos os grupos (p = 0,03) | Sim CN x Flumioxazina 0,5 g/L (p = 0,018) | Sim CN x Flumioxazina 0,5 g/L (p = 0,002) e CN x Flumioxazina 1,0 g/L (p = 0,013) | Não (p > 0,05) |
Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
Microscopicamente, o IM foi comparado entre os grupos (Tabela 4). Foi demonstrado o efeito citotóxico do herbicida com flumioxazina na concentração 0,5 g/L pela diferença significativa encontrada, quando comparado ao CN.
Entre os grupos, houve diferença estatisticamente significante em relação à presença de AC, quando comparado ao CN (p = 0,04). As AC encontradas no herbicida com flumioxazina 0,5 g/L apresentaram essa diferença, quando comparadas ao CN (p = 0,002), assim como na concentração 1,0 g/L (p = 0,013). Esses resultados sugerem genotoxicidade do herbicida por intervirem no número de AC observadas, quando comparados ao grupo CN (Tabela 4).
Com relação à mutagenicidade, apesar de ter sido observada a presença de micronúcleos em ambas as concentrações testadas, não foi possível observar efeito mutagênico, visto que os resultados estatísticos não foram significantes (p > 0,05). Na comparação da quantidade de micronúcleos encontrada nos grupos CP e CN com os grupos teste, também não foi verificada diferença estatisticamente significante (p > 0,05) (Tabela 4).
DISCUSSÃO
O herbicida com flumioxazina foi escolhido por ser utilizado por agricultores na região da Zona da Mata, no estado de Minas Gerais, principalmente em culturas de soja e feijão12. O estudo mostrou que o herbicida, em ambas as concentrações testadas, foi tóxico às raízes ao provocar alterações nas células vegetais aqui analisadas, como necroses nas pontas.
Na análise microscópica, foi possível constatar que o herbicida com flumioxazina, na concentração recomendada para o uso (0,5 g/L), apresentou sinais de citotoxicidade. Além disso, foram verificados efeitos de genotoxicidade em ambas as concentrações testadas, por provocar AC nas células da cebola.
Embora tenham sido observados micronúcleos nas concentrações testadas, não foi encontrada significância estatística quando comparadas aos grupos CN e CP. Os micronúcleos podem ser originados de forma espontânea, portanto, novos estudos devem ser realizados para verificar a formação dos mesmos.
O fato desse herbicida ter apresentado efeito citotóxico e genotóxico mostra a importância do monitoramento dessas substâncias químicas e seus efeitos nos organismos vivos, visto que as alterações provocadas a nível molecular afetaram diretamente o material genético na amostra analisada.
O teste A. cepa já foi utilizado em várias análises, como na avaliação da genotoxicidade de medicamentos28, de infusões de plantas medicinais29 e na avaliação da qualidade de águas de rios30. É um teste que, quando necessário, pode ser complementado pelo teste cometa na análise de fragmentação do DNA das células, para que os efeitos encontrados sejam adequadamente associados e ter sua causa investigada. Sugere-se que o teste cometa seja realizado para complementar os testes de genotoxicidade, e que um número maior de bulbos para os controles seja adicionado para aumentar o poder estatístico na comparação entre os grupos.
Krüger23 e Leme e Marin-Morales25 consideraram, como efeito de toxicidade, a inibição do crescimento radicular. No presente estudo, dois fatores foram analisados para determinar a toxicidade: a alteração do tamanho/número e as AC das raízes. O efeito tóxico pode ser mascarado pela presença de macronutrientes inorgânicos (por exemplo, nitrogênio e fósforo), resultando em alongamento das raízes da cebola31. Porém, a determinação do efeito tóxico foi baseada na presença de AC, como necroses, raízes distorcidas e escurecidas, observadas no tratamento com flumioxazina em ambas as concentrações.
As plantas possuem mecanismos de autodefesa que podem ser enfraquecidos quando são expostas a situações de estresse ambiental. Por isso, o uso excessivo de defensivos, além de nem sempre deter as pragas, pode provocar o surgimento de doenças nas plantas. Assim, o herbicida como agente estressor pode ser prejudicial às raízes, provocando alterações radiculares e morte prematura das mesmas32.
A citotoxicidade foi analisada pela determinação do IM, que é utilizado como um biomarcador de proliferação celular ao medir a proporção de células em divisão nas diversas fases do ciclo celular25,33. O presente estudo identificou citotoxicidade na concentração 0,5 g/L ao apresentar diferenças estatisticamente significantes do IM, quando comparado ao grupo CN. Tanto o aumento quanto a diminuição desse índice indicam citotoxicidade: o aumento sugere desordem celular ao provocar a multiplicação das divisões celulares; e a redução indica dano no DNA, que leva à parada no ciclo celular na tentativa de reparo25. Houve associação do IM com o herbicida na concentração 0,5 g/L e o CN quando associado às AC (p = 0,018), sugerindo que quanto maior IM, maior o número de AC.
Vale ressaltar que o aumento do IM pode estar relacionado ao aumento no tamanho das raízes. Dois estudos constataram o mesmo efeito ao analisar a citotoxicidade de águas de rios, observando que, quanto maior o IM, maior o tamanho das raízes34,35. Do mesmo modo, diversos estudos demonstraram essa relação ao observar que a diminuição desse índice também causa inibição do crescimento radicular23,35,36.
A presença de AC foi associada ao efeito genotóxico. As substâncias genotóxicas nem sempre interagem diretamente com o DNA. Porém, aquelas capazes de causar essa interferência induzem danos ao material genético nas células por meio de interações com a sequência e a estrutura do DNA. Essas anomalias cromossômicas em células de A. cepa são um parâmetro eficiente para a investigação do potencial genotóxico de compostos químicos, pois fornecem informações que devem ser consideradas essenciais no processo de carcinogênese25. Agentes genotóxicos são capazes de atuar amplamente sobre a célula, seja na organização de suas organelas ou de seus compartimentos, além de causar alterações que podem afetar o ciclo celular, desregulando suas fases, gerando células aberrantes e, até mesmo, induzi-las à morte37.
O presente estudo sugeriu efeito genotóxico do herbicida com flumioxazina nas duas concentrações testadas e ainda demonstrou a associação entre o número de AC e IM. É conhecida a capacidade de herbicidas provocarem anomalias celulares. Plantas de sorgo tratadas com o herbicida Atrazina apresentaram maior número de cromossomos, células binucleadas e anormalidades em células-mãe de grãos-de-pólen, o que comprova a interferência do herbicida na estabilidade da meiose38.
Efeitos clastogênicos (quebras no DNA) nas espécies Pisum sativum e A. cepa, induzidas pelo tratamento com herbicidas, também demonstram efeitos de indução a quebras cromossômicas no DNA39. Fernandes2 considerou uma ação aneugênica que impede a segregação simétrica do material genético durante a divisão celular, levando a um desequilíbrio genômico. Pelos resultados deste estudo, é possível sugerir ações aneugênicas pela presença de cromossomos vagantes e retardatários, ou seja, que não foram segregados corretamente, bem como ações clastogênicas, principalmente nas amostras tratadas com o benzoato de sódio 1%, por apresentar essa ação conhecida.
Também foi possível observar a presença de necrose, em nível microscópico, na concentração de 1,0 g/L (Figura 2I), que pode ser explicada pela resposta da célula a danos irreversíveis provocados no material genético40. Diferentes mecanismos de manutenção da homeostase celular estão ligados ao processo de divisão celular, ao metabolismo celular e à morte celular. Falhas nesses mecanismos por falta de reparo podem promover a transformação neoplásica e caracterizar o início do processo de formação de tumores. Dessa forma, células não reparadas são encaminhadas para o processo de morte celular, também chamado de necroptose na patologia, ou necrose celular programada, no intuito de evitar o desencadeamento de tumores41. Por isso, é importante estudar fatores e/ou substâncias que podem interferir no ciclo celular, como realizado neste estudo.
Na investigação da mutagenicidade, a análise foi feita por meio da contagem de micronúcleos. Existem divergências no conceito de mutagenicidade por diferentes autores. Leme e Marin-Morales25 e Carvalho et al.27 consideram a presença dos micronúcleos como um parâmetro para mutagenicidade, enquanto Krüger23 e Fenech42 consideram como parâmetro de genotoxicidade. Micronúcleos se originam de fragmentos cromossômicos acêntricos ou são formados em células em divisão que apresentam fragmentos cromossômicos inteiros que interromperam a capacidade de se ligar ao fuso mitótico, ou seja, não completam a migração anafásica da divisão celular42. Tal característica indica a presença de substâncias com efeitos mutagênicos.
O presente estudo, apesar de apresentar células com a presença de micronúcleos nas raízes tratadas com flumioxazina nas concentrações testadas, não confirmou a mutagenicidade do composto por não apresentar significância estatística quando comparados ao grupo CN e CP. A indução de micronúcleos é comumente usada na detecção de danos genotóxicos e mutagênicos resultantes da exposição a agentes tóxicos. Porém, os micronúcleos também podem se originar espontaneamente43, podendo ser da ordem de 3/1.000 células analisadas42,44. Assim, o efeito mutagênico, devido à presença de micronúcleos em uma substância testada, deve ser criteriosamente analisado.
Quanto aos efeitos genotóxicos, uma revisão sistemática de publicações sobre o impacto do uso de agrotóxicos no meio ambiente, produzidas no período de 2011 a 2017, evidenciou o prejuízo causado pelo uso dessas substâncias, muitas vezes, por alterarem o habitat natural dos ecossistemas45. Esses riscos não são somente para o meio ambiente, mas também para a saúde humana, principalmente de agricultores e manipuladores que são sucessivamente submetidos à exposição de pesticidas. O não uso de proteções adequadas e o desrespeito aos limites de concentrações de uso permitidos pelos órgão de fiscalização aumentam os problemas de saúde e os danos ambientais15.
O mapa de uso de agrotóxicos nos municípios do sudoeste do Paraná mostrou que a produção de commodities, como soja, milho e trigo, tem sido responsável pelo consumo exorbitante de agrotóxicos nos municípios em questão, de modo que os principais ingredientes ativos utilizados desencadeiam alto risco de contaminação ambiental e também para a saúde humana. O herbicida abordado neste estudo é muito utilizado no Brasil no controle de ervas daninhas nessas culturas46.
É importante conhecer os efeitos e possíveis riscos relacionados às exposições excessivas aos agrotóxicos utilizados. Os testes de monitoramento dessas substâncias, quer os que indicam o grau de exposição genotóxica dos indivíduos, como o bioensaio com A. cepa, ou aqueles que determinam os efeitos desses compostos in vitro, são fundamentais ao monitorar as implicações futuras à saúde humana.
As exposições excessivas aos agrotóxicos não estão somente nos alimentos contendo resíduos, mas também no contato dos trabalhadores rurais e familiares que, ao manipularem esses compostos, tornam-se os mais suscetíveis aos danos. Um dos problemas das sucessivas exposições a esses herbicidas está no fato de que eles levam a um acúmulo de mutações que, em um momento superior, poderão provocar alterações mutagênicas e carcinogênicas. O desenvolvimento do câncer não representa o único dano de exposição a essas substâncias; as intoxicações agudas e crônicas também podem ocorrer. O uso de monitores ambientais para a avaliação das atividades citotóxicas, genotóxicas e mutagênicas de químicos ambientais, principalmente os agrotóxicos, deve ser considerado como potencial indicador de risco para a saúde humana e para o meio ambiente.
CONCLUSÃO
O herbicida com flumioxazina, em ambas as concentrações, apresentou efeitos de toxicidade devido às necroses e anomalias observadas em suas raízes. A citotoxicidade foi detectada na concentração de uso, e a genotoxicidade foi observada nas duas concentrações testadas. Efeitos mutagênicos não foram constatados.










 text in
text in 


