Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Pan-Amazônica de Saúde
versión impresa ISSN 2176-6215versión On-line ISSN 2176-6223
Rev Pan-Amaz Saude vol.11 Ananindeua 2020 Epub 14-Sep-2020
http://dx.doi.org/10.5123/s2176-6223202000544
ARTÍCULO ORIGINAL
Bioensayo con Allium cepa revela genotoxicidad de herbicida con flumioxazin
1 Centro Universitário UNIFAMINAS, Muriaé, Minas Gerais, Brasil
2 Instituto Federal de Educação, Ciência e Tecnologia do Sudeste de Minas Gerais, Muriaé, Minas Gerais, Brasil
3 Fundação Cristiano Varella, Hospital do Câncer de Muriaé, Muriaé, Minas Gerais, Brasil
4 Universidade Federal do Estado do Rio de Janeiro, Programa de Pós-Graduação em Neurologia, Rio de Janeiro, Rio de Janeiro, Brasil
OBJETIVO:
Analizar el potencial genotóxico de un herbicida con flumioxazin por el bioensayo Allium cepa.
MATERIALES Y MÉTODOS:
El herbicida fue probado en dos concentraciones: 0,5 g/L (concentración indicada para el uso) y 1,0 g/L (doble de la concentración recomendada). Se utilizó agua destilada como control negativo y, como control positivo de citotoxicidad, benzoato de sodio 1%.
RESULTADOS:
Los resultados mostraron efectos de toxicidad en ambas concentraciones de herbicidas. Se observaron efectos de citotoxicidad en el herbicida con flumioxazina a una concentración de 0,5 g/L, que presentó un patrón microscópico igual al de control positivo. Los efectos de genotoxicidad se observaron en ambas concentraciones (0,5 g/L y 1,0 g/L) que dieron lugar a aberraciones cromosómicas en las células, mostrando que el herbicida interfiere directamente en el ciclo celular de las células vegetales de la cebolla.
CONCLUSIÓN:
El herbicida con flumioxazina presentó toxicidad y genotoxicidad en las concentraciones analizadas y efectos de citotoxicidad solamente en la concentración recomendada para el uso.
Palabras clave: Genotoxicidad; Allium cepa; Herbicidas; Índice Mitótico
INTRODUCCIÓN
La industrialización y el crecimiento desenfrenado de las actividades asociadas a la agricultura y al comercio ha generado consecuencias perjudiciales para la salud humana y ambiental. Diversos estudios evidenciaron la presencia de residuos de sustancias químicas en los alimentos, en las aguas, en el suelo y en diversos organismos, debido al uso indiscriminado de agrotóxicos, que poseen propiedades bioacumulativas1,2,3,4.
Datos del Sistema Nacional de Información Tóxico-Farmacológica (Sinitox) mostraron casi 30.000 casos de personas intoxicadas por plaguicidas, en el periodo de 2007 a 2014, equivalentes al promedio de ocho intoxicaciones diarias. La mortalidad fue de 0,26% (78/30.000 casos)5,6. Con la actualización de los datos, en 2017, se producía un aumento significativo tanto en el número total de casos (76.115) como en la intoxicación media diaria (unos 18), pero con la mortalidad en el mismo nivel5. En 2019, el gobierno brasileño liberó más de 200 tipos de pesticidas, de los cuales el 43% son altamente tóxicos7.
Los pesticidas se pueden agrupar en dos categorías: químicos o biológicos, según la Agencia de Protección Ambiental de los Estados Unidos. Entre la categoría de químicos se encuentran organofosforados, carbamatos, organoclorados, piretroides y dicarboxídos8. En este último se encuentra el producto de este estudio, que es de la clase de herbicidas selectivos de acción no sistémica del grupo químico ciclohexano dicarboximida, clasificación dicarboximida, cuyo mecanismo de acción se basa en la inhibición de la enzima protoporfirinógeno oxidasa. Tales herbicidas necesitan ser activados por la luz para promover la peroxidación de los lípidos, que producen especies reactivas de oxígeno y causan la muerte celular9. En Brasil, este compuesto se clasifica toxicológicamente como clase II y clase III en cuanto al potencial de peligrosidad ambiental y se utiliza para el control de malezas, como la cuerda de viola (Ipomoea grandifolia) y la hierba caliente (Spermacoce latifolia),en el cultivo de soja, porotos y algodón, y Richardia brasiliensis, en cultivos de maíz10,11. Según la recomendación del fabricante, el herbicida con flumioxazin es peligroso para el medio ambiente y, según la clasificación de la Agencia Internacional para la Investigación del Cáncer (International Agency for Research on Cancer)12, está incluido en el grupo 3, por lo tanto, no carcinogénico para los seres humanos.
Por lo tanto, la preocupación con la exposición a estas clases de pesticidas se debe al hecho de que la mayoría de estos agentes son capaces de interactuar con el material genético de las células, causando lesiones que no son reparables. Esta acumulación de daño mutagénico causa daños genotóxicos que eventualmente conducen a la carcinogénesis13. Sin embargo, vale la pena mencionar que todos los agentes mutagénicos son genotóxicos y no todas las sustancias genotóxicas son mutagénicas, precisamente porque no todos son capaces de interactuar directamente con el ADN14. Tofolo et al.15 advirtieron de estos riesgos para la salud de los agricultores que están sujetos a la exposición a plaguicidas. Los profesionales de la industria agraria son los más expuestos a estos compuestos a la hora de manipular, diluir, preparar, aplicar y monitorear los cultivos; sin embargo, no solo estos, sino también los indirectamente expuestos, como los individuos que viven cerca de los cultivos y los miembros de la familia que entran en contacto con la ropa del profesional que hizo uso de pesticidas16.
Algunos ensayos de evaluación de genotoxicidad son capaces de detectar aberraciones cromosómicas, intercambio de cromátidas hermanas y micronúcleos, mientras que el ensayo cometa, que es una prueba complementaria, se utiliza para verificar el daño del ADN más específicamente17,18. El bioensayo con Allium cepa utiliza la aparición de anomalías cromosómicas como uno de sus bioindicadores para analizar los efectos tóxicos, citotóxicos, genotóxicos y mutagénicos de un compuesto químico en las raíces de cebolla. Fiskesjö19 destaca el uso de diferentes sistemas vegetales en pruebas para determinar ciertos daños derivados de compuestos químicos. Entre las plantas, las especies del género Allium son las más utilizadas para estudios de los mecanismos básicos y determinación de los efectos de algunos agentes químicos. Aunque existen ciertas diferencias entre el metabolismo de vegetales y animales, la activación pro-mutagénica en plantas tiene una alta relevancia, ya que los humanos estamos continuamente expuestos a estos riesgos al consumir vegetales tratados con agentes químicos20. Dentro de este género, la Royal Swedish Academy of Sciences cuenta con la especie A. cepa como organismo modelo21, además de ser considerado el estándar oro en la evaluación de efectos clastogénicos y aneugénicos sobre material genético22.
El compuesto elegido como control positivo en este estudio fue el benzoato de sodio al 1%23,24,25. Un estudio evaluó el potencial citotóxico del glutamato monosódico y el benzoato de sodio al 1% por A. cepa y observó toxicidad celular al reducir o incluso inhibir el crecimiento de las raíces y causar daño celular. El mismo estudio mostró que el estrés en las raíces fue mayor en el tratamiento con benzoato de sodio 1%, evidenciado por la diferenciación celular temprana26. Este compuesto se utilizó como control positivo del efecto de citotoxicidad y ayudó en la validación de la técnica en relación con la exposición de los bulbos a sustancias distintas de las probadas.
Las pruebas que utilizan A. cepa tienen bajo costo y se pueden realizar en un corto período de tiempo, ayudando en estudios de prevención y control de daños al medio ambiente19. Además, también se destacan porque tienen alta sensibilidad y buena correlación con otros sistemas de ensayo, siendo posible realizar varias exposiciones al mismo compuesto con fines de monitoreo. Son pruebas fáciles que presentan un rápido crecimiento de las raíces, además de la facilidad en el análisis, al generar un gran número de células en división22,26.
Debido a la relevancia de investigar los posibles efectos del uso de plaguicidas y los riesgos para la salud humana, el objetivo de este estudio fue investigar el potencial genotóxico de un herbicida con flumioxazina mediante el bioensayo A. cepa en dos concentraciones diferentes.
MATERIALES Y MÉTODOS
El presente estudio se desarrolló siguiendo protocolos adaptados de Krüger23, y Aiub y Felzenswalb24.
PREPARACIÓN DE LA MUESTRA
Se utilizaron treinta cebollas adquiridas comercialmente, del mismo origen y tamaño, sanas y sin raíces. Se realizó el raspado superficial de los bulbos, que se pusieron en contacto con agua destilada, para el crecimiento de la raíz, en vasos desechables, suspendidos por palillos de dientes. Esta exposición se realizó por la mañana, cuando hay un mayor número de divisiones mitóticas24. Se mantuvieron así durante 48h23,24,25, con cambios de vasos y de agua a cada 24 h para que no hubiera proliferación de hongos. Los horarios de cambio se definieron desde la primera exposición. Los 30 bulbos expuestos al agua destilada mostraron crecimiento de raíces después del período de exposición de 48 h.
Después de este período, los bulbos se distribuyeron aleatoriamente en cuatro grupos: control negativo (CN), con agua destilada; control positivo (CP), con benzoato de sodio al 1%; ensayo 1, con la sustancia de ensayo (flumioxazina) en concentración de 0,5 g/L (concentración indicada para su uso); y la prueba 2, con flumioxazina a 1,0 g/L. La muestra se expuso durante otras 48 h. Los grupos control se determinaron de acuerdo con la proporción del 10% para el número total de cebollas probadas (N = 30), representando aproximadamente el 30% del grupo de prueba (N = 10), es decir, 3CP y 3CN; para los grupos de prueba, el 40% del total de bulbos, 12 en cada uno.
PREPARACIÓN PARA EL ANÁLISIS MACROSCÓPICO DE TOXICIDAD
Al final del período de exposición de 48 horas, se realizó un análisis macroscópico de la raíz. Se contó el número total de raíces de los 30 bulbos, y se midió la longitud de las tres raíces más grandes de cada bulbo con la ayuda de una regla. Los resultados obtenidos en relación con los tamaños de las raíces (en centímetros) en las sustancias de ensayo se compararon con los grupos de control (positivo y negativo) para determinar la toxicidad.
PREPARACIÓN PARA EL ANÁLISIS MICROSCÓPICO DE CITOTOXICIDAD Y GENOTOXICIDAD
En el análisis citotóxico, las raíces medidas en el análisis macroscópico se colocaron en la lámina de acuerdo con la indicación (por medio de una flecha) de la dirección de la campana, porque esta es la parte de la raíz con el mayor número de nuevas células y división celular. Las raíces se sometieron a tinción orceína-acética al 2% y se calentaron en el mechero de Bunsen para la fijación y ruptura de la pared celular. Las raíces se lavaron con agua destilada para eliminar el exceso de tinte y luego se trituraron manualmente con lámina. Se contaron 1.000 células en cada una de las raíces. El índice mitótico (IM) se obtuvo a través del total de células en división (profases, prometafase, metafase, anafase y telofase) en cada 1.000 células analizadas, según la siguiente fórmula23:
Para el conteo de aberraciones cromosómicas (AC), con el objetivo de analizar la genotoxicidad, se cuantificaron las siguientes anormalidades: micronúcleos, puentes anafásicos, cromosomas retardatarios, quiebra cromosómica, anormalidades del huso y alteraciones nucleares. El número total de AC encontradas em 1.000 células fue dividido por 1.000 e multiplicado por 100.
La presencia de micronúcleos fue el parámetro utilizado para analizar el efecto mutagénico. La cuantificación se realizó por el número de micronúcleos contabilizados en 1.000 células por raíz. En el estudio, esta presencia se asoció con el parámetro de mutagenicidad, según Leme y Marin-Morales25 y Carvalho et al.27.
ANÁLISIS ESTADÍSTICO
El análisis estadístico se realizó utilizando el programa SPSS v17.0. Se realizó la prueba de normalidad de Kolmogorov-Smirnov. Las correlaciones de los factores que interfieren en el crecimiento de las raíces se realizaron mediante la prueba de correlación de Spearman's Rho. Los análisis de comparación entre los grupos se obtuvieron mediante pruebas no paramétricas para muestras independientes (Kruskal-Wallis, para más de dos muestras, y Mann-Whitney para dos muestras), considerándolas significativas cuando p < 0,05.
RESULTADOS
ANÁLISIS MACROSCÓPICO DE LAS RAÍCES
El análisis macroscópico se realizó de forma descriptiva en relación al número, tamaño (Tabla 1) y aspecto de las raíces.
Tabla 1 - Mediana y desvío estándar de los grupos control y prueba, de acuerdo con el número de raíces de cada bulbo de A. cepa y el tamaño, en cm, de las tres mayores
| Grupos | Número de raíces | Tamaño (cm) | |
|---|---|---|---|
| Control negativo | 25 ± 3,46 (mín. = 21; máx. = 27) | 1,05 ± 0,08 | |
| Control positivo | 18 ± 5,30 (mín. = 14; máx. = 24) | 0,32 ± 0,01 | |
| Flumioxazin 0,5 g/L | 27 ± 12,10 (mín. = 9; máx. = 44) | 1,23 ± 0,02 | |
| Flumioxazin 1,0 g/L | 31 ± 13,60 (mín. = 14; máx. = 68) | 1,00 ± 0,03 |
mín.: Mínimo; máx.: Máximo.
En cuanto al aspecto, los bulbos tratados con CP mostraron inhibición en el crecimiento radicular (Figura 1A). En el tratamiento con flumioxazina 0,5 g/L (Figura 1B) no hubo inhibición del crecimiento. Se observaron raíces endurecidas, oscuras y retorcidas, bien como la presencia de necrosis en las puntas, en ambas concentraciones de herbicidas (Figuras 1B y 1C).
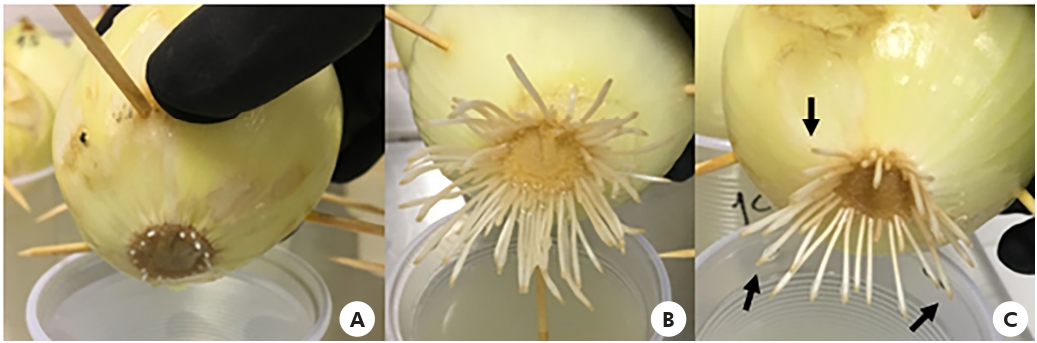
Fotos: Lais Gonçalves Parvan.
A: Inhibición del crecimiento radicular tratada con benzoato de sodio al 1% (CP); B: Raíces tratadas con flumioxazina 0,5 g/L; C: Anomalías, como necrosis (flechas) y oscurecimiento de la raíz, observadas en ambas concentraciones de herbicidas.
Figura 1 - Bulbos de A. cepa luego de la completa exposición a la flumioxazina
ANÁLISIS MICROSCÓPICO DE LAS RAÍCES
El efecto citotóxico de las cebollas se analizó calculando THE (Tabla 2), el efecto genotóxico por recuento de CA y el efecto mutagénico por recuento de micronúcleos. La citotoxicidad se calculó observando células en todas las fases del ciclo: profases, pre metafases, metafases, prefases, anafases y telofases24.
Tabla 2 - Resultado de los valores del IM de cada grupo
| Grupos | IM (media ± desvío estándar) | |
|---|---|---|
| Control negativo | 0,0003 ± 0,0005 (mín. = 0; máx. = 0,0001) | |
| Control positivo | 0,0036 ± 0,005 (mín. = 0,00008; máx. = 0,007) | |
| Flumioxazin 0,5 g/L | 0,0033 ± 0,0037 (mín. = 0,00016; máx. = 0,012) | |
| Flumioxazin 1,0 g/L | 0,0020 ± 0,0041 (mín. = 0; máx. = 0,01) |
mín.: Mínimo; máx.: Máximo.
La frecuencia de AC fue presentada en la tabla 3. No se observaron AC en el grupo CN. El análisis microscópico de las raíces en las concentraciones test mostró AC como puentes anafásicos (Figuras 2A-B), anormalidades del huso (Figura 2C), metafase con quiebra cromosómica (Figura 2D), cromosomas vagantes (Figuras 2E-F), metafase anormal (Figura 2G), micronúcleos (Figura 2H) y células necróticas (Figura 2I).
Tabla 3 - Frecuencia de AC entre los grupos
| Grupos | AC (media ± desvío estándar) | |
|---|---|---|
| Control negativo | - | |
| Control positivo | 0,0002 ± 0,00021 (mín. = 0,00005; máx. = 0,00035) | |
| Flumioxazin 0,5 g/L | 0,01 ± 0,01 (mín. = 0; máx. = 0,0002) | |
| Flumioxazin 1,0 g/L | 0,00004 ± 0,00005 (mín. = 0; máx. = 0,00016) |
mín.: Mínimo; máx.: Máximo; Señal convencional utilizada: - Dato numérico igual a cero, no resultante de redondeo.
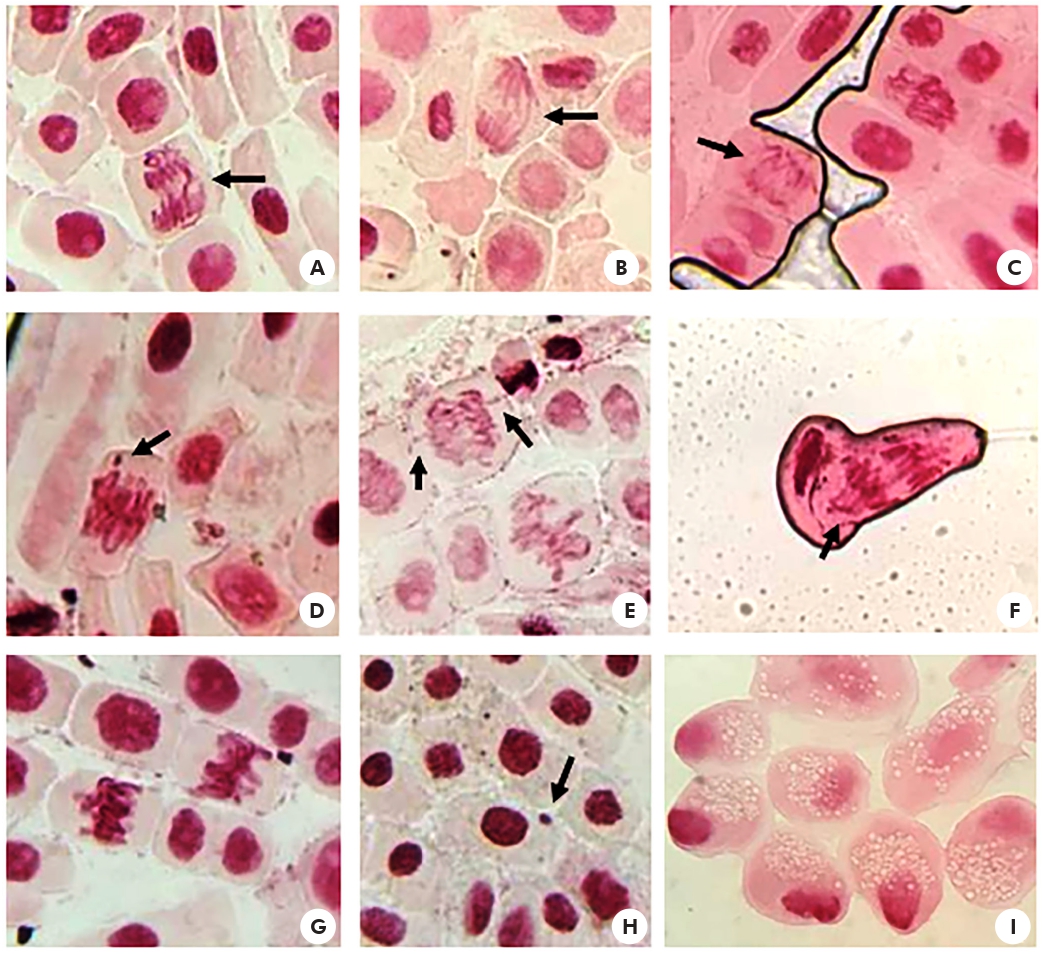
Fotos: Lais Gonçalves Parvan.
Aumento de 40 veces. A-B: puente anafásico (flecha); C: anomalías del huso (flecha); D: metafase con quiebra cromosómica (flecha); E-F: cromosoma errante (flecha); G: fase anormal cumplida; H: micronúcleo (flecha); I: células necróticas.
Figura 2 - Células meristemáticas de A. cepa tratadas con flumioxazina en concentraciones de 0,5 y 1,0 g/L
Los grupos CN y CP no presentaron micronúcleos en 1.000 células contadas. Las cebollas probadas en flumioxazina (0,5 g/L) presentaron un promedio de 0,1 ± 0,13 (mín. = 0; máx. = 0,4), mientras que las probadas en concentración 1,0 g/L presentaron un promedio de 0,3 ± 0,7 (mín. = 0; máx. = 0,2).
ANÁLISIS ENTRE LOS GRUPOS
Fueron comparados macroscópicamente, el número y el tamaño de las raíces de cada grupo. Hubo asociación entre las sustancias probadas y el tamaño de las raíces cuando analizadas entre todos los grupos (p = 0,03). Sin embargo, no hubo asociación entre el número de raíces y las sustancias probadas (p = 0,06) (Tabla 4).
Tabla 4 - Análisis general entre los grupos probados
| Grupos | Análisis macroscópico | Análisis microscópico | |||
|---|---|---|---|---|---|
| Nº de raíces | Tamaño (cm) | IM (análisis de efecto citotóxico) | AC (análisis de efecto genotóxico) | Micronúcleos (análisis de efecto mutagénico) | |
| Control negativo | 25 | 1,05 | 0,0003 | - | - |
| Control positivo | 18 | 0,32 | 0,0036 | 0,0002 | - |
| Flumioxazin 0,5 g/L | 27 | 1,23 | 0,0033 | 0,01 | 0,1 |
| Flumioxazin 1,0 g/L | 31 | 1,00 | 0,0020 | 0,00004 | 0,3 |
| ¿Estadísticamente significante? | No (p = 0,06) | Sí, entre todos los grupos (p = 0,03) | Sí CN x Flumioxazin 0,5 g/L (p = 0,018) | Sí CN x Flumioxazin 0,5 g/L (p = 0,002) y CN x Flumioxazin 1,0 g/L (p = 0,013) | No (p > 0,05) |
Señal convencional utilizada: - Dato numérico igual a cero, no resultante de redondeo.
Microscópicamente, el IM fue comparado entre los grupos (Tabla 4). Se demostró el efecto citotóxico del herbicida con flumioxazin en la concentración 0,5 g/L por la diferencia significativa encontrada, cuando comparada al CN.
Entre los grupos, hubo una diferencia estadísticamente significativa en relación con la presencia de AC en comparación con la CN (p = 0,04). La AC encontrada en el herbicida con flumioxazin 0,5 g/L mostró esta diferencia en comparación con la CN (p = 0,002), así como en la concentración de 1,0 g/L (p = 0,013). Estos resultados sugieren genotoxicidad herbicida porque intervienen en el número de AC observadas en comparación con el grupo CN (Tabla 4).
En cuanto a la mutagenicidad, aunque se observó la presencia de micronúcleos en ambas concentraciones ensayadas, no fue posible observar efecto mutagénico, ya que los resultados estadísticos no fueron significativos (p > 0,05). En la comparación de la cantidad de micronúcleos encontrados en los grupos CP y CN con los grupos de prueba, tampoco hubo diferencias estadísticamente significativas (p > 0,05) (Tabla 4).
DISCUSIÓN
El herbicida con flumioxazina fue elegido porque es utilizado por agricultores de la región de la Zona da Mata, en el estado de Minas Gerais, principalmente en cultivos de soja y porotos12. El estudio mostró que el herbicida, en ambas concentraciones probadas, era tóxico para las raíces al causar cambios en las células vegetales analizadas aquí, como necrosis en las puntas.
En el análisis microscópico, fue posible verificar que el herbicida con flumioxazina, a la concentración recomendada para su uso (0,5 g/L), presentaba signos de citotoxicidad. Además, se verificaron los efectos de la genotoxicidad en ambas concentraciones probadas, ya que causó AC en las células de cebolla.
Aunque se observaron micronúcleos en las concentraciones probadas, no se encontró significación estadística en comparación con los grupos CN y CP. Los micronúcleos pueden originarse espontáneamente, por lo tanto, se deben realizar más estudios para verificar su formación.
El hecho de que este herbicida presentara un efecto citotóxico y genotóxico muestra la importancia de monitorizar estas sustancias químicas y sus efectos sobre los organismos vivos, ya que los cambios provocados a nivel molecular afectaron directamente al material genético de la muestra analizada.
La prueba de A. cepa ya se ha utilizado en varios análisis, como en la evaluación de la genotoxicidad de fármacos28, infusiones de plantas medicinales29 y en la evaluación de la calidad del agua de río30. Se trata de una prueba que, cuando sea necesario, puede complementarse con la prueba cometa en el análisis de fragmentación de ADN de las células, de forma que los efectos encontrados se asocien adecuadamente y se investigue su causa. Se sugiere que la prueba cometa se realice para complementar las pruebas de genotoxicidad, y que se agregue un mayor número de bulbos para los controles, para aumentar la potencia estadística en la comparación entre los grupos.
Krüger23 y Leme y Marin-Morales25 consideraron la inhibición del crecimiento radicular como un efecto tóxico. En el presente estudio, se analizaron dos factores para determinar la toxicidad: el cambio en el tamaño/número y la AC de las raíces. El efecto tóxico puede ser enmascarado por la presencia de macronutrientes inorgánicos (por ejemplo, nitrógeno y fósforo), lo que resulta en el alargamiento de las raíces de la cebolla31. Sin embargo, la determinación del efecto tóxico se basó en la presencia de AC, como necrosis, raíces distorsionadas y oscurecidas, observadas en el tratamiento con flumioxazina en ambas concentraciones.
Las plantas tienen mecanismos de autodefensa que pueden debilitarse cuando se exponen a situaciones de estrés ambiental. Por lo tanto, el uso excesivo de pesticidas, además de no siempre disuadir a las plagas, puede causar la aparición de enfermedades en las plantas. Así, el herbicida como agente estresor puede ser perjudicial para las raíces, provocando cambios radiculares y la muerte prematura de las mismas32.
La citotoxicidad se analizó mediante la determinación del IM, que se utiliza como biomarcador de proliferación celular midiendo la proporción de células divididas en las diversas fases del ciclo celular25,33. El presente estudio identificó citotoxicidad a una concentración de 0,5 g/L al presentar diferencias estadísticamente significativas en el IM en comparación con el grupo CN. Tanto el aumento como la disminución de este índice indican citotoxicidad: el aumento sugiere un trastorno celular al causar la multiplicación de las divisiones celulares; y la reducción indica daño en el ADN, lo que lleva a una parada del ciclo celular en un intento de repararlo25. Hubo una asociación del IM con el herbicida a una concentración de 0,5 g/L y la CN cuando se asoció con AC (p = 0,018), lo que sugiere que cuanto mayor el IM, mayor es el número de AC.
Cabe destacar que el aumento del IM puede estar relacionado con el aumento del tamaño de la raíz. Dos estudios encontraron el mismo efecto al analizar la citotoxicidad de las aguas de los ríos, señalando que cuanto mayor es el IM, mayor es el tamaño de la raíz34,35. Asimismo, varios estudios lo han demostrado, observando que la disminución de este índice también causa inhibición del crecimiento radicular23,35,36.
La presencia de AC se asoció con el efecto genotóxico. Las sustancias genotóxicas no siempre interactúan directamente con el ADN. Sin embargo, aquellas capaces de causar esta interferencia inducen daño al material genético en las células a través de interacciones con la secuencia y estructura del ADN. Estas anomalías cromosómicas en las células de A. cepa son un parámetro eficiente para la investigación del potencial genotóxico de los compuestos químicos, ya que proporcionan información que debe considerarse esencial en el proceso de carcinogénesis25. Los agentes genotóxicos son capaces de actuar ampliamente sobre la célula, ya sea en la organización de sus orgánulos o de sus compartimentos, además de provocar cambios que pueden afectar al ciclo celular, desregular sus fases, generar células aberrantes e incluso inducirlas a la muerte37.
El presente estudio sugirió el efecto genotóxico del herbicida con flumioxazina en las dos concentraciones probadas y también demostró la asociación entre el número de AC y IM. Es conocida la capacidad de los herbicidas de causar anomalías celulares. Las plantas de sorgo tratadas con el herbicida Atrazina mostraron un mayor número de cromosomas, células binucleadas y anomalías en las células madre del grano de polen, lo que demuestra la interferencia del herbicida en la estabilidad de la meiosis38.
Los efectos clastogénicos (roturas de ADN) sobre las especies de Pisum sativum y A. cepa, inducidos por el tratamiento con herbicidas, también demuestran efectos de inducción a roturas cromosómicas en el ADN39. Fernandes2 consideró una acción aneugénica que impide la segregación simétrica del material genético durante la división celular, dando lugar a un desequilibrio genómico. A partir de los resultados de este estudio, es posible sugerir acciones aneugénicas debidas a la presencia de cromosomas errantes y cromosomas retardantes, es decir, que no fueron segregados correctamente, así como acciones clastogénicas, especialmente en muestras tratadas con benzoato de sodio al 1%, porque presentan esta acción conocida.
También fue posible observar la presencia de necrosis, a nivel microscópico, a una concentración de 1,0 g/L (Figura 2I), lo que puede explicarse por la respuesta de la célula al daño irreversible causado en el material genético40. Diferentes mecanismos de mantenimiento de la homeostasis celular están vinculados al proceso de división celular, metabolismo celular y muerte celular. Las fallas en estos mecanismos debido a la falta de reparación pueden promover la transformación neoplásica y caracterizar el inicio del proceso de formación del tumor. Así, las células no regeneradas se refieren al proceso de muerte celular, también llamado necroptosis en patología, o necrosis celular programada, con el fin de evitar la activación de tumores41. Por lo tanto, es importante estudiar los factores y/o sustancias que pueden interferir en el ciclo celular, tal como se realiza en este estudio.
En la investigación de la mutagenicidad, el análisis se realizó mediante el conteo de micronúcleos. Existen divergencias en el concepto de mutagenicidad por parte de diferentes autores. Rudder y Marin-Morales25 y Carvalho et al.27 consideran la presencia de micronúcleos como parámetro de mutagenicidad, mientras que Krüger23 y Fenech42 lo consideran como parámetro de genotoxicidad. Los micronúcleos se originan a partir de fragmentos cromosómicos acéntricos o se forman en células en división que presentan fragmentos cromosómicos completos que han interrumpido la capacidad de unirse al huso mitótico, es decir, no completan la migración anafásica de la división celular42. Esta característica indica la presencia de sustancias con efectos mutagénicos.
El presente estudio, a pesar de presentar células con la presencia de micronúcleos en las raíces tratadas con flumioxazina a las concentraciones probadas, no confirmó la mutagenicidad del compuesto porque no presentó significación estadística en comparación con el grupo CN y CP. La inducción de micronúcleos se utiliza, comúnmente, para detectar daños genotóxicos y mutagénicos resultantes de la exposición a agentes tóxicos. Sin embargo, los micronúcleos también pueden originarse espontáneamente43 y pueden ser del orden de 3/1.000 células analizadas42,44. Por lo tanto, el efecto mutagénico, debido a la presencia de micronúcleos en una sustancia probada, debe analizarse cuidadosamente.
En cuanto a los efectos genotóxicos, una revisión sistemática de publicaciones sobre el impacto del uso de plaguicidas en el medio ambiente, producidas en el período de 2011 a 2017, evidenció el daño causado por el uso de estas sustancias, a menudo al cambiar el hábitat natural de los ecosistemas45. Estos riesgos no son solo para el medio ambiente, sino también para la salud humana, especialmente para los agricultores y manipuladores que son sometidos sucesivamente a la exposición a pesticidas. La falta de uso de protecciones adecuadas y el incumplimiento de los límites de concentraciones de uso permitidos por los organismos de control aumentan los problemas de salud y los daños ambientales15.
El mapa de uso de plaguicidas en los municipios del suroeste de Paraná mostró que la producción de commodities, como la soja, el maíz y el trigo, ha sido responsables del consumo exorbitante de plaguicidas en los municipios afectados, por lo que los principales principios activos utilizados desencadenan un alto riesgo de contaminación ambiental y también para la salud humana. El herbicida abordado en este estudio es ampliamente utilizado en Brasil en el control de malezas en estos cultivos46.
Es importante conocer los efectos y posibles riesgos relacionados con la exposición excesiva a los pesticidas utilizados. Las pruebas de seguimiento de estas sustancias, ya sean las que indican el grado de exposición genotóxica de los individuos, como el bioensayo con A. cepa, o las que determinan los efectos de estos compuestos in vitro, son fundamentales a la hora de monitorizar las implicaciones futuras para la salud humana.
Las exposiciones excesivas a plaguicidas no solo se encuentran en alimentos que contienen residuos, sino también en el contacto de trabajadores rurales y familiares que, al manipular estos compuestos, se convierten en los más susceptibles a los daños. Uno de los problemas de las exposiciones sucesivas a estos herbicidas es el hecho de que conducen a una acumulación de mutaciones que, en un momento mayor, pueden causar cambios mutagénicos y cancerígenos. El desarrollo de cáncer no representa el único daño de la exposición a estas sustancias; también pueden ocurrir intoxicaciones agudas y crónicas. El uso de monitores ambientales para la evaluación de las actividades citotóxicas, genotóxicas y mutagénicas de los productos químicos ambientales, especialmente los plaguicidas, debe considerarse un indicador de riesgo potencial para la salud humana y el medio ambiente.
CONCLUSIÓN
El herbicida con flumioxazina, en ambas concentraciones, presentó efectos de toxicidad debido a las necrosis y anomalías observadas en sus raíces. La citotoxicidad se detectó en la concentración de uso, y la genotoxicidad se observó en las dos concentraciones probadas. No fueron constatados efectos mutagénicos.
AGRADECIMIENTOS
À UNIFAMINAS, por la ejecución del trabajo; al Instituto Federal Sudeste, por la colaboración; y al CNPq, por el apoyo.
REFERENCIAS
1 Ventura BC. Avaliação dos efeitos citotóxicos, genotóxicos e mutagênicos do herbicida Atrazina, utilizando Allium cepa e Oreochromis niloticus como sistemas-teste [dissertação]. Rio Claro (SP): Universidade Estadual Paulista, Instituto de Biociências; 2004. [ Links ]
2 Fernandes TCC. Investigação dos efeitos tóxicos, mutagênicos e genotóxicos do herbicida trifluralina, utilizando Allium cepa e Oreochromis niloticus como sistemas-testes [dissertação]. Rio Claro (SP): Universidade Estadual Paulista, Instituto de Biociências; 2005. [Link] [ Links ]
3 Oliveira LCC. Resíduos de agrotóxicos nos alimentos, um problema de saúde pública [trabalho de conclusão de curso]. Uberaba (MG): Universidade Federal do Triângulo Mineiro; 2014. [Link] [ Links ]
4 Valentim LSO, Veiga DPB, Mário Jr RJ, Elmec AM. Água potável e resíduos de agrotóxicos no estado de São Paulo. BEPA. 2019;16(186):43-53. [Link] [ Links ]
5 Fundação Oswaldo Cruz. Centro de Informação Científica e Tecnológica. Sistema Nacional de Informações Tóxico-Farmacológicas. Tabela 2. Casos, óbitos e letalidade de intoxicação humana por região e centro. Brasil, 2017 [Internet]. Rio de Janeiro: Fiocruz; 2017 [citado 2019 jun 13]. Disponível em: Disponível em: https://sinitox.icict.fiocruz.br/sites/sinitox.icict.fiocruz.br/files//Brasil2_1.pdf . [Link] [ Links ]
6 Bombardi LM. Geografia do uso de agrotóxicos no Brasil e conexões com a União Europeia. São Paulo: FFLCH-USP; 2017. [Link] [ Links ]
7 Greenpeace. Unearthed. Brazil pesticide approvals soar as Jair Bolsonaro moves to weaken rules [Internet]. 2019 Jun [cited 2019 Dec 1]. Available from: Available from: https://unearthed.greenpeace.org/2019/06/12/jair-bolsonaro-brazil-pesticides/ . [ Links ]
8 Oga S. Fundamentos da toxicologia. São Paulo: Atheneu; 1996. 515 p. [ Links ]
9 Rodrigues MAT. Classificação de fungicidas de acordo com o mecanismo de ação proposto pelo FRAC [dissertação]. Botucatu (SP): Universidade Estadual Paulista, Faculdade de Ciências Agronômicas; 2006. [Link] [ Links ]
10 Flumyzin 500 [Internet]. Curitiba (PR): Agência de Defesa Agropecuária do Paraná; 2009 [citado 2019 jan 23]. Disponível em: Disponível em: http://www.adapar.pr.gov.br/arquivos/File/defis/DFI/Bulas/Herbicidas/FLUMYZIN_500.pdf . [ Links ]
11 Pedrosa PAA. Análise macroscópica e microscópica da toxicidade do herbicida Flumyzin 500 (Flumioxazina) pelo bioensaio Allium cepa [dissertação]. Muriaé (MG): Centro Universitário Unifaminas; 2017. [ Links ]
12 World Health Organization. International Agency for Research on Cancer. Occupational exposures in insecticide application, and some pesticides. Lyon (FR): IARC; 1987. (IARC monographs on the evaluation of carcinogenic risks to humans; vol. 53). [Link] [ Links ]
13 Griffiths AJF, Miller JH, Suzuki DT, Lewontin RC, Gelbart WM, Wessler SR. Introdução à genética. 9. ed. Rio de Janeiro: Guanabara Koogan, 2009. [ Links ]
14 Ribeiro LR, Salvadori DF, Marques EK, organizadores. Mutagênese ambiental. Canoas: ULBRA; 2003. [ Links ]
15 Tofolo C, Fuentefria AM, Farias FM, Machado MM, Oliveira LFS. Contributing factors for farm workers' exposure to pesticides in the west of the state of Santa Catarina, Brazil. Acta Sci Health Sci. 2014;36(2):153-9. Doi: 10.4025/actascihealthsci.v36i2.22383 [Link] [ Links ]
16 Peres F, Rozemberg B, Alves SR, Moreira JC, Oliveira-Silva JJ. Comunicação relacionada ao uso de agrotóxicos em uma região agrícola do estado do Rio de Janeiro. Rev Saude Publica. 2001 dez;35(6):564-70. Doi: 10.1590/S0034-89102001000600010 [Link] [ Links ]
17 Valente D, Costa-Amaral IC, Carvalho LVB, Santos MVC, Castro VS, Rodrigues DRF, et al. Utilização de biomarcadores de genotoxicidade e expressão gênica na avaliação de trabalhadores de postos de combustíveis expostos a vapores de gasolina. Rev Bras Saude Ocup. 2017 abr;42(supl 1):e2s. Doi: 10.1590/2317-6369000124415 [Link] [ Links ]
18 Collins AR, Azqueta A. DNA repair as a biomarker in human biomonitoring studies; further applications of the comet assay. Mutat Res. 2012 Aug;736(1-2):122-9. Doi: 10.1016/j.mrfmmm.2011.03.005 [Link] [ Links ]
19 Fiskesjö G. The Allium test as a standard in environmental monitoring. Hereditas. 1985 Mar;102(1):99-112. Doi: 10.1111/j.1601-5223.1985.tb00471.x [Link] [ Links ]
20 Grippa GA, Morozesk M, Nati N, Matsumoto ST. Estudo genotóxico do surfactante Tween 80 em Allium cepa. Rev Bras Toxicol. 2010;23(1-2):11-6. [ Links ]
21 Cabrera GL, Rodriguez DM. Genotoxicity of soil from farmland irrigated with wastewater using three plant bioassays. Mutat Res. 1999 May;426(2):211-4. Doi: 10.1016/s0027-5107(99)00070-6 [Link] [ Links ]
22 Bagatini MD, Silva ACF, Tedesco SB. Uso do sistema teste de Allium cepa como bioindicador de genotoxicidade de infusões de plantas medicinais. Rev Bras Farmacogn. 2007 jul-set;17(3):444-7. Doi: 10.1590/S0102-695X2007000300019 [Link] [ Links ]
23 Krüger RA. Análise da toxicidade e da genotoxicidade de agrotóxicos utilizados na agricultura utilizando bioensaios com Allium cepa [dissertação]. Nova Hamburgo (RS): Centro Universitário Feevale; 2009. [Link] [ Links ]
24 Aiub CAF, Felzenswalb I. O uso de Allium cepa como modelo experimental para investigar gentoxicidade de substâncias usadas em conservantes alimentares. Rev Genet Esc. 2011;6(1):12-15. [ Links ]
25 Leme DM, Marin-Morales MA. Allium cepa test in environmental monitoring: a review on its application. Mutat Res. 2009 Jul-Aug;682(1):71-81. Doi: 10.1016/j.mrrev.2009.06.002 [Link] [ Links ]
26 Pessoa LGA, Bohm PAF, Bohm FMLZ. Avaliação do potencial citotóxico do glutamato monossódico e benzoato de sódio. In: 1º Encontro Anual de Iniciação Científica, 5º Seminário de Pesquisa e Pós-graduação; 2015 out 27-29; Campo Mourão, PR. [ Links ]
27 Carvalho LG, Britto FF, Marin-Morales MA, Maffei EMD. Análises citológicas do inseticida Deltametrina usando o Teste de Micronúcleo. Rev Biol. 2017;17(1):1-5. Doi: 10.7594/revbio.17.01.01 [Link] [ Links ]
28 Jesus AM, Zamberlam CR. Genotoxicidade do diazepam e potencial de reversão do Ginkgo biloba pelo método Allium cepa. Rev Saude. 2018;12(1 esp):10. [Link] [ Links ]
29 Silva JDA, Nogueira CR, Vieira MC, Heredia-Vieira SC, Barufatti A, Crispim BA, et al. Propriedades toxicológicas de um extrato aquoso de folhas de Aristolochia triangularis utilizando os bioensaios de letalidade com Artemia salina e Allium cepa. Cienc Rural. 2019;49(8):e20190091. Doi: 10.1590/0103-8478cr20190091 [Link] [ Links ]
30 Rodrigues GZP, Dalzochio T, Gehlen G. Uso do bioensaio com Allium cepa L. e análises físico-químicas e microbiológicas para avaliação da qualidade do Rio da Ilha, RS, Brasil. Acta Toxicol Argent. 2016;24(2):97-104. [Link] [ Links ]
31 Rodrigues SC, Bianchini A. Extraction and concentration of freshwater - and seawater - derived dissolved organic matter for use in aquatic toxicology studies. J Braz Soc Ecotoxicol. 2007;2(3):275-81. [Link] [ Links ]
32 Tsuzuki Y. Defesa fisiológica contra doenças e pragas. São Paulo: Gráfica Paulo's; 2010. 97 p. [ Links ]
33 Mercado SAS, Caleño JDQ. Cytotoxic evaluation of glyphosate, using Allium cepa L. as bioindicator. Sci Total Environ. 2020 Jan;700:134452. Doi: 10.1016/j.scitotenv.2019.134452 [Link] [ Links ]
34 Motta LS, Damasceno JM, Pereira IFM, Vidal ACB, Silva DC, Silva PT, et al. Bioensaio com Allium cepa L. revela ação tóxica e citogenotóxica na água do Rio São Francisco sob influência do canal do Tourão (Juazeiro/BA). Semina Cien Biolog Saude. 2017 mai-jun;38(supl 1):109. [ Links ]
35 Braga JRM, Lopes DM. Citotoxicidade e genotoxicidade da água do rio Subaé (Humildes, Bahia, Brasil) usando Allium cepa L. como bioindicador. Rev Ambient Agua. 2015 jan-mar;10(1):130-40. Doi: 10.4136/ambi-agua.1459 [Link] [ Links ]
36 Tedesco SB, Laughinghouse IV HD. Bioindicator of genotoxicity: the Allium cepa test. In: Srivastava JK, editor. Environmental contamination. Rijeka (HR): InTech; 2012. Chapter 8; p. 137-56. [ Links ]
37 Kaioumova D, Süsal C, Opelz G. Induction of apoptosis in human lymphocytes by the herbicide 2,4-dichlorophenoxyacetic acid. Hum Immunol. 2001 Jan;62(1):64-74. Doi: 10.1016/s0198-8859(00)00229-9 [Link] [ Links ]
38 Liang GHL, Feltner KC, Liang YTS, Morrill JL. Cytogenetic effects and responses of agronomic characters in grain sorghum (Sorghum vulgare Pers.) following atrazine application. Crop Sci. 1967 May;7(3):245-8. Doi: 10.2135/cropsci1967.0011183X000700030023x [Link] [ Links ]
39 Grant WF, Owens ET. Chromosome aberration assays in Pisum for the study of environmental mutagens. Mutat Res. 2001 May;488(2):93-118. Doi: 10.1016/S1383-5742(00)00064-8 [Link] [ Links ]
40 Elmore S. Apoptosis: a review of programmed cell death. Toxicol Pathol. 2007 Jun;35(4):495-516. Doi: 10.1080/01926230701320337 [Link] [ Links ]
41 Amabis JM, Martho GR. Biologia das células. 4. ed. Vol. 1. São Paulo: Moderna; 2015. [ Links ]
42 Fenech M. The in vitro micronucleus technique. Mutat Res. 2000 Nov;455(1-2):81-95. Doi: 10.1016/S0027-5107(00)00065-8 [Link] [ Links ]
43 Heddle JA, Carrano AV. The DNA content of micronuclei induced in mouse bone marrow by γ-irradiation: evidence that micronuclei arise from acentric chromosomal fragments. Mutat Res. 1977 Jul;44(1):63-9. Doi: 10.1016/0027-5107(77)90115-4 [Link] [ Links ]
44 Rabello-Gay MM, Rodrigues MALR, Monteleone-Neto R. Mutagênese, carcinogênese e teratogênese: métodos e critérios de avaliação. Ribeirão Preto: Sociedade Brasileira de Genética; 1991. 246 p. [ Links ]
45 Lopes CVA, Albuquerque GSC. Agrotóxicos e seus impactos na saúde humana e ambiental: uma revisão sistemática. Saúde Debate. 2018 abr-jun;42(117):518-34. Doi: 10.1590/0103-1104201811714 [Link] [ Links ]
46 Gaboardi SC, Candiotto LZP, Ramos LM. Perfil do uso de agrotóxicos no Sudoeste do Paraná (2011-2016). Rev Nera. 2019;46(22):13-40. [ Links ]
Recibido: 29 de Diciembre de 2019; Aprobado: 30 de Junio de 2020











 texto en
texto en 


