Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Pan-Amazônica de Saúde
versión impresa ISSN 2176-6215versión On-line ISSN 2176-6223
Rev Pan-Amaz Saude vol.11 Ananindeua 2020 Epub 24-Sep-2020
http://dx.doi.org/10.5123/s2176-6223202000378
ARTÍCULO ORIGINAL
Estudio seroepidemiológico del sarampión en poblaciones residentes en la Región Metropolitana de Belém, estado de Pará, Brasil, 2016 a 2018
1 Instituto Evandro Chagas/SVS/MS, Ananindeua, Pará, Brasil
OBJETIVO:
Investigar la seroprevalencia de anticuerpos contra el sarampión en adultos jóvenes, residentes en Belém y Ananindeua, estado de Pará, Brasil, con el objetivo de identificar individuos susceptibles.
MATERIALES Y MÉTODOS:
Se trata de un estudio transversal de 2.220 personas, 1.109 de Belém y 1.111 de Ananindeua, entre 15 y 39 años, de escuelas, colegios, universidades, institutos de investigación y cuarteles. Los datos de los participantes se recogieron a través de un cuestionario epidemiológico y se tipificaron utilizando el software Epi info™ v7.0. Se utilizó la prueba binomial para el análisis de dos proporciones a través del programa BioEstat v5.3, nivel de significación p < 0,05.
RESULTADOS:
La susceptibilidad general al sarampión fue del 17,2%, 16,4% en Belém y 18,0% en Ananindeua, más en el sexo masculino, con amplia distribución geográfica. La diferencia en la seropositividad en relación a los tipos de vacuna recibida fue significativa, los porcentajes más altos fueron de la vacuna triple viral (SRP), así como la comparación de la información entre autoinformada y comprobada por vacunación. Con respecto al número de dosis, no hubo significación en la seropositividad entre los que informaron una dosis en relación a tres dosis de la vacuna contra el sarampión. Se detectó una disminución en los niveles de anticuerpos con el tiempo (20 años) después de la última vacunación.
CONCLUSIÓN:
Hay grupos de susceptibles que forman focos de personas vulnerables en ambos municipios, lo que indica la necesidad de fortalecer la vigilancia epidemiológica y las estrategias de vacunación, en vista de la reintroducción del virus, para controlar la enfermedad en Brasil.
Palabras clave: Sarampión; Vacuna; Erradicación de Enfermedades; Estudios Seroepidemiológicos
INTRODUCCIÓN
El sarampión es una enfermedad exantemática contagiosa, causada por el virus del sarampión, el Measles morbillivirus (familia Paramyxoviridae, género Morbillivirus, orden Mononegavirales), con distribución universal. La transmisión se produce directamente, por medio de secreciones nasofaríngeas expulsadas al toser, estornudar, hablar o respirar, por dispersión de aerosoles con partículas virales en el aire interior. Presenta un cuadro clínico de hipertermia, erupción maculopapular generalmente asociada con tos, secreción nasal, conjuntivitis y manchas de Koplik en la mucosa oral, después de manifestaciones prodrómicas de dos a cuatro días, y puede evolucionar a complicaciones graves. No existe un tratamiento específico, la vacunación es la mejor manera de prevenir1,2.
En Brasil, el virus del sarampión dejó de circular en 2001, con registros de casos importados de otros países de América y otros continentes, principalmente de África, y se identificaron los genotipos D4, D8 y B33.
La recomendación para mantener altos niveles de inmunidad y detener la cadena de transmisión del sarampión es mantener una cobertura de vacunación (CV) homogénea del 95%. El Ministerio de Salud (MS) de Brasil recomienda el uso de la vacuna triple viral (CRS: sarampión, paperas y rubéola) a los 12 meses de edad, primera dosis (D1) de la vacuna, y entre los 15 meses y los 4 años de edad, una dosis de tetra viral (SCR-V: sarampión paperas, rubéola y varicela), que corresponde a la segunda dosis (D2) de la vacuna. Si la persona no recibió la vacuna adecuadamente y tiene entre 5 y 29 años de edad, debe realizar dos dosis de SRC, con un intervalo de 30 días; y si tiene entre 30 y 49 años de edad, solo una dosis de CRS4. Incluso con un programa de inmunización adecuado, la acumulación de susceptibles puede ocurrir después de unos años, debido a que la vacuna no promueve la seroconversión o esta no es duradera, caracterizando fallas vacunales primarias (PVF) y fallas vacunales secundarias (FVS), respectivamente5.
En 2010, hubo tres casos confirmados de sarampión en Belém, estado de Pará, en estudiantes de entre 18 y 26 años, sin antecedentes de vacunación, con identificación del genotipo viral D46. De 2013 a 2015, Brasil enfrentó una epidemia con casos confirmados por laboratorio en varios estados, con mayor frecuencia en los estados de Pernambuco y Ceará. Se registraron 220 casos en ocho estados en 2013, 876 en cuatro estados en 2014 y 214 en tres estados en 20157 debido a la circulación del genotipo D8, el mismo detectado en América Latina y el Caribe (2010-2015)7. Con la vacunación y la vigilancia constantes, los casos fueron contenidos, y ningún caso fue registrado después de 12 meses. En septiembre de 2016, la Organización Mundial de la Salud (OMS) certificó la eliminación del sarampión en Brasil8.
Las estrategias mundiales para la eliminación del sarampión han evitado aproximadamente 21,1 millones de muertes. En 2017, la OMS informó la ocurrencia de 6,7 millones de casos y 110.000 muertes en todo el mundo9. Sin embargo, debido a la baja CV, en 2018 hubo un resurgimiento en todas las regiones del mundo, y se confirmaron 328.689 casos en las regiones: europea, 84.468; el sudeste asiático, 83.647; África, 55.394; Mediterráneo oriental, 57.960; Pacífico Occidental, 30.531; y Las Américas, 16.689 casos10,11.
En febrero de 2018, Brasil registró brotes que comenzaron en el estado de Roraima, con 12 muertes reportadas. De estos, cuatro ocurrieron en Roraima, en niños menores de 5 años (uno brasileño, dos venezolanos y un coreano); seis ocurrieron en el estado de Amazonas, cuatro de ellos menores de 1 año de edad, uno en el grupo de edad de 40-49 años y uno en más de 50 años de edad; y dos registrados en Pará, en la ciudad de Belém, correspondientes a venezolanos/indígenas menores de 1 año de edad12. Venezuela había estado enfrentando un brote de sarampión desde julio de 2017, con la mayoría de los casos provenientes del estado de Bolívar. Debido a la situación socioeconómica que enfrentaba el país, hubo un intenso movimiento migratorio que contribuyó a la propagación del virus a otras zonas geográficas12.
También en 2018, Brasil tuvo brotes de sarampión en 10 estados y en el Distrito Federal, confirmando un total de 10.326 casos, con mayor ocurrencia en Amazonas y Roraima, con 9.803 y 361 casos, respectivamente. También confirmaron casos, los estados de Pará (79), Rio Grande do Sul (46), Rio de Janeiro (20), Sergipe (4), Pernambuco (4), São Paulo (3), Bahía (3), Rondônia (2); y Distrito Federal (1). Los genotipos detectados fueron D8, de Venezuela y Líbano, y B3 de Europa12,13.
La tasa de incidencia de casos confirmados en la Amazonía, de 2018 a 2019, fue de 273,1/100.000 habitantes, siendo los menores de 1 año y los de 20 a 29 años, con las incidencias más altas, 2.191,8 y 358,6, respectivamente. En Roraima, la tasa fue de 81,3/100,00 habitantes, con una mayor incidencia en niños menores de 1 año, con 841,8/100,00 habitantes, y en niños de 1 a 4 años, con 255,8/100.000 habitantes. Pará tuvo una incidencia general de 1,3/100.000 habitantes, siendo mayor en niños menores de 1 año, con 15,0/100.000 habitantes. Se realizaron campañas de vacunación para aumentar la CV, donde el objetivo era vacunar, al menos, al 95% de los niños de 1 a 5 años13.
La OMS alertó a Brasil sobre la necesidad de contener los casos en menos de 12 meses; pero, Amazonas y Pará continuaron confirmando casos, lo que hizo que Brasil perdiera el estatus de país libre de sarampión en 201913.
En 2019, Brasil reportó 64.765 casos sospechosos de sarampión, de los cuales 18.203 (28,1%) fueron confirmados en 23 Unidades de la Federación. La mayoría ocurrió en el estado de São Paulo, que registró 16.090 (88,4%) casos confirmados en 259 municipios, seguido por los estados de Paraná (760; 4,2%), Río de Janeiro (333; 1,8%), Pernambuco (268; 1,5%), Santa Catarina (251; 1,4%), Minas Gerais (135; 0,7%) y Pará (118; 0,6%). En ese mismo año, se confirmaron 15 muertes, y seis (40,0%) ocurrieron en niños menores de 1 año de edad; dos (13,3%) en niños de 1 año de edad; y siete (46,7%) en adultos mayores de 20 años. De las 15 muertes, dos casos fueron vacunados contra el sarampión14.
El estudio de Pacheco et al.15, 2019, describió el riesgo de restaurar la transmisión endémica del sarampión en Brasil y encontró que, a nivel nacional, el CV de D1 de la vacuna SCR ha disminuido desde 2014, no alcanzando la meta establecida por el DM; y lo mismo ocurrió con el CrS D2, que no ha alcanzado la meta desde 2013. A nivel regional, también se encontraron reducciones, y el CV más bajo para D1 y D2 se observó en la Región Norte. Según el Departamento de Informática del Sistema Único de Salud de Brasil (DATASUS) del Ministerio de Salud, Belém y Ananindeua presentaron CV a continuación el recomendado tanto para D1 como para D2. En 2016, Belém presentó D1 de 77,0% y D2 de 72,0%; en 2017, D1 de 65,8% y D2 de 42,4%; y, en 2018, D1 del 75,1% y D2 del 55,2%. En 2016, Ananindeua presentó D1 de 34,0% y D2 de 29,8%; en 2017, D1 de 52,6% y D2 de 57,9%; y, en 2018, D1 del 56,7% y D2 del 42,1%16.
El sarampión continúa expandiéndose en los brotes mundiales, con 568.573 casos confirmados en 2019; y, para agosto de 2020, se habían confirmado 77.673 casos en todas las regiones de la OMS17. Los genotipos actualmente circulantes del virus del sarampión son B3 y D818.
Ante este escenario, los estudios de seroprevalencia guían la vigilancia epidemiológica en la aplicación de medidas profilácticas y de control en la población susceptible, contribuyendo así a la salud pública y al rescate de la certificación de eliminación del sarampión en Brasil.
En este contexto, se investigó el panorama de susceptibilidad al virus del sarampión en poblaciones de dos municipios del área metropolitana de Belém en una población de individuos nacidos entre 1978 y 2002.
MATERIALES Y MÉTODOS
Estudio transversal en una población de individuos de 15 a 39 años, de ambos sexos, aparentemente saludables, seleccionados de forma aleatoria y por grupos en escuelas, facultades, universidades, cuarteles e instituto de investigación de dos municipios de la Región Metropolitana de Belém. Fueron contemplados por ser los más poblados de Pará y con CV por debajo de lo preconizado por el MS16.
El tamaño de la muestra se calculó considerando que se trataba de un muestreo estratificado por edad. La aplicación StatCalc se utilizó en el Epi Info™ v7.0, y los parámetros de prevalencia máxima estimada (80%), límite de confianza (5%), nivel de confianza (95%) y ajuste por efecto de delineamiento (deff = 1,5), para controlar los factores de confusión, así como la pérdida de potencia de la prueba estadística utilizada. El cálculo se realizó utilizando la fórmula n = [EDFF*Np(1-p)] / [(d2/Z21-α/2*(N-1)+p*(1-p)], y el resultado total fue de 2.210, 1.107 para Belém y 1.103 para Ananindeua. Este muestreo se calculó para detectar las diferencias estadísticas consideradas significativas desde el nivel de α del 5% e IC del 95%, considerando posibles pérdidas en el proceso de selección.
Se seleccionaron un total de 2.220 participantes para el estudio, 1.109 de Belém y 1.111 de Ananindeua, con muestras recogidas desde abril de 2016 hasta septiembre de 2018. Los siguientes criterios de inclusión fueron: pertenecer al grupo de edad de 15 a 39 años y ser residente de los municipios seleccionados, independientemente de la historia de la vacuna contra el sarampión o la historia de la enfermedad.
Los sitios de estudio en Belém fueron: Escuela Estatal de Primaria y Secundaria (EEEFM) Profesor Jorge Lopes Raposo (Icoaraci), EEEFM de Outeiro (Outeiro), EEEFM Abelardo Leão Condurú (Mosqueiro), Instituto Federal de Pará, Facultades Integradas de la Amazonía, Colegio Maurício de Nassau, Universidad Estatal de Pará, Escuela Superior de la Amazonía, Comando Militar do Norte, Bomberos de Belém e Instituto Evandro Chagas (Campus Belém y Ananindeua). En Ananindeua: EEEFM Antônio Goldim Lins, EEEFM Antônio Teixeira Gueiros, EEEFM Erotides Frota Aguiar, Facultad de la Amazonía, Instituto Federal de Pará campus Ananindeua, Sistema de Enseñanza de la Amazonía, Universidad Federal de Pará campus Ananindeua y Bomberos de Ananindeua.
Quienes aceptaron participar firmaron el Formulario de Consentimiento Libre e Informado; y, en los casos de menores de 18 años, se firmó un Término de Consentimiento Libre e Informado tanto por el participante como por el tutor. Posteriormente, los participantes respondieron a un cuestionario aplicado por ocho investigadores de campo debidamente capacitados, con el objetivo de una mayor familiaridad y uniformidad en la información. Los cuestionarios se escribieron utilizando Epi info™ v7.0.
Se recogieron datos como: nombre; edad; sexo; municipio de origen; dirección del domicilio; historial de inmunización (estado de vacunación, tipos de vacunación y número de dosis) basado en la tarjeta de vacunación o, si se pierde, basado en informes del participante o madre/responsable, si es menor; en caso de un individuo no vacunado, la justificación; historial de aparición de la enfermedad; y dos preguntas para verificar si conocían el modo de transmisión y el modo de prevención del sarampión. El conocimiento se computó como "parcialmente" en caso de que supieran responder solo una de las preguntas.
De acuerdo con la dirección de residencia, se decidió mapear la distribución de los participantes por distritos administrativos de Belém y por barrio de Ananindeua. Belém tiene ocho distritos administrativos19 y Ananindeua tiene 22 distritos urbanos y nueve rurales20.
La investigación cualitativa de anticuerpos IgG se llevó a cabo por el método ELISA (Enzygnost Anti-Measles Virus/IgG), utilizando kits comerciales (SIEMENS®, Marburg, Alemania), de acuerdo con las instrucciones del fabricante. La cuantificación de los anticuerpos IgG se expresó en unidades internacionales (mUI/mL) mediante cálculo por el método α, según las instrucciones del fabricante. Los valores considerados reactivos fueron IgG > de 350 mUI/mL, los no reactivos fueron < 150 mUI/mL y los niveles no concluyentes entre 150-350 mUI/mL. Los individuos no reactivos (IgG-) y no concluyentes se consideraron susceptibles, y aquellos con reactividad (IgG+) se consideraron inmunes. Las muestras de suero con resultados no concluyentes se sometieron a una nueva prueba para confirmar el resultado.
Para el análisis estadístico, se utilizó la prueba binomial no paramétrica para una proporción del programa BioEstat v5.3, estableciendo un nivel de significancia con p < 0.05, así como el programa Microsoft Excel 2013 para representaciones gráficas y el software Arc GIS v10.2 para la generación de mapas.
El estudio fue aprobado por el Comité de Ética en Investigación (CEP) del IEC, bajo la aprobación de la opinión No. 2556024 CAAE 46849515800000019, garantizando la privacidad de la información y el anonimato de los sujetos de investigación, según lo establecido por la Ordenanza No. 466/2012, del Consejo Nacional de Investigación21.
RESULTADOS
Entre los 2.220 participantes, 49,9% (1.109/2.220) residían en Belém y 50,1% (1.111/2.220) en Ananindeua. La media aritmética de las edades fue de 21 años, mediana 23 años y desvío estándar de 1,3. La frecuencia de participantes del sexo femenino fue de 66,8% (1.482/2.220). En Belém, 49,1% (545/1.109) de los participantes era del grupo etario de 20 a 29 años y, en Ananindeua, 52,4% (582/1.111) estaba entre los 15 y 19 años (Tabla 1).
Tabla 1 - Perfil de los participantes del estudio, según sexo, grupo etario, historia vacunal, ocurrencia de la enfermedad y conocimiento sobre el sarampión, Belém y Ananindeua, estado de Pará, Brasil, 2016 a 2018
| Variables | Total | Localidades | p-valor* | ||||
|---|---|---|---|---|---|---|---|
| Belém | Ananindeua | ||||||
| N | % | N | % | N | % | ||
| Sexo | |||||||
| Masculino | 738 | 33,2 | 363 | 32,7 | 375 | 33,8 | 0,6415 |
| Femenino | 1.482 | 66,8 | 746 | 67,3 | 736 | 66,2 | |
| Grupo etario (años) | |||||||
| 15-19 | 908 | 40,9 | 326 | 29,4 | 582 | 52,4 | <0,0001 |
| 20-29 | 884 | 39,8 | 545 | 49,1 | 339 | 30,5 | |
| 30-39 | 428 | 19,3 | 238 | 21,5 | 190 | 17,1 | |
| Estatus vacunal | |||||||
| Vacunados | 1.615 | 72,7 | 795 | 71,7 | 820 | 73,8 | 0,5136 |
| No vacunados | 37 | 1,7 | 20 | 1,8 | 17 | 1,5 | |
| No supo informar | 568 | 25,6 | 294 | 26,5 | 274 | 24,7 | |
| Carnet de vacunación | |||||||
| Sí | 695 | 31,3 | 329 | 29,7 | 366 | 32,9 | 0,1055 |
| No | 1.525 | 68,7 | 780 | 70,3 | 745 | 67,1 | |
| Tipos de vacunas y su administración | |||||||
| Vacuna contra el sarampión (VCS) | 132 | 8,2 | 67 | 8,4 | 65 | 7,9 | <0,0001 |
| Vacuna doble viral (SR) | 65 | 4,0 | 22 | 2,8 | 43 | 5,2 | |
| Vacuna triple viral (SCR) | 163 | 10,1 | 44 | 5,5 | 119 | 14,5 | |
| VCS+SR | 413 | 25,5 | 257 | 32,3 | 156 | 19,0 | |
| VCS+SCR | 58 | 3,6 | 38 | 4,8 | 20 | 2,5 | |
| SR+SCR | 90 | 5,6 | 33 | 4,2 | 57 | 7,0 | |
| VCS+SR+SCR | 68 | 4,2 | 49 | 6,2 | 19 | 2,3 | |
| No supo Informar | 626 | 38,8 | 285 | 35,8 | 341 | 41,6 | |
| Número de dosis | |||||||
| Una | 158 | 9,8 | 75 | 9,4 | 83 | 10,1 | 0,0004 |
| Dos | 415 | 25,7 | 205 | 25,8 | 210 | 25,6 | |
| Tres o más | 424 | 26,2 | 243 | 30,6 | 181 | 22,1 | |
| No supo informar | 618 | 38,3 | 272 | 34,2 | 346 | 42,2 | |
| Justificativa para no vacunar | |||||||
| Falta de vacuna en la unidad | 2 | 5,4 | 1 | 5,0 | 1 | 5,9 | 0,2799 |
| Desconocimiento de la vacuna | 12 | 32,4 | 6 | 30,0 | 6 | 35,3 | |
| Otros | 19 | 51,4 | 9 | 45,0 | 10 | 58,8 | |
| No supo informar | 4 | 10,8 | 4 | 20,0 | - | - | |
| Ocurrencia de sarampión | |||||||
| Sí | 145 | 6,5 | 91 | 8,2 | 54 | 4,9 | 0,0004 |
| No | 1.758 | 79,2 | 843 | 76,0 | 915 | 82,3 | |
| No supo informar | 317 | 14,3 | 175 | 15,8 | 142 | 12,8 | |
| Conocimiento sobre el sarampión | |||||||
| Sí | 851 | 38,3 | 486 | 43,8 | 365 | 32,8 | <0,0001 |
| No | 868 | 39,1 | 355 | 32,0 | 513 | 46,2 | |
| Parcialmente | 501 | 22,6 | 268 | 24,2 | 233 | 21,0 | |
* Prueba binomial para una proporción; Señal convencional utilizada: - Dato numérico igual a cero, no resultante de redondeo.
En cuanto a la historia de vacunación contra el sarampión, el 72,7% (1.615/2.220) informó haber recibido la vacuna; sin embargo, sólo el 31,3% (695/2.220) tenía el carnet de vacunación. Del total de vacunados autoinformados, el 38,8% (626/1.615) y el 38,3% (618/1.615) no conocían el tipo de vacuna y el número de dosis, respectivamente (Tabla 1). La falta del carnet de vacunación por pérdida, para demostrar el estado vacunal de los participantes, representa un factor limitante en los estudios seroepidemiológicos de enfermedades inmunoprevenibles.
Entre las justificaciones declaradas por individuos no vacunados, el 32,4% (37/12) declaró desconocimiento de la vacuna, el 5,4% (2/37) falta de vacuna en el puesto y el 51,4% (19/37) otras razones, como la vivienda en un área de difícil acceso, el olvido de la persona responsable, no experto en la vacunación, la falta de conocimiento sobre los beneficios de la vacuna y el miedo a las reacciones adversas. Del total de participantes, el 39,1% (868/2.220) informó no conocer el modo de transmisión y la prevención del sarampión; y el 6,5% (145/2.220) informó ya haber contraído el sarampión (Tabla 1), de los cuales el 58,6% (85/145) pertenecía al grupo de edad de 30 a 39 años.
La frecuencia general de individuos inmunes (reactivos) para el sarampión en la prueba IgG ELISA fue del 82,8% (1.838/2.220) y el 17,2% (382/2.220) susceptibles, el 10,2% no reactivos y el 7,0% no concluyentes (Tabla 2). La seropositividad fue del 83,6% en Belém y del 82% en Ananindeua, ambos municipios mostraron diferencias estadísticamente significativas (p < 0,05) en relación con el porcentaje de CV recomendado por la DM. En la estratificación por grupo de edad, la proporción de adolescentes susceptibles de 15 a 19 años fue de 22,4% y 21,0% en Belém y Ananindeua, respectivamente (Tabla 2).
Tabla 2 - Frecuencias de individuos inmunes y susceptibles al sarampión en la población estudiada por la investigación de anticuerpos IgG específicos, por grupo de edad, en los municipios de Belém y Ananindeua, Estado de Pará, Brasil, 2016 a 2018
| BELÉM | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Grupo etario (años) | Total | % | Inmune | % | IC 95% | Susceptible* | % | IC 95% | p-valor† |
| 15-19 | 326 | 29,4 | 253 | 77,6 | 75,2-79,6 | 73 | 22,4 | 20,0-24,4 | p < 0,05 |
| 20-29 | 545 | 49,1 | 457 | 83,9 | 81,6-85,7 | 88 | 16,1 | 14,1-18,0 | p < 0,05 |
| 30-39 | 238 | 21,5 | 217 | 91,2 | 89,5-92,5 | 21 | 8,8 | 7,2-10,2 | p < 0,05 |
| Total | 1.109 | 100,0 | 927 | 83,6 | 81,4-85,4 | 182 | 16,4 | 14,3-18,2 | p < 0,05 |
| ANANINDEUA | |||||||||
| Grupo etario (años) | Total | % | Inmunes | % | IC 95% | Susceptible* | % | IC 95% | p-valor† |
| 15-19 | 582 | 52,4 | 460 | 79,0 | 76,5-80,9 | 122 | 21,0 | 18,6-23,0 | p < 0,05 |
| 20-29 | 339 | 30,5 | 279 | 82,3 | 80,0-84,2 | 60 | 17,7 | 15,1-19,2 | p < 0,05 |
| 30-39 | 190 | 17,1 | 172 | 90,5 | 88,8-91,9 | 18 | 9,5 | 7,8-11,0 | p < 0,05 |
| Total | 1.111 | 100,0 | 911 | 82,0 | 79,7-83,9 | 200 | 18,0 | 15,8-19,9 | p < 0,05 |
| Total general | 2.220 | 100,0 | 1.838 | 82,8 | 81,3-84,1 | 382 | 17,2 | 15,6-18,5 | p < 0,05 |
* Suma de los negativos e inconcluyentes en la prueba de ELISA; † Prueba binomial para una proporción.
Las participantes femeninas presentaron un 84,2% de reactividad y los varones 80,0%, con diferencia estadísticamente significativa (prueba binominal, z = 0,51, p = 0,0061) (Figura 1). Los participantes de Belém procedían de ocho distritos administrativos del municipio: Distrito Administrativo de Mosqueiro (DAMOS), Distrito Administrativo de Outeiro (DAOUT), Distrito Administrativo de Icoaraci (DAICO), Distrito Administrativo de Benguí (DABEN), Cruce de Distrito Administrativo (DAENT), Distrito Administrativo de Sacramenta (DASAC), Distrito Administrativo de Belém (DABEL) y Distrito Administrativo de Guamá (DAGUA). De Ananindeua, los participantes pertenecían a 15 barrios: Centro, Águas Brancas, Águas Lindas, Coqueiro, Distrito Industrial, Maguari, 40 Horas, Atalaia, Conjunto Guajará I, Guanabara, Icuí-Guajará, Jaderlândia, Heliolândia, Curuçamba y PAAR.
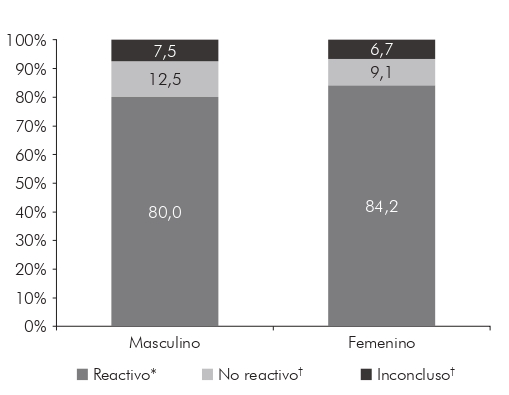
z = 0,51, p = 0,0061; * Inmune; † Susceptible.
Figura 1 - Prevalencia de anticuerpos IgG anti-sarampión, según el sexo, en la población estudiada de los municipios de Belém y Ananindeua, estado de Pará, Brasil, 2016 a 2018
El mapeo de los individuos susceptibles al sarampión, entre los ocho distritos administrativos de Belém, reveló que seis (75,0%) distritos presentaron frecuencias estadísticamente significativas (p > 0,0001): DAGUA (20,0%), DABEL (19,0%), DAICO (14,0%), DABEN (13,0%), DASAC (12,0%) y DAENT (16,0%). En Ananindeua, siete (46,7%) barrios presentaron porcentajes de susceptibles significantes (p > 0,0001) en relación al virus del sarampión: Coqueiro (22,0%); Distrito Industrial (16,0%); Águas Lindas (15,0%); Maguari (12,0%); Águas Brancas (12,0%); barrio Centro (9,0%) e Icuí-Guajará (6,0%) (Figura 2).
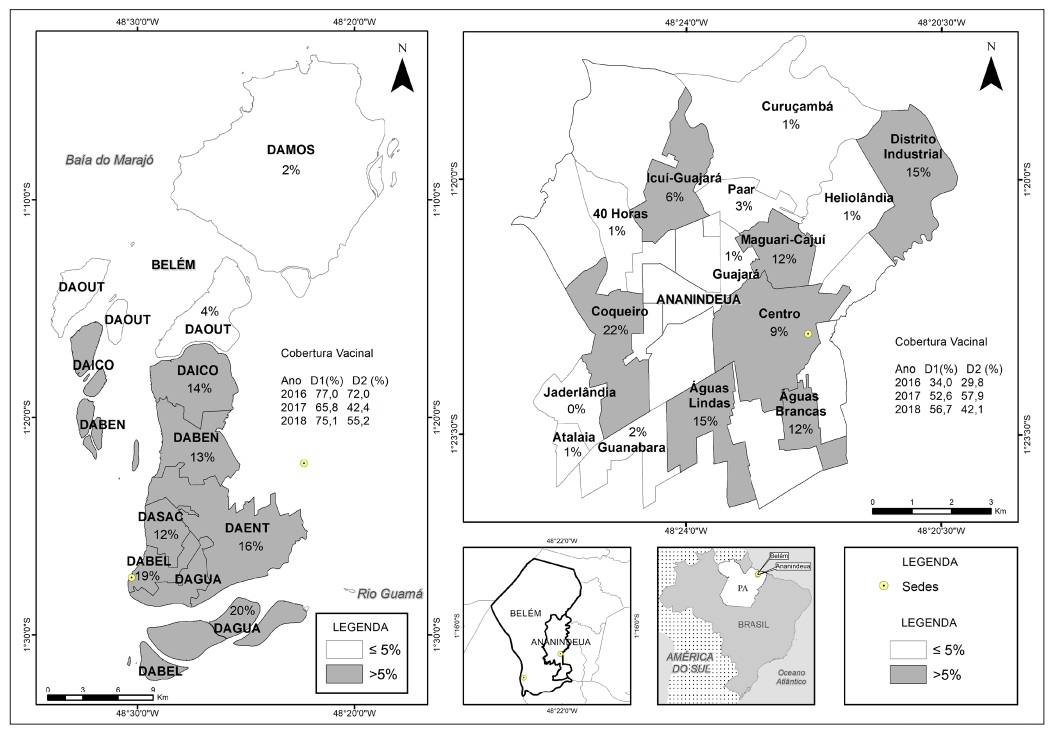
Fuente: LABGEO/IEC/SVS/MS.
DAMOS: Distrito Administrativo Mosqueiro; DAOUT: Distrito Administrativo Outeiro; DAICO: Distrito Administrativo Icoaraci; DABEN: Distrito Administrativo Benguí; DAENT: Distrito Administrativo Entroncamento; DASAC: Distrito Administrativo Sacramenta; DABEL: Distrito Administrativo Belém; DAGUA: Distrito Administrativo Guamá; D1: Primera dosis de la vacuna contra el sarampión; D2: Segunda dosis de la vacuna contra el sarampión.
Figura 2 - Mapeo de los participantes susceptibles al sarampión distribuidos por distritos administrativos de Belém y barrios de Ananindeua, estado de Pará, Brasil, 2016 a 2018
Las frecuencias de inmunes y susceptibles, según la historia de vacunación relacionada con el tipo de vacuna y sus combinaciones, se muestran en la Figura 3. Para evaluar el impacto de posibles lapsos en el autoinforme, se analizaron las frecuencias de individuos inmunes y susceptibles según la autorreferencia (Figura 3A) y también según el carnet de vacunación (Figura 3B). En los análisis se consideró parte de los pacientes vacunados autoinformados, así como parte de los pacientes vacunados comprobados por el carnet, ya que no todas las autorreferencias de vacunación conocían el tipo, y no todos los carnets de vacunación tenían esta información legible. La diferencia en los factores inmunes entre los individuos que recibieron VCS simple y combinado con dos (doble viral - SR) y tres componentes (SCR) presentó la prueba G = 6,1677, p = 0,4491, para los pacientes vacunados autoinformados y x² = 27,666, p = 0,0001, para aquellos con carnet de vacunación. Comparando los dos análisis, se encontró la prueba G = 2,4443, p < 0,0001.
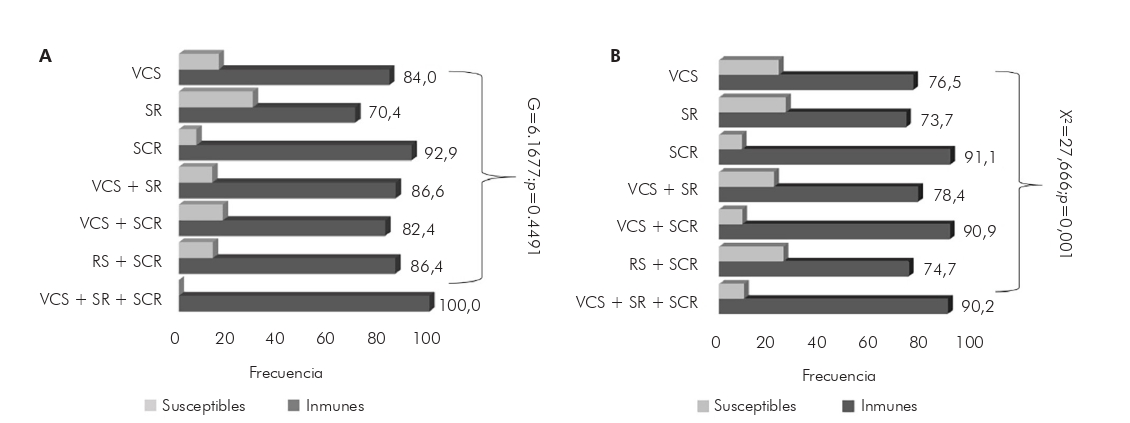
A: Información basada en autorreferencias; B: Información sobre la vacuna comprobada por el carnet de vacunación. VCS: Vacuna contra el sarampión - monovalente; SR: Sarampión y rubéola - doble viral; SCR: Sarampión, paperas y rubéola - triple viral. G = 244,43, p < 0,0001.
Figura 3 - Frecuencia de inmunes y susceptibles al sarampión, según los tipos de vacunas recibidas por los participantes, en Belém y Ananindeua, Estado de Pará, Brasil, 2016 a 2018
Los niveles de anticuerpos IgG específicos del sarampión, en relación con el número de dosis de vacuna recibidas, se analizaron solo en los participantes que presentaron el carnet de vacunación, excluyendo a aquellos que informaron haber contraído la enfermedad. De los 521 analizados, el 14,0% (73/521) había recibido sólo una dosis de SVC; 32,8% (171/521), dos dosis; y 53,2% (277/521), tres dosis o más. La prueba de proporción para dos muestras independientes mostró que el odds ratio (OR) para el título del reactivo de anticuerpos fue similar entre los participantes que recibieron una dosis de la vacuna frente a tres dosis, OR = 1,70 (IC del 95%: 0,70-3,78); p = 0,2538) y también para aquellos que recibieron dos dosis de la vacuna frente a tres dosis, OR=0,79 (IC del 95%: 0,48-1,27); p = 0,3917), así como para aquellos que recibieron una dosis frente a dos dosis, OR=2,17 (IC del 95%: 0,95-4,92; p = 0,0899) (Tabla 3).
Tabla 3 - Título del IgG, por ELISA/ Enzygnost Anti-Measles Virus/IgG, de acuerdo con el número de dosis de vacuna con componente de sarampión y el análisis comparativo entre el número de dosis, entre participantes de Belém y Ananindeua, estado de Pará, Brasil, 2016 a 2018
| Vacuna con componente del sarampión | Títulos (mIU/mL) | ||
|---|---|---|---|
| Nº de dosis administradas | > 350* | 150-350† | < 150‡ |
| Una (73) | 65 (89,0%) | 4 (5,5%) | 4 (5,5%) |
| Dos (171) | 135 (78,9%) | 15 (8,8%) | 21 (12,3%) |
| Tres o más (277) | 229 (82,7%) | 21 (7,6%) | 27 (9,7%) |
| Total (521) | 429 (82,3%) | 40 (7,7%) | 52 (10,0%) |
| Comparación entre Nº de dosis | Odds ratio | IC 95% | p-valor |
| Una dosis x tres dosis | 1,70 | 0,70-3,78 | 0,2538 |
| Dos dosis x tres dosis | 0,79 | 0,48-1,27 | 0,3917 |
| Una dosis x dos dosis | 2,17 | 0,95-4,92 | 0,0899 |
* Reactivo; † Indeterminado; ‡ No reactivo.
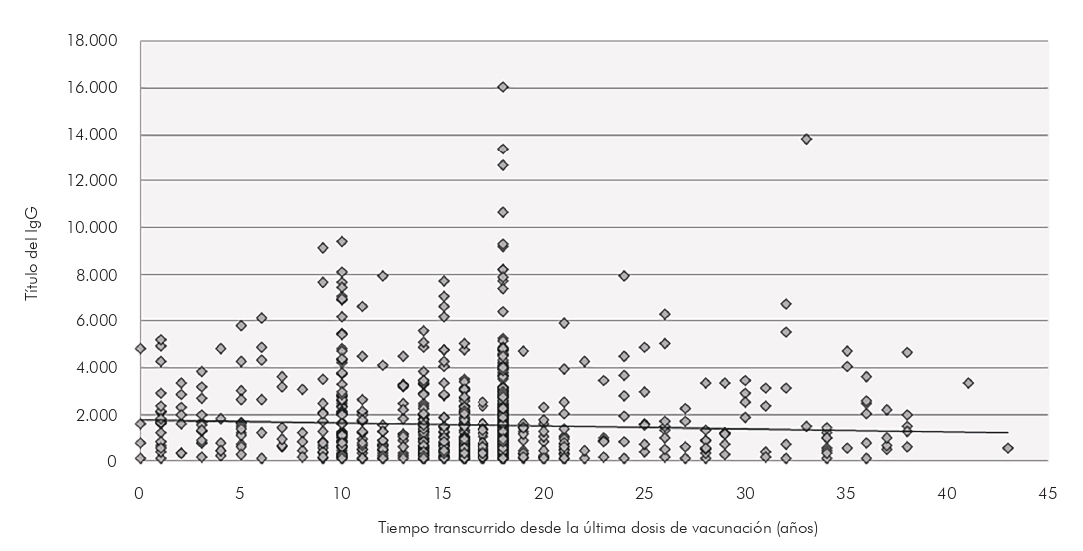
Para verificar una posible asociación entre títulos de anticuerpos para sarampión y tiempo posvacunación, se utilizó el análisis de correlación de Spearman, considerando el tiempo en años pasados después de la última dosis de la vacuna autorreferida y comprobada por vacunación por cada participante, resultando en: rs = -0,0897; t = -28721; p = 0,004 (Figura 4).
DISCUSIÓN
Este artículo es pionero en el estado de Pará, con un análisis seroepidemiológico del sarampión que aborda la seroprevalencia y el perfil epidemiológico de una población que experimentó el período epidémico y el proceso de cambios en el programa de inmunización, con el objetivo de la eliminación del sarampión, con la implementación de las vacunas SR y SCR desde el año 2000.
La frecuencia general de individuos inmunes, así como en todos los grupos de edad del estudio, fue inferior al 95% recomendado por el MS de Brasil. Este hecho demuestra que parte de la población puede no haber recibido refuerzo, de acuerdo con la guía del MS. Upholstery et al.22, al describir la seroprevalencia de sarampión en individuos mayores de 10 años en São José de Rio Preto, en el estado de São Paulo, encontraron porcentajes similares (84,2%) en la población de 10 a 40 años.
La susceptibilidad general fue del 17,2% para el virus del sarampión en Belém y Ananindeua; las frecuencias más altas de susceptibilidad se detectaron entre los participantes de 15 a 29 años, hecho motivado por la falta de la segunda dosis de la vacuna, PVF o FVS. Todos los grupos de edad en el estudio, en ambos municipios, mostraron diferencias estadísticamente significativas en relación con el porcentaje de susceptibles ingresados por el MH, demostrando que existe riesgo de brotes de sarampión, debido a la concentración de pacientes susceptibles a lo largo de los años combinada con la importación del virus que comenzó a circular en el país. Estos resultados fueron más altos que los encontrados por Sampaio et al.23, cuando estudiaron la prevalencia de anticuerpos contra el sarampión entre estudiantes vacunados de escuelas y universidades de la ciudad de São Paulo, con un 3,2%.
Según información del Programa Nacional de Inmunización, el CV para el sarampión en Pará, en el período de 1998 a 2018, fue del 79,5%. Tras la implementación de las vacunas SR y SCR, entre 2000 y 2003, se registró un CV del 118,6% (según los valores publicados por el sistema DATASUS), disminuyendo al 62,1% en 2003; a partir de 2004, alcanzó el objetivo fijado por el MH (95%) para el año 2012. En el período de 2013 a 2018, el CV volvió a disminuir, alcanzando el 53,2% en 201816.
Se notó que, tras la declaración de la eliminación del sarampión, hubo escasez de vacunas SR y SCR en los centros de salud, además de la reducción de las campañas de vacunación, con poca difusión. Los movimientos antivacunas han crecido a nivel mundial, incluso en Brasil, que siempre ha sido un ejemplo internacional de programas de inmunización, causando una disminución en la aceptación de vacunas y un aumento en los brotes y epidemias de enfermedades prevenibles por vacunación, como el sarampión24.
Los hombres eran más susceptibles al sarampión que las mujeres, un resultado similar a los hallazgos de Poethko-Müller y Mankertz25 en Alemania. Esto pudo haber ocurrido debido a las campañas de vacunación, que se produjeron en la implementación de SR y SCR, inicialmente contempladas mujeres en edad fértil, con el objetivo de evitar la rubéola entre las mujeres embarazadas26. También se observó un menor porcentaje de participantes masculinos en el estudio, tanto en Belém como en Ananindeua, un hallazgo opuesto al estudio de Tafuri et al.27, al analizar el monitoreo del proceso de eliminación del sarampión en Apulian, Italia. Según los autores, un menor apoyo puede haber sido influenciado por la aversión a los procedimientos invasivos manifestada por los hombres durante el procedimiento de recolección de sangre27.
La distribución geográfica de los individuos susceptibles fue revelada por la evidencia de estos individuos en seis distritos administrativos de Belém y en siete barrios de Ananindeua, incluyendo frecuencias de susceptibilidad significativas en varios de ellos. Al verificar el CV de 2018, Belém registró 65.2% y Ananindeua 49.4%, demostrando un porcentaje muy por debajo del deseado, creando así bolsas de susceptibles en riesgo de contraer la enfermedad, principalmente debido a la migración poblacional al norte del país16.
Analizando las frecuencias de inmunes y susceptibles al sarampión entre los tipos de vacunas administradas (VCS, SR y SCR) en información basada en autorreferencias, no se encontraron diferencias significativas; sin embargo, entre los que presentaron el carnet de vacunación, se encontró esta diferencia. En cuanto al tipo de vacuna administrada, al comparar la información de los pacientes vacunados probados por el carnet de vacunación con la información basada en autorreferencias, se detectó una diferencia significativa, lo que sugiere que cualquier lapso en los informes sobre el tipo de vacuna fue impactante. La vacuna SCR mostró una mayor frecuencia de positividad, ya que es la más utilizada desde su implantación. Santos et al.28 demostraron que la inmunogenicidad y la reactogenicidad de la vacuna combinada son similares a la vacuna única contra el antígeno del sarampión. Rivière et al.29, al evaluar los beneficios económicos de un programa combinado de vacunación en Canadá, concluyó que hubo ahorros considerables en los costos.
La presencia de individuos susceptibles en estos grupos mencionados, especialmente entre los vacunados con carnet de vacunación, evidencia la ocurrencia de fallas en la vacuna. La acumulación de susceptibles provoca la aparición de brotes, por lo que las condiciones adecuadas de la cadena de frío, el correcto manejo y administración de la vacuna son importantes para mitigar el PVF y el FVS30.
Comparando los títulos de anticuerpos contra el sarampión de los confirmados por el carnet de vacunación, se observó que el grupo de no reactivos y no reactivos que recibieron D2 es preocupante, lo que puede explicarse por la aparición de PVF y FVS en la administración de esta dosis o por la rápida pérdida de anticuerpos. Hallazgos similares han sido reportados por Kang al.31 al estudiar una población de vacunados en Corea.
Los niveles de anticuerpos IgG específicos del sarampión en relación con el número de dosis de vacuna recibidas mostraron que el odds ratio (OR) para el título de anticuerpos positivos no fue significativo entre los participantes que recibieron dosis únicas, en comparación con dos o tres dosis. Estos resultados muestran que, para lograr la inmunidad, una dosis de la vacuna puede ser suficiente; sin embargo, según el informe de los Centros para el Control y la Prevención de Enfermedades (CDC)32 una dosis de la vacuna SCR tiene aproximadamente un 93.0% de eficacia para el sarampión, y dos dosis o más, 97.0%. Comparando los datos de este estudio con los del informe de los CDC y los del estudio de Ogawa et al.33, que evaluó la historia de vacunación en médicos y estudiantes de enfermería, el nivel de inmunidad de este estudio fue menor; sin embargo, los resultados entre la comparación entre el número de dosis fueron similares. Lievano et al.34 detectaron el 8% de las personas sin síntomas clásicos con evidencia serológica de infección por sarampión. Parte de la población del presente estudio experimentó el período epidémico de sarampión antes de la eliminación.
La correlación entre el título de anticuerpos IgG contra el sarampión y el tiempo transcurrido después de la última vacunación mostró una débil asociación negativa, revelando una reducción en los niveles de anticuerpos a lo largo del tiempo, aproximadamente 20 años después de la última vacunación, confirmando la disminución de la inmunidad inducida por la vacuna. Hallazgos similares han sido reportados por Smetana et al.35 en la República Checa, con una reducción de anticuerpos alrededor de 30 a 39 años después de la última vacunación. Estos resultados demuestran que los individuos que han sido inmunizados en la infancia o adolescencia pueden llegar a ser susceptibles como adultos y, en el caso de las mujeres, pueden transferir bajos niveles de anticuerpos maternos a sus hijos, demostrando la necesidad de cumplir con las recomendaciones de la D2 con el fin de corregir posibles fallos de la vacuna36.
El perfil diversificado de los tipos de vacunas y los regímenes de vacunación contra el sarampión muestran que esta población ha sufrido cambios durante las estrategias en el programa de vacunación del MS, con la implementación del plan de eliminación del sarampión y la rubéola. En Pará, en 2000, se llevó a cabo la primera campaña de vacunación con SR para las edades de 1 a 4 años y para las mujeres en edad fértil; y, en 2003, la VCS fue reemplazada por la CRS, administrándola a los 12 meses de edad, según lo recomendado por el MS37.
CONCLUSIÓN
El estudio revela una susceptibilidad significativa en el grupo de edad de 15 a 39 años, formando bolsas de vulnerables, detectando una brecha en la protección contra el sarampión en adultos después de 20 años de la última vacunación. Puede haber sido la causa de los brotes de sarampión en Belén y Ananindeua desde 2018. Es clara la necesidad de fortalecer las estrategias de vacunación y toma de decisiones por parte del Estado frente a la reintroducción del virus, con el objetivo de controlar la enfermedad en Brasil, reanudar la certificación de eliminación del sarampión en el país y el alcance de su erradicación. Se sugiere la implementación de vigilancia serológica para identificar susceptibles y revacunación cuando se detecte la ausencia de anticuerpos protectores.
AGRADECIMIENTOS
Al Instituto Evandro Chagas y a los técnicos involucrados; Antônio Carlos Fernandes do Nascimento y Patrícia Sousa Moraes de Almeida, responsables por las pruebas serológicas; Vanda do Socorro da Costa Siqueira y Aline Colares, por la aplicación de los cuestionarios; Clistenes Catete y Marcos Vulcão, por la elaboración de gráficos y mapas, Ângela Pereira, por la corrección lingüística; Emilene Monteiro Furtado Serra, Aurélia Maria Mendes Oliveira, Leda Mani França de Arruda, Raimunda do Socorro Pimentel, Idebê Caldas da Cruz y Rita Maria Felix de Oliveira, que actuaron en la recolección de las especies biológicas
REFERENCIAS
1 Laksono BM, Vries RD, McQuaid S, Duprex WP, Swart RL. Measles virus host invasion and pathogenesis. Viruses. 2016;8(8):210. Doi: 10.3390/v8080210 [Link] [ Links ]
2 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Coordenação-Geral de Desenvolvimento da Epidemiologia em Serviços. Guia de vigilância em saúde. Vol. 1. Brasília: Ministério da Saúde; 2017. p. 119-34. [Link] [ Links ]
3 Prevots DR, Parise MS, Segatto TCV, Siqueira MM, Santos ED, Ganter B, et al. Interruption of measles transmission in Brazil, 2000-2001. J Infect Dis. 2003 May;187 Suppl 1:S111-20. Doi: 10.1086/368030 [Link] [ Links ]
4 Ministério da Saúde (BR). Calendário nacional de vacinação [Internet]. Brasília: Ministério da Saúde ; 2013 [citado 2018 dez 12]. Disponível em: Disponível em: https://www.saude.gov.br/saude-de-a-z/vacinacao/calendario-vacinacao . [ Links ]
5 Mello JN, Haddad DAR, Câmara GNP, Carvalho MS, Abrahão NM, Procaci VR. Panorama atual do sarampo no mundo: risco de surtos nos grandes eventos no Brasil. J Bras Med. 2014 jan-fev;102(1):33-40. [Link] [ Links ]
6 Jesus HS, Nascimento GL, Rosa FM, Santos DA. Investigação de surto de sarampo no Estado do Pará na era da eliminação da doença no Brasil. Cad Saude Publica. 2015;31(10):2241-6. Doi: 10.1590/0102-311X00017515 [Link] [ Links ]
7 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Plano de contingência para resposta às emergências de saúde pública: sarampo. Brasília: Ministério da Saúde ; 2016. [Link] [ Links ]
8 Pan American Health Organization, World Health Organization. Region of the Americas is declared free or measles [Internet]. Washington: PAHO, WHO; 2016 [cited 2019 Sep 3]. Available from: Available from: https://www.paho.org/hq/index.php?option=com_content&view=article&id=12528:region-americas-declared-free-measles&Itemid=1926&lang=en . [ Links ]
9 World Health Organization. New measles surveillance data from WHO [Internet]. Geneva: World Health Organization; 2019 [cited 2019 Sep 11]. Available from: Available from: https://www.who.int/immunization/newsroom/new-measles-data-august-2019/en/ . [ Links ]
10 Centers for Disease Control and Prevention. Nationwide rubella epidemic - Japan, 2013. MMWR Morb Mortal Wkly Rep. 2013 Jun 14;62(23):457-86. [Link] [ Links ]
11 World Health Organization. Measles and rubella surveillance data. Reported measles and rubella cases and incidence rates by member states [Internet]. Geneva: World Health Organization ; 2020 [cited 2019 Sep 3]. Available from: Available from: who.int/immunization/monitoring_surveillance/burden/vpd/surveillance_type/active/measles_monthlydata/en/ . [ Links ]
12 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Situação do sarampo no Brasil - 2018. Informe. 2018 nov;(32):1-9. [Link] [ Links ]
13 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Situação do sarampo no Brasil - 2018-2019. Informe. 2019 mar;(37):1-11. [Link] [ Links ]
14 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Vigilância epidemiológica do sarampo no Brasil 2019: janeiro a dezembro. Bol Epidemiol. 2020 mar;51(6). [Link] [ Links ]
15 Pacheco FC, França GVA, Elidio GA, Leal MB, Oliveira C, Guilhem DB. Measles-containing vaccines in Brazil: coverage, homogeneity of coverage and associations with contextual factors at municipal level. Vaccine. 2020 Feb;38(8):1881-7. Doi: 10.1016/j.vaccine.2020.01.030 [Link] [ Links ]
16 Ministério da Saúde (BR). Departamento de Informática do SUS. Imunizações - cobertura - Pará [Internet]. Brasília: Ministério da Saúde ; 2019 [citado 2018 dez 10]. Disponível em: Disponível em: http://tabnet.datasus. gov.br/cgi/deftohtm.exe?pni/CNV/CPNIPA.def . [ Links ]
17 Word Health Organization. Measles - global situation [Internet]. Geneva: World Health Organization ; 2019 [cited 2020 May 7]. Available from: Available from: https://www.who.int/csr/don/26-november-2019-measles-global_situation/en/ . [ Links ]
18 Fraser-bell CJ. Global re-emergence of measles - 2019 update. Glob Biosecur. 2019;1(3). Doi: 10.31646/gbio.43 [Link] [ Links ]
19 Prefeitura Municipal de Belém (PA). Anuário estatístico do município de Belém 2011. 16. ed. Belém: Secretaria Municipal de Coordenação Geral do Planejamento e Gestão; 2012. [Link] [ Links ]
20 Gusmão LHA. Mapas dos bairros de Ananindeua (serviço) [Internet]. 2017 dez [citado 2019 set 7]. Disponível em: Disponível em: http://geocartografiadigital.blogspot.com/2017/12/ . [ Links ]
21 Brasil. Ministério da Saúde. Comissão Nacional de Ética em Pesquisa. Resolução nº 466, de 12 de dezembro de 2012. Aprova diretrizes e normas regulamentadoras de pesquisas envolvendo seres humanos [Internet]. [Diário Oficial da União], Brasília (DF); 2012 [citado 2013 jun 3]. Disponível em: Disponível em: http://conselho.saude.gov.br/resolucoes/2012/Reso466.pdf . [ Links ]
22 Estofolete CF, Milhim BHGA, França CG, Silva GCD, Augusto MT, Terzian ACB, et al. Prevalence of measles antibodies in São José do Rio Preto, São Paulo, Brazil: a serological survey model. Sci Rep. 2020 Mar;10:5179. Doi: 10.1038/s41598-020-62151-3 [Link] [ Links ]
23 Sampaio BCF, Rodrigues JP, Meireles LR, Andrade Jr HF. Measles, rubella, mumps and Toxoplasma gondii antibodies in saliva of vaccinated students of schools and universities in São Paulo city, Brazil. Braz J Infect Dis. 2020 Feb;24(1):51-7. Doi: 10.1016/j.bjid.2019.11.005 [Link] [ Links ]
24 Sato APS. Qual a importância da hesitação vacinal na queda das coberturas vacinais no Brasil? Rev Saude Publica. 2018;52:96. Doi: 10.11606/S1518-8787.20180520011991 [Link] [ Links ]
25 Poethko-Müller C, Mankertz A. Seroprevalence of measles-, mumps- and rubella-specific IgG antibodies in German children and adolescents and predictors for seronegativity. PLoS One. 2012;7(8):e42867. Doi: 10.1371/journal.pone.0042867 [Link] [ Links ]
26 Moraes MM, Cruz ACR, Silva DFL, Sagica FES, Santos ECO. Trajetória da rubéola no Estado do Pará, Brasil: rumo à erradicação. Rev Pan-Amaz Saude. 2015;6(1):19-28. Doi: 10.5123/S2176-62232015000100003 [Link] [ Links ]
27 Tafuri S, Gallone MS, Gallone MF, Pappagallo MT, Larocca A, Germinario C. Monitoring the process of measles elimination by serosurveillance data: the apulian 2012 study. Vaccine. 2016 Apr;34(18):2092-5. Doi: 10.1016/j.vaccine.2016.03.011 [Link] [ Links ]
28 Santos EM, Martins R, Noronha T, Cruz R, Siqueira M, Pavão AL, et al. Estudo comparativo da imunogenicidade da vacina tríplice viral (sarampo, caxumba e rubéola) nas apresentações monodose e multidose, em lactentes. In: 6º Seminário Anual Científico e Tecnológico de Bio-Manguinhos; 2018; Rio de Janeiro, RJ. Anais... Rio de Janeiro: Bio-Manguinhos; 2018. p. 24-5. [Link] [ Links ]
29 Rivière M, Tretiak R, Levinton C, Fitzsimon C, Leclerc C. Economic benefits of a routine second dose of combined measles, mumps and rubella vaccine in Canada. Can J Infect Dis. 1997 Sep-Oct;8(5):257-64. Doi: 10.1155/1997/215175 [Link] [ Links ]
30 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Departamento de Vigilância das Doenças Transmissíveis. Manual de normas e procedimentos para vacinação. Brasília: Ministério da Saúde ; 2014. 176 p. [Link] [ Links ]
31 Kang HJ, Han YW, Kim SJ, Kim YJ, Kim AR, Kim JA, et al. An increasing, potentially measles-susceptible population over time after vaccination in Korea. Vaccine. 2017 Jul;35(33):4126-32. Doi: 10.1016/j.vaccine.2017.06.058 [Link] [ Links ]
32 Centers for Disease Control and Prevention. Plan for travel [Internet]. Atlanta (GA): Centers for Disease Control and Prevention; 2019 [cited 2020 Feb 19]. Available from: Available from: https://www.cdc.gov/measles/plan-for-travel.html . [ Links ]
33 Ogawa M, Ae R, Sasahara T. Relationship between self-reported vaccination history and measles and rubella antibody titers in medical and nursing students. Adv Infect Dis. 2017 May;7(2):27-36. Doi: 10.4236/aid.2017.72004 [Link] [ Links ]
34 Lievano FA, Helfand RF, Harpaz R, Walls L, Katz RS, Williams I, et al. Lack of evidence of measles virus shedding in people with inapparent measles virus infections. J Infect Dis. 2004 May;189 Suppl 1:S165-70. Doi: 10.1086/377715 [Link] [ Links ]
35 Smetana J, Chlibek R, Hanovcova I, Sosovickova R, Smetanova L, Gal P, et al. Decreasing seroprevalence of measles antibodies after vaccination - possible gap in measles protection in adults in the Czech Republic. PLoS One. 2017 Jan;12(1):e0170257. Doi: 10.1371/journal.pone.0170257 [Link] [ Links ]
36 Wiedermann U, Garner-Spitzer E, Wagner A. Primary vaccine failure to routine vaccines: why and what to do? Hum Vaccin Immunother. 2016 Jan;12(1):239-43. Doi: 10.1080/21645515.2015.1093263 [Link] [ Links ]
37 Ministério da Saúde (BR). Secretaria de Vigilância em Saúde. Secretaria de Atenção à Saúde. Relatório da verificação dos critérios de eliminação da transmissão dos vírus endêmicos do sarampo e rubéola e da síndrome da rubéola congênita (SRC) no Brasil. Brasília: Ministério da Saúde ; 2010. [Link] [ Links ]
Cómo citar este artículo / How to cite this article: Moraes MM, Sagica FES, Jesus MI, Medeiros RLF, Silva DFL, Matos HJ, et al. Estudio seroepidemiológico del sarampión en poblaciones residentes en la Región Metropolitana de Belém, estado de Pará, Brasil, 2016 a 2018. Rev Pan Amaz Saude. 2020;11:e202000378. Doi: http://dx.doi.org/10.5123/S2176-6223202000378
Recibido: 24 de Junio de 2019; Aprobado: 09 de Julio de 2020











 texto en
texto en 
 Curriculum ScienTI
Curriculum ScienTI