INTRODUÇÃO
A esquistossomose está entre as doenças parasitárias de maior prevalência mundial1. De acordo com relatórios da Organização Mundial da Saúde (OMS), essa parasitose pertence ao grupo de doenças tropicais negligenciadas, com quase 240 milhões de pessoas no mundo necessitando de tratamento2. Em 2018, foram tratadas mais de 97,2 milhões de pessoas3.
A esquistossomose foi registrada em 78 países, incluindo sobretudo regiões das Américas, África e Mediterrâneo Oriental. Nas Américas, o Brasil é o país mais afetado, com cerca de 1,5 milhão de pessoas infectadas por Schistosoma mansoni e mais de 25 milhões habitando locais com alto risco de infecção3,4,5,6,7. A transmissão autóctone foi relatada em todas as cinco regiões brasileiras, sendo os estados endêmicos Alagoas, Bahia, Maranhão, Paraíba, Pernambuco, Rio Grande do Norte, Sergipe, Espírito Santo e Minas Gerais4. Atualmente, a esquistossomose é encontrada em uma extensão contínua que envolve o Rio Grande do Norte até o norte de Minas Gerais, adentrando o interior da Bahia, Minas Gerais e Maranhão. Nos estados das Regiões Norte, Centro Oeste e Sul, a transmissão ocorre em áreas restritas, sendo considerada focal8.
Diante da expansão da doença no país, em 1975 foi criado o Programa Especial de Controle da Esquistossomose (PECE), que visou eliminar a transmissão e reduzir a prevalência da infecção para menos de 4%. Apesar dos bons resultados, o objetivo principal não foi alcançado. Posteriormente, o PECE foi substituído pelo Programa de Controle da Esquistossomose (PCE) na década de 19809,10. Em 1993, houve a descentralização das ações da vigilância e controle da esquistossomose pela criação do Projeto de Controle de Doenças Endêmicas no Nordeste, aumentando a participação dos municípios e também a cobertura do PCE. Atualmente, o controle da doença depende da implementação de políticas públicas, sob responsabilidade dos gestores municipais e está inserido entre as atividades da Atenção Básica5.
A implementação de medidas de controle da esquistossomose, desde 1976, ocasionou redução das formas hepatoesplênicas e do número de óbitos. Após essa melhoria, a doença atingiu um novo estado endêmico, com resposta insatisfatória às ações de controle5. Em 2010, o Inquérito Nacional da Prevalência da Esquistossomose mansoni e Geo-Helmintoses (INPEG) evidenciou queda significativa nas taxas de positividade em todos os estados brasileiros, com os maiores índices de prevalência nas Regiões Norte e Nordeste, tendo o estado de Sergipe apresentado a maior proporção de positivos (8,19%), muito superior ao observado para a Região Nordeste (1,27%)11. Desse modo, Sergipe apresenta, historicamente, alta prevalência para essa parasitose, com registros de prevalência superior a 50% em municípios do leste do estado12,13.
Em virtude das dificuldades para a vigilância e controle da esquistossomose, é importante compreender a dinâmica da transmissão e os fatores a ela associados14. A transmissão da doença ocorre por veiculação hídrica em corpos de água contaminados com esgoto doméstico. Esse modo de infecção explica sua maior prevalência na população de baixa renda, em destaque as comunidades agrícolas e pesqueiras, estando, portanto, associada a baixas condições socioeconômicas e tendo como condicionantes um saneamento básico deficiente, más condições de higiene, ausência de educação voltada para a saúde e contato frequente do homem com águas contaminadas por esgotos domésticos3,11.
Além de afetar a saúde da população, a esquistossomose causa importantes impactos econômicos15. Primeiramente, essa parasitose é mais incapacitante que letal3,16, reduzindo o número da população economicamente ativa. Além disso, a esquistossomose gera altos custos à saúde pública, divididos entre os custos diretos (diagnóstico e tratamento de complicações), custos diretos não relacionados à saúde (transporte e atendimento doméstico) e custos indiretos (auxílio doença e morte prematura)17. O turismo, por sua vez, também é afetado, visto que alguns pontos turísticos apresentam potencial risco de infecção18.
As contribuições científicas para o conhecimento da esquistossomose foram muito significativas. Entretanto, ainda há escassez de estudos recentes que desenhem a condição local dessa doença e analisem o funcionamento e os resultados das medidas de controle. Nesse contexto, e considerando que Sergipe é o estado de maior prevalência dessa parasitose no Brasil11, este estudo teve por objetivo descrever o quadro epidemiológico da esquistossomose no estado e avaliar as atividades relacionadas ao PCE em análise de série temporal.
MATERIAIS E MÉTODOS
Este estudo analisou dados da esquistossomose mansoni em Sergipe, o menor estado brasileiro em território (21.926,908 km2), localizado na Região Nordeste. Sua população é composta por 2.068.017 habitantes, e a densidade demográfica é de 94,36 habitantes/km2. Sergipe é dividido em 75 municípios, sendo a capital Aracaju localizada na região litoral do estado19.
Para a análise dos aspectos epidemiológicos da esquistossomose mansoni, foi realizado um estudo ecológico de séries temporais de 2008 a 2017. Foram utilizados dados secundários do Sistema de Informação do Programa de Controle da Esquistossomose (SISPCE) da Secretaria de Estado da Saúde de Sergipe (SES/SE) e dados disponíveis no Departamento de Informática do Sistema Único de Saúde (DATASUS). Fizeram parte dos dados coletados pelo PCE somente os municípios considerados endêmicos para essa parasitose (51 municípios)20. No período de 2008 a 2011, os dados disponíveis no DATASUS6 foram semelhantes aos dados da SES/SE. No entanto, a partir de 2012, os dados do DATASUS mostraram-se significativamente menores e incompletos. Portanto, para os anos de 2012 a 2017, foram utilizadas as informações disponíveis em planilhas oficiais da SES/SE.
Foram compilados dados anuais, por município, referentes às seguintes informações: a) população trabalhada; b) número de exames realizados; c) número de positivos para S. mansoni; d) percentual de positividade para S. mansoni; e) número de positivos por carga parasitária; f) número de indivíduos a serem tratados para S. mansoni; e g) número de indivíduos tratados para S. mansoni. Considerou-se adesão ao PCE o registro de atividades do município no SISPCE em cada ano.
Os dados foram tabulados no programa Microsoft Excel 2016®21 e posteriormente calculados, por ano: número de exame realizados; percentual de adesão dos municípios endêmicos ao PCE (considerando o total de 51 municípios endêmicos); percentual de positividade da população avaliada; percentual de casos com alta carga parasitária (17 ou mais ovos por lâmina - equivalente a aproximadamente 400 ovos ou mais por grama de fezes22); e percentual de tratados para esquistossomose mansoni. O método utilizado para a realização dos exames parasitológicos de fezes foi o Kato-Katz, o preconizado pelo Ministério da Saúde para o PCE5,11.
Os resultados foram analisados por ano e como média de todo o período, associada ao desvio padrão. Para as variáveis percentual de positividade, percentual de positivos com alta carga parasitária e percentual de tratados, foi necessário realizar cálculo de média ponderada, utilizando como pesos, respectivamente, o número de exames realizados, o número de casos positivos e o número de pessoas a tratar. Abaixo descreve-se o cálculo realizado, onde "P" corresponde ao percentual por ano e "Pe" ao peso:
Utilizou-se o programa Joinpoint Regression v4.7.0.0®23 para a construção de gráficos de dispersão, relacionando cada uma das variáveis citadas (dependentes) ao ano (variável independente), com demonstração da variação anual percentual (annual percentage change - APC), considerando o intervalo de confiança (CI) de 95%. A regressão linear foi determinada pela regressão de Poisson e a correlação entre as variáveis pela correlação de Spearman, expressa pelo coeficiente de correlação de Spearman (rs), utilizando o programa BioEstat v5.3®24.
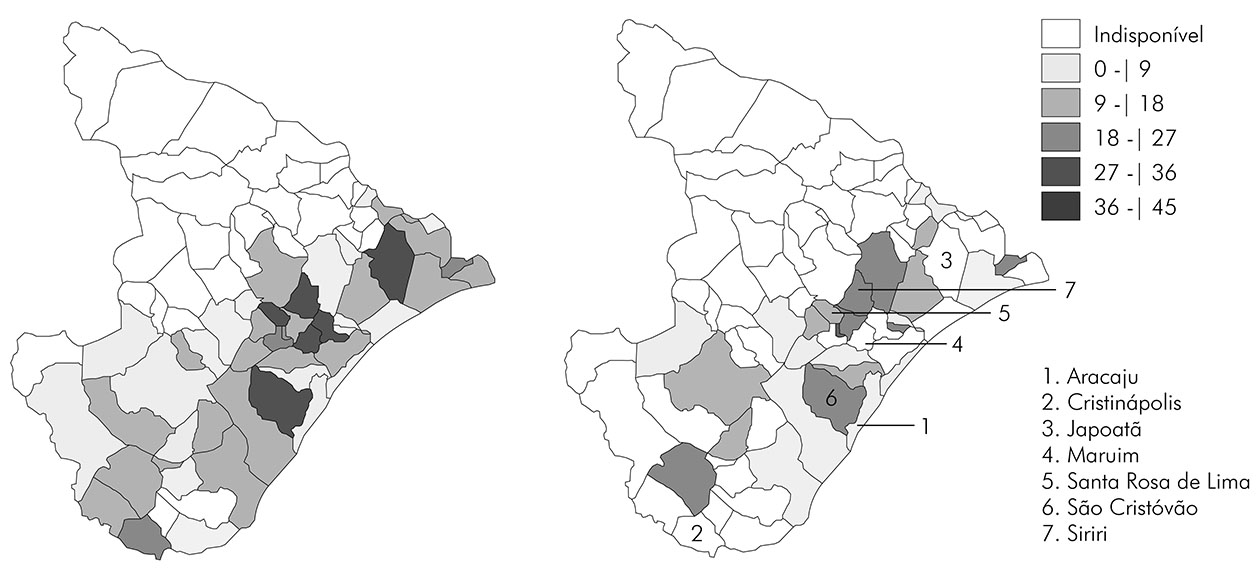
Por fim, avaliou-se a distribuição espacial da esquistossomose no estado de Sergipe em relação ao percentual de positividade nos anos de maior e menor adesão dos municípios endêmicos ao PCE (2011 e 2017, respectivamente), por meio da construção de mapas temáticos, demonstrando o percentual de positividade da esquistossomose mansoni por município. A elaboração dos mapas foi realizada pelo programa TabWin v4.1.56. Os municípios tiveram seus percentuais de positividade distribuídos em cinco intervalos: I) 0 a 9%; II) 10 a 18%; III) 19 a 27%; IV) 28 a 36%; e V) 37 a 45%. Com base nas definições contidas no INPEG11, os municípios com percentual de positividade abaixo de 5% foram considerados de baixa endemicidade; entre 5% e 25%, de média endemicidade; e acima de 25%, de alta endemicidade.
RESULTADOS
Entre 2008 e 2017, a adesão média dos municípios endêmicos de Sergipe ao PCE foi 72% ± 11% (36,7 ± 5,6), sendo a maior adesão 88,2% (45) em 2011 e a menor 51% (26) em 2017. Foram realizados 677.861 exames durante o período estudado, com média anual de 67.786 ± 23.808. O maior número de exames realizados foi 100.387 em 2011 e o menor foi 30.494 em 2016 (Tabela 1).
Tabela 1 - Série histórica com a distribuição de exames realizados e de percentuais de adesão dos municípios ao PCE, positividade para S. mansoni, positivos com alta carga parasitária e tratamento realizado no estado de Sergipe (2008-2017)
| Ano | Variáveis | ||||
|---|---|---|---|---|---|
| Número de exames realizados | Percentual de adesão de municípios ao PCE | Percentual de positividade para S. mansoni | Percentual de positivos com alta carga parasitária | Percentual de tratados para S. mansoni | |
| 2008 | 79.858 | 76,5 | 10,3 | 6,7 | 77,5 |
| 2009 | 92.957 | 80,4 | 8,8 | 5,4 | 52,3 |
| 2010 | 91.719 | 82,3 | 9,6 | 7,5 | 64,1 |
| 2011 | 100.387 | 88,2 | 8,5 | 7,9 | 75,2 |
| 2012 | 71.585 | 76,5 | 7,6 | 6,9 | 65,0 |
| 2013 | 62.542 | 64,7 | 8,1 | 11,9 | 78,5 |
| 2014 | 47.058 | 64,7 | 6,9 | 8,0 | 79,0 |
| 2015 | 61.485 | 70,6 | 7,4 | 8,6 | 77,0 |
| 2016 | 30.494 | 64,7 | 9,9 | 11,7 | 58,3 |
| 2017 | 39.776 | 51,0 | 7,1 | 8,8 | 73,3 |
| Média do período total | 67.786 | 72,0 | 8,6* | 7,9* | 68,7* |
Fonte: SISPCE-SE/SES-SE/DATASUS, 2019.
* Média ponderada de acordo com o número de exames realizados, número de casos positivos e número de pessoas a tratar em cada ano.
A positividade média para S. mansoni nos exames realizados foi de 8,6% ± 1,2% (5.799 ± 2.448 exames positivos), sendo o maior percentual 10,3% (8.258) em 2008, e o menor 6,9% (3.227) em 2014 (Tabela 1). A capital, Aracaju, demonstrou média de positividade inferior às médias para o estado ao longo dos anos (2,8% ± 1,2% ao ano), sendo 2010 o ano de maior positividade (4,6%).
Dentre o número total de positivos, observou-se média de 7,9% ± 2,1% (457 ± 157) casos com alta carga parasitária por ano, atingindo o valor máximo de 11,9% (604) em 2013 e valor mínimo de 5,4% (442) em 2009. Em relação à cobertura de tratamento, registrou-se proporção média de 68,7% ± 9,5% (4.278 ± 1.606) pacientes tratados por ano, variando de 58,3% (2.618) em 2016 a 79,0% (2.567) em 2014 (Tabela 1).
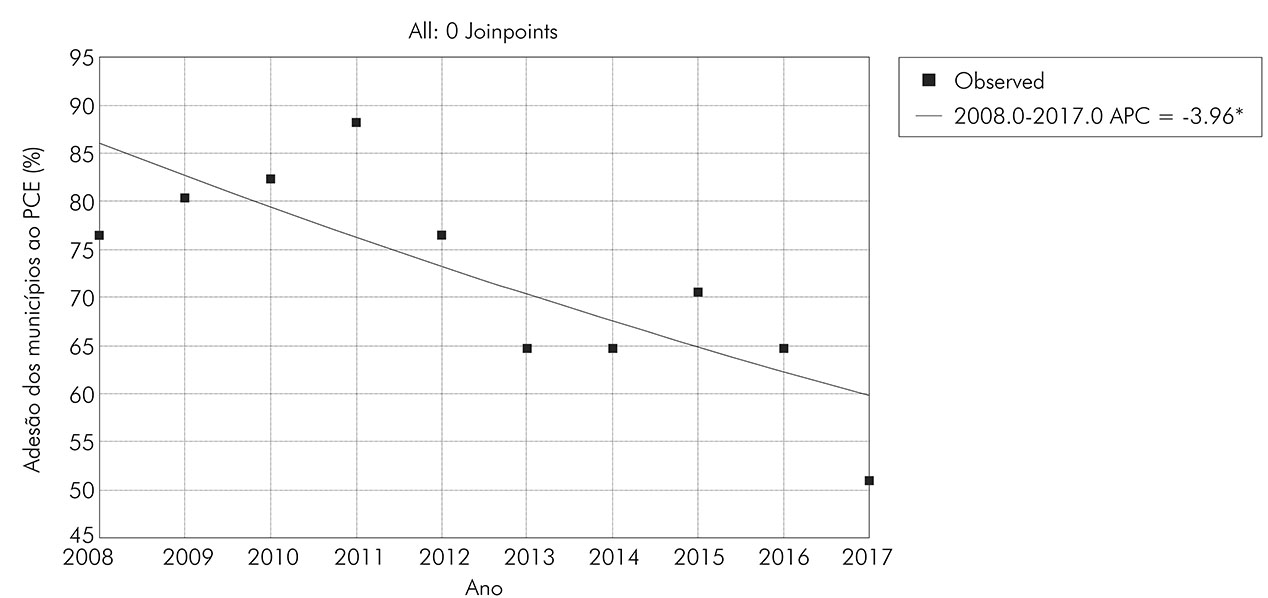
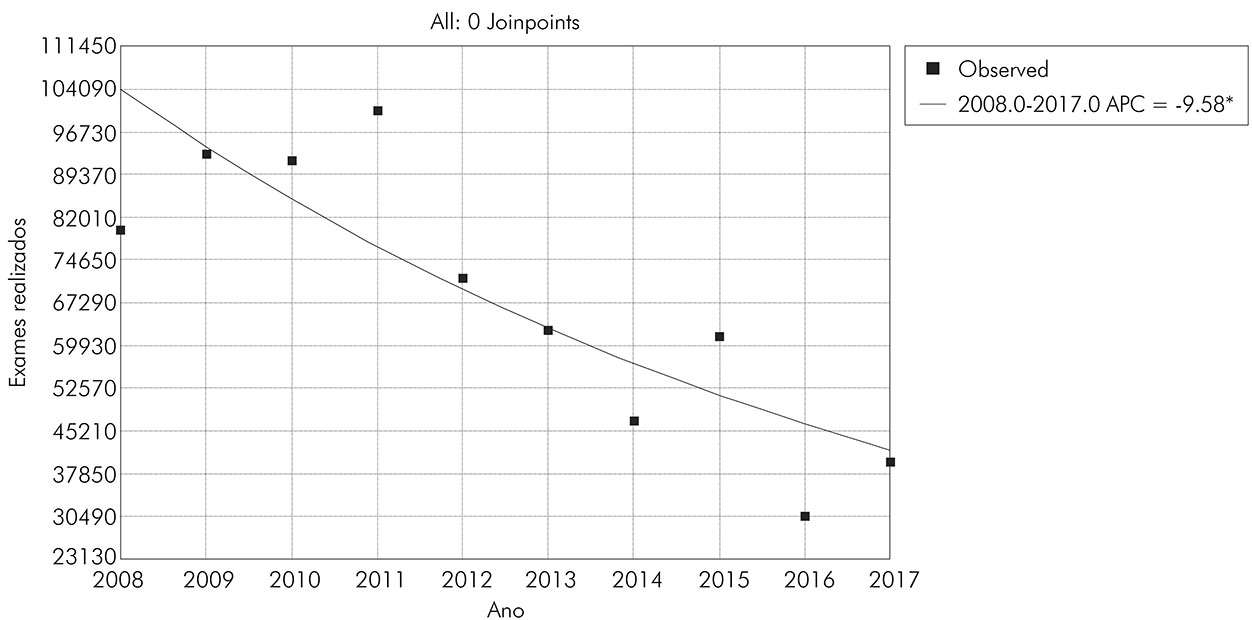
Ao longo da série temporal estudada, o percentual de adesão dos municípios sergipanos ao PCE apresentou tendência de redução estatisticamente significante de aproximadamente 4% ao ano (APC = -3,96; CI = -1,4 a -6,4; p = 0,0007) (Figura 1). O número de exames realizados pelo Programa também sofreu redução estatisticamente significativa de 9,6% ao ano (APC = -9,58; CI = -14,4 a -4,4; p = 0,0031), o que demonstra queda na cobertura populacional dos inquéritos coproscópicos do PCE (Figura 2).
Fonte: SISPCE-SE/SES-SE/DATASUS, 2019.
* Indicates that the Annual Percent Change (APC) is significantly different from zero at the alpha = 0.05 level. Final Selected Model: 0 Joinpoints.
Figura 1 - Distribuição, por ano, da proporção de adesão dos municípios sergipanos ao PCE (2008-2017)
Fonte: SISPCE-SE/SES-SE/DATASUS, 2019.
* Indicates that the Annual Percent Change (APC) is significantly different from zero at the alpha = 0.05 level. Final Selected Model: 0 Joinpoints.
Figura 2 - Número de exames realizados para S. mansoni, por ano, no estado de Sergipe (2008-2017)
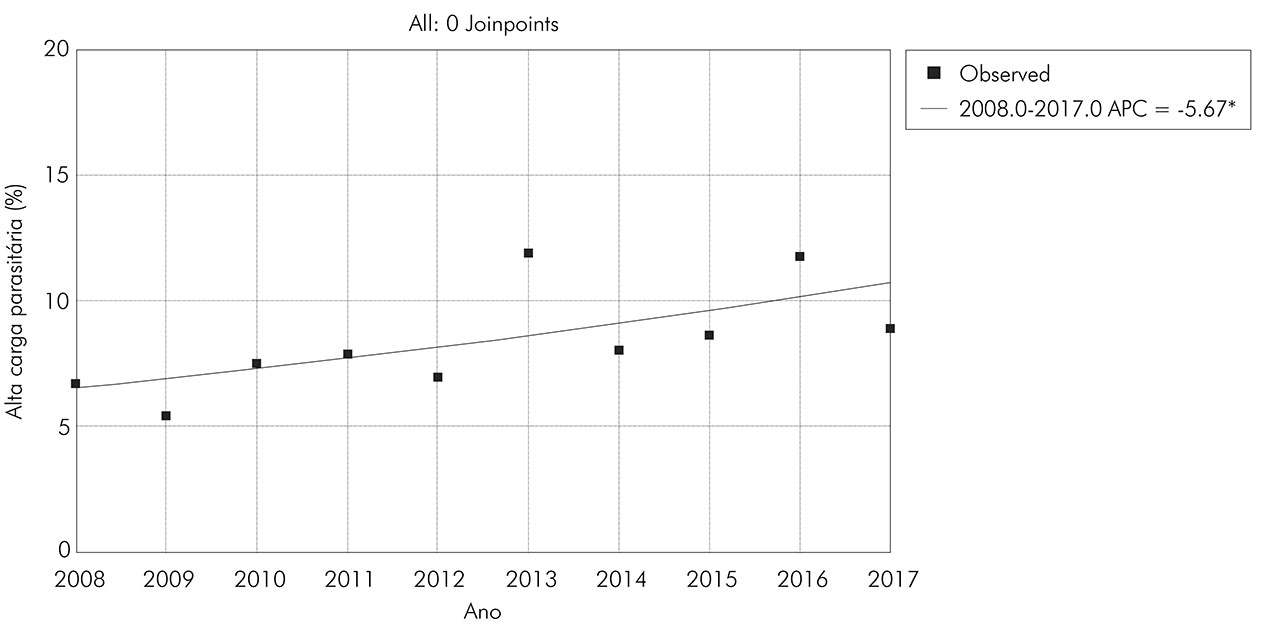
A evolução do percentual de pacientes com alta carga parasitária para S. mansoni apresentou tendência crescente, com aumento percentual estatisticamente significante de 5,7% ao ano (APC = 5,67; CI = 0,4 a 11,3; p = 0,038) (Figura 3).
Fonte: SISPCE-SE/SES-SE/DATASUS, 2019.
* Indicates that the Annual Percent Change (APC) is significantly different from zero at the alpha = 0.05 level. Final Selected Model: 0 Joinpoints.
Figura 3 - Distribuição da frequência percentual de positividade para S. mansoni com alta carga parasitária no estado de Sergipe (2008-2017)
A análise de regressão linear para as seguintes variáveis não demonstrou significância estatística: percentual de positividade para S. mansoni (APC = -2,49; CI = -5,6 a 0,7; p = 0,1); e percentual de pacientes tratados (APC = 0,73; CI = -2,8 a 4,4; p = 0,7).
Houve correlação negativa estatisticamente significante entre o percentual de adesão de municípios ao PCE e o percentual de pacientes com alta carga parasitária (rs = -0,7139; p = 0,0203) e também entre o número de exames realizados anualmente e o percentual de pacientes com alta carga parasitária (rs = -0,7091; p = 0,0216).
A distribuição espacial da esquistossomose mansoni em Sergipe foi observada em termos de percentual de positividade (Figura 4). Foram avaliados os anos de 2011 e 2017, em que houve a maior (45) e menor adesão (26) de municípios ao PCE, respectivamente. Em 2011, foram realizados 100.387 exames e o percentual de positividade médio foi de 8,5%, dos quais 75,2% foram tratados. Nesse ano, os seguintes municípios apresentaram alta endemicidade: Cristinápolis (25,2%), Japoatã (27,1%), Maruim (28,8%), Santa Rosa de Lima (30,5%) e São Cristóvão (32,8%). Além desses cinco, 30 municípios mostraram média endemicidade e 10 municípios foram considerados de baixa endemicidade, dentre os quais está a capital do estado, Aracaju (4,4%). Em 2017, foram realizados 39.776 exames, e o percentual de positividade médio foi de 7,1%, dos quais 73,3% foram tratados. Nesse ano, o município Siriri apresentou prevalência de 25,5%, sendo o único município de alta endemicidade. Apresentaram média endemicidade 20 municípios e cinco mostraram baixa endemicidade, incluindo Aracaju (1,4%).
DISCUSSÃO
Sergipe foi apontado como o estado brasileiro de maior prevalência de esquistossomose no último inquérito realizado no Brasil11. Entretanto, apesar dessa constatação, os resultados da presente análise apontaram redução da atenção à esquistossomose. O número de municípios executando as atividades do PCE, de 2008 a 2017, apresentou tendência decrescente e redução aproximada de 4% ao ano, de modo que, em 2017, somente 26 municípios registraram atividades, excluindo, inclusive, municípios considerados de alta endemicidade em períodos anteriores, como Japoatã, Maruim e Cristinápolis. Essa queda na adesão ao Programa traz sérias consequências para o estado, uma vez que a Secretária de Vigilância em Saúde (SVS) fornece insumos e apoios técnico e financeiro baseados em relatórios estatísticos e análises do PCE advindos das secretarias estaduais e municipais de Saúde25. Dado relevante é que essa redução de adesão ao PCE coincide com a emergência - ou agravamento - de outras epidemias no estado, como dengue, chikungunya, zika, dentre outras, sugerindo possível desvio da atenção dos órgãos de saúde pública26,27,28,29,30,31.
Em decorrência do menor número de municípios endêmicos realizando atividades do Programa, o número de exames realizados diminuiu, apresentando tendência de queda de aproximadamente 9,6% por ano, o que assinala provável subnotificação de casos. Outros autores também relataram essa redução no número de exames realizados em períodos semelhantes ao estudado26,32, paralelo a decréscimo da adesão de municípios ao PCE25. Esses fenômenos ocorreram pouco após a descentralização das ações de controle da endemia e podem gerar dados errôneos acerca da distribuição da doença no estado, bem como interpretações equivocadas acerca do real cenário da doença25. Soma-se a isso, a discordância de informações, a partir de 2012, entre o DATASUS e os dados da SES/SE que, além de contribuir para tais erros de interpretação, apontam falhas no fluxo de registro das notificações entre municípios, estados e União.
A proporção de exames positivos para esquistossomose apresentou oscilações durante o período estudado, com média de 8,6%. Em 2011, ano de maior adesão dos municípios, a positividade foi de 8,5%, percentual semelhante à média dos 10 anos e superior à média nordestina no mesmo ano33, bem como a de outros estados de alta prevalência da doença, como Alagoas34. Embora a positividade não expresse a prevalência da doença, uma vez que os inquéritos coproscópicos não são realizados para este fim e não têm base em amostra representativa da população, a média encontrada é também semelhante à prevalência obtida no inquérito nacional (8,19%) realizado entre 2010 e 201511. De fato, Sergipe é um estado historicamente endêmico, com condições favoráveis ao estabelecimento dessa parasitose25,35,36,37. Em 2010, o estado apresentou déficit de saneamento básico, com quase o dobro do percentual de pessoas vivendo em domicílios com serviços de abastecimento de água e esgotamento sanitário inadequados (11%) em relação ao país (6%)38.
Referente à prevalência municipal no período mais recente avaliado (2017), destacam-se Ilha das Flores, Itabaianinha, São Cristóvão e Siriri, que registraram taxa de positividade superior a 20%. Estes municípios apresentaram Índices de Desenvolvimento Humano Municipal (IDHM) considerados médios em 2010 (0,562; 0,556; 0,662; e 0,609, respectivamente) e notavelmente inferiores ao IDHM nacional (0,727)39. A capital sergipana, de IDHM alto (0,770)38, contudo, apresentou positividade de 4,6% no mesmo ano. Essa comparação pode indicar uma relação entre o grau de desenvolvimento humano e a prevalência da esquistossomose, desde que presentes os elos da cadeia de transmissão40. Além das baixas condições socioeconômicas e do déficit na infraestrutura serem fatores determinantes da alta prevalência da esquistossomose26, a heterogeneidade e a irregularidade na execução de programas de controle41 também devem ser reconhecidos como contribuintes para a desigualdade da positividade entre os municípios. Em 2017, por exemplo, vários municípios considerados de elevada endemicidade não registraram ações do PCE (Figura 4).
Outro fato importante é a modificação na dinâmica de transmissão da doença em resposta às modificações ambientais provocadas pelo homem. Sabe-se que, com a urbanização, grandes áreas do solo são impermeabilizadas, o que dificulta a drenagem da água da chuva e possibilita a formação de alagados muitas vezes contaminados com efluentes domésticos. Diante disso, a transmissão da esquistossomose passou a ser não somente associada a lagoas e outros reservatórios em áreas rurais, mas também a alagadiços peridomiciliares nas áreas urbanas, com aumento de casos autóctones42,43,44,45. Esse mecanismo de transmissão pode ser evitado após implantação de medidas para adequada drenagem de águas pluviais e tratamento dos esgotos46.
No que diz respeito à gravidade da infecção, este estudo expôs um aumento na carga parasitária, passando de 5,4% (2009) para 11,9% (2013), com valores mantendo-se superiores a 8% desde 2013, em contramão com a redução histórica observada em outros estados brasileiros após a adoção dos programas de controle34,47. O aumento da carga parasitária mostrou correlação com a redução das atividades do Programa e do número de exames realizados. Esse encontro pode ser resultado do enfraquecimento das ações para o diagnóstico precoce, embora se deva considerar a possibilidade de viés referente à não adesão de municípios que poderiam apresentar menores percentuais de alta carga parasitária. Porém, municípios de média e elevada endemicidade também estão deixando de realizar as atividades do PCE (Figura 4). A observação do aumento da carga parasitária é muito relevante, uma vez que a intensidade da infecção possui relação direta com a gravidade da doença, com consequências graves para o paciente e aumento do custo para os serviços de sáude48. Além disso, a cobertura de tratamento apresentou média de 68,7% ± 9,5%, percentual ainda inferior à meta de 80,0% de tratamento definida pelo PCE5. Esse déficit pode refletir falhas nos planejamentos das ações, como busca ativa de pacientes em horários incompatíveis com a sua rotina, ou a dificuldade do acesso do doente aos serviços de saúde da atenção primária32.
Em 2012, o Ministério da Saúde divulgou o "Plano integrado de ações estratégicas de eliminação da hanseníase, filariose, esquistossomose e oncocercose como problema de saúde pública, tracoma como causa de cegueira e controle das geo-helmintíases" em que, dentre seus objetivos, visava eliminar a esquistossomose como problema de saúde pública nos municípios endêmicos até 2015. Um dos objetivos desse plano era realizar a cobertura de 100% de tratamento de casos positivos16. Como esta análise demonstra, além de não atingir as metas programadas, houve retrocesso no estado de Sergipe, situação que também foi reproduzida em outros estados brasileiros34.
Este estudo apresenta como limitação o uso de dados secundários, gerados a partir da execução e registro dos dados do PCE, que pode ter sido diferente em cada município, como a abrangência e a frequência dos inquéritos e a inserção na atenção básica. No entanto, ele é útil no que tange ao reconhecimento do cenário de possível perda de prioridade do PCE em Sergipe. Somente com a retomada da implementação do programa de controle e a execução de novas medidas junto com a efetivação do Plano Nacional de Saneamento Básico49, o Brasil pode se aproximar da meta de eliminação da esquistossomose como um problema de saúde pública até 2025, definida pela OMS3.
CONCLUSÃO
Conforme análise dos dados, houve diminuição das atividades do PCE nos municípios sergipanos durante o período de 2008 a 2017. Além disso, observou-se tendência de aumento de casos com alta carga parasitária e, provavelmente, de casos graves, com consequente aumento de custos em saúde pública ao estado. Em nenhum ano foi atingida a meta de 80% de cobertura de tratamento definida pelo Programa. Essas observações revelam as dificuldades para o controle da esquistossomose no estado de maior prevalência do Brasil.










 text in
text in