INTRODUÇÃO
Os moluscos gastrópodes dulciaquícolas possuem representantes em várias famílias de importância médica e veterinária, sendo encontrados em diversos tipos de coleções hídricas1. As principais famílias desses moluscos são Planorbidae, Lymnaeidae, Physidae, Thiaridae, Ampullariidae, Ancylidae e Hydrobiidae que desempenham papel de hospedeiros intermediários dos trematódeos digenéticos1,2.
Entre os planorbídeos, o gênero Biomphalaria Preston, 1910 se destaca no Brasil com 10 espécies descritas e uma subespécie. Oito espécies foram identificadas no estado de São Paulo, sendo três hospedeiras naturais do trematódeo Schistosoma mansoni Sambon, 1907, Biomphalaria glabrata (Say, 1818), Biomphalaria straminea (Dunker, 1848) e Biomphalaria tenagophila (d'Orbigny, 1835); uma espécie potencial hospedeira do S. mansoni, Biomphalaria peregrina (d'Orbigny, 1835); e quatro espécies não hospedeiras do S. mansoni, Biomphalaria occidentalis (Paraense, 1981), Biomphalaria intermedia (Paraense & Deslandes, 1962), Biomphalaria oligoza (Paraense, 1975) e Biomphalaria schrammi (Crosse, 1984)1,2,3.
Com relação à esquistossomose no estado de São Paulo, a doença possui um perfil epidemiológico de baixa prevalência, porém com grandes áreas de transmissão autóctone e de casos importados, os quais compreendem as regiões do Vale do Ribeira de Iguape, Baixada Santista, Região Metropolitana de Campinas, Região Metropolitana de São Paulo, Vale do Paraíba e Litoral Norte4,5.
As doenças causadas por trematódeos são transmitidas por penetração direta da larva na pele e transmissão alimentar6. No primeiro caso, por exemplo, as larvas do S. mansoni e, no segundo caso, pela ingestão de água e de alimentos como peixes e crustáceos crus ou malcozidos, hortaliças cruas e mal lavadas, podendo resultar em várias doenças, como a equinostomíase, paragonimíases, clonorquíase, dermatites cercarianas em humanos e fasciolíase7,8,9,10.
Os estudos desenvolvidos sobre as interações parasitas-hospedeiros são baseados em levantamentos faunísticos considerando o sistema molusco-trematódeo. Esse modelo de investigação é muito utilizado nas pesquisas no Brasil e em outros países11,12,13.
Apesar dos conhecimentos adquiridos, é necessário elucidar diversas larvas e associá-las às formas adultas, bem como conhecer aspectos relacionados ao ciclo biológico e outros. Somente assim, será possível interpretar corretamente os papéis que os hospedeiros intermediários cumprem na transmissão das doenças14,15.
O presente estudo tem como objetivo identificar moluscos dulciaquícolas e larvas de trematódeos procedentes de valas de drenagem no município de Peruíbe, estado de São Paulo, e descrever a morfologia das larvas eliminadas pelos moluscos.
MATERIAIS E MÉTODOS
ÁREAS DE ESTUDO
As coletas dos moluscos foram realizadas nos meses de outubro a dezembro de 2016 e de abril a julho de 2017, em valas de irrigação no peridomicílio de três áreas do município de Peruíbe, litoral sul do estado de São Paulo (Figura 1). As áreas selecionadas foram: A - Nova Peruíbe: 24º17'50"S, 47º1'24"W (área periférica) com 14 valas; B - Jardim Caraguava: 24º17'42"S, 47º0'56"W (área periférica) com 28 valas; e C - Ruínas: 24º16'8"S, 46º56'12"W (área urbana) com 11 valas. Todas as áreas foram georreferenciadas com a utilização do aparelho GPS (global position system) eTrex Summit® (Garmin).
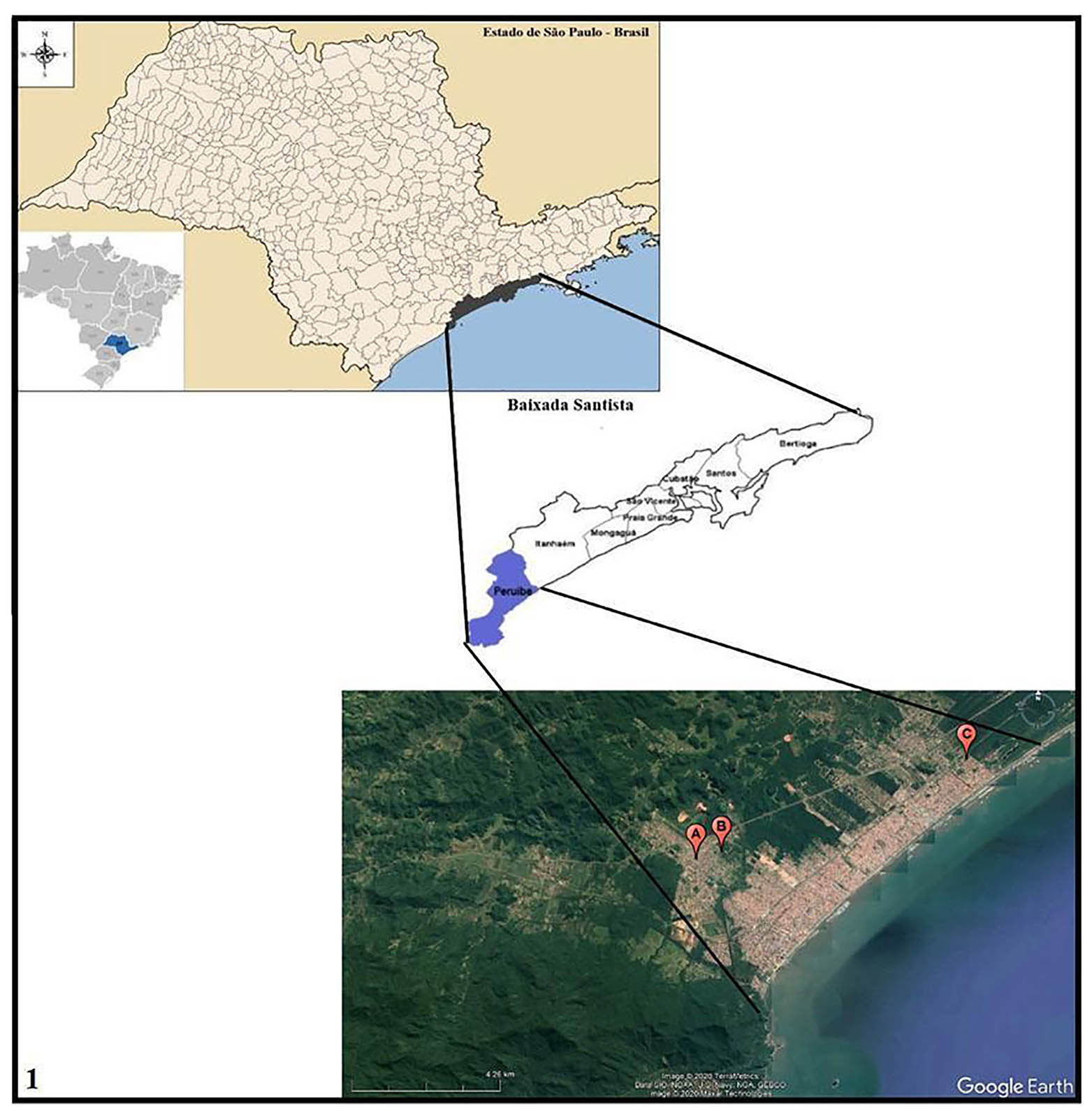
Fonte: Tabwin versão 4.1.5 - Datasus; Google Earth. Imagem produzida por Nayla Zanella Carramão.
Área A: Nova Peruíbe; Área B: Jardim Caraguava; Área C: Ruínas.
Figura 1 - Localização de Peruíbe na Baixada Santista, estado de São Paulo, Brasil, e imagem via satélite das áreas de coletas malacológicas
A área C (Ruínas) foi selecionada em razão das semelhanças ambientais com as áreas A (Nova Peruíbe) e B (Jardim Caraguava), como a presença de valas de irrigação com água e vegetação no peridomicílio, assim como larvas de insetos, girinos, moluscos e alguns peixes. No entorno das valas, foram notados alguns animais como cães, gatos, aves (urubus, patos, galinhas) e eventualmente cavalos. Todas as áreas tinham saneamento básico; no entanto, havia efluentes sanitários sendo lançados nas valas, contaminando também os solos pela ausência de pavimentação.
COLETA DE MOLUSCOS
Para a realização das coletas, não foi necessário solicitar licença ao Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis, em razão da Superintendência de Controle de Endemias (Sucen) ser responsável pelas ações de vigilância e controle de vetores e hospedeiros intermediários1.
A metodologia empregada nas coletas seguiu o Manual da Sucen: Procedimento Operacional Padrão para o Programa de Vigilância e Controle da Esquistossomose Mansônica (POPESQUISTO)16. As coletas dos moluscos ocorreram em toda a extensão da vala, coletando-se três amostras a cada trecho de 100 m.
Considerou-se, como amostra, um copo de plástico resistente (volume de 200 mL), com capacidade para 20 a 30 moluscos aproximadamente, conforme o tamanho do animal. Os copos utilizados receberam um pouco de vegetação aquática para manutenção da umidade interna, cuja abertura foi vedada com gaze. As amostras foram identificadas quanto à data da coleta, número da amostra, nome da localidade (bairro), nome da vala (igual ao nome da rua) e número do trecho da vala.
As coletas foram realizadas com o auxílio de uma pá coletora, constituída de tela metálica (malha de 2 mm) em ângulo reto, com o cabo de madeira longo e uma pinça de ponta reta de aço inox de 30 cm. Ao final das coletas, todas as amostras foram acondicionadas em caixas de plástico para serem transportadas com segurança.
TRATAMENTO DOS MOLUSCOS
Os procedimentos iniciais aconteceram no período da tarde, assim que as amostras do campo chegavam ao laboratório. Os moluscos foram quantificados e separados por gênero, segundo os parâmetros conquiológicos1. Após a triagem, os animais seguiram agrupados de acordo com o gênero ao qual pertenciam. Cada recipiente recebeu até 15 moluscos, água isenta de cloro e pequena porção de alface fresca.
EXAME PARASITOLÓGICO
Os exames para a avaliação da infecção por cercárias nos moluscos ocorreram individualmente em alvéolos da placa de cultura com água, exceto animais de maior diâmetro que foram colocados em pequenos recipientes de vidro transparente (7 cm). Os moluscos foram expostos à luz artificial (fotoestimulação) por 2 h, sempre no período diurno.
As formas larvais que emergiram dos moluscos foram observadas na própria placa de cultura de célula, que foi colocada sobre a base do microscópio estereoscópico em aumentos de 10-15x. Para um maior detalhamento das estruturas larvais, foi necessário colocar as larvas entre lâmina e lamínula para serem analisadas no microscópio óptico.
As pesquisas parasitológicas foram finalizadas com o esmagamento dos moluscos, visando encontrar possíveis cercárias em seus tecidos internos (vísceras). Para tanto, foi utilizada uma placa de vidro de 8,0/12,0 cm que recebeu até cinco moluscos, conforme o tamanho do animal; e, com duas placas, realizou-se o esmagamento da concha, por meio de uma leve pressão16,17. As taxas de infecção global e específica dos moluscos foram determinadas após os exames, segundo o método descrito por Ruiz18.
PREPARAÇÃO DAS LÂMINAS
As larvas encontradas na água e nas vísceras dos moluscos esmagados foram capturadas com pipeta e transferidas para lâminas com uma gota de água para serem examinadas a fresco e, posteriormente, com os corantes lugol (0,1%) e vermelho neutro (0,05%), foram levadas ao microscópio óptico. A fotografia das larvas ocorreu em aumentos de 40x, exceto para Apharyngostrigea sp., larva mais robusta, que foi fotografada em aumento de 10x.
A identificação morfológica das larvas foi baseada nos seguintes critérios: formato do corpo e da cauda; tamanho e posição das ventosas; presença ou ausência de estruturas especializadas, como estilete oral e ocelos; presença de faringe; entre outras estruturas, conforme mostram as chaves taxonômicas de Pinto e Melo9, Martorelli et al.15, Naruto19, Frandsen e Christensen20, Shell21 e Boaventura et al.22.
IDENTIFICAÇÃO DE BIOMPHALARIA SPP.
Após os exames parasitológicos iniciais, foram separados dois ou três exemplares de Biomphalaria spp. que não liberaram cercárias para a identificação das espécies, conforme os protocolos do Ministério da Saúde1, de Deslandes23, da Pan American Health Organization24 e de Paraense25.
A identificação e as imagens foram feitas no Laboratório de Malacologia do Centro Regional de São Vicente/Sucen.
RESULTADOS
MOLUSCOS COLETADOS E IDENTIFICADOS
Foram coletados e examinados 5.969 moluscos, procedentes de 53 valas distribuídas nas três áreas: 1.163 moluscos na área A; 3.841 moluscos na B; e 965 moluscos na C. A identificação dos moluscos revelou B. tenagophila, B. straminea, Drepanotrema sp. (Planorbidae), Lymnaea sp. (Lymnaeidae), Physa sp. (Physidae), Pomacea sp. (Ampullariidae) e Melanoides tuberculata (Müller, 1774) (Thiaridae) (Tabela 1).
Tabela 1 - Frequência de moluscos dulciaquícolas coletados em três áreas de Peruíbe, estado de São Paulo, Brasil, 2016-2017
| Moluscos | Área A | Área B | Área C | |
|---|---|---|---|---|
| N | N | N | ||
| Biomphalaria tenagophila | 962 | 3.592 | 631 | |
| Biomphalaria straminea | - | - | 4 | |
| Melanoides tuberculata | 19 | 4 | 163 | |
| Physa sp. | 169 | 232 | 124 | |
| Lymnaea sp. | - | 6 | 39 | |
| Drepanotrema sp. | - | 3 | - | |
| Pomacea sp. | 13 | 4 | 4 | |
| Total | 1.163 | 3.841 | 965 |
Área A: Nova Peruíbe; Área B: Jardim Caraguava; Área C: Ruínas. Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
IDENTIFICAÇÃO DE TREMATÓDEOS E TAXAS DE INFECÇÃO
Nove formas larvais foram registradas e classificadas em sete tipos morfológicos, a saber: xifidiocercária - Cercaria lutzi (Ruiz, 1943); equinocercária - Cercaria granulifera (Lutz, 1924) e Echinostoma sp.; estrigeocercária - Cercaria caratinguensis (Ruiz, 1953) e Apharyngostrigea sp.; distoma brevifurcada faringeada - Cercaria ocellifera (Lutz, 1917); distoma brevifurcada afaringeada - Cercaria blanchardi (Pirajá da Silva, 1912) ou larva de S. mansoni; pleurolofocercária - Centrocestus formosanus (Nishigori, 1924); e anfistomocercária - Anfistoma sp. As larvas C. lutzi, C. granulifera, C. caratinguensis e C. ocellifera apareceram com maior frequência (Tabela 2).
Tabela 2 - Frequência de moluscos infectados, segundo formas larvais e taxa de infecção por área pesquisada, no município de Peruíbe, estado de São Paulo, Brasil, 2016-2017
| Formas larvais | Moluscos infectados | Área A | Área B | Área C | |||
|---|---|---|---|---|---|---|---|
| N | % | N | % | N | % | ||
| Cercaria lutzi | Biomphalaria tenagophila | 9 | 0,93 | 324 | 9,02 | 16 | 2,53 |
| Physa sp. | 1 | 0,59 | - | - | - | - | |
| Cercaria granulifera | Biomphalaria tenagophila | 4 | 0,41 | 59 | 1,64 | 25 | 3,96 |
| Echinostoma sp. | Biomphalaria tenagophila | - | - | 1 | 0,02 | - | - |
| Cercaria caratinguensis | Biomphalaria tenagophila | 4 | 0,41 | 38 | 1,05 | - | - |
| Apharyngostrigea sp. | Biomphalaria tenagophila | - | - | - | - | 3 | 0,47 |
| Cercaria ocellifera | Biomphalaria tenagophila | - | - | 9 | 0,25 | 2 | 0,31 |
| Cercaria blanchardi | Biomphalaria tenagophila | - | - | 6 | 0,16 | - | - |
| Centrocestus formosanus | Melanoides tuberculata | 1 | 5,26 | - | - | - | - |
| Anfistoma sp. | Biomphalaria tenagophila | - | - | 1 | 0,02 | - | - |
Área A: Nova Peruíbe; Área B: Jardim Caraguava; Área C: Ruínas. Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
Entre os espécimes de B. tenagophila coletados na área B (Jardim Caraguava), seis exemplares portavam larvas de S. mansoni, representando uma taxa de infecção de 0,16%. Entretanto, as maiores taxas de infecção de B. tenagophila foram com C. lutzi (9,02%), na área B, e C. granulifera (3,96%), na área C (Ruínas). As taxas de infecção dos moluscos, quando comparadas por área pesquisada, resultaram em 11,40%, 4,76% e 1,63%, respectivamente, para Jardim Caraguava, Ruínas e Nova Peruíbe (Tabela 2).
DESCRIÇÃO MORFOLÓGICA DAS LARVAS ENCONTRADAS NOS EXAMES PARASITOLÓGICOS
Duas larvas distintas do tipo equinocercária (Figura 2: A e D) foram observadas. Uma delas, denominada de Echinostoma sp., apresentou: membrana natatória na cauda simples (Figura 2: B); ventosas oral e ventral de tamanhos semelhantes; numerosas células cistogênicas espalhadas pelo corpo; presença de esôfago e dois cecos intestinais longos, os quais seguem para a região posterior do corpo (Figura 2: A). Larvas produzidas em rédias de coloração acastanhada (Figura 2: C).
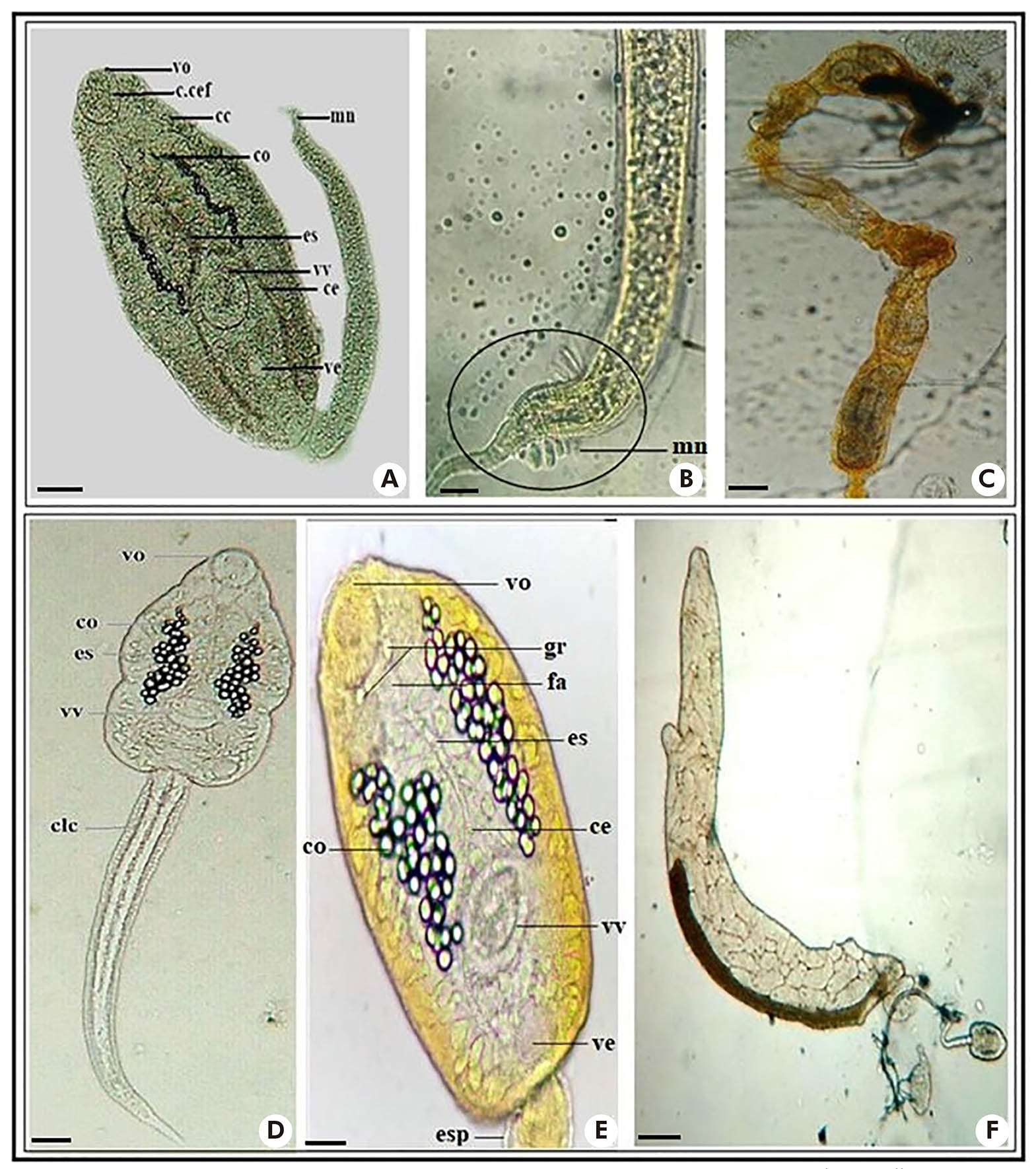
Fotos: Nayla Zanella Carramão.
A: Corpo e cauda de Echinostoma sp.; B: Membrana natatória de Echinostoma sp.; C: Rédia acastanhada de Echinostoma sp.; D: Corpo e cauda de Cercaria granulifera; E: Estruturas do corpo e cauda da Cercaria granulifera; F: Rédia acastanhada de Cercaria granulifera. Corante utilizado - Lugol diluído 0,1% (A, B, E); Sem corante - a fresco (D, F). Escala: 50 μm. vo: Ventosa oral; fa: Faringe; gr: Grânulos; c.cef: Colar cefálico; cc: Células cistogênicas; co: Concreções; es: Esôfago; vv: Ventosa ventral; ce: Cecos; ve: Vesícula excretora; mn: Membrana natatória; clc: Células caudais; esp: Espinhos.
Figura 2 - Larvas do tipo equinocercária
A segunda equinocercária (Figura 2: D e E) apresentou: faringe muscular, esôfago longo e bifurcado em dois cecos intestinais, seguindo para a região posterior do corpo; vesículas excretoras em cada lado do corpo, com canais coletores que possuem, nas porções mais dilatadas, 35-45 granulações esféricas refringentes ou concreções de fácil visualização; ventosa oral e ventral; presença de dois grânulos refringentes situados à frente da faringe e próximos à base da ventosa oral (Figura 2: E); cauda simples, longa e estreita recoberta por espinhos. Tais características são de C. granulifera, forma larval de Paryphostomum segregatum (Dietz, 1909). Desenvolvimento em rédias8 (Figura 2: F).
Uma larva do tipo xifidiocercária, C. lutzi (Figura 3: A e B), foi encontrada apresentando: ventosa oral bem desenvolvida e estilete, e ventosa ventral na região mediana do corpo; presença de glândulas de penetração facilmente observadas, sendo cinco em cada lado do corpo; vesícula excretora em forma de "Y" e cauda simples. Desenvolvimento em esporocistos (Figura 3: C).
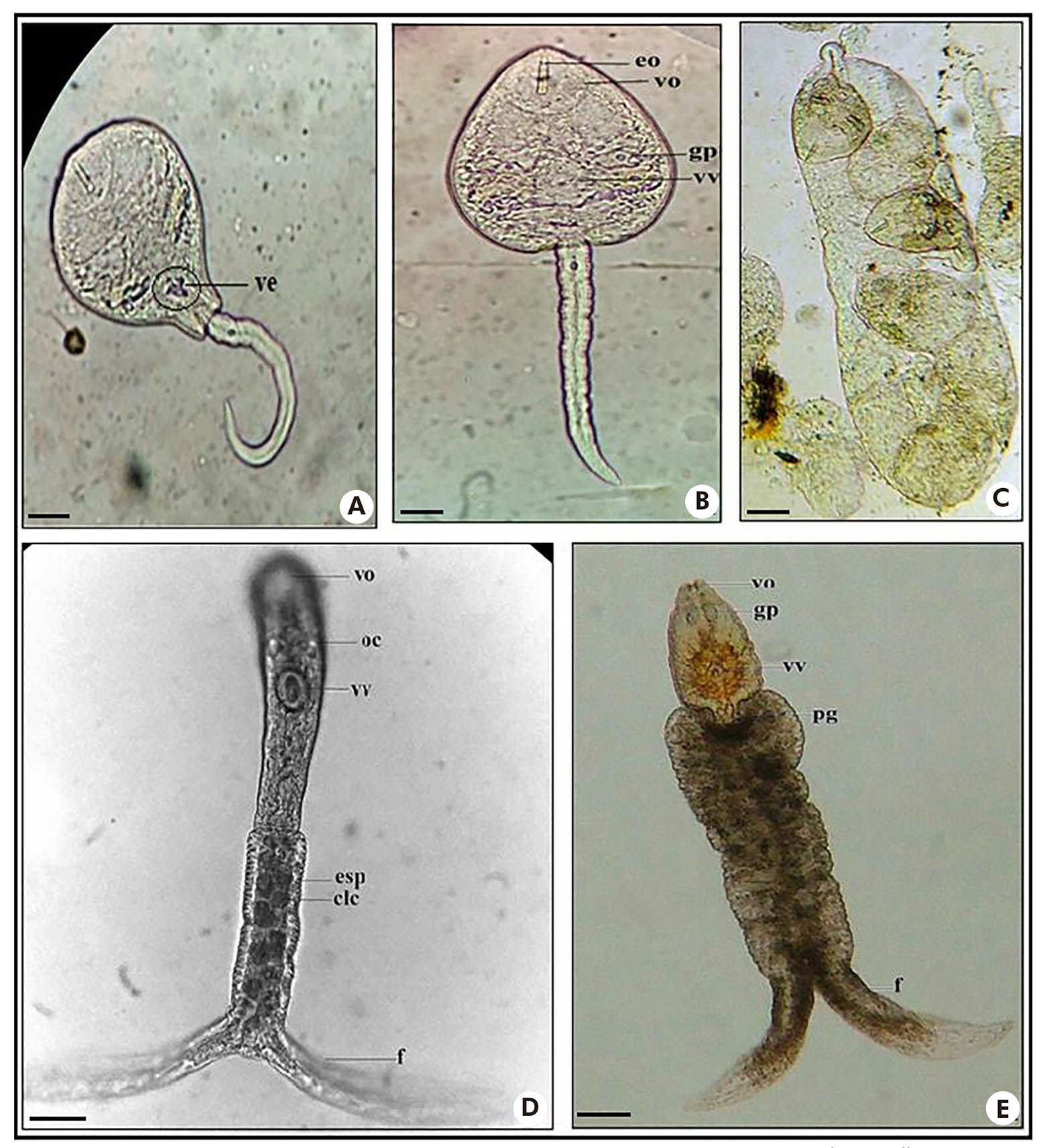
Fotos: Nayla Zanella Carramão.
A, B: Corpo e cauda de Cercaria lutzi; C: Esporocistos de Cercaria lutzi; D: Corpo e cauda de Cercaria caratinguensis; E: Corpo e cauda de Apharyngostrigea sp. Exame a fresco. Escala: 50 μm. ve: Vesícula excretora (Y); eo: Estilete oral; vo: Ventosa oral; gp: Glândulas de penetração; vv: Ventosa ventral; oc: Ocelos; esp: Espinhos; clc: Células caudais; f: Furca; pg: Primórdio genital.
Figura 3 - Larvas do tipo xifidiocercária (A, B, C) e estrigeocercária (D, E)
Duas larvas do tipo estrigeocercária (Figura 3: D e E) foram encontradas, sendo uma delas semelhante a C. caratinguensis, com: corpo alongado; ventosas oral e ventral, sendo a ventosa ventral localizada na porção média do corpo; ocelos sem pigmentação; cauda longifurcada, com furcas achatadas lateralmente e mais longas que a haste, sendo que, em seu interior, foram observados cinco pares de células. Desenvolvimento em esporocistos20,21.
A segunda estrigeocercária (Figura 3: E) apresentou características semelhantes à larva Apharyngostrigea: corpo grande e oval; presença de ventosas oral e ventral (bem esférica); uma faringe; duas glândulas de penetração em formato de bolsa de cada lado do corpo, logo abaixo da ventosa oral; presença do primórdio genital no corpo próximo ao início da cauda; cauda bifurcada, com furcas médias e largas, achatadas dorso ventralmente, um tronco caudal acentuadamente globoso; presença de grânulos de cor marrom no interior do corpo e da cauda. Desenvolvimento em esporocistos20,21.
As larvas do tipo distoma brevifurcada faringeada (Figura 4: A e B) assemelham-se com C. ocellifera, pertencente à família Clinostomidae, com: membrana dorsal no corpo alongado; ocelos pigmentados; ventosa oral grande e ovalada, ventosa ventral não visualizada; cauda longa e bifurcada em furcas curtas. Desenvolvimento em rédias8.
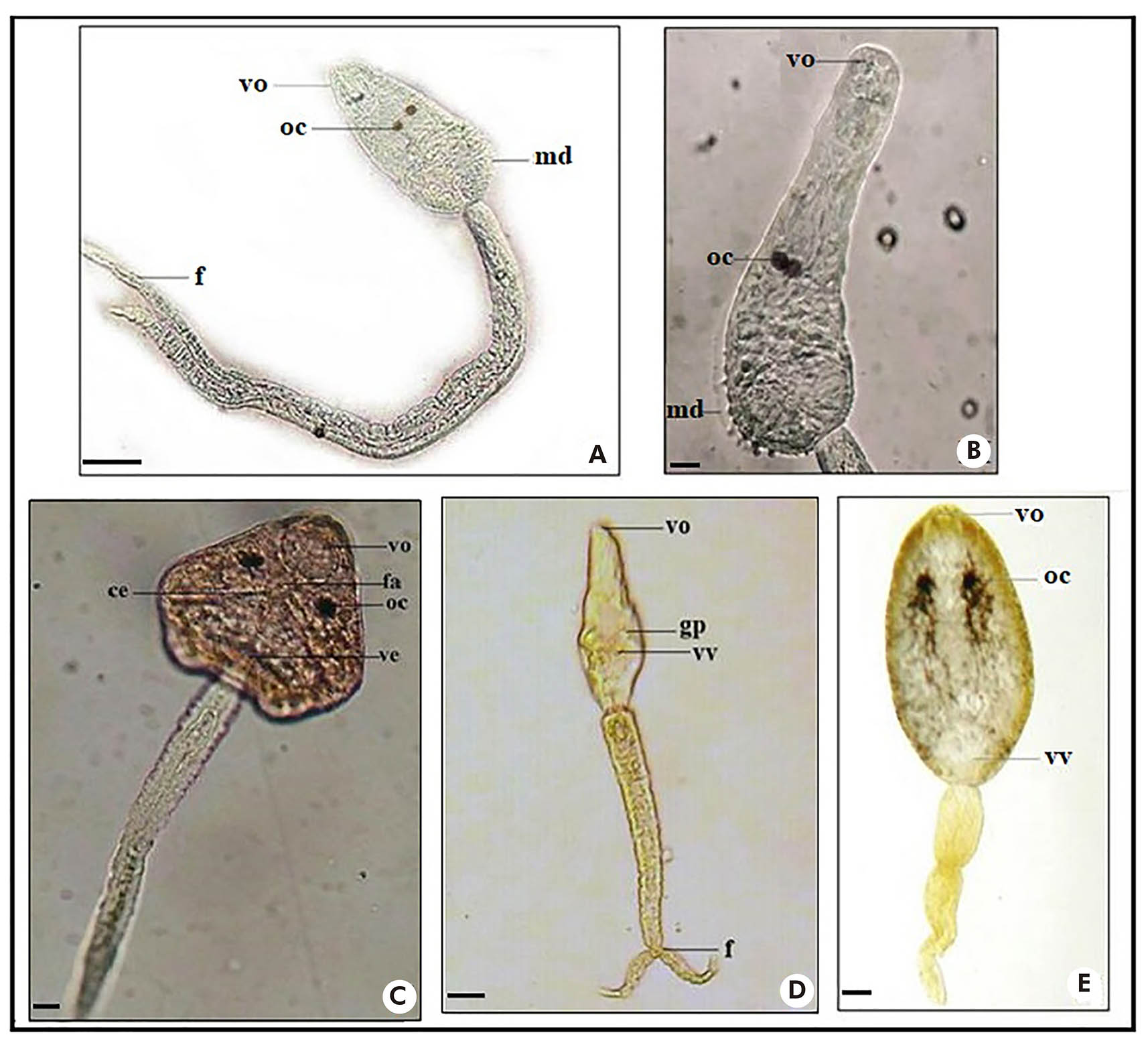
Fotos: Nayla Zanella Carramão.
A: Corpo e cauda de Cercaria ocellifera; B: Corpo de Cercaria ocellifera; C: Corpo e cauda de Centrocestus formosanus; D: Corpo e cauda de Cercaria blanchardi (Schistosoma mansoni); E: Corpo e cauda de Anfistoma sp. Corantes: vermelho neutro 0,05% (C) e lugol 0,1% (D, E). Escala: 50 μm. vo: Ventosa oral; oc: Ocelos; md: Membrana dorsal; f: Furca; vv: Ventosa ventral; fa: Faringe; ce: Cecos; ve: Vesícula excretora; gp: Glândulas de penetração.
Figura 4 - Larvas do tipo distoma brevifurcada faringeada, pleurolofocercária e anfistomocercária - com ocelos pigmentados (A, B, C, E); e distoma brevifurcada afaringeada - sem ocelos pigmentados (D)
A larva do tipo anfistomocercária (Figura 4: E) apresentou: corpo alongado, com células cistogênicas espalhadas e presença de dois ocelos pigmentados; ventosas oral e ventral grandes, estando a ventosa ventral localizada na região posterior do corpo; cauda simples. Desenvolvimento em rédias8,26.
A larva do tipo pleurolofocercária (Figura 4: C) apresentou características de C. formosanus com: corpo oval e numerosas células cistogênicas; ventosa oral grande, e ventosa ventral de difícil visualização; faringe muscular; dois cecos intestinais longos, abaixo dos ocelos e vesícula excretora na parte proximal da cauda; cauda simples com pequena membrana natatória. Desenvolvimento em rédias27,28.
A larva do tipo distoma brevifurcada afaringeada, representada por C. blanchardi (Figura 4: D), apresentou: corpo alongado; ventosa oral desenvolvida, e ventosa ventral pequena, localizada na região subequatorial do corpo; glândulas de adesão e penetração; faringe ausente; cauda cilíndrica, bifurcada em furcas curtas. Desenvolvimento em esporocistos19.
DISCUSSÃO
Os resultados obtidos permitiram identificar as formas larvais e os moluscos hospedeiros intermediários dos trematódeos, ampliando o conhecimento sobre as condições epidemiológicas e sanitárias dos locais pesquisados em Peruíbe. Ressalta-se que, apesar de existir saneamento básico, as valas recebiam efluentes sanitários, favorecendo a transmissão de doenças e possivelmente a esquistossomose.
As pesquisas malacológicas resultaram em 5.969 moluscos coletados. A espécie B. tenagophila predominou em todas as áreas, assim como Physa sp. foi a segunda numericamente superior. É importante considerar que a fauna malacológica possui estreita relação com os fatores ambientais, e alguns grupos taxonômicos podem ser mais sensíveis a determinadas perturbações ambientais que outros9. Por essas características biológicas, os moluscos são muito utilizados nas avaliações e monitoramentos das condições ambientais12,13.
Quando comparada globalmente, a taxa de infecção foi maior no Jardim Caraguava (área B), com 11,4%. Em relação à taxa de infecção específica, B. tenagophila foi a espécie mais parasitada e suscetível a oito das nove formas larvais encontradas (Tabela 2).
Echinostoma sp., Apharyngostrigea sp., C. formosanus e Anfistoma sp. foram eliminadas por poucos moluscos. Esses dados podem indicar a influência de fatores ambientais sobre as larvas de trematódeos; entretanto, tais aspectos podem ser elucidados com novos estudos.
Os estudos morfológicos revelaram seis espécies de larvas de trematódeos, e três larvas não receberam a identificação específica, como Echinostoma sp., Apharyngostrigea sp. e Anfistoma sp. (Tabela 2). Segundo Locke et al.29, as espécies não podem ser identificadas apenas pela morfologia. É necessário combinar com as ferramentas moleculares nos estágios larvais associados aos adultos conhecidos.
Em relação à C. lutzi (Figura 3: A e B), essa larva foi associada ao parasito Pneumonoeces neivai (Travassos & Artigas, 1927) encontrado em pulmão de anuros30,31. Os trematódeos da família Echinostomatidae são parasitas intestinais de aves, répteis e mamíferos, inclusive humanos, com relatos de casos na Ásia9,14. A equinocercária identificada como C. granulifera (Figura 2: D e E) foi considerada a forma larval de P. segregatum. Ruiz32 verificou as formas císticas na faringe de girinos, peixes e moluscos e a forma adulta do parasita no urubu.
A larva Anfistoma sp. (Figura 4: E), do grupo Paramphistomoidea, tem importância veterinária, principalmente para ruminantes33. A larva Anfistoma lunatum foi associada ao parasita Zygocotyle lunata (Diesing, 1836), encontrado em mamíferos ruminantes e em aves, como a galinha caipira (Gallus gallus domesticus). De acordo com Barbosa26, o encistamento da larva ocorre em substratos do meio externo, como concha de molusco, crustáceo, tegumento de girinos, vegetação ou qualquer objeto.
C. formosanus (Figura 4: C) foi associada à centrocestíase em humanos na Ásia (Taiwan e Filipinas), adquirida pelo consumo de peixes crus com metacercárias26,33,34. As larvas identificadas como C. caratinguensis e Apharyngostrigea sp. (Figura 3: D e E) pertencem à família Strigeidae. Os parasitos foram encontrados em aves e mamíferos e as metacercárias em peixes, moluscos e anfíbios35.
C. ocellifera (Figura 4: A e B) é considerada a forma larval de Clinostomum heluans Braun, 1989, da família Clinostomatidae, parasita de répteis e aves aquáticas, também encontrado em girinos, peixes e moluscos, seus hospedeiros intermediários31.
Por fim, salienta-se o encontro de larvas de S. mansoni (C. blanchardi) em seis espécimes de B. tenagophila procedentes de valas do Jardim Caraguava, área afetada por enchentes. Moradores relatam que, nas ocasiões de enchentes, os moluscos são carreados para dentro das casas, sendo inevitável o contato físico, demonstrando ser essa mais uma situação de vulnerabilidade ambiental que pode propiciar a transmissão de várias doenças, entre elas, a esquistossomose. Segundo Artigas et al.36, casos de esquistossomose são reportados em Peruíbe desde 1966.
CONCLUSÃO
A presença de larvas de trematódeos na área estudada indica a existência de focos ativos que requerem atenção especialmente pela presença de moluscos portando larvas de S. mansoni. Assim, medidas de controle e vigilância malacológica são imprescindíveis em áreas vulneráveis como a de Peruíbe, cuja fauna de moluscos é composta por famílias de importância médica e veterinária.











 text in
text in 


