INTRODUÇÃO
Streptococcus agalactiae ou estreptococo do grupo B de Lancefield (EGB) apresenta morfologia de cocos em cadeia e reação tintorial gram-positiva. Pode colonizar os tratos gastrointestinal e geniturinário de mulheres, de forma assintomática, e causar infecções graves em recém-nascidos1,2. Quando transferido no momento do parto para o neonato, pode causar sepses e meningites, aumentando os riscos de mortalidade3. O Centers for Disease Control and Prevention (CDC) trata a infecção/colonização por essa bactéria como uma das principais causas infecciosas de morbidade e mortalidade neonatal nos Estados Unidos da América4. Um estudo realizado em Moçambique com um total de 183 natimortos detectou EGB em 2,1% deles por meio de análise do sangue umbilical5.
As complicações que se manifestam durante a gravidez, parto e puerpério podem ser prevenidas através da assistência pré-natal, sendo possível identificar situações de risco para mãe e feto6. No entanto, uma pesquisa realizada com 100 gestantes, com o intuito de detectar a colonização por EGB, demonstrou positividade de 14%7. Outro estudo realizado no estado do Rio de Janeiro revelou que dentre as 3.647 gestantes participantes entre a 35ª e a 37ª semana gestacional, 26,2% estavam colonizadas por essa bactéria8.
Dessa forma, com o objetivo de reduzir os danos perinatais associados, Toyofuku et al.9 demonstraram que a profilaxia intraparto em gestantes colonizadas reduziu em 32,5% a morte neonatal em uma região com altas taxas de prevalência dessa bactéria. Assim, o CDC4 recomenda a triagem para a colonização de EGB em mulheres entre a 35ª e a 37ª semana gestacional e o início da antibioticoprofilaxia assim que for identificada a presença de EGB. Já o Ministério da Saúde recomenda a investigação dessas bactérias apenas em gestantes de alto risco que apresentarem sinais e sintomas, como sangramentos. Entretanto, a gestante pode estar colonizada e não apresentar sintomas, podendo transmitir esse microrganismo para o feto, o qual ficará suscetível à infecção que pode levar à ocorrência de sepse10.
É preciso salientar que a gestação de alto risco é caracterizada por maior suscetibilidade a prejuízos à saúde da mãe e do feto, como complicações no trabalho de parto (parto prematuro), doenças clínicas maternas e alterações fetais que podem desencadear complicações nesse período11. Adicionalmente, fatores sociodemográficos, como baixos níveis de renda, escolaridade, elevadas taxas de gestações e assistência obstétrica falha favorecem a persistência dos indicadores de mortalidade entre as gestantes12,13,14.
Além disso, bactérias do gênero Streptococcus podem apresentar resistência aos antimicrobianos de escolha profilática, devido a alterações químicas nos sítios de ligação dos antimicrobianos na parede celular e transferência de genes codificadores de resistência15. Podem ainda formar comunidades que propiciam sua sobrevivência em ambientes hostis por longos períodos, chamados biofilmes15. Desse modo, essa bactéria é uma importante causa de infecção em mulheres grávidas e seus recém-nascidos; apesar disso, tem sido pouco estudada na América Latina16.
O conhecimento sobre a colonização e o perfil de sensibilidade de EGB isolados em gestantes é de grande valia, considerando a possibilidade de transmissão vertical, a sua patogenicidade, os riscos inerentes à saúde da mãe e do feto e a possibilidade de resistência aos antimicrobianos. Além desses fatores, cabe ressaltar que, durante o período gestacional, a administração de antimicrobianos é complicada, principalmente tratando-se de gestantes de alto risco; e, no estado do Pará, Brasil, há escassez de dados epidemiológicos sobre esse assunto.
Diante do exposto, esta pesquisa teve como objetivos caracterizar o perfil clínico-epidemiológico de gestantes colonizadas por S. agalactiae e determinar o perfil de sensibilidade desses isolados em um hospital que presta serviços de média e alta complexidade na Amazônia.
MATERIAIS E MÉTODOS
ASPECTOS ÉTICOS
A pesquisa foi aprovada pelo Comitê de Ética em Pesquisa do Sul do Pará, pertencente à Faculdade de Ensino Superior da Amazônia Reunida, no dia 29 de outubro de 2018, sob o número CAAE: 99503018.2.0000.8104; e, atendendo à Resolução nº 466/12 do Conselho Nacional de Saúde, as coletas só foram iniciadas no mês de março de 2019, após aprovação pelo Comitê.
TIPO E LOCAL DO ESTUDO
O estudo foi do tipo descritivo, prospectivo e transversal, com abordagem quantitativa, realizado em um hospital público regional, referência em gestação de alto risco, que atende em média cerca de 100 gestantes por mês e presta serviços de média e alta complexidade a pacientes de 15 municípios do sudeste do estado do Pará, os quais pertencem ao 12º Centro Regional de Saúde, que engloba uma população de 541.347 habitantes. O hospital está situado na cidade de Redenção, à distância de 1.018 km da capital Belém17,18.
PERÍODO E POPULAÇÃO DO ESTUDO
As coletas foram realizadas no período de 15 de março a 15 de abril de 2019, totalizando 32 dias consecutivos. Para a seleção da população deste estudo, foram considerados os seguintes critérios de inclusão: mulher em acompanhamento pré-natal no hospital que apresentava gestação de alto risco. Apesar do CDC4 recomendar a realização do exame a partir da 35ª semana gestacional, para fins desta pesquisa foram incluídas gestantes a partir da 22ª. Atendendo à resolução do Conselho Nacional de Saúde nº 466/1219, todas as gestantes que concordaram em participar do estudo assinaram o Termo de Consentimento Livre e Esclarecido (TCLE). Foram excluídas as gestantes que não assinaram o TCLE, as que não possuíam capacidade civil e dependiam da assinatura do seu tutor ou curador, bem como as que faziam uso de antibiótico e/ou que utilizaram nos últimos 10 dias.
Assim, 50 gestantes participaram do estudo. Dois swabs estéreis alginatados foram coletados de cada uma delas, um retal e outro vaginal, os quais foram imediatamente encaminhados para análise no laboratório do próprio hospital, seguindo recomendações posteriormente descritas.
Os dados sociodemográficos e clínico-obstétricos foram analisados considerando as variáveis: raça, escolaridade, moradia (rural/urbana), município de origem, faixa etária, doenças crônicas (de base), infecções sexualmente transmissíveis (IST), número de gestações e idade gestacional no momento da coleta dos swabs.
PROCEDIMENTOS PARA COLETA, DETECÇÃO FENOTÍPICA E PERFIL DE SENSIBILIDADE
As coletas dos espécimes clínicos foram realizadas de acordo com as recomendações do CDC4. Utilizando swabs alginatados estéreis, foram obtidas amostras do introito vaginal e do reto. O material coletado foi imediatamente inoculado em caldo de enriquecimento seletivo Todd Hewitt (Probac®) suplementado com antibióticos, hermeticamente fechado e levado até o laboratório do próprio hospital.
No setor de microbiologia, as amostras inoculadas foram incubadas a 35-37 °C, por 24 h; posteriormente, foram repicadas em Todd Hewitt Sangue (Probac®), sendo adicionada primeiro uma fita Hemolisinabac (Probac®) no centro da placa. Com o auxílio de uma alça bacteriológica estéril e descartável, foram realizadas estrias perpendiculares à fita, e, logo após, as placas foram incubadas novamente a 35-37 °C, por 24 h. Utilizando controle positivo para teste de CAMP após 24 h, realizou-se a interpretação do teste com detecção de β-hemólise com formação de seta. Seguindo as recomendações da Agência Nacional de Vigilância Sanitária para a identificação fenotípica de S. agalactiae20, as cepas foram submetidas à prova da catalase e ao teste de PYR (Probac®), para determinação da atividade da enzima pyrrolidonil arilamidase, nos quais observou-se negatividade para todas as cepas incluídas nesta pesquisa.
O teste de sensibilidade aos antimicrobianos foi realizado a partir de culturas recentes, com suspensões das amostras em solução salina esterilizada, com turvação correspondendo a 0,5 da escala de Mac Farland em ágar sangue, pelo método de disco-difusão conforme descrito pelo Clinical and Laboratory Standards Institute (CLSI)21. Como controle, foi usada uma cepa de Streptococcus pneumoniae (ATCC® 49619TM). Após 24 h de incubação a 35-37 °C, o diâmetro da zona de inibição de crescimento foi registrado em milímetros e os isolados foram classificados como sensíveis, intermediários e resistentes, de acordo com os critérios do CLSI21. Para a verificação da resistência induzida à clindamicina, foi realizado o D-teste, no qual o disco de clindamicina (Polisensidisc®) foi adicionado em um sítio diferente para melhor visualização.
Foram testados os antimicrobianos penicilina (10 U), ampicilina (10 μg), cefotaxima (30 μg), eritromicina (15 μg), clindamicina (2 μg), cloranfenicol (30 μg), oxacilina (1 μg), azitromicina (15 μg), ciprofloxacina (5 μg), tetraciclina (30 μg), linezolida (30 μg), vancomicina (30 μg) e meropeném (10 μg)22. A resistência a três ou mais classes dos antimicrobianos testados foi definida como resistência a múltiplos fármacos22.
ANÁLISE DOS DADOS
Após a coleta, os dados foram organizados em tabelas do Microsoft Excel (2013) e consolidados de acordo com a codificação apropriada para cada uma das variáveis estudadas. Foi realizada a análise descritiva dos dados utilizando frequência absoluta, relativa (percentual), média e desvio padrão.
RESULTADOS
Foram rastreadas amostras de secreções vaginais e retais de 50 gestantes de alto risco atendidas em um hospital regional no sudeste do estado do Pará para a presença de S. agalactiae. A colonização se fez presente em 34,0% (17/50) das gestantes, das quais 35,3% (6/17) ocorreram em secreções vaginais, 23,5% (4/17) em região anal e 41,2% (7/17) em ambas. A média de idade das participantes foi de 26,4 anos (desvio padrão ± 7,2). A maior frequência de exames positivos foi observada em gestantes na fase termo, com escolaridade ≤ oito anos, cor de pele não branca, residente em zona rural e que apresentavam multigestações (Tabela 1).
Tabela 1 - Perfil sociodemográfico, fatores clínico-obstétricos e frequência de gestantes colonizadas por EGB, assistidas em um hospital regional do estado do Pará, Brasil, entre março e abril de 2019
| Variáveis de exposição | Gestantes | Exames positivos | ||
|---|---|---|---|---|
| N = 50 | % | N = 17 | % | |
| Idade (X = 26,4; desvio padrão ± 7,2) | ||||
| ≤ 25 | 24 | 48,0 | 8 | 33,3 |
| ≥ 26 | 26 | 52,0 | 9 | 34,6 |
| Escolaridade | ||||
| ≤ 8 anos | 9 | 18,0 | 5 | 55,6 |
| ≥ 9 anos | 41 | 82,0 | 12 | 29,3 |
| Cor de pele | ||||
| Branca | 4 | 8,0 | 1 | 25,0 |
| Não branca | 46 | 92,0 | 16 | 34,8 |
| Área de residência | ||||
| Rural | 7 | 14,0 | 4 | 57,1 |
| Urbana | 43 | 86,0 | 13 | 30,2 |
| Nº de gestações | ||||
| Primigestas | 21 | 42,0 | 6 | 28,6 |
| Multigestas | 29 | 58,0 | 11 | 37,9 |
| Idade gestacional (momento da coleta do swab) | ||||
| (X = 31,9; desvio padrão ± 5,9) | ||||
| Pré-termo < 37 semanas | 35 | 70,0 | 10 | 28,6 |
| Termo 37 a 42 semanas | 15 | 30,0 | 7 | 46,7 |
| Pós-termo > 42 semanas | - | - | - | - |
| Diagnóstico de IST (na gestação atual) | ||||
| Sim | 3 | 6,0 | - | - |
| Não | 47 | 94,0 | 17 | 36,2 |
Sinal convencional utilizado: - Dado numérico igual a zero, não resultante de arredondamento.
Dentre os fatores que justificam o acompanhamento dessas gestantes em atendimento de média e alta complexidade, os mais frequentes observados foram hipertensão (26,0%; 13/50), diabetes (10,0%; 5/50), gestação gemelar (10,0%; 5/50), doenças renais (8,0%; 4/50) e idade materna (8,0%; 4/50). Outro risco associado foi a presença de IST, como sífilis, hepatite viral B e infecção pelo HIV, que foi observado em 6,0% (3/50) das gestantes.
Com relação ao perfil de sensibilidade dos microrganismos isolados, 100,0% (17/17) se mostraram sensíveis aos antimicrobianos linezolida, vancomicina e meropeném (Figura 1). Porém, altas taxas de resistência foram detectadas para ciprofloxacina (82,4%; 14/17), seguido por cloranfenicol (70,6%; 12/17), azitromicina (58,8%; 10/17) e tetraciclina (58,8%; 10/17). Das cepas analisadas, 88,2% (15/17) eram multirresistentes, apresentando resistência à eritromicina, ampicilina, penicilina, ciprofloxacina e tetraciclina (Quadro 1). As classes de antimicrobianos com maiores taxas de resistência (in vitro) foram as quinolonas, seguidas por β-lactâmicos, anfenicóis, macrolídeos, lincosamidas e tetraciclinas.
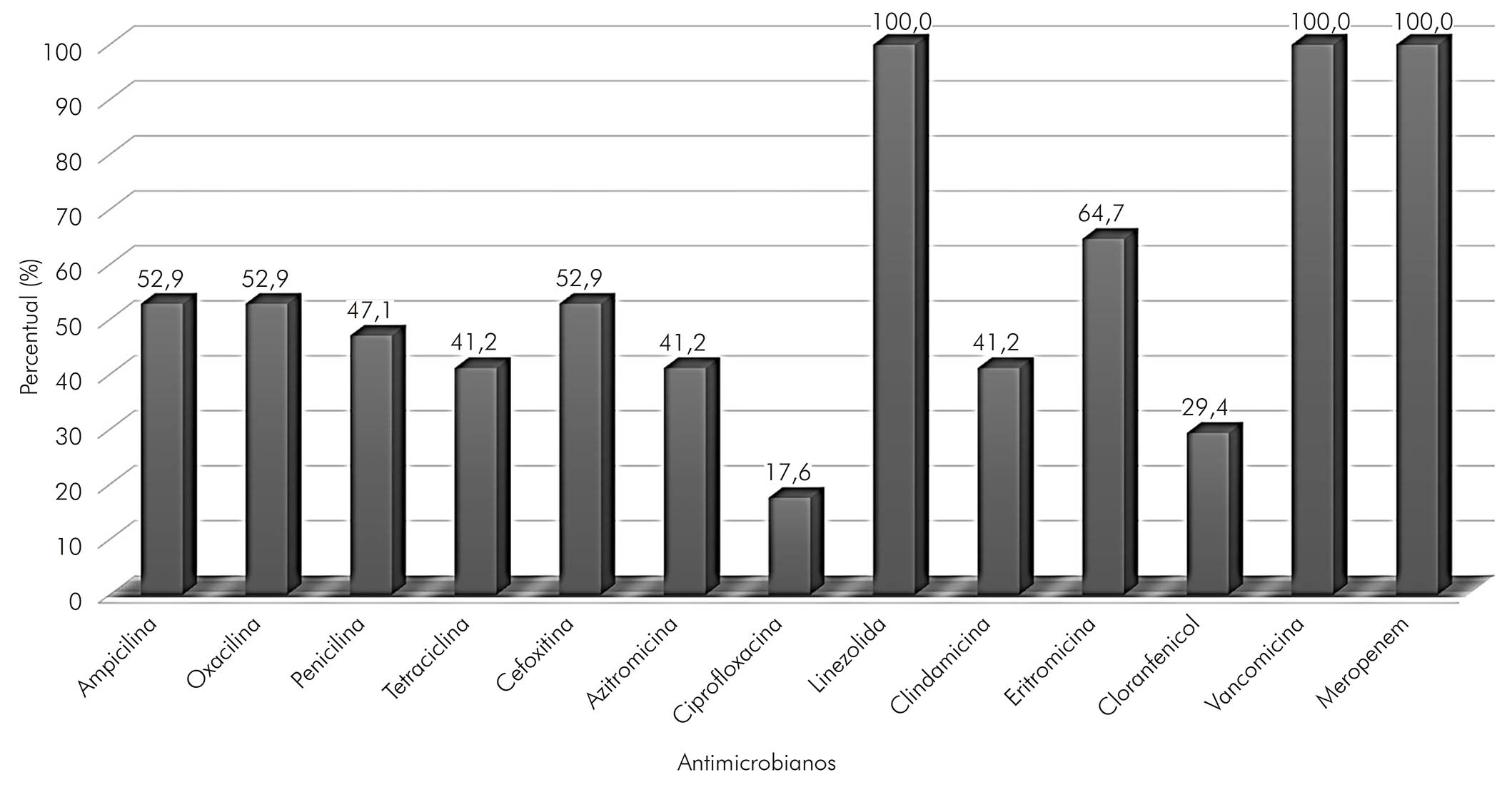
Figura 1 - Perfil de sensibilidade frente aos antimicrobianos testados em disco-difusão (in vitro) das cepas de Streptococcus agalactiae isoladas de gestantes de alto risco no sudeste do estado Pará, Brasil, entre março e abril de 2019
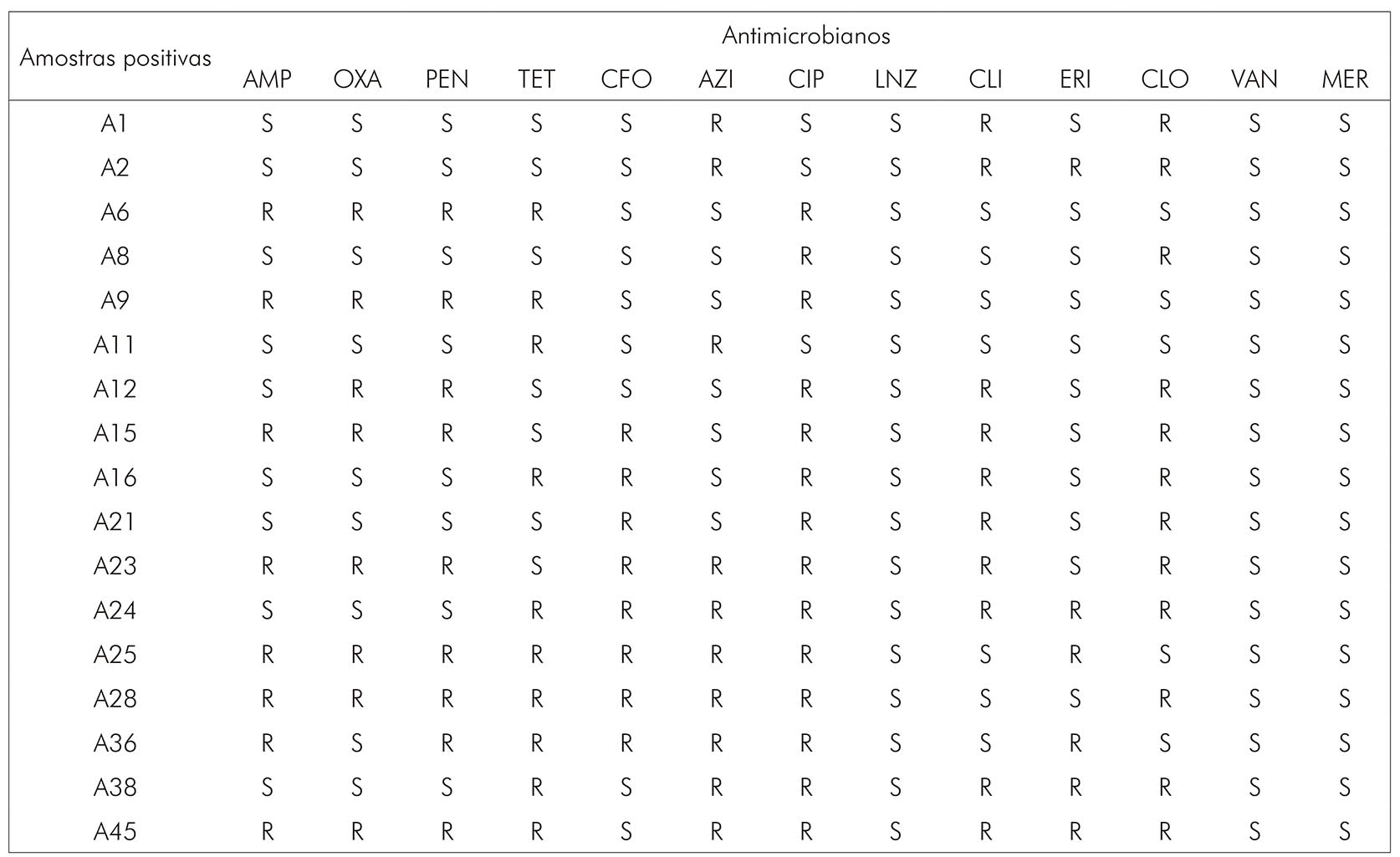
A: Dado demonstrativo representando as amostras positivas para Streptococcus agalactiae, nomeadas de acordo com a identificação recebida durante análise; S: Sensível; R: Resistente. AMP: Ampicilina; OXA: Oxacilina; PEN: Penicilina; TET: Tetraciclina; CFO: Cefotaxima AZI: Azitromicina; CIP: Ciprofloxacina; LNZ: Linezolida; CLI: Clindamicina; ERI: Eritromicina; CLO: Cloranfenicol; VAN: Vancomicina; MER: Meropeném.
Quadro 1 - Perfil de sensibilidade de Streptococcus agalactiae isolados de 17 gestantes de alto risco no estado do Pará, Brasil, entre março e abril de 2019
DISCUSSÃO
Neste estudo, a colonização por EGB foi detectada em gestantes de alto risco. Esse fato pode ser associado a alterações anatômicas e fisiológicas, como hipertrofia das paredes da vagina, o aumento do fluxo sanguíneo, alterações do pH, temperatura e acidez vaginal, além de alguns hábitos de higiene íntima como, por exemplo, o uso de duchas e sabonetes íntimos23,24.
Apesar de a amostragem ser um fator limitante nesta pesquisa, estudos com o intuito de analisar os fatores sociodemográficos são capazes de inferir a existência de grupos mais suscetíveis à colonização por EGB25,26. Tal fato foi demonstrado em um estudo conduzido na Arábia Saudita com 1.328 gestantes, no qual a colonização por EGB foi de 4,2% em gestantes com idade entre 25 e 29 anos e de 27,4% entre aquelas com mais de 40 anos27.
Os resultados da presente pesquisa concordam com os de um estudo realizado no Rio de Janeiro, que demonstrou que hipertensão arterial e diabetes gestacional foram as patologias maternas mais observadas entre gestantes de alto risco8. A patologia que mais predispõe à colonização materna ainda não está bem elucidada; porém, pressupõe-se que a alteração do estado imunológico, como ocorre na diabetes durante a gravidez, possibilita a infecção invasiva por EGB28,29,30.
Os medicamentos utilizados para o tratamento do EGB devem ter a capacidade de inibir a síntese da parede celular, a síntese proteica e a DNA girase; todavia, alguns antimicrobianos não podem ser prescritos durante a gestação por apresentarem capacidade de romper a barreira placentária e causar prejuízos à saúde da mãe e do feto. Dessa forma, recomenda-se a utilização de penicilina, amoxacilina, ampicilina, cefalexina e nitrofurantoína durante a gestação e, em caso de alergias à penicilina, a clindamicina ou eritromicina4,31.
Entretanto, ao analisar os resultados relativos à eficácia desses antimicrobianos para os isolados desta pesquisa, foi possível observar que as penicilinas e as cefalosporinas testadas não apresentaram boa sensibilidade (in vitro). Corroborando esse dado, um estudo realizado no estado do Ceará demonstrou que dentre cepas de EGB isoladas algumas apresentavam resistência à ampicilina (44,4%), cefalotina (44,4%), clindamicina (77,8%), cloranfenicol (11,1%), eritromicina (33,3%) e penicilina (44,4%)32. Baixos índices de resistência dessa bactéria à eritromicina foram relatados em outras pesquisas, revelando índices de sensibilidade para esse medicamento de 85,7% e 92,5%33,34.
Índices de sensibilidade reduzida de EGB à penicilina foram descritos na literatura internacional35,36. Esses índices podem ser associados a diversos fatores, como o seu uso em larga escala e mutações que alteram o sítio de ligação das proteínas ligadoras de penicilinas, mutações essas que podem ser carreadas por plasmídeos e transferidas de forma horizontal entre espécies distintas35,36. Todavia, a descrição de resistência de EGB a esse medicamento no Brasil continua muito baixa, e isso pode estar relacionado aos baixos índices de pesquisas voltadas para essa temática e a ausência de estrutura para a realização do teste16,32. Assim como nesta pesquisa, Linhares et al.32 relataram a não realização da pesquisa do EGB para as gestantes em rotinas pré-natais.
Além disso, como demonstrado em um estudo realizado no estado do Amazonas, as penicilinas e cefalosporinas estão entre os principais medicamentos utilizados, com destaque para cefalexina (39,7%), amoxicilina (29,4%), seguidos por benzilpenicilina benzatina (4,4%), ciprofloxacina (3,7%), sulfadiazina (3,7%), tetraciclina (3,7%), azitromicina (2,9%) e levofloxacina (2,9%), o que pode influenciar o aumento de detecções de cepas resistentes a esses medicamanetos37.
As bactérias analisadas nesta pesquisa apresentaram altos índices de resistência para a quinolona testada. Segundo uma pesquisa realizada na Argentina, esse fato está associado à ocorrência de mutações pontuais nos genes gyrA e parC38. Ressalta-se a relevância do monitoramento da sensibilidade dessa bactéria, pois, além de apresentar fatores de virulência que facilitam o desenvolvimento de processo infeccioso, pode apresentar mecanismos de resistência que dificultam a abordagem terapêutica38,39.
O uso de medicamentos de forma indiscriminada pode promover o surgimento de bactérias multirresistentes, as quais estão associadas a índices elevados de morbimortalidade40,41. Com o advento da resistência bacteriana, a identificação do patógeno e o conhecimento sobre o seu perfil de sensibilidade em infecções/colonizações durante a gestação tornaram-se importantes para uma profilaxia intraparto eficiente. Nesse sentido, o CDC recomenda uma triagem baseada em resultados microbiológicos, com detecção de colonização por coleta de swab realizada rotineiramente entre a 35ª e a 37ª semana gestacional4,41.
De forma semelhante, o American College of Obstetricians and Gynecologists recomenda a realização do rastreio de EGB entre a 36ª e a 37ª semana de gestação, com profilaxia antibiótica intraparto apropriada42. Entretanto, neste estudo, foram consideradas as gestantes a partir da 22ª semana gestacional, levando-se em conta: o risco de parto prematuro, por se tratar de gestantes de alto risco; o fato da colonização por EGB durante a gravidez ser transitória, intermitente ou constante; e que, no hospital em estudo, a pesquisa para a presença EGB não é realizada em qualquer fase da gestação. Assim, cabe ressaltar que há evidências científicas que sugerem a associação entre a colonização por essa bactéria e a prematuridade, resultando em aumento das taxas de mortalidade43,44.
No hospital onde foi realizado o presente estudo, apesar de atender especificamente gestantes de alto risco, o exame para a detecção de EGB não é realizado como parte do acompanhamento ao pré-natal, o que pode elevar os riscos à saúde da mãe e do feto. Em contrapartida, em um hospital do estado de São Paulo, foram implementadas estratégias preventivas considerando períodos corretos para coleta, maiores índices de positividade e riscos inerentes à saúde da mãe e do feto para a triagem e detecção do EGB, possibilitando mitigar o número de infecções neonatais de 57,8% para 55,1%, o que mostra a importância de políticas e estratégias públicas para melhoria da assistência em saúde44,45.
É importante frisar ainda que a interpretação dos resultados se deu à luz de limitações. O número de participantes foi relativamente pequeno, limitando assim a possibilidade de representatividade das detecções de resistências. Isso pode estar associado ao fato do hospital atender apenas gestantes de alto risco.
CONCLUSÃO
Foi possível evidenciar a presença de EGB entre as gestantes de alto risco atendidas em um hospital regional em uma cidade no sudeste do Pará, e detectar cepas multirresistentes, inclusive com resistência a penicilinas e cefalosporinas. As frequências de positividade para colonização por EGB e de multirresistência detectadas ressaltam a importância da triagem para detecção microbiológica dessa bactéria durante a gestação e o início da antibioticoprofilaxia quando indicada, demonstrando a necessidade de adequar a prática de acompanhamento pré-natal às recomendações vigentes. O conhecimento sobre o perfil clínico-epidemiológico descrito nesta pesquisa pode contribuir para a elaboração de medidas preventivas locais.
Recomenda-se ainda a realização de novos estudos com um número amostral maior e com uma caracterização epidemiológica seguindo as recomendações vigentes, buscando correlacionar a colonização por EGB materna com prejuízos à saúde do feto.











 text in
text in 


