INTRODUÇÃO
A esquistossomose é uma doença infectoparasitária causada por helmintos da classe dos trematódeos e do gênero Schistosoma. Por ser uma doença negligenciada, com características de morbidade crônica, carece de maior atenção das autoridades1. Estudos acerca desse parasito vêm sendo desenvolvidos desde a década de 1950 no Brasil e trouxeram grandes contribuições, sobretudo nos aspectos clínicos e epidemiológicos da doença2. Diante disso, surgem diferentes modelos utilizando animais, como roedores (principalmente camundongos), mamíferos (como o coelho Sylvilagus floridanus) e primatas de diferentes espécies3,4. Essa crescente demanda por investigações experimentais com o Schistosoma mansoni levou à busca de modelos animais que pudessem se assemelhar ao máximo aos humanos. O modelo primata surgiu como uma possibilidade, já que esses animais apresentam características morfológicas e biológicas semelhantes às do homem, o que sugere formas de infecção similares4,5. Portanto, objetivou-se estabelecer um modelo de estudo de esquistossomose em espécies de primatas não humanos neotropicais, a fim de obter novos conhecimentos acerca de melhores formas para prevenção pelo uso de novas drogas e vacinas, que possibilitem a cura e controle, além da possibilidade de estabelecer métodos diagnósticos mais eficazes.
MATERIAIS E MÉTODOS
ASPECTOS ÉTICOS
O projeto referente a este estudo foi elaborado e submetido à apreciação do Comitê de Ética em Pesquisa com Animais (CEUA) do Instituto Evandro Chagas (IEC), sendo aprovado pelo mesmo sob o Certificado nº 25/2018, registrado com o nº 10/2018.
ANIMAIS
Foram utilizados seis primatas adultos da espécie Sapajus apella, três machos e três fêmeas, todos provenientes do biotério destinado ao manejo de primatas do Centro Nacional de Primatas (CENP), localizado no IEC campus Ananindeua, estado do Pará. Os animais foram mantidos em gaiolas individuais (70 x 70 x 80 cm), no galpão de experimentação animal do CENP.
Obtenção das cercárias
Para a obtenção das cercárias (formas infectantes do parasito S. mansoni), foram utilizados espécimes de Biomphalaria glabrata, naturalmente infectados, obtidos durante coleta de rotina em bairros da cidade de Belém, capital do Pará, e mantidos no Laboratório de Parasitoses Intestinais, Esquistossomose e Malacologia (LPIEM), pertencente à Seção de Parasitologia do IEC. Quinze caramujos infectados foram colocados em um Becker com 300 mL de água desclorada e expostos a lâmpadas incandescentes de 60 W, por um período de 2 h, para liberação de cercárias (Figura 1). Cerca de 1 mL dessa solução foi retirada para visualização e contagem das cercárias em lupa eletrônica, seguindo as práticas e guias do LPIEM, obtendo-se, ao final, uma alíquota referente à média de 500 cercárias.

Fotos: LPIEM/IEC/SVS/MS.
A: Molusco B. glabrata em Becker com água desclorada; B: Exposição à luz para liberação de cercárias; C: Cercária de S. mansoni vista em microscópio estereoscópio com objetiva de 40x.
Figura 1 - Procedimentos de obtenção das cercárias em espécimes de B. glabrata naturalmente infectados
Infecção experimental
Os primatas foram distribuídos randomicamente em dois grupos experimentais de igual número para infecção. Dentro dos grupos, também foram randomizadas as formas de infecção de cada animal. Ao final, três primatas foram infectados por via intradérmica e três por via transcutânea.
Na infecção por via transcutânea, cada animal teve uma parte do pelo do seu abdômen e tórax raspados, onde foi colocada, gota a gota, uma solução com cerca de 500 cercárias sobre a pele depilada, por 45 min, como descrito por Brener e Alvarenga5 e Brito et al.6. Na infecção por via intradérmica, uma suspensão com volume referente a 500 cercárias foi transferida para uma seringa com agulha de calibre 22 e injetado nos animais7 (Quadro 1).
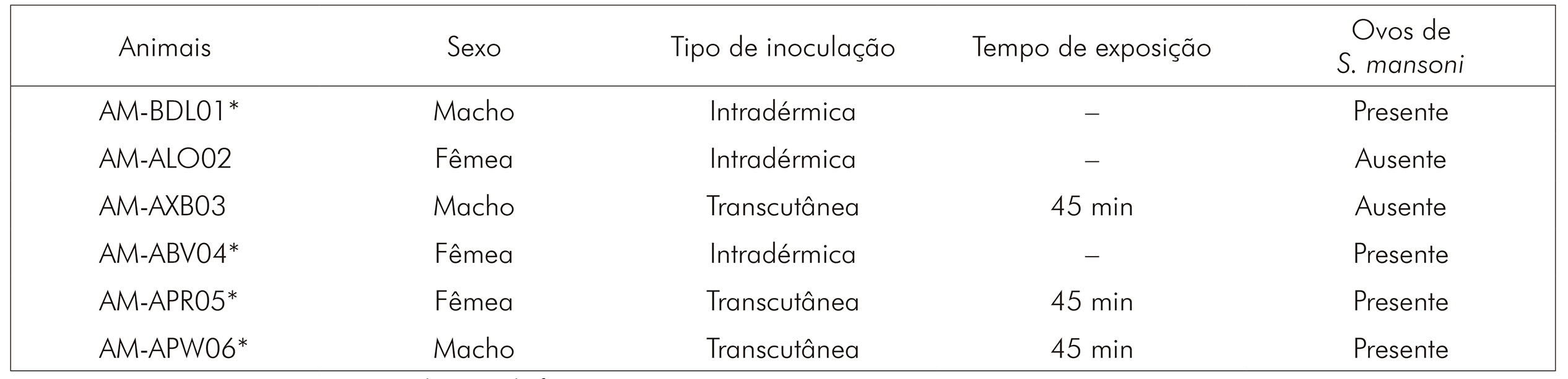
* Animais positivos nos exames parasitológicos de fezes.
Quadro 1 - Identificação dos primatas e suas respectivas formas de infecção
Com o objetivo de diminuir o estresse dos animais durante os processos de infecção e exames de rotina, foi induzida a anestesia por injeção via intramuscular de 4,4 mg/kg de Zoletil® (Virbac, SP, Brasil) - cloridrato de tiletamina e cloridrato de zolazepam. Para a prevenção de possíveis efeitos adversos provocados pelo uso desses medicamentos, a exemplo de sialorreia, foi aplicado um anticolinérgico, o sulfato de atropina a 1%, na dose de 0,05 mg/kg de peso do animal, por via subcutânea8.
COLETAS DO MATERIAL BIOLÓGICO
Anterior à infecção experimental dos animais, foram coletadas amostras de urina, sangue e fezes para atestar que os animais estavam livres de qualquer tipo de infecção. Foram coletadas semanalmente, durante seis semanas (7º, 14º, 21º, 28º, 35º e 42º dia pós-infecção), amostras de urina e fezes para a detecção de antígeno e ovos de S. mansoni, respectivamente. Em seguida, aproximadamente a cada 30 dias (70º, 98º, 126º, 154º dia pós-infecção), foram coletadas uma amostra de urina e uma de fezes para monitoramento da infecção. Os animais foram tratados no 161º dia pós-infecção. Todo material biológico coletado que não foi utilizado para a realização de exames foi etiquetado, processado e armazenado em biobanco.
Para a coleta de fezes, um papel esterilizado era posicionado ao fundo das gaiolas dos animais, de forma a forrá-las, para receber o material fecal, o qual era coletado utilizando colheres plásticas esterilizadas e então armazenado em potes plásticos até a realização da análise diagnóstica.
Para a coleta de urina, foi adaptado um método utilizando sonda uretral Tom Cat de 1,8 mm, estéril e lubrificada com gel para auxiliar na inserção na uretra do animal, para que alcançasse a vesícula urinária para remoção de 2 mL de urina. Em caso de impossibilidade da obtenção de urina via sonda, esse material foi coletado diretamente da bexiga dos animais, por meio de punção com o auxílio do equipamento de ultrassonografia LOGIQ E® (GE Medical Systems, China) e transdutor multifrequencial de banda larga linear, com frequência de 8 a 18 Mhz (Figura 2). Após a coleta, os recipientes contendo as urinas foram etiquetados, a urina analisada pelo método imunocromatográfico e o restante armazenado e congelado em biobanco.
Método de sedimentação espontânea das fezes - HPJ (adaptado)
As amostras de fezes foram processadas de acordo como o método de sedimentação espontânea descrito por Lutz9 e padronizado por Hoffman, Pons e Janer10, que consiste na homogeneização das fezes, as quais devem ser filtradas em gaze e suspensas em água, retendo resíduos fecais e aumentando a concentração de ovos dos demais detritos encontrados.
Método de Kato-Katz
É um método qualitativo e quantitativo que permite a determinação do número de ovos por grama de fezes (OPG), estimando assim a intensidade da infecção. As lâminas de Kato-Katz11 são preparadas usando o Helm Test Kit® (Bio-Manguinhos/Fiocruz, RJ, Brasil) (Figura 3). O número de ovos encontrados durante a leitura das lâminas é multiplicado por 24 para quantificação do número de ovos por grama de fezes, considerando que o orifício da placa perfurada contém, em média, 43,7 mg de fezes.

Fotos: LPIEM/IEC/SVS/MS.
A: Fezes posicionadas em papel; B: Compressão das fezes em malha de nylon; C: Preenchimento do orifício em placa perfurada; D: Posicionamento da lâmina de celofane sobre as fezes; E: Fezes sendo espalhadas para posterior análise.
Figura 3 - Aplicação da técnica Kato-Katz para determinar a quantidade de ovos de S. mansoni nas fezes dos animais experimentais
Teste rápido de urina (point-of-care cathodic circulating antigen - POC-CCA)
A urinálise foi realizada de acordo com o teste imunocromatográfico para a detecção presuntiva qualitativa de uma infecção ativa por S. mansoni com o objetivo de detectar antígenos circulating cathodic antigen (CCA) do parasito adulto na urina do paciente12. De acordo com o protocolo descrito pelo fabricante do kit (Rapid Medical Diagnostics, África do Sul), todos os testes devem ser lidos dentro de um período de 20 a 25 min após a aplicação do reagente, e qualquer resultado obtido fora desse período deve ser considerado inválido e necessita repetição. Qualquer teste em que a linha controle permaneça azul também deve ser desconsiderado13 (Figura 4).
RESULTADOS
Quanto aos métodos de inoculação de cercárias de S. mansoni em primatas da espécie Sapajus apella, de um total de seis primatas desafiados, quatro (66,6%) adquiriram a infecção, dois por via intradérmica e dois por via transcutânea.
A verificação da infecção (presença de ovos) dos quatro primatas positivos foi observada pela técnica de Kato-Katz no 42º dia para o animal AM-APR05, no 70º dia para os animais AM-BDL01 e AM-ABV04 e no 126º dia para o animal AM-APW06, com média de 77 dias pós-infecção (Quadro 2).
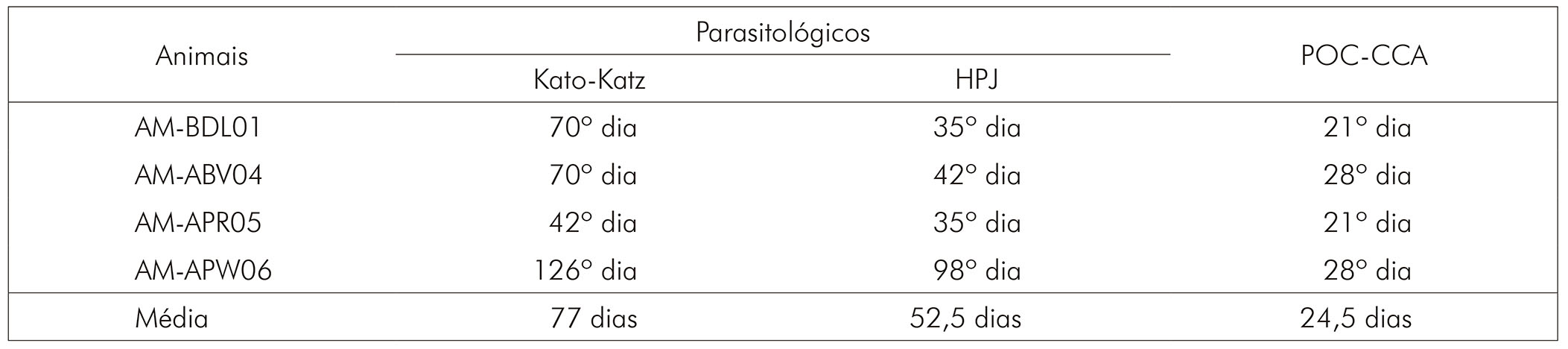
Quadro 2 - Presença de ovos de S. mansoni nas fezes e antígeno circulante e suas médias em dias pós-infecção pelos métodos coproscópicos e POC-CCA, respectivamente
As cargas parasitárias dos exames de fezes positivos variaram entre 8 e 1.120 OPG no animal AM-BDL01, com média geométrica de 40,6. Assim, esse animal foi classificado com baixa carga parasitária. Para o animal AM-ABV04, os valores variaram entre 16 e 1.104 OPG, com média geométrica de 123,9, sendo classificado com carga parasitária média. Para o animal AM-APR05, os valores variaram entre 8 e 296 OPG, com média geométrica de 45, sendo classificado com baixa carga parasitária. O animal AM-APW06 foi o único que não apresentou variação, pois só foram encontrados ovos em uma única lâmina, apresentando assim 8 OPG, sendo classificado com baixa carga parasitária (Gráfico 1).
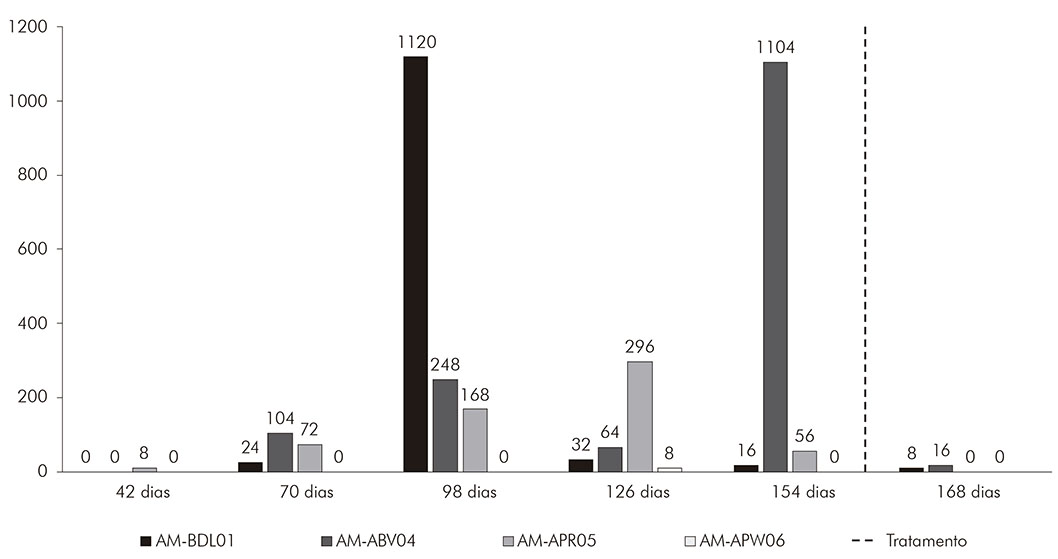
Gráfico 1 - Variação do total de ovos por grama de fezes eliminada pelos animais experimentais durante o período de positividade
A avaliação pela técnica de HPJ mostrou a primeira presença de ovos no 35º dia para os animais AM-BDL01 e AM-APR05, no 42º dia para o animal AM-ABV04 e no 98º dia para o animal AM-APW06, com média de 52,5 dias pós-infecção (Quadro 2).
Para a técnica POC-CCA, a presença de antígeno circulante de S. mansoni foi detectada no 21º dia para os animais AM-BDL01 e AM-APR05 e no 28º dia para os animais AM-ABV04 e AM-APW06, com média de 24,5 dias pós-infecção (Quadro 2). O animal AM-ALO02, apesar de ter apresentado traço, não foi considerado positivo por não ter confirmação de presença de ovos nas fezes pelas técnicas coproscópicas.
A coleta de urina nos machos foi possível com o uso de sondas uretrais, sem dificuldades. Entretanto, nas fêmeas, esse mesmo processo foi inviável, tendo sido então necessário realizar punção na vesícula urinária com o auxílio do aparelho de ultrassonografia como guia.
DISCUSSÃO
A infecção por via intradérmica se mostrou mais viável devido à facilidade de aplicação e uso de menores dosagens de anestésicos. Já na forma transcutânea, o tempo de contenção dos animais é maior, requerendo assim, intervalos maiores entre infecções de diferentes animais, o que pode influenciar na vida útil das cercárias14. Além disso, o uso de maiores doses do anestésico durante o processo de infecção pode causar impactos negativos à saúde do animal, pois cada um responde de maneira diferente à dosagem recomendada pelo Guia Terapêutico Veterinário15.
As técnicas coproscópicas HPJ e Kato-Katz detectaram ovos de S. mansoni dentro do período esperado em que os vermes atingem maturidade sexual e iniciam a postura de ovos16,17. Entretanto, em todos os animais positivos, foram identificados ovos de S. mansoni primeiramente pela técnica de HPJ, fato que pode ser explicado principalmente pela quantidade maior (3 a 5 g de fezes) examinada nesse método, quando comparada aos 43,7 mg por lâmina utilizados pela técnica de Kato-Katz11. Nesse sentido, a utilização das duas técnicas melhora a detecção de positivos; entretanto, apenas a técnica de Kato-Katz pode estimar o OPG, possibilitando o acompanhamento de possíveis flutuações na carga parasitária dos indivíduos e, consecutivamente, a verificação de morbidade.
A aplicação do teste imunocromatográfico POC-CCA detectou antígeno circulante mais cedo nas urinas dos primatas, quando comparado aos ovos encontrados pelas técnicas coproscópicas, corroborando com diferentes estudos12,18,19. Contudo, a presença de "traços" detectados pelo POC-CCA em animais negativos para os testes coproscópicos pode indicar cargas parasitárias muito baixas ou infecções unissexuadas, o que justificaria a ausência de ovos nas fezes e a presença de traços de antígeno em um dos animais que permaneceu negativo até o tratamento20.
CONCLUSÃO
Este estudo demonstrou que os primatas responderam de maneira satisfatória à infecção com 500 cercárias de S. mansoni em ambas as vias de infecção, além de terem eliminado ovos em quantidades significativas sem desenvolver doença grave durante todo o período de observação. Além disso, mostrou a praticidade da via intradérmica quando comparada à transcutânea. Quanto à otimização da detecção inicial da infecção, foi demonstrado que o melhor é o uso do método de HPJ em conjunto com o de Kato-Katz. Em suma, este modelo apresenta-se viável para diferentes estudos relacionados à esquistossomose mansônica.












 Curriculum ScienTI
Curriculum ScienTI